7.1. Montelukast en monoterapia
Preguntas para responder:
- En niños preescolares con episodios de sibilancias/asma, ¿es eficaz el tratamiento con montelukast?
- En niños mayores de cinco años con asma persistente, ¿cuál es la eficacia del tratamiento preventivo con glucocorticoides inhalados versus montelukast?
En niños preescolares con episodios de sibilancias/asma, ¿es eficaz el tratamiento con montelukast?
A pesar de que la mayoría de las guías recomiendan los glucocorticoides inhalados (GCI) como tratamiento de elección para niños con asma, de cualquier gravedad y de todas las edades, en el caso de niños preescolares con sibilancias/asma desencadenadas por infecciones víricas algunas guías proponen los antileucotrienos como tratamiento de elección (110) ya que existe controversia sobre la eficacia del tratamiento con GCI en estos niños.
En la Guía de Práctica Clínica sobre Asma de Osakidetza/Servicio Vasco de Salud de 2005 (21) se recomiendan los GCI como tratamiento preventivo de elección tanto en niños como en adultos al considerarse que son más eficaces que las cromonas y los antileucotrienos e indicándose además que no se recomienda el uso de antileucotrienos en monoterapia de mantenimiento en niños y adultos con asma.
En la
ficha técnica de montelukast 4mg se indica que montelukast puede ser una opción de tratamiento alternativo a los glucocorticoides inhalados a dosis bajas para pacientes entre dos y cinco años de edad con asma persistente leve que no tienen un historial reciente de ataques de asma graves que hayan requerido el uso de glucocorticoides orales y que hayan demostrado que no son capaces de utilizar glucocorticoides inhalados.
Evidencia científica
La guía SIGN (45) no considera la utilización de montelukast en niños preescolares con asma. La guía GEMA (46) indica que los antileucotrienos son eficaces aunque en menor medida que los GCI para el control del asma infantil. En la Guía de Práctica Clínica sobre Asma de Osakidetza/Servicio Vasco de Salud (21) no se recomienda la utilización de antileucotrienos en monoterapia tanto en niños como en adultos.
Montelukast versus placebo
Se han encontrado dos tipos de estudios: tres ECAs en los que se valora la eficacia del tratamiento con montelukast en niños con episodios de sibilancias/asma intermitente desencadenados por infecciones respiratorias (111-113) y tres ECAs en niños con asma persistente (114-116) en los que se valora la utilización de montelukast de forma continuada como tratamiento preventivo de exacerbaciones de asma. En todos los casos se trata de estudios que están financiados por la industria.
En el caso de sibilancias/asma intermitente, y en relación al número de pacientes con exacerbaciones que requieren glocucorticoides orales, Bisgaard et al. (111) señalan un Relative Rate (ratio de eventos por año) de 0,82 (IC 95% de 0,54 a 1,25) para los niños tratados con montelukast diario frente al placebo y Robertson et al. (112) un OR de 0,81 (IC95% de 0,56 a 1,17) para los niños tratados con montelukast intermitente. El estudio de mayor calidad (113), que define la variable principal número de ataques de asma como número de episodios que requieren utilización de recursos (no sólo glucocorticoides orales), tampoco encuentra diferencias significativas entre los niños tratados de forma diaria o episódica con montelukast frente a placebo. En el estudio de Bisgaard (111), que define la exacerbación como el aumento de síntomas y uso de Β2-agonista 2 veces/día como mínimo, uso de glucocorticoide oral o inhalado como rescate uno o más días u hospitalización por asma, se señala que montelukast reduce las exacerbaciones frente a placebo en un 31,9% de los casos.
Calidad muy baja
En cuanto a las hospitalizaciones, no se encuentran diferencias significativas en ninguno de los estudios que reportan datos al respecto (111-112), tanto en el porcentaje de pacientes hospitalizados (111) (4,2% en el grupo tratado con montelukast frente al 5,8% en el grupo placebo) como en el porcentaje de episodios que acaban en hospitalización (112) (2,9% vs 3,9%, respectivamente).
Calidad muy baja
En relación a la presencia o gravedad de los síntomas en los episodios, no se encuentran diferencias en el porcentaje de días sin síntomas (113), pero sí en la puntuación total o media de los síntomas durante los episodios de asma entre ambos grupos de tratamiento. En uno de los estudios (112) la puntuación total de todos los episodios fue menor para el grupo montelukast (mediana 37; RIC de 19 a 62) que para el placebo (mediana 43; RIC de 22 a 73) (112) y en el segundo, la media diaria de síntomas durante los 12 días de tratamiento del episodio también fue menor para el grupo tratado con montelukast de forma intermitente (113).
Calidad baja
En referencia al uso de β2 agonistas, en uno de los estudios (113) se produce una reducción significativa del número de pulsaciones diarias durante el episodio (0,31 pulsaciones menos al día (IC95% de -0,54 a -0,03) en el grupo tratado con montelukast de forma intermitente frente a placebo), pero no así en el segundo estudio (mediana de 36 pulsaciones en ambos grupos de tratamiento) (112).
Calidad baja
Por último, un único estudio recoge un menor número de abandonos por efectos adversos clínicos en el grupo tratado con montelukast frente a placebo (OR 0,094 (IC95% de 0,01 a 0,72) (111).
Calidad baja
El estudio de Valovirta (113) incluye niños con enfermedad leve, lo que explica que sólo el 50% de los episodios culminen en un ataque de asma. Además incluyen aproximadamente un 16% de niños menores de dos años, grupo de edad excluido en el estudio de Bisgaard (111). En este último estudio el 15% de los pacientes tenían síntomas consistentes de asma persistente y no intermitente.
En el caso del asma persistente se han encontrado tres estudios (114-116), dos de los cuales fueron diseñados para evaluar la seguridad y tolerabilidad de montelukast, uno en niños de entre dos y cinco años (114) y el segundo de menores de dos años de edad (115).
En relación al porcentaje de pacientes con exacerbaciones que requieren glucocorticoides orales, en el estudio Knorr et al. (114) es menor en el grupo tratado con montelukast frente a placebo (19% versus 28%, respectivamente), aunque en el de Adelsberg et al. (115) no se encuentran diferencias significativas, lo que se atribuye a que el diseño del estudio se hizo para evaluar seguridad y no la eficacia del tratamiento.
Calidad muy baja
En cuanto a los síntomas de asma, en uno de los estudios montelukast reduce el número de días con síntomas (114) y en otro estudio produce una reducción significativa de la puntuación total obtenida frente a placebo (Mediana puntuación montelukast de 5,5 (RIC de 0 a 9) a 1,5 (RIC de 0 a 6); del grupo placebo de 3 (RIC de 1 a 8) a 4 (de 1 a 8)) (116).
Calidad muy baja
En cuanto al uso de β2-agonistas, uno de los dos estudios señala un menor número de días de uso (p=0,001)(114), mientras que el otro indica que el uso disminuye sólo en los niños menores de dos años con rinitis alérgica o dermatitis atópica (115).
Calidad muy baja
El único estudio (114) que mide la diferencia en la puntuación obtenida para la calidad de vida así como el número de abandonos por efectos adversos no encuentra diferencias significativas entre el grupo tratado con montelukast y el grupo placebo.
Calidad baja-muy baja
Montelukast versus glucocorticoides inhalados
En cuanto a la eficacia y seguridad de montelukast frente a los glucocorticoides inhalados en niños preescolares, se ha encontrado un artículo que valora esta pregunta mediante el sistema GRADE (110). Sin embargo, este artículo no indica la estrategia de búsqueda utilizada, por lo que se decide realizar una búsqueda de estudios originales desde 2005, encontrándose otro estudio realizado en preescolares (117) en el que se compara el uso de montelukast, fluticasona y palcebo en niños que presenten síntomas que «justifiquen» el tratamiento.
Uno de los tres artículos considerados (118) analiza la eficacia de montelukast, budesonida y placebo en el tratamiento episódico del asma intermitente, no encontrando diferencias en el número de pacientes que requieren ciclos de glucocorticoide oral, en la proporción de días sin síntomas ni en la calidad de vida de los niños. El número de pacientes hospitalizados es mayor en el grupo montelukast frente al grupo de GCI (6,3% vs 2,1%, respectivamente), pero la diferencia no es significativa.
Calidad muy baja
Calidad muy baja
Tampoco se encuentran diferencias significativas en el aumento de talla a los 12 meses de seguimiento.
Calidad baja
Los dos estudios (117-119) restantes incluyen niños con asma persistente. En relación al porcentaje de niños que requiere glucocorticoides orales o medicación adicional para el asma, el estudio de Szeffler et al. (119) concluye que éste es significativamente menor en el grupo tratado con budesonida, aunque la diferencia de ser significativa a las 52 semanas de seguimiento (RR 1,25 (IC95% de 0,92 a 1,72)).
Calidad muy baja
En relación al efecto sobre los síntomas, uno de los estudios no encuentra diferencias, aunque el estudio de Kooi et al. (117) sugiere un efecto beneficioso de fluticasona en comparación con placebo pero no frente montelukast.
Calidad muy baja
En cuanto a la diferencia en la calidad de vida o abandonos por efectos adversos (119), no se encontraron diferencias significativas entre los grupos de tratamiento.
Calidad muy baja
Los autores de la revisión GRADE encontrada concluyen que en niños preescolares con sibilancias recurrentes, los antileucotrienos no son más efectivos o seguros que los glucocorticoides inhalados, aunque la calidad de la evidencia encontrada es muy baja.
Resumen de la evidencia
|
Calidad muy baja
|
El uso intermitente tanto de montelukast como de budesonida en los episodios de sibilancias por infecciones respiratorias de etiología viral no mejora los resultados en salud (111-113, 118). |
|
Calidad muy baja
|
En el asma persistente el tratamiento con budesonida disminuye el número de pacientes que requieren glucocorticoides orales en comparación con montelukast (117-119). |
|
Calidad muy baja
|
Montelukast puede tener algún efecto beneficioso versus placebo en el tratamiento del asma persistente (114-116). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es la siguiente para cada una de las comparaciones:
- C1: Montelukast vs. Placebo
- C2: Montelukast vs. GCIs
Para ambas comparaciones y tanto con Sibilancias/Asma intermitente como con Asma persistente la calidad global de la evidencia es muy baja.
En preescolares con sibilancias/asma intermitente, montelukast administrado al comienzo de una IRS de etiología viral o de forma continua no disminuye el número de pacientes que requieren glucocorticoide oral, aunque hay evidencia controvertida sobre la severidad de los síntomas y el uso de β2-agonistas.
En preescolares con asma intermitente con episodios moderado o graves, el uso episódico de budesonida al comienzo de una IRS no aumenta el % de días sin síntomas ni disminuye el uso de glucocorticoide oral.
En niños de dos a cinco años con asma persistente, la administración diaria de montelukast sí disminuye el uso de glucocorticoide oral, número de días sin síntomas y severidad frente a placebo.
En asma persistente, el % de pacientes que requieren glucocorticoides orales es menor en el grupo tratado con budesonida que en el grupo tratado con monteluksat.
- El balance entre beneficios y riesgos:
En el caso de Sibilancias/Asma intermitente para ambas comparaciones los beneficios y riesgos están equilibrados.
En el caso de Asma persistente, para la C1 los beneficios superan ligeramente los riesgos/inconvenientes y para C2 los riesgos/inconvenientes superan ligeramente los beneficios.
Usar tanto montelukast como budesonida de forma intermitente en los episodios de infecciones respiratorias de etiología viral no aporta beneficios.
En el asma persistente el uso de montelukast puede tener algún efecto beneficioso versus placebo, pero el uso de budesonida disminuye el número de pacientes que requieren glucocorticoides orales en comparación a montelukast.
- Valores y preferencias de pacientes y/o sus ciudadores: Probable incertidumbre y variabilidad en la opinión sobre los desenlaces.
De los datos del estudio cualitativo realizado en nuestro contexto con madres de niños con asma, se señaló la dificultad de utilizar los inhaladores/nebulizadores en preescolares, y que disponer de un tratamiento administrado vía oral sería más sencillo para ellos. Sin embargo, la elección no es tan clara si la eficacia de ambos no fuera similar.
- Costes y uso de recursos: los costes son altos en relación a los beneficios.
El uso de montelukast tiene un mayor coste que el glucocorticoide inhalado, más aún si se tiene en cuenta que los GCI disminuyen el número de pacientes con exacerbaciones que requieren glucocorticoide oral.
Por lo tanto, la evidencia indica que el uso de forma intermitente de montelukast en los episodios de sibilancias por infecciones respiratorias de etiología viral no aporta beneficios. En el asma persistente parece que es el tratamiento con budesonida el que mejora los síntomas y disminuye el número de pacientes que requieren glucocorticoides orales en comparación a placebo y no montelukast. Sin embargo, montelukast puede tener algún efecto beneficioso versus placebo. Puede haber variabilidad en los valores y preferencias de los pacientes debido a la facilidad de administración de los tratamientos, pero la evidencia y los costes favorecen el uso de los GCI, por ello se llega a esas recomendaciones.
Recomendaciones
|
Débil
|
En preescolares con sibilancias/asma leve intermitente se sugiere no comenzar ninguna medicación. |
|
Débil
|
En niños preescolares con asma leve persisitente se sugiere comenzar tratamiento diario con glucocorticoides inhalados a dosis bajas como tratamiento de elección. |
En niños mayores de cinco años con asma leve persistente, ¿cuál es la eficacia del tratamiento preventivo con glucocorticoides inhalados versus montelukast?
La Guía de Práctica Clínica sobre Asma de Osakidetza/Servicio Vasco de Salud (21) recomienda como tratamiento de primera elección para la prevención de exacerbaciones asmáticas en niños con asma leve persistente la utilización de glucocorticoides inhalados. Sin embargo, sus posibles efectos adversos sobre el crecimiento y el tipo de vía por la que éstos se administran han favorecido el aumento del uso de montelukast.
En la ficha técnica se indica que montelukast no debe sustituir a los glucocorticoides no debe sustituir a los glucocorticoides inhalados. Sin embargo, sí se señala que está indicado como terapia adicional en los pacientes de dos a cinco años con asma persistente de leve a moderada, no controlados adecuadamente con corticosteroides inhalados y en quienes los beta-agonistas de acción corta «a demanda» no permiten un control clínico adecuado del asma.
Por este motivo se ha decidido actualizar esta pregunta, para ver si hay nuevos estudios que puedan aportar nueva evidencia para recomendar o no su uso en monoterapia.
Evidencia científica
En la guía GEMA de 2009 (46) se considera que el tratamiento de elección en el asma leve persistente son los GCI a dosis bajas utilizado de forma regular, aunque también se señala que los antagonistas de los receptores de leucotrienos puede considerarse como tratamiento alternativo. En la guía SIGN (45) se recomiendan los glucocorticoides inhalados como los fármacos para alcanzar los objetivos del tratamiento de prevención, tanto para adultos como niños con asma.
Se han encontrado tres revisiones sistemáticas que respondían a la pregunta clínica (120-122). La revisión de Cochrane está desactualizada (búsqueda hasta el año 2003) (122). La revisión de Miceli Sopo (122) es narrativa y la búsqueda de literatura se realiza hasta 2008. La última revisión identificada (121), además de incluir la búsqueda más reciente, es en niños y meta-analiza los datos de las variables exacerbaciones, función pulmonar final (FEV1% predicho), cambio de la función pulmonar (FEV1), del uso medio de albuterol, cambio en la media de síntomas respecto al basal y hospitalizaciones por exacerbaciones del asma.
Como en esta revisión no se contemplan las variables calidad de vida, disminución de los síntomas nocturnos, hiperreactividad bronquial, abandonos por efectos adversos, variación del crecimiento en un año, casos de neumonía y número de pacientes con alteraciones en el comportamiento, se ha vuelto a los estudios originales y, cuando ha sido posible, se han meta-analizado los datos.
En el estudio de Castro-Rodríguez se identificaron siete ECA (111, 119, 123-127) en los que se comparaba la eficacia de los glucocorticoides inhalados en niños con asma frente a montelukast. En esta revisión se define como exacerbación al uso de glucocorticoides sistémicos, aunque no todos los estudios incluidos en la revisión lo definen de la misma manera.
En cuanto al tipo de paciente asmático, tres estudios incluyen pacientes con asma leve (111, 119, 126) y los cuatro restantes pacientes con asma leve-moderado (123-125, 127).
Los resultados del meta-análisis muestran que los pacientes tratados con GCI presentan una disminución significativa del riesgo de sufrir una exacerbación en comparación a aquellos pacientes que son tratados con montelukast (RR 0,83; IC95% de 0,72 a 0,96). Además, tras un análisis de subgrupos post-hoc, los autores demuestran que factores como la duración del tratamiento, la calidad de los estudios o el patrocinio no influyen en el tamaño del efecto. Se observa que el estudio con más peso (128) incluye pacientes con asma leve, aunque define exacerbación como síntomas que requieren visita a urgencias u hospitalización, uso adicional de glucocorticoides inhalados, glucocorticoide oral o parenteral o más de 10 pulsaciones de albuterol en 24 horas.
Calidad alta
En cuanto al resto de variables, los pacientes tratados con glucocorticoides presentaban un FEV1 % predicho significativamente mayor que aquellos pacientes tratados con montelukast. Los niños tratados con glucocorticoides presentaban una disminución significativa del uso de salbutamol que los niños tratados con montelukast. En este último caso, la diferencia era 0,34 veces la desviación estándar (IC95% de 0,16 a 0,53), aunque los estudios eran heterogéneos. En cuanto al número de pacientes hospitalizados por presencia de exacerbaciones, no se encontraron diferencias significativas entre ambos tratamientos.
Calidad alta
Calidad moderada
Calidad moderada
En lo que corresponde a las variables meta-analizadas para esta pregunta, para lo que también se ha tenido en cuenta 9 ECA adicionales (129, 137), se han encontrado diferencias significativas en la disminución de los síntomas nocturnos (DM=0,14; IC95%=0,01; 0,26) y en la mejora de la hiperreactividad bronquial (DEM=-1,02;IC95%=-1,25;-0,79) para los pacientes tratados con glucocorticoides inhalados frente a los pacientes tratados con montelukast. En cuanto a la calidad de vida, no se observan diferencias.
Calidad alta
Calidad moderada</br /> Calidad alta
No hay diferencias significativas en el número de pacientes que abandona el tratamiento por efectos adversos entre los pacientes tratados con glucocorticoides frente a los tratados con montelukast. Sin embargo, sí parece que la velocidad de crecimiento se ve disminuida de forma significativa para aquellos pacientes tratados con glucocorticoides inhalados, ya que los pacientes tratados con montelukast crecen 0,56 centímetros más (IC95%=0,32;0,79). Sin embargo, queda por conocer cuál es el efecto a largo plazo sobre la talla final que alcanza el niño. La mejor evidencia sobre el efecto de los glucocorticoides inhalados en el crecimiento a largo plazo viene del estudio CAMP (Childhood Asthma Management Program), un ECA de buena calidad con una media de seguimiento de 4,3 años. En este caso, se aleatorizaban 1041 niños asmáticos con budesonida y nedocromil o placebo. El incremento medio de la talla era significativamente menor en los pacientes tratados con budesonida que en los pacientes con placebo (-1,1cm; 22,7cm en comparación con 23,8cm; p=0,005) (138).
Recientemente, se ha publicado una cohorte prospectiva en la que se han seguido 82 niños asmáticos que usaban beclometasona en una media diaria de 351,8 mcg (rango 137,3-1140 mcg). El seguimiento duró una media de 5,2 años (rango 2,3-6,1) y se observó que los parámetros de crecimiento no se veían afectados por la duración del tratamiento o dosis de beclometasona de 500 mcg, 750 mcg y más (p<0,17) (139).
Para el resto de variables de seguridad relacionadas con los glucocorticoides (talla final, crisis adrenales y casos de neumonía) y con montelukast (alteraciones del comportamiento) no se han encontrado suficientes datos en los ensayos clínicos incluidos en la revisión. Por ello, se han realizado búsquedas específicas de estudios y revisiones sobre estos efectos adversos y, cuando ha sido posible, se ha trasladado la información a una tabla GRADE.
En relación a montelukast, en un estudio sobre los posibles BRAES (Behaviour Related Adverse Experiences o Alteraciones del comportamiento) asociados a su utilización se indica que no hay diferencias en los niños de seis a 17 años tratados con montelukast frente a placebo (140). En otro estudio publicado en Suecia, en el que se analizaron todos los reportes de desórdenes psiquiátricos durante el tratamiento con montelukast en niños durante el período 1998-2007, se concluye que los efectos adversos psiquiátricos pueden ocurrir durante el mismo, indicando que se necesitan más estudios para establecer la magnitud del problema (141).
Calidad muy baja
También se ha encontrado un estudio retrospectivo que recoge los casos de nuemonía registrados en ensayos clínicos con budesonida y pacientes con asma, en el que se concluye que el riesgo de tener neumonía en pacientes asmáticos tratados con budesonida o con budesonida y formoterol no aumenta; de hecho, parece que este es menor en comparación con los pacientes que reciben placebo o sólo formoterol (142).
Calidad muy baja
En lo que a las crisis adrenales se refiere, en una revisión reciente sobre efectividad comparada y perfiles de seguridad de fármacos para el control del asma se indica que el uso de glucocorticoides inhalados puede alterar el eje hipotalámico-hipofisario y producir una supresión adrenal (138). Los ensayos publicados utilizan resultados intermediarios para medir este efecto, como los niveles urinarios o séricos de cortisol y resultados de test de estimulación. No está claro hasta qué punto se pueden extrapolar estos resultados para evaluar el riesgo de tener una supresión adrenal clínicamente significativa. Varios estudios de casos indican que la crisis aguda adrenal es un efecto adverso raro del tratamiento con GCI, señalando que su aparición parece asociarse a la utilización de dosis altas de glucocorticoides. En la revisión de Ahmet A, 2011 (143), se indica que la mayor serie de casos viene de un estudio nacional realizado en el Reino Unido, en el que se identificaron 33 casos de supresión adrenal (28 niños y cinco adultos). Todos estaban siendo tratados con altas dosis de glucocorticoides inhalados (500-2000 mcg/día), fluticasona en su mayoría.
Resultados de las alertas bibliográficas (desde el 17/11/2012)
Se ha encontrado una revisión Cochrane publicada en el 2012 (144) en la que si bien los datos sobre los pacientes con exacerbaciones que requieren glucocorticoide oral no coinciden exactamente con los de la revisión de Castro-Rodríguez (145), la conclusión a la que se llega es similar. Los autores concluyen que en niños y adultos con asma leve o moderado persistente los antileucotrienos son menos efectivos para prevenir la aparición de exacerbaciones y alcanzar el control de la enfermedad que los glucocorticoides inhalados a una dosis mediana de 200 HFA-BDP (dipropinato de beclometasona impulsado por hidrofluoralcano) o equivalente. Según los autores, la utilización de antileucotrienos se asocia con un aumento del riesgo en un 51% de sufrir una exacerbación que requiera el tratamiento con glucocorticoides sistémicos, una tasa de hospitallizaciones tres veces mayor y una tasa de abandonos por falta de control del asma dos veces mayor en comparación con el uso de glucocorticoides inhalados.
También se ha encontrado una publicación del estudio CAMP de 2012 en el que se observa que la talla final a los 24,9 (±2,79) años en el grupo tratado con budesonida es 1,2 centímetros menor (IC95%:-1,9;-0,5) en comparación con el grupo placebo (p=0,001). En este estudio se concluye que la disminución inicial en la talla que se asocia al uso de glucocorticoides inhalados en niños prepuberales persiste como una reducción de la talla en la edad adulta, aunque ésta no es ni progresiva ni acumulativa, sino que se da en los dos primeros años de tratamiento (146).
Resumen de la evidencia
|
Calidad alta
|
Los pacientes tratados con GCI presentan una disminución significativa del riesgo de sufrir una exacerbación en comparación a aquellos pacientes que son tratados con montelukast (RR=0,83; IC95% de 0,72 a 0,96). Asimismo, la velocidad de crecimiento en un año se ve disminuida de forma significativa para los pacientes tratados con glucocorticoides inhalados frente montelukast, ya que los tratados con montelukast crecen 0,56 centímetros más (IC 95%=0,32;0,79) (111, 119, 123-127, 140-143). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es alta.
- El balance entre beneficios y riesgos: Los beneficios superan ligeramente los riesgos/inconvenientes.
Los glucocorticoides inhalados son mejores que los antileucotrienos a la hora de disminuir las exacerbaciones que requieren glucocorticoides sistémicos en el asma leve persistente, aunque la diferencia encontrada es menor que la que el grupo elaborador esperaba.
El estudio que más tiene es el de García et al. 2005, que favorece a los glucocorticoides inhalados, está financiando por la industria (Merck) y presentan la variable «asthma rescue free days» como variable principal. El mayor inconveniente que puede haber es la posible reducción en la talla final de los niños tratados con GCI, aunque parece que esta no es superior al centímetro.
- Valores y preferencias de pacientes y/o sus ciudadores: Probable incertidumbre y variabilidad en la opinión sobre los desenlaces.
En el grupo focal realizado con madres de niños con asma, se observa que las madres prefieren un tratamiento oral a un inhalador.
Las madres de niños con asma más grave muestran una mayor preocupación por los efectos adversos de los glucocorticoides. Sin embargo, las madres de niños con asma más leve, estaban satisfechas en este caso con los resultados obtenidos.
- Costes y uso de recursos: Los costes son bajos en relación a los beneficios.
Los glucocorticoides son más baratos, más aún si se tiene en cuenta que su uso disminuye el número de exacerbaciones que requieren glucocorticoides sistémicos, entre otros aspectos.
Por lo tanto, los GCI parecen ser más eficaces en el tratamiento de niños con asma leve persistente, y la mayor preocupación podría estar en los efectos de los glucocorticoides en la talla final de los niños tratados con los mismos, aunque parece que el efecto es menor (1cm sobre la talla final).
Recomendaciones
|
Fuerte
|
En escolares con asma leve persistente se recomienda la utilización de los glucocorticoides inhalados como tratamiento de mantenimiento frente a montelukast. |
7.2. Macrólidos en preescolares con asma o sibilancias:
Preguntas para responder:
- ¿Cuál es la eficacia de los macrólidos en el tratamiento, tanto en reagudizaciones como en prevención, de niños preescolares con asma/sibilancias?
El asma en edad preescolar se caracteriza con frecuencia por presentar reagudizaciones asociadas a cuadros catarrales o virales y por estar prácticamente asintomáticos entre los episodios.
En lactantes y preescolares es más frecuente que en los lavados broncoalveolares (BAL) y las biopsias bronquiales el infiltrado sea neutrofílico y no esonofílico. El asma puede mejorar con el tratamiento continuo con glucocorticoides inhalados o con montelukast, pero muchos precisan dosis elevadas de glucocorticoide inhalado u oral para su control, lo que se asocia a efectos secundarios a corto y largo plazo.
Se ha descrito que los macrólidos son capaces de mejorar la inmunidad inespecífica, la secreción glandular y sobre todo, de disminuir la expresión de receptores ICAM e inhibir, por lo tanto, la adhesión de los rinovirus. Además, también se ha observado in vitro que los macrólidos son capaces de inhibir la activación de los neutrófilos.
Desde el punto de vista fisiopatológico, el uso de macrólidos, sobre todo en lactantes y preescolares, podría ser efectivo en este tipo de asma, que no mejora con la medicación habitual y que tiene un claro desencadenante viral, con episodios autolimitados y escasa sintomatología entre los mismos.
Los macrólidos han demostrado ser eficaces en patologías como el asma corticorresistente, la fibrosis quística, la EPOC y la sinusitis crónica, entre otras enfermedades respiratorias, y aunque en la población de adultos con procesos comórbidos en los que se emplean otras medicaciones aumenta el riesgo cardiaco, la azitromicina ha demostrado ser una medicación segura en pacientes con Fibrosis Quística y EPOC (147-151).
Evidencia científica
Ninguna de las dos guías base (45, 46) trata esta pregunta.
Se han encontrado dos revisiones (152, 153) que estudian si los macrólidos son efectivos como tratamiento añadido en el manejo de pacientes con asma crónica (153) y si troleandromicina ayuda a reducir la dosis de glucocorticoides en pacientes con asma estable corticodependiente (152).
La primera revisión incluye siete ECA (uno de ellos en niños (154) y concluye que no hay suficiente evidencia para apoyar o descartar la utilización de macrólidos en pacientes con asma crónico. La segunda revisión incluye tres estudios (dos de ellos en niños (154, 155)) y concluye que no hay suficiente evidencia para apoyar el uso de troleandomicina en el tratamiento de asma corticodependiente y que ésta no ayuda a disminuir la dosis de glucocorticoides en estos pacientes.
En la actualización de la búsqueda se han encontrado seis estudios más, aunque sólo tres de ellos incluyen niños de seis a 18 años de edad (156-158).
Para responder a esta pregunta se han seleccionado los dos estudios en niños incluidos en las revisiones anteriores (154, 155) y los tres estudios en niños identificados en la actualización (156-158). Se trata de cinco estudios muy pequeños, cuatro de los cuales incluyen niños con asma moderado-severo (154-157) y uno niños con asma intermitente o leve persistente (158).
Dos de los estudios utilizan troleandromicina 250mg/día (154, 155), otros dos azitromicina (250 o 500 mg/día (según peso del niño) durante 24 semanas (12) o una dosis de 10 mg/kg/día durante ocho semanas (157)) y el último utiliza claritromicina 15 mg/kg/día durante tres semanas con o sin medicación adicional (158).
Los tiempos de tratamiento oscilan entre dos semanas y tres meses, siendo tres los estudios que valoran la eficacia del macrólido para disminuir la dosis de glucocorticoides inhalados y dos los que valoran sus efectos sobre la función pulmonar y los síntomas o la gravedad durante las exacerbaciones.
En cuanto al número de pacientes con exacerbaciones que requieren glucocorticoides orales, no se han encontrado diferencias, OR 1,79 (IC95% de 0,54 a 5,93) (157, 158).
Calidad muy baja
La adición de azitromicina en asma moderado-severo tampoco disminuye de forma significativa la dosis de glucocorticoides en pacientes con asma moderada-severa corticodependiente (DEM -0,7 (IC95% de -1,63 a 0,23))(154, 155).
En niños con asma intermitente o leve persistente, la adición de claritromicina durante tres semanas al tratamiento habitual se asocia con una diferencia de nueve días más sin síntomas (IC95% de 6,33 a 11,67) y con la disminución de la duración y gravedad durante el primer período de pérdida de control (158). En asma moderado-severo sólo un estudio recoge mejoría significativa en los síntomas tras añadir troleandromicina al tratamiento estándar con metilprednisolona (reducción del 50% en la puntuación) (154).
Calidad baja
Calidad muy baja
En cuanto a la hiperrespuesta bronquial, un estudio señala que la PC20 disminuye en los dos grupos que llevan metilprednisolona pero no en el grupo tratado con troleandomicina y prednisona (154); el segundo indica que el porcentaje de caída del FEV1 es mayor en el grupo tratado con azitromicina (de 2,75%(DT=2,12) a 1,42%(DT=1,54)) que en el grupo con placebo (de 1,48%(DT=1,75) a 1,01%(DT=1,38)) (12). Y el tercer estudio señala que la respuesta mejora (aunque no de forma significativa) en más pacientes del grupo tratado con TAO/MP (155) que en los demás grupos.
Calidad muy baja
La función pulmonar no mejora de forma significativa al añadir un macrólido. La revisión Cochrane de Evans (152), que incluye los resultados de Ball y Kamada (154, 155), indica que la DEM es de 0,06 veces más (de 0,8 menos a 0,92 más) y el tercer estudio encuentra que no hay diferencias significativas en la mejora del FEV1 en los que llevan tratamiento con azitromicina.
Calidad baja
Tampoco hay más abandonos por efectos adversos en niños a los que se les añade macrólidos al tratamiento habitual (156,158).
Calidad muy baja
En cuanto a la hospitalización, sólo un estudio menciona que no ha habido ningún evento en ninguno de los grupos de tratamiento.
Calidad muy baja
Además de los estudios evaluados se han encontrado dos ensayos clínicos en marcha (ver tabla 1) sobre la utilización de macrólidos en niños con asma, uno de ellos en niños preescolares. Sin embargo, todavía no se dispone de resultados.
Resistencia a antibióticos
Uno de los inconvenientes para utilizar macrólidos en el tratamiento de asma a dosis sub-bactericidas es el papel que puede tener en el aumento de la resistencia a estos antibióticos. En un estudio realizado en Gipuzkoa entre 2005 y 2007 (159) se observa una disminución de las resistencias del neumococo atribuida a una mejor prescripción y a la utilización de la vacuna conjugada en pediatría. Por eso se insiste en su uso adecuado, a dosis altas y por períodos de tiempo reducidos. En este estudio se indica que las cepas más resistentes se aislaron en niños menores de cinco años con otitis media. Además, más del 90% de las cepas presentaban resistencia cruzada, resistencia de alto nivel que no se supera por mucho que se eleve las dosis de antibióticos. En cuanto a Streptococcus pyogenes, los macrólidos son la alternativa de elección en caso de alergia a penicilina, aunque hay una tasa elevada de resistencia disociada a los mismos (159). En el estudio SAUCE sobre resistencia antibiótica de patógenos respiratorios en España (160) se describe que aunque ha habido un descenso de la resistencia a diferentes antibióticos, la resistencia de Streptococcus pneumoniae a eritromicina, claritromicina y azitromicina sigue siendo del 20%, y de Streptococcus pyogenes de 19% a eritromicina y 11,6% a azitromicina, respectivamente. Sin embargo, cabe mencionar que en la actualidad se han publicado dos estudios sobre macrólidos sin efecto antibacteriano, uno en Fase I y otro en Fase II (161) nuevos fármacos que podrían suponer la superación el problema de las resistencias en el futuro.

Resultados de alertas bibliográficas
Recientemente se ha publicado un meta-análisis (114-116) (sobre la utilización de macrólidos para el manejo de asma a largo plazo, en la que se incluyen estudios realizados tanto en niños como en adultos, entre los que se encuentran dos de los estudios ya incluidos en la pregunta. Los autores concluyen que la administración de tres o más semanas de macrólidos para el asma no mejora el FEV1 pero sí el flujo espiratorio máximo, los síntomas, la calidad de vida y la hiperrespuesta bronquial, por lo que concluyen que el tratamiento añadido con macrólidos en el asma puede ser beneficioso, aunque se necesitan estudios sobre seguridad y efectividad a largo plazo que utilicen protocolos y resultados estandarizados.
Resumen de la evidencia
|
Calidad muy baja
|
No hay beneficios demostrados para la utilización de macrólidos en el tratamiento de niños con asma tanto en la disminución de número de pacientes con exacerbaciones que requieren glucocorticoides orales como en la reducción de dosis de glucocorticoides en pacientes con asma moderada-severa corticodependiente (154-158). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es muy baja.
Gran heterogeneidad en las pautas y en el tipo de pacientes. Además no hay estudios publicados con niños preescolares, aunque si se han identificado dos estudios en marcha que todavía no han publicado sus resultados.
- El balance entre beneficios y riesgos: Los riesgos/inconvenientes superan ligeramente los beneficios.
No hay beneficios demostrados para la utilización de macrólidos en el tratamiento de niños con asma.
Puede que la utilización de macrólidos a dosis bajas con otro propósito diferente al tratamiento de infecciones bacterianas produzca un aumento de la resistencia a macrólidos. Habría que tener esto en cuenta a la hora de valorar su utilización, sobre todo si la calidad de la evidencia en relación a la eficacia en el tratamiento de niños con asma es muy baja.
- Valores y preferencias de pacientes y/o sus cuidadores: Probable incertidumbre y variabilidad en la opinión sobre los desenlaces.
- Costes y uso de recursos: Los costes están en el límite en relación a los beneficios.
Por lo tanto, se han encontrado pocos estudios y de diseño muy heterogéneo que no demuestran beneficio a la hora de utilizar macrólidos en el tratamiento de niños preescolares con asma/sibilancias en la práctica habitual. Además, su uso crónico o por largas temporadas puede llevar a la aparición de resistencias bacterianas, efecto secundario poblacional que debería ser sopesado con los efectos secundarios que sobre estos pacientes tienen las dosis altas de glucocorticoides inhalados y el uso de glucocorticoide oral como tratamiento de las crisis o como tratamiento de fondo.
Dada la heterogeneidad y la escasa calidad de los estudios, en la actualidad no existe evidencia suficiente para recomendar su uso en el asma del niño. Su uso debería estar limitado a pacientes seguidos en consulta hospitalaria y que presentan asmas corticorresistentes y en las que por la ausencia de atopia y la nula mejoría con la medicación habitual se sospecha un asma neutrofílica.
Recomendaciones
|
Fuerte
|
Se recomienda no utilizar macrólidos en el tratamiento de preescolares con sibilancias /asma en la práctica clínica habitual. |
|
√
|
En ausencia de evidencia se debería limitar el uso de macrólidos al contexto de investigación y en lactantes-preescolares con asma de difícil control (que no hayan respondido a la medicación habitual o la requieran a dosis asociadas a importantes efectos secundarios), y exclusivamente en atención especializada. |
7.3. Eficacia de los diferentes GCI
Preguntas para responder:
- ¿Cuál es la efectividad de los diferentes GCI para el tratamiento de mantenimiento de niños con asma?
En la Guía de Práctica Clínica sobre Asma de Osakidetza/Servicio Vasco de Salud, se recoge evidencia de alta calidad que define a los GCI como el tratamiento preventivo más efectivo para el asma de distintos niveles de gravedad, tanto en adultos como en niños de todas las edades (162-164). En lactantes y niños preescolares con diagnóstico médico de asma los GCI mejoran el control del asma, en lo que se refiere a síntomas, disminución del riesgo de exacerbaciones y el uso de medicación de rescate (165-167) y en niños de dos a cinco años mejoraron la HRB y la función pulmonar a corto plazo pero no a largo plazo.
Se recomienda que todos los niños y adultos con asma leve persistente reciban GCI. En niños con asma leve persistente se recomienda su introducción precoz y en el niño de cualquier edad que presenta episodios frecuentes de sibilancias (aunque no presente síntomas entre las crisis) se recomienda la valoración de la introducción de GCI.
Con una creciente gama de GCI para elegir, es importante establecer su eficacia y seguridad. Por ello, el objetivo de esta revisión es comparar los resultados de eficacia y seguridad relativa de los diferentes GCI comercializados en nuestro entorno (budesonida, beclometasona, fluticasona, ciclesonida y mometasona) para el tratamiento del asma crónico en niños.
Evidencia científica
La guía SIGN actualizada a 2011 (45), a pesar de que comenta la existencia de una serie de revisiones Cochrane que comparan diferentes esteroides inhalados, puntualiza que no las han incluido en la actualización, debido a que estas revisiones han llegado a sus mismas conclusiones, aunque utilizando una metodología distinta. En la revisión de la evidencia realizada por la guía SIGN, se excluyen además muchos estudios que comparan diferentes GCI por tener diseños inadecuados. GEMA 2009 (46) incluye dos RS en 2005, aunque no se comparan los diferentes fármacos, sino que se compara la efectividad de diferentes GCI frente a placebo. En resumen, las dos guías son consistentes en recomendar los GCI inhalados como tratamiento de elección, sin especificar prioridad entre ellos.
En relación con resultados de seguridad, la guía de SIGN remarca la importancia de la evaluación individual del equilibrio entre beneficios y riesgos en cada caso, particularmente en pacientes infantiles con altas dosis de GCI. Resultados de un metaanálisis muestran que las dosis de GCI por encima de 400 microgramos de BUD o dosis equivalentes, pueden estar asociados a efectos adversos sistémicos, tales como la falta de crecimiento y supresión adrenal (168). Aunque éste último efecto secundario ha sido identificado en un pequeño número de niños tratados mayoritariamente con altas dosis. La dosis del tratamiento con CGI requerida para provocar a un niño una situación de riesgo de insuficiencia suprarrenal clínica es desconocido, aun así se considera probable que se produzca en dosis ≥ 800 microgramos de BDP (dipropionato de beclometasona) por día o equivalente. Se considera que con ajustes adecuados de dosificación de GCI los efectos adversos son compensados por su capacidad de disminución de necesidad de tratamiento esteroideo oral por exacerbaciones (169). En la guía SIGN, por tanto, se recomienda la utilización de dosis mínima necesaria para mantener el control y la monitorización anual del crecimiento de la población infantil con asma.
Para dar respuesta a la pregunta sobre selección de GCI en el tratamiento de niños asmáticos hemos considerado los estudios comparativos entre los diferentes GCI comercializados en España (budesonida, beclometasona, fluticasona, mometasona y Ciclesonida), no se han considerado estudios que evalúan la eficacia de GCI frente a placebo. En primer lugar, se ha decidido utilizar evidencia procedente de estudios realizados en niños y en el caso de no disponer de los mismos, se ha utilizado la evidencia procedente de la población adulta, considerándolo indirecta y de menor calidad.
En la búsqueda bibliográfica se han identificado dos informes de evaluación de tecnologías sanitarias de NICE (National Institute for Clinical Excellence), elaborados en 2007 y actualizados en 2012, que evalúan la efectividad comparada de los diferentes GCI en pacientes ≥ 12 años (170) y en niños menores de 12 años (171). También se ha identificado una RS del 2013 (172) que evalúa la eficacia y los efectos adversos de ciclesonida frente a otros GCI en niños asmáticos, así como otra RS del 2013 que incluye estudios que evalúan la eficacia de mometasona frente a otros GCI (173), aunque en este caso los estudios incluidos se realizaron en pacientes niños ≥ 15 años y adultos.
Siguiendo la base de la RS Cochrane del 2007 (168), incluido narrativamente en la actualización de los informes de ETS de la NICE (170, 171), se ha seleccionado y resumido la evidencia de estudios realizados solo en niños y se ha organizado por subgrupos de comparaciones. En el caso en el que no se disponga de ningún estudio para alguna comparación se ha resumido la evidencia procedente de estudios realizados en adultos.
La siguiente tabla resume las comparaciones evaluadas en los ECA incluidos en esta revisión:
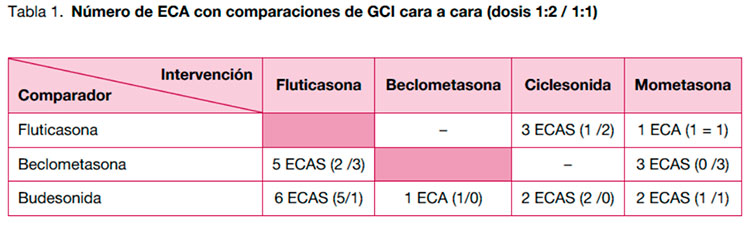
En total se incluyen 23 ECAS que evalúan la eficacia de 13 diferentes comparaciones a dosis 1:2 y 11 a dosis 1:1. De entre los estudios incluidos solo 17 fueron realizados en niños.
No se han identificado estudios realizados en niños que evalúen la eficacia con mometasona. En total se ha identificado 23 ECA (Tabla 2).

Fluticasona vs. Beclometasona o budesonida
Los informes de ETS de NICE (170, 171) resumen la evidencia de forma narrativa, y su actualización del 2012 incluye una RS Cochrane publicada en el 2007 (172). Dicha revisión compara la efectividad de tres GCI, comparando fluticasona con beclometasona o budesonida en el tratamiento de adultos y niños con asma, donde se presentan los resultados meta-analizados de los estudios incluidos en el informe de ETS de NICE y algún otro ECA.
La RS (172) presenta datos del análisis de subgrupos por edades, por lo que hemos podido utilizar los datos de resultados independientes para los niños. En dichos estudios la efectividad relativa a dosis 1:2 y 1:1 se ha valorado sobre resultados de función pulmonar (FEV1, PEF, PEF%), no obteniéndose resultados sobre exacerbaciones, síntomas o eventos adversos, resultados priorizados para esta evaluación. En la actualización de los informes en el 2012 también se menciona dos nuevos (169, 178) estudios no incluidos en las revisiones previas.
Comparación 1 y 3: Fluticasona (FP) vs. Beclometasona (BDP)
Dos ECA (174, 175) compararon la eficacia y la seguridad de FP frente a BDP en población infantil, a dosis 1:2 (FP: 200 µg/día vs. BDP: 400 µg/día) y otros tres estudios (176-178) a dosis 1:1 (FP: 400 µg/día vs. BDP: 400 µg/día).
Los estudios a dosis 1:2 diferían en su tamaño muestral (398 vs. 23) y en la población de pacientes. En uno (175) se incluían, pacientes no tratados previamente con GCI y el otro ECA (174) incluía pacientes tratados previamente y con un mal control. Los resultados sobre la función pulmonar no muestran diferencias estadísticamente significativas y respecto a los síntomas, uso de medicación de rescate, exacerbaciones y eventos adversos no fueron recuperables. Se trata de estudios con un tamaño muestral pequeño y uno de ellos promovido por la industria, por lo que se considera que los resultados son de calidad baja.
Calidad baja
En los estudios a dosis 1:1, se compararon dosis de 400 µg/día de ambos fármacos. Uno de los tres estudios identificado en las búsquedas realizadas para esta revisión, se trata de un pequeño estudio abierto (N=50 niños) del 2010 (178) en el que la efectividad se evalúa mediante mediciones de FP durante tres meses, que no se ha podido incluir en la estimación global del efecto. En ambos grupos de este estudio se observaron mejoras estadísticamente significativas en las mediciones de FP a lo largo de los tres meses. Se observó además una diferencia estadísticamente significativa en la mejora de FEV1 (P< 0,005) y FEV1/FVC, FEF25-75 (P < 0,005) a favor del grupo con fluticasona. La mejora de los síntomas nocturnos al primer mes y de los síntomas diurnos al segundo mes, también mostraron diferencias significativas respecto al tratamiento con beclometasona.
En los datos metaanalizados de los otros dos estudios (176, 177) los resultados sobre función pulmonar muestran diferencias estadísticamente significativas a favor del grupo tratado con FP, con mejores resultados de FEV1 y PEFR matutino. Se trata de estudios con un tamaño muestral relativamente pequeño, en algún caso promovido por la industria farmacéutica y, por lo general, con OSA (Ocultación de la Secuencia de Aleatorización) y aleatorizaciones no muy claras; por ello, se considera que los resultados son de baja calidad.
Calidad baja
Comparación 2 y 4: Fluticasona (FP) vs. Beclometasona (BDP)
Cinco estudios (169, 179-182), compararon la eficacia y la seguridad de FP frente a BUD en población infantil a dosis 1:2 ( 2 estudios a FP: 200 µg/día vs. BUD: 400 µg/día, y otros tres estudios a FP: 400 µg/día vs. BUD: 800 µg/día), Un único estudio (183) a dosis 1:1 (FP: 400 µg/día vs. BUD: 400 µg/día).
Los estudios a dosis 1:2 (169, 179-182) diferían en la dosificación utilizada. En relación a los resultados sobre la función pulmonar, solo se observan diferencias estadísticamente significativas en el cambio de PEFR matutino a favor del grupo tratado con FP. Resultados de FEV1y PEF clínico fueron similares en ambos grupos. Se trata de estudios en algún caso promovido por la industria farmacéutica, uno de ellos abierto y, por lo general, con OSA y aleatorizaciones no muy claras; por ello, se considera que los resultados son de calidad baja.
Calidad baja
El estudio (183) a dosis 1:1 también muestra resultados similares de la función pulmonar en ambos grupos y una diferencia significativa a favor de FP solo observado en resultados de PEF matutino. Se trata de un estudio mediano bien realizado, con resultados con intervalos de confianza amplios y promovido por la industria, por eso se considera que los resultados son de calidad baja.
Calidad baja
En resumen, se considera que estos estudios no parecen apoyar la superioridad de ninguno de estos fármacos frente al otro. A pesar de que FP muestra mejores resultados pulmonares a dosis 1:1, no se han demostrado mejorías en resultados clínicamente relevantes, por tanto, podrían considerarse clínicamente equivalentes.
Beclometasona vs. Budesonida
Comparación 5: Beclometasona (BDP) vs. Budesonida (BUD)
Un pequeño ECA(184) multicéntrico (n=41) realizado en niños asmáticos evalúa la eficacia del tratamiento con incremento de dosis de BDP (200, 400 y 800 microgramos/día) en relación al tratamiento a dosis estables de BUD (400 microgramos/día). Los dos tercios de la duración del tratamiento se realizaron a bajas dosis, por lo que la comparación de los dos fármacos a lo largo de los tres meses de estudio se considera a dosis 1:1.
La función adrenal mostró un deterioro significativo con el tratamiento de incremento de dosis de BDP, pero el efecto global sobre la función adrenal no difirió significativamente entre los dos grupos de tratamiento. Los resultados de la función pulmonar (PEFR), uso de medicación de rescate y seguridad fueron similares según los autores. Los datos aportados en el estudio son difíciles de interpretar por lo que no se han podido realizar las estimaciones oportunas. Se considera que la evidencia procedente de este ECA es de muy baja calidad para los resultados de nuestro interés, por sus limitaciones de diseño (aleatorización no clara, OSA desconocido, análisis por protocolo) pequeño tamaño muestral e imprecisión de resultados.
Calidad baja
En resumen, existe una muy limitada evidencia con estudios que incluyen a población menor de 12 años y no hay evidencia con menores de cinco años. La calidad metodológica de los ECA incluidos varió y hubo variabilidad en la forma en que se midieron y se reportaron los resultados. En general, hubo pocas diferencias estadísticamente significativas entre los tres GCI (FP, BDP y BUD) cuando se evaluó por pares.
Ciclesonida vs. Fluticasona o budesonida
En relación con la efectividad comparada de la ciclesonida, la RS publicada en 2013 (172) incluye seis estudios que comparaban el tratamiento de ciclesonida con budesonida o fluticasona durante tres meses en 3,256 niños (de cuatro a 17 años) con asma crónica. Todos los estudios incluidos en esta revisión (172) fueron diseñados como ensayos de no inferioridad. Los pacientes incluidos en los estudios publicados tenían entre cuatro y 15 años y diagnosticados con asma moderada a severa crónica, con un FEV1 relativamente pobre como requisito al inicio del estudio, en la mayoría de los estudios incluidos. Se usaron diferentes sistemas de administración y dosificaciones diferentes, tanto de ciclesonida como de los otros GCI comparadores (ciclesonida de 80 a 320 µg, budesonida 400 a 800 µg, y fluticasona de 88 a 176 µg), aunque las dosis de partida en los estudios estaban dentro de los rangos aceptados para los niños con asma de distinta gravedad.
Comparaciones 6 y 8: Cilesonida (CLI) vs. Fluticasona (FP)
Uno de los estudios (n=502) (185) que evaluó ciclesonida frente a fluticasona, a dosis 1:2, muestra que los niños tratados con ciclesonida presentaron más exacerbaciones que los tratados con fluticasona RR 3,57 IC95% (1,35 a 9,47), sin observarse diferencias en los efectos adversos y los síntomas. La calidad de la evidencia de los resultados se considera baja o muy baja, debido a bajo tamaño muestral, resultados imprecisos y patrocinado por la industria.
Calidad muy baja
Calidad baja
El tratamiento de ciclesonida frente a fluticasona (a dosis 1:1) se ha evaluado en dos ECAS (n=1,048) (185, 186) y no se han mostrado diferencias relevantes en resultados de exacerbaciones, síntomas asmáticos y efectos adversos. Las estimaciones son de muy baja a baja calidad debido a la evidencia indirecta procedente de utilización de dosis mayores a las habituales en la práctica clínica, estimaciones imprecisas por bajo número de eventos y pocos estudios que fueron además patrocinados por la industria.
Calidad muy baja
Calidad moderada-baja
Comparación 7: Ciclesonida (CLI) vs. Budesonida (BUD)
El tratamiento de ciclesonida frente a budesonida (a dosis 1:2) en dos ECAS (n=1,024) (187, 188) no han mostrado diferencias relevantes en exacerbaciones, síntomas asmáticos y calidad de vida. Las estimaciones son de muy baja a baja calidad debido a la evidencia indirecta procedente de utilización de dosis mayores a las habituales en la práctica clínica, estimaciones imprecisas por bajo número de eventos y pocos estudios que fueron además patrocinados por la industria.
Calidad muy baja-
baja-baja
No se dispone de evidencia de la efectividad comparada de ciclesonida frente a beclometasona en niños asmáticos.
En resumen, no se ha podido demostrar ni rechazar un efecto relativo beneficioso sobre los síntomas asmáticos, exacerbaciones y efectos secundarios. Ciclesonida no se muestra inferior en comparación con budesonida o fluticasona en términos de función pulmonar. Por tanto, los resultados sobre la eficacia y seguridad relativa de la ciclesonida en comparación con budesonida o fluticasona no son concluyentes, ya que en general, se encontraron relativamente pocos estudios, se compararon diferentes inhaladores y el tiempo de tratamiento y de seguimiento (12 semanas) de los estudios fue demasiado corto para la evaluación de los resultados clave como número de exacerbaciones y retraso del crecimiento.
Mometasona vs. Fluticasona, beclometasona o budesonida
En la revisión de la bibliografía se ha identificado el único estudio realizado en niños entre cuatro y 11 años de edad (195). Se trata de un ensayo abierto y financiado por los productores de mometasona, que evaluaba la seguridad a largo plazo (52 semanas) de dos dosificaciones diferentes de mometasona inhalada (100µg/dos veces al día y 200µg/día) en niños con asma leve a moderada frente a beclometasona (168 µg/día). Sin embargo, los datos aportados en la publicación no han sido suficientes para extraer las estimaciones de efecto. Por ello, se ha optado por describir este estudio solo narrativamente y sintetizar la evidencia procedente de ensayos realizados en niños mayores y adultos en su mayoría.
Los ensayos sintetizados realizados en adultos y seleccionados para responder a esta pregunta, proceden del informe de ETS de la NICE (170) actualizada en 2012 y de la RS de 2013 (173) que evalúa la eficacia y seguridad de mometasona en relación a cualquier GCI con dosis diarias equipotentes, en pacientes con asma moderada a severa con tratamiento previo de GCI.
Para mantener la consistencia en la síntesis de la evidencia se ha procedido a seguir el esquema de presentar los resultados por subgrupos de comparación, por eso no se han utilizado los resultados agrupados presentados en la revisión del 2013, si no que se han extraído los resultados de los estudios individuales para organizar la evidencia por subgrupos de fármacos comparadores.
Comparaciones 9 y 11: Mometasona (MF) vs. Fluticasona (FP)
Un ECA (189) paralelo multicéntrico, publicado en 2001 y que incluía 733 pacientes comparó la eficacia y la seguridad de mometasona frente a fluticasona. El estudio contenía cuatro brazos de tratamiento en los que se compararon tres dosis diferentes de mometasona (200, 400 y 800 µg/día) con una dosis estable de FP (500 µg/día). Hemos resumido las comparaciones obtenidas en las dosificaciones bajas (MF: 200 µg/día y 400 µg/día, 1:2 y 1:1; respectivamente).
A dosis 1:2 (MF 200 µg/día vs. FP 500 µg/día), en el grupo de mometasona se observaron menos efectos adversos debidos al tratamiento (20%) que en grupo de fluticasona (29%), sin observarse diferencias estadísticamente claras aunque tiene su relevancia clínica. Los abandonos debidos al tratamiento fueron similares en ambos grupos. En relación a resultados de la función pulmonar, a pesar de no observarse diferencias significativas en el cambio del FEV1 matutino, el cambio en el PEFR matutino fue significativamente mayor, y por tanto mejor, en el grupo de fluticasona.
Calidad baja
Calidad moderada
A dosis 1:1 (MF 400 µg/día vs. FP 500 µg/día), los grupos de tratamiento no mostraron diferencias estadísticamente significativas a favor de ningún fármaco. Los efectos adversos y abandonos debidos al tratamiento, cambio del FEV1 matutino y el cambio en el PEFR matutino fueron similares para ambos grupos.
Calidad baja
Calidad moderada
Los datos proceden de un estudio paralelo bien diseñado (189) y ejecutado, aunque con una OSA no clara, que incluye pacientes >12 años con mayoría de adultos, por lo que se considera que la evidencia es indirecta, no probada en población pediátrica. Además, el bajo número de eventos sobre ciertos resultados, acarrea resultados imprecisos. Por todo ello se considera una baja calidad de evidencia de los resultados críticos de nuestro interés.
Comparaciones 12: Mometasona (MF) vs. Beclometasona (BDP)
El estudio prospectivo abierto multicéntrico, el único realizado en niños (195) pretendía evaluar la seguridad de utilización de mometasona e incluía a 233 pacientes de cuatro a 11 años de edad con diagnóstico de asma persistente de al menos seis meses de duración. En este estudio, que solo se presenta narrativamente y no ha sido sintetizado en las tablas de evidencia por falta de datos, los pacientes fueron aleatorizados a tres brazos de tratamiento mometasona 100µg/dos veces al día, mometasona 200µg/día (el doble de dosificación de la aprobada por la FDA (Food and Drug Administration) o beclometasona 168 µg/ dos veces al día, durante un periodo de 52 semanas. Los resultados de seguridad evaluados en el niño fueron eventos adversos, signos vitales, examen físico y pruebas de laboratorio.
En resumen, la incidencia de efectos adversos fue similar en los tres grupos de tratamiento de niños. El evento adverso más frecuente fue la infección del tracto respiratorio superior, 47%-49% de los pacientes con tratamiento de mometasona y el 51% de los pacientes tratados con beclometasona. La mayoría de los eventos adversos se consideraron no relacionados con el fármaco del estudio, Los eventos más frecuentes fueron dolor de cabeza (MF-200µg: 8%; MF- 100 µg dos veces al día: el 4%; beclometasona – MDI (Inhaladores de dosis medida) 168 µg dos veces al día: 2%) y la candidiasis oral (4% en cada tratamiento grupo). No hubo cambios clínicamente relevantes en las pruebas de laboratorio, como el cortisol plasmático, signos vitales o los exámenes físicos se observaron en ningún grupo de tratamiento. Y el tiempo para la primera exacerbación asmática fue similar en los tres brazos de estudio (31, 35 y 17 semanas p=0,370). Por tanto, se considera que la mometasona es bien tolerada por la población infantil y que muestra un perfil de seguridad similar a la beclometasona.
Calidad muy baja
Calidad muy baja
Se considera que los resultados son de baja a muy baja calidad debido al pequeño tamaño muestral en cada brazo de tratamiento y bajo número de eventos que hacen que las estimaciones sean imprecisas. Además, se sugiere la existencia riesgo de sesgo por utilización de dosis no recomendadas y el hecho de que el estudio haya sido patrocinado por los fabricantes del fármaco en estudio.
Los estudios resumidos en las tablas de evidencia y realizados en adultos fueron tres pequeños ECA (190-192) publicados en 1999 y 2001 (n=416) que evaluaron la efectividad de mometasona frente a beclometasona a dosis 1:1 (400 µg/día vs. BDP 336 µg/día). En relación a resultados de la función pulmonar, el grupo tratado con mometasona se observó un mayor cambio en el FEV1 y PEFR matutino, que en el grupo de beclometasona. Los resultados sobre efectos adversos y abandonos debidos al tratamiento fueron sin embargo, similares en ambos grupos. Se considera una calidad baja de los resultados más críticos debido a que los datos proceden de estudios realizados en población adulta y no pediátrica, con bajo número de pacientes y número de eventos que derivan en estimaciones imprecisas con amplios intervalos de confianza.
Calidad moderada y baja
Comparaciones 10 y 13: Mometanona (MF) vs. Budesonida (BUD)
Dos ECA (193, 194) multicéntricos realizados en niños mayores de doce años y adultos.
El ECA publicado en el 2000 (193) evalúa la efectividad comparada de diferentes dosis de mometasona (200, 400 y 800 µg/día) frente a dosis altas mantenidas de budesonida (800 µg/día). Los datos derivados de la comparación mometasona 400 µg/día vs. budesonida 800 µg/día, se han resumido como valoración de la efectividad de mometasona a dosis 1:2.
Se observa que en el grupo tratado con mometasona hubo un menor número de abandonos debidos al tratamiento que en el grupo tratado con budesonida, y además, el cambio en el FEV1 también fue significativamente algo mejor. Las estimaciones proceden de un estudio realizado en adultos, con pequeño tamaño muestral y a veces bajo número de eventos con estimaciones imprecisas, por lo que se considera una moderada calidad de la evidencia.
Calidad moderada
El ECA publicado en el 2003 (194), compara la efectividad relativa de mometasona (400 µg/día) frente a budesonida (400 µg/día) o placebo. Los resultados de la comparación a dosis 1:1, no muestran diferencias estadísticamente significativas en los resultados sobre número de pacientes con efectos adversos y abandonos debidos al tratamiento. Sin embargo, los resultados sobre cambio en la necesidad de medicación de rescate muestra una ligera mejoría significativa frente al tratamiento con budesonida, así como resultados de la función pulmonar en el cambio matutino de FEV1 y PEFR a favor del grupo tratado con mometasona.
Calidad baja
Calidad moderada
En resumen, la evidencia indirecta procedente de estudios realizados en niños mayores de 12 años y adultos, muestra que mometasona podría proporcionar nos peores resultados de la función pulmonar en comparación con fluticasona (a dosis 1:2) y mejores resultados en comparación con beclometasona (a dosis 1:1) y budesonida (a dosis 1:2 y 1:1). Por otro lado, en relación a resultados más críticos, se ha observado que mometasona podría ser más segura, por su menor tasa de efectos adversos, que la fluticasona (a dosis 1:2) y que la budesonida (a dosis 1:2), por su menor tasa de abandonos debidos al tratamiento y menor necesidad de medicación de rescate.
Resumen de la evidencia
|
Fluticasona vs. Beclometasona o budesonida
|
|
Calidad baja
|
En resumen se considera que los estudios que comparan fluticasona frente a beclometasona a dosis 1:2 (174, 175) y a dosis 1:1 (176-178) y fluticasona frente a budesonida a dosis 1:2 (169, 179-182), y a dosis 1:1 (183) no parecen apoyar la superioridad de ninguno de estos fármacos frente al otro. A pesar de que FP muestra mejores resultados pulmonares a dosis 1:1, no se han demostrado mejorías en resultados clínicamente relevantes, por tanto, podrían considerarse clínicamente equivalentes. |
|
Beclometasona vs. Budesonida
|
|
Calidad baja
|
Un estudio pequeño con una muy limitada evidencia que incluye a población de entre siete a 15 años, mostró resultados de la función pulmonar (PEFR), uso de medicación de rescate y seguridad similares para ambos fármacos (184). |
|
Ciclesonida vs. Fluticasona o budesonida
|
|
Calidad moderada, baja y muy baja
|
No se ha podido demostrar ni rechazar un efecto relativo beneficioso sobre los síntomas asmáticos, exacerbaciones y efectos secundarios. Ciclesonida no se muestra inferior en comparación con budesonida o fluticasona en términos de función pulmonar. Por tanto, los resultados sobre la eficacia y seguridad relativa de la ciclesonida en comparación con budesonida o fluticasona no son concluyentes, ya que en general se encontraron relativamente pocos estudios, se compararon diferentes inhaladores y el tiempo de tratamiento y de seguimiento (12 semanas) de los estudios fue demasiado corto para la evaluación de los resultados clave como número de exacerbaciones y retraso del crecimiento (172, 185-188). |
|
Mometasona vs. Fluticasona, beclometasona o budesonida
|
|
Calidad moderada, baja y muy baja
|
La evidencia indirecta procedente de estudios realizados en niños mayores de 12 años y adultos, muestra que mometasona podría proporcionar unos peores resultados de la función pulmonar en comparación con fluticasona (a dosis 1:2) y mejores resultados en comparación con beclometasona (a dosis 1:1) y budesonida (a dosis 1:2 y 1:1). Por otro lado, en relación a resultados más críticos, se ha observado que mometasona podría ser más segura, por su menor tasa de efectos adversos, que la fluticasona (a dosis 1:2) y que la budesonida (a dosis 1:2), por su menor tasa de abandonos debidos al tratamiento y menor necesidad de medicación de rescate. (189-195). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es la siguiente para cada una de las comparaciones:
- C-1: Fluticasona vs. Beclometasona (1:2), es muy baja
- C-2: Fluticasona vs. Budesonida (1:2), es baja
- C-3: Fluticasona vs. Beclometasona (1:1) , es baja
- C-4: Fluticasona vs. Budesonida (1:1) , es baja
- C-5: Beclometasona vs. Budesonida (1:1) , es baja
- C-6: Ciclesonida vs. Fluticasona (1:2) , es muy baja
- C-7: Ciclesonida vs. Budesonida (1:2) , es muy baja
- C-8: Ciclesonida vs. Fluticasona (1:1) , es muy baja
- C-9: Mometasona vs. Fluticasona (1:2) , es baja
- C-10: Mometasona vs. Budesonida (1:2) , es baja
- C-11: Mometasona vs. Fluticasona (1:1) , es baja
- C-12: Mometasona vs. Beclometasona (1:1) , es baja
- C-13: Mometasona vs. Budesonida (1:1) , es baja
- El balance entre beneficios y riesgos: C1, C2, C3, C4, C5, C7, C8, C11 y C12 los beneficios y riesgos/ están equilibrados.
En C6 los riesgos/ inconvenientes superan ligeramente los beneficios.
En C9, C10 y C13 los beneficios superan ligeramente los riesgos/ inconvenientes.
- Valores y preferencias de pacientes y/o sus cuidadores: Probable incertidumbre y variabilidad en la opinión sobre los desenlaces.
La gradación de la importancia de las variables de resultado de los clínicos no difería sustancialmente respecto a la gradación de los familiares de pacientes. (Ejercicio Grade: clínicos vs. Pacientes)
- Costes y uso de recursos: Los costes están en el límite en relación a los beneficios.
Los fármacos más nuevoss, en general, son más caros. (Ver tablas de coste tratamiento día en las fichas).
CTD de menor a mayor: Beclometasona <budesonida<fluticasona<mometasona<ciclesonida.
Por lo tanto, existe una muy limitada evidencia con estudios que incluyen a población menor de 12 años y no hay evidencia con menores de cinco años.
La calidad metodológica de los ECA que evalúan la fluticasona frente a beclometasona o budesonida varió y hubo variabilidad en la forma en que se midieron y se reportaron los resultados. No se dispone de evidencia sobre resultados importantes para pacientes y en relación a desenlaces de función pulmonar, en general hubo pocas diferencias significativas entre los tres GCI (FP, BDP y BUD) cuando se evaluó por pares.
En relación con la eficacia de Ciclesonida, no se ha podido demostrar ni rechazar un efecto relativo beneficioso sobre los síntomas asmáticos, exacerbaciones y efectos secundarios; Ciclesonida no se muestra inferior en comparación con budesonida o fluticasona en términos de función pulmonar. Por tanto, los resultados no son concluyentes ya que, en general, se encontraron relativamente pocos estudios, se compararon diferentes inhaladores y el tiempo de tratamiento y de seguimiento (12 semanas) de los estudios fue demasiado corto para la evaluación de los resultados clave como número de exacerbaciones y retraso del crecimiento.
En cuanto a mometasona, cabe destacar que solo se dispone de evidencia indirecta procedente de estudios realizados en niños mayores de 12 años y adultos, donde en uno de los ECAs se observa que mometasona podría ser más segura, por su menor tasa de efectos adversos, que la fluticasona (a dosis 1:2) y que la budesonida (a dosis 1:2) por su menor tasa de abandonos debidos al tratamiento. En relación a desenlaces de la función pulmonar, podría proporcionar unos peores resultados en comparación con fluticasona (a dosis 1:2) y mejores resultados en comparación con beclometasona (a dosis 1:1) y budesonida (a dosis 1:2 y 1:1), también parece ser algo beneficioso con menor necesidad de tratamiento de rescate que con budesonida (a dosis 1:1). Sin embargo, son necesarios estudios que puedan confirmar estos resultados en población adulta y pediátrica con más datos acerca de variables de resultado importantes para los pacientes.
La confianza en la estimación de la importancia de los desenlaces para los pacientes se fundamenta en el ejercicio de gradación realizado con los pacientes y en la opinión de los clínicos, por lo que se considera una probable incertidumbre y variabilidad en la opinión de la población sobre los mismos.
Ciclesonida y mometasona tienen la ventaja de admnistrarse una vez al día, mientras que budesonida y fluticasona dos veces diariamente; esto podría incrementar el cumplimiento terapéutico. Sin embargo, y a pesar de no haberse realizado una evaluación económica para su estudio, se sabe que la ciclesonida como fármaco más nuevo sigue siendo más caro que budesonida y fluticasona. Además, su utilización en niños preescolares no ha demostrado mejoras que disminuirían la utilización de los recursos, por ello se considera que los costes de este fármaco son altos en relación a los beneficios. Cabe destacar que ciclesonida y mometasona son fármacos no indicados en niños menores de 12 años por lo que no se puede recomendar su utilización para dicha población.
Recomendaciones
|
Débil
|
Se sugiere considerar el glucocorticoide inhalado más adecuado en función de la edad, el coste, el tipo de dispositivo de inhalación y las preferencias de los niños con asma y/o sus cuidadores. Mometasona y ciclesonida son fármacos de administración inhalada no indicados en niños menores de 12 años, por lo que no se puede recomendar su utilización en dicha población. |
7.4. Tratamiento intermitente con glucocorticoides inhalados
Preguntas para responder:
- En niños preescolares con episodios de sibilancias recurrentes y sin síntomas entre las crisis, ¿el tratamiento con glucocorticoides inhalados durante los catarros es eficaz para la prevención de exacerbaciones de asma?
- En niños con asma leve persistente, ¿cuál es la eficacia del tratamiento con glucocorticoides inhalados utilizados de forma intermitente (durante las infecciones virales o de forma estacional) en comparación con el tratamiento continuo?
En niños preescolares con episodios de sibilancias recurrentes y sin síntomas entre las crisis, ¿el tratamiento con glucocorticoides inhalados durante los catarros es eficaz para la prevención de exacerbaciones de asma?
Las infecciones del tracto respiratorio son responsables de más del 80% de los episodios de sibilancias en niños (196, 197) que en ocasiones progresan a exacerbaciones graves que requieren tratamiento con glucocorticoides sistémicos y con más de 30 visitas a unidades de urgencias por 1000 habitantes, una tasa tres veces mayor que los niños en edad escolar y adultos (198, 199).
La mayoría de los niños preescolares que presentan sibilancias solo cuando sufren una infección del tracto respiratorio suelen ser, por lo general, no atópicos y suelen superar los síntomas a los seis años de edad (2, 200). Por eso, se considera que la mayoría no requieren tratamiento con esteroides inhalados regulares.
En esta pregunta se pretende evaluar la efectividad del tratamiento intermitente con GCI solo durante los catarros en el grupo de pacientes preescolares con sibilancias recurrentes y con bajo riesgo de asma.
Evidencia científica
En relación con población preescolar con episodios recurrentes de sibilancias, la guía de SIGN 2011(45) refleja que la mayoría de los niños de esta población no requieren tratamiento con GCI, basándose en la evidencia que confirma que muchos pacientes de entre los menores de cinco años, no atópicos con episodios recurrentes de sibilancias inducidas por virus, no van a tener asma atópica crónica. La guía GEMA (46) recoge evidencia que confirma la escasa respuesta al tratamiento con GCI de esta población y también observa que el tratamiento intermitente con GCI no mejora ni el control ni la evolución de la enfermedad, aunque no realiza ninguna recomendación.
Se han seleccionado dos ECA (118, 201). El primer ECA (10) publicado en 2008, incluía a 238 preescolares de entre 12 a 59 meses con sibilancias intermitentes moderadas o graves que recibieron en cada infección respiratoria identificada por los padres, un tratamiento de siete días de budesonida (1 mg dos veces al día), montelukast (4 mg /día),o placebo, según el grupo de aleatorización. Los familiares de los niños con asma recibieron previamente educación para que fueran capaces de realizar una identificación objetiva de los primeros síntomas respiratorios de la infección respiratoria. Para nuestra revisión solo nos interesan los resultados provenientes del grupo que recibe budesonida vs. Placebo (los resultados de la comparación budesonida vs. Placebo y vs. Montelukast se han tenido en cuenta en otra de las preguntas actualizadas). El segundo ECA (202) seleccionados incluye a 126 niños de edades comprendidas entre uno y seis años. Los aleatorizados al grupo de tratamiento recibieron fluticasona 750 µg dos veces al día durante 10 días comenzando cuando los familiares detectaron los primeros síntomas. Los del grupo control recibieron placebo. Los familiares de los niños con asma fueron previamente educados para que fueran capaces de realizar una identificación objetiva de los primeros síntomas respiratorios.
En cuanto a resultados relacionados con la eficacia del tratamiento, se observó que el número de pacientes con una o más exacerbaciones por infección, que requirieron tratamiento con GC (glucocorticoides) orales fue menor en el grupo de tratamiento intermitente RR 0,65 (IC 95% de 0,50 a 0,83), así como las exacerbaciones con sintomatología asmática, por infección OR 0,66 (IC 95%de 0,43 a 1,02).
Calidad baja
La calidad de vida de los familiares del grupo tratamiento, medido mediante el cuestionario PACQ-QL (Pediatric Asthma Caregiver Quality of life quesionnaire), no muestra diferencias entre grupos DM -0,01 (sIC 95% de -0,30 a 0,28) en la estimación agrupada de los resultados de los dos estudios; Sin embargo, en uno de los estudios (9) la calidad de vida fue significativamente superior en el grupo con fluticasona, DM 0,49 (IC 95%de 0,1 a 0,89). No obstante, está diferencia no es clínicamente relevante (ya que la diferencia mínima importante es de 0,5 puntos). La proporción de días libre de episodios no fue diferente en los dos grupos DM 0,02 (IC 95% de -0,09 a 0,13) y los preescolares asignados al grupo de fluticasona en el estudio publicado en 2009 (9) tuvieron una menor necesidad de rescate con agonistas β2 de acción corta por infección, Razón de tasa de 0,80 (IC 95% de 0,68 a 0,94).
Calidad baja
Los resultados más relacionados con la seguridad como el cambio en la media de la talla ajustado por edad y sexo en uno de los estudios) DM 0,12 (IC 95% de -0,41 a 0,65), y el número de hospitalizaciones, OR 0,53 (IC 95% de 0,24 a 1,17) no mostraron diferencias entre los grupos.
Calidad baja
La calidad de la evidencia evaluada se considera baja, los resultados muestran riesgo de sesgo por evidencia indirecta ya que las dosis de GCI utilizada en el estudio (fluticasona 750 mcg 2 veces al día y budesonida 1mg 2 veces al día) representa un tratamiento de altas dosis fuera de indicación actual (Indicación en preescolares: 100 mcg 2 veces al día) y porque la mayoría de las estimaciones se reportan por número de infecciones respiratorias en lugar de datos individuales de pacientes. Además, muchos de los resultados son imprecisos por tratarse de un estudio con un tamaño muestral pequeño y en ocasiones con pocos eventos.
En resumen, con la utilización de altas dosis de GCI durante los catarros se observa un beneficio en el ahorro de utilización de glucocorticoides orales, con un menor número de pacientes que requirieron más de un curso del tratamiento por infección respiratoria en el grupo de tratamiento intermitente, y un menor número de rescates con agonistas β2 por infecciones respiratorias, a cambio de recibir un número alto de ciclos de GCI a muy altas dosis durante una media de 10 meses (aproximadamente 50 cursos menos de tratamiento oral con GC frente a 521 ciclos de tratamiento inhalado en unos 60 niños). Además, finalmente la frecuencia de exacerbaciones, infecciones observadas con sintomatología asmática, no fue significativamente diferente en los dos grupos de tratamiento. Por otro lado, las diferencias en la calidad de vida de los familiares tampoco mostraron relevancia clínica, y en relación a los efectos secundarios de la medicación sobre el crecimiento, se observó que los pacientes del grupo tratamiento crecieron algo menos.
Resumen de la evidencia
|
Calidad baja
|
La utilización de altas dosis de GCI durante los catarros muestra un beneficio en el ahorro de utilización de glucocorticoides orales, con un menor número de pacientes que requirieron más de un curso del tratamiento por infección respiratoria en el grupo de tratamiento intermitente, y un menor número de rescates con agonistas β2 por infecciones respiratorias, a cambio de recibir un número muy alto de ciclos de GCI a muy altas dosis durante una media de 10 meses. No se observan diferencias relevantes en la frecuencia de exacerbaciones, ni en la calidad de vida de los familiares y se observó que los pacientes del grupo tratamiento crecieron algo menos (118, 201). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es baja.
Disminución de la calidad por problemas de imprecisión por bajo número de eventos y evidencia indirecta por utilización de altas dosis de medicación y aportar resultados en relación al número de infecciones, no en relación al número de pacientes.
- El balance entre beneficios y riesgos: Los beneficios superan ligeramente los riesgos/inconvenientes.
Se observa un efecto beneficioso a favor del tratamiento intermitente a altas dosis de GCI durante siete-diez días con tasas menores de exacerbaciones graves, sin diferencias relevantes en la frecuencia de exacerbaciones y calidad de vida crecimiento y hospitalizaciones, aunque con una ligera mejoría con menores tasas de rescate con β2 agonistas, a cambio de recibir un número muy alto de ciclos de GCI a muy altas dosis durante una media de 10 meses.
- Valores y preferencias de pacientes y/o sus cuidadores: Incertidumbre o variabilidad importantes en la opinión sobre los desenlaces.
Del estudio realizado para conocer las posibles diferencias en la valoración de la importancia de los desenlaces de interés por las madres y padres de niños con asma y los profesionales sanitarios, se obtiene que la gradación de la importancia de las variables de resultado de los clínicos no difería sustancialmente respecto a la gradación de los familiares de pacientes.
Con alta incertidumbre: se espera que los pacientes den una importancia alta a una menor dosis acumulada de glucocorticoides administrados, por su mayor riesgo acumulado de sufrir los efectos secundarios.
- Costes y uso de recursos: Los costes están en el límite en relación a los beneficios.
No se dispone de datos sobre coste-efectividad, no obstante, el tratamiento durante las crisis, aunque de corta duración, per se supone un mayor coste que el no tratamiento, aunque evita intervenciones de rescate (GC orales y β2 agonistas) debidas a infecciones respiratorias.
La administración del tratamiento intermitente a las dosis del estudio requiere de nebulizadores no disponibles en nuestro medio. La implementación de las mismas supondría una inversión importante debido a su alto coste.
Por lo tanto, la evidencia de baja calidad, por ser indirecta e imprecisa muestra que con la utilización de altas dosis de GCI durante los catarros existe un beneficio en el ahorro de utilización de glucocorticoides orales, con un menor número de pacientes que requirieron más de un curso del tratamiento por infección respiratoria en el grupo de tratamiento intermitente, y un menor número de rescates con agonistas β2 por infecciones respiratorias, a cambio de recibir un número muy alto de ciclos de GCI a muy altas dosis durante una media de 10 meses. No se observan diferencias relevantes en la frecuencia de exacerbaciones, ni en la calidad de vida de los familiares y se observó que los pacientes del grupo tratamiento crecieron algo menos. Se desconocen las posibles preferencias de los pacientes aunque se considera que la mayoría daría una importancia alta a una menor dosis acumulada de glucocorticoides administrados, por su mayor riesgo acumulado de sufrir los efectos secundarios. No se dispone de datos sobre coste-efectividad, no obstante el tratamiento durante las risis per se supone un menor coste.
Inconveniente: Las dosis de glucocorticoides utilizada en los estudios (fluticasona 750 mcg dos veces al día y budesonida 1mg dos veces al día) representan un tratamiento de altas dosis fuera de indicación actual (Indicación en preescolares: 100 mcg dos veces al día) (Ver Ficha técnica).
Recomendaciones
|
Fuerte
|
Se recomienda no utilizar dosis altas de glucocorticoides inhalados de forma intermitente para prevenir las exacerbaciones durante las infecciones respiratorias de vías altas en preescolares con episodios de sibilancias recurrentes. |
En niños con asma leve persistente, ¿cuál es la eficacia del tratamiento con glucocorticoides inhalados utilizados de forma intermitente (durante las infecciones virales o de forma estacional) en comparación con el tratamiento continuo?
Las infecciones virales del tracto respiratorio superior (URI o resfriados) son una importante, y probablemente la más común de las causas del aumento de síntomas pulmonares en niños y adultos con asma persistente leve (203-209).
A pesar de que numerosas guías de práctica clínica recomiendan el tratamiento diario con GCI para el tratamiento de asma leve persistente de pacientes infantiles, muchos pacientes y sus familiares no siguen estas recomendaciones. En su lugar, muchos utilizan terapia de control y broncodilatadora en periodos cortos e intermitentemente durante los episodios sintomáticos. Este tratamiento intermitente podría representar dos ventajas adicionales en niños con asma persistente: la mejora del cumplimiento terapéutico y la disminución de efectos adversos por la posible utilización de menores dosis de glucocorticoides.
En nuestro contexto existe, además, una tendencia de tratar a los niños de forma estacional, tratándolos en periodos de más riesgo con una proporción importante de reagudizaciones, desde el final del verano hasta el comienzo del invierno.
En esta pregunta pretendemos evaluar la posibilidad de tratar de forma intermitente el asma persistente y, por tanto, comparar el tratamiento intermitente con GCI frente al tratamiento continuo (que es lo que recomiendan las GPC en este escalón).
Evidencia científica
Ninguna de las guías seleccionadas realiza recomendaciones sobre tratamiento intermitente con glucocorticoides en niños con alto riesgo de asma o diagnóstico de asma.
Se ha encontrado una RS Cochrane publicada en el 2012 (144) y actualizada en el 2013 (210) que pretendía comparar la eficacia y seguridad del tratamiento GCI intermitente frente al continuo en niños y adultos con asma persistente y preescolares con sospecha de asma persistente. En la actualización del 2013 se realiza un metaanálisis de siete ECA, y un análisis diferenciado de subgrupos de las poblaciones de preescolares (de uno a cinco años), escolares (hasta los 18 años) y adultos. Mediante las alertas también se ha identificado otra revisión sistemática (211) con el mismo objetivo de evaluar la eficacia del tratamiento diario con CGI frente al intermitente en preescolares escolares y adultos con sibilancias persistentes y asma persistente de leve a moderado y donde se incluían los mismos siete ensayos incluidos en la revisión Cochrane. Para responder a nuestra pregunta se han seleccionado los cuatro estudios que fueron realizados en población infantil hasta los 18 años (212-214) y se han utilizado los resultados presentados en la revisión Cochrane, (210) por ser más exhaustivos.
De los cuatro estudios, dos incluyeron población preescolar (213, 214) hasta los cuatro años y con episodios frecuentes de sibilancias con y sin otros factores como IPA positivo o exacerbaciones en el último año. Los otros dos estudios incluían a pacientes escolares (212, 215) con asma recientemente detectada en uno (212) y asmáticos persistentes leves bien controlados durante dos años en el otro (215). El tratamiento de intervención (el tratamiento intermitente) en dos de los estudios fue beclometasona a demanda (213, 215), mientras que en los otros dos budesonida a dosis establecidas (212, 214).
Los resultados muestran que en los dos tipos de tratamientos no existen diferencias significativas en el número de pacientes con uno o más exacerbaciones que requerían GC orales de rescate (RR 1,14 (IC 95% de 0,9 a 1,44)), siendo los resultados consistentes en ambas subpoblaciones (preescolares y escolares). La proporción de días de asma controlada, con datos para la subpoblación infantil más mayor, fue ligeramente menor en el grupo de tratamiento intermitente (DM -0,09 (IC 95% -0,16 a -0,02), aunque la diferencia fue muy poco relevante.
Calidad baja
En relación con los resultados de seguridad, los dos grupos de tratamiento mostraron similares efectos sobre el número de pacientes hospitalizados (RR 0,85 (IC 95% de 0,29 a 2,49) o sobre el número pacientes con efectos adversos graves (RR 0,83 (IC 95% de 0,3 a 2,29), sin diferencias relevantes entre las estimaciones para cada subpoblación diferente. El tratamiento intermitente mostró mejores resultados sobre el crecimiento o cambio de talla que el tratamiento continuo (DM 0,40 (IC 95% de 0,11 a 0,70) cm), aunque de nuevo sin ser clínicamente relevantes, solo medio centímetro mayor en un año y con la misma tendencia en ambas subpoblaciones. En cuanto a los abandonos del tratamiento debidos a un mal control asmático o exacerbaciones, se observaron resultados en conjunto no concluyentes sin diferencias estadísticas, ni clínicas entre los grupos de tratamiento, RR 1,32 (IC 95% 0,69 a 2,52), aunque con una tendencia contraria en las subpoblaciones donde los preescolares se beneficiarían más del tratamiento intermitente y los escolares del diario. Por último, el uso de medicación de rescate en escolares tampoco mostró diferencias en el cambio de media de pulsaciones diarios utilizados en ambos grupos, DM 0,14 (IC 95% de – 0,07 a 0,35).
Calidad baja
Calidad baja
Calidad moderada
La evidencia incluida en esta revisión, a pesar de basarse en estudios bien diseñados y realizados, es considerada de baja calidad debido a limitaciones de evidencia indirecta donde se incluyen pacientes con diferentes perfiles de riesgo, diferentes tratamientos de intervención y en uno de los estudios se utilizan dosis mucho mayores a las autorizadas para la utilización en población pediátrica. En general, los estudios son de pequeño tamaño y en muchos casos con bajo número de eventos que hacen que los resultados sean imprecisos.
Resumen de la evidencia
|
Calidad baja
|
Estudios en población preescolar (213, 214) y escolares (212, 215) hasta los 18 años no mostraron diferencias significativas en el número de pacientes con una o más exacerbaciones que requerían GC orales de rescate, número de pacientes hospitalizados, pacientes con efectos adversos graves ni número de abandonos del tratamiento debidos a un mal control asmático o exacerbaciones. Con el tratamiento intermitente se sugieren peores tasas de control asmático y mejores resultados en el crecimiento de los niños. |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es baja.
La evidencia es considerada de baja calidad debido a limitaciones de evidencia indirecta donde se incluyen pacientes con diferentes perfiles de riesgo, diferentes tratamientos de intervención y en uno de los estudios se utilizan dosis mucho mayores a las autorizadas para la utilización en población pediátrica. En general, los estudios son de pequeño tamaño y, en muchos casos, con bajo número de eventos que hacen que los resultados sean imprecisos.
- El balance entre beneficios y riesgos: Los beneficios superan ligeramente los riesgos/inconvenientes.
No hay diferencias en el número de pacientes con exacerbaciones que requerían GC orales de rescate, en las hospitalizaciones, efectos adversos graves, abandonos de tratamiento por mal control asmático y uso de β2 agonistas de rescate. La proporción de días con control asmático fue ligeramente inferior en el grupo de tratamiento intermitente y el crecimiento a un año fue ligeramente superior en este grupo.
- Valores y preferencias de pacientes y/o sus cuidadores: Incertidumbre o variabilidad importantes en la opinión sobre los desenlaces.
La gradación de la importancia de las variables de resultado de los clínicos no difería sustancialmente respecto a la gradación de los familiares de pacientes. (Ejercicio Grade: clínicos vs. Pacientes).
Se cree que la mayoría de los pacientes puedan preferir un tratamiento menos intensivo por su mayor comodidad y potencialidad de adherencia y con menores eventos adversos, como la disminución del crecimiento. Sin embargo, se considera que algunos de ellos se posicionarían a favor del tratamiento continuo por sus mejores resultados sobre una mayor proporción de días con control asmático.
- Costes y uso de recursos: Los costes están en el límite en relación a los beneficios.
No se dispone de datos sobre coste-efectividad, no obstante el tratamiento durante las crisis, per se supone un menor coste que el tratamiento diario, aunque podría aumentar intervenciones de rescate (GC orales y β2 agonistas) debidas a un mal control asmático.
Por lo tanto, la evidencia de baja calidad, por ser indirecta, e imprecisa en muchos casos, muestra que con la utilización de GCI de forma intermitente no difiere demasiado de la utilización del tratamiento diario, se sugieren peores tasas de control asmático y mejores resultados en el crecimiento de los niños. Se desconocen las posibles preferencias de los pacientes, aunque se cree que la mayoría de los pacientes preferiría un tratamiento menos intensivo por su mayor comodidad y potencialidad de adherencia y con menores eventos adversos, como la disminución del crecimiento. Sin embargo, se considera que algunos se posicionarían a favor del tratamiento continuo por sus mejores resultados sobre una mayor proporción de días con control asmático. Tampoco se dispone de datos sobre coste-efectividad, no obstante se cree que el tratamiento intermitente per se supondría un menor coste. Aun así, debido a la baja calidad de la evidencia, por ahora hasta que se acumule evidencia de mayor calidad se sugiere seguir manteniendo las pautas diarias de tratamiento en niños en los que el tratamiento esté indicado.
Recomendaciones
|
Débil
|
Se sugiere la utilización de tratamiento continuado con glucocorticoide inhalado frente al tratamiento intermitente en niños en los que el tratamiento está indicado. |
|
|
Con la evidencia disponible no se puede hacer una recomendación a favor ni en contra del uso del tratamiento intermitente en niños con asma estacional sin reagudizaciones graves y asintomáticos entre crisis. |
7.5. Estrategia para descender el escalón de tratamiento en niños con asma
Preguntas para responder:
- En niños con asma y tratamiento farmacológico, ¿cuándo se recomienda bajar de escalón y con qué estrategia?
Existe amplia literatura sobre la efectividad de distintos fármacos para subir de escalón de tratamiento en el asma no controlado y también ensayos que valoran el efecto ahorrador de glucocorticoide a través de la introducción de otros fármacos (beta-agonistas de Larga Duración (LABA), antileucotrienos). Sin embargo, los ensayos clínicos que valoran cómo bajar de escalón cuando el asma está bien controlado son muy escasos, más aun los realizados entre la población infantil.
En la Guía de Práctica Clínica sobre Asma de Osakidetza/Servicio Vasco de Salud (21) se recomienda en pacientes con asma estable tratados con dosis moderadas-altas de GCI, una reducción gradual del tratamiento para mantener un control adecuado con la mínima medicación efectiva, con un seguimiento de control trimestral. Dichas recomendaciones se fundamentan principalmente en un ECA (216) de alta calidad que evalúa la efectividad de la estrategia de disminución del 50% del GCI y en otros tres ECA (71, 217, 218) de menor calidad, alguno realizado en adultos, en la que se evidencia que el cese del tratamiento con GCI frecuentemente se asocia al empeoramiento del control del asma.
Evidencia científica
Tanto la guía SIGN (45) como la guía GEMA (46) siguen recomendando la utilización de la dosis de mantenimiento mínima necesaria de GCI y una disminución paulatina de la misma y con un control de tres meses entre cada nueva fase de disminución, basándose en estudios de moderada calidad (216, 219), realizando recomendaciones débiles. Además, la guía SIGN (45) sugiere que en pacientes infantiles con asma leve y con patrón estacional, la disminución de la medicación de mantenimiento puede realizarse con mayor progresión durante las etapas sin sintomatología. La Guía GINA 2012 (2), que incluye otros ECA (220, 221), con moderada calidad no tenidos en cuenta en la otras GPC, mantiene las recomendaciones de las otras dos guías y, además, especifica la forma de disminuir el escalón terapéutico tanto para los pacientes controlados con monoterapia, mediante la disminución del 50% de la dosificación del GCI cada vez trimestralmente, como en casos más severos que precisan terapia combinada con b2 agonistas de larga duración, donde se recomienda como primera línea la disminución del GCI hasta alcanzar la dosis mínima necesaria para mantener el control y después suspender LABA.
Se han seleccionado dos estudios que evalúan diferentes estrategias de descenso de escalón: un ECA (215) realizado en niños (cinco-ocho años) asmáticos controlados con monoterapia y una RS (222) que incluye cinco ECA realizados en adultos y adolescentes mayores de 15 años con asma y controlados mediante terapia combinada de GCI con LABA.
Descenso de escalón desde tratamiento de mantenimiento con monoterapia de GCI y SABA (Short Acting Beta Agonists) como tratamiento de rescate.
El ECA (215) seleccionado incluía a niños de cinco a ocho años con asma moderado persistente controlado con medicación de mantenimiento de dosis medias de GCI y medicación de rescate con SABA. Su doble objetivo fue evaluar la efectividad de añadir GCI a la terapia de rescate y también la estrategia de eliminación del tratamiento de mantenimiento con GCI, en un periodo de 44 semanas.
Tras un periodo de iniciación de cuatro semanas en la que todos los participantes tomaban dosis medias de GCI diarios de mantenimiento y beta-agonistas de corta duración a demanda como rescate, los participantes fueron aleatorizados a cuatro brazos de tratamiento:
- grupo con tratamiento diario de mantenimiento con GCI y tratamiento de rescate con GCI junto a SABA (subida de escalón),
- grupo con tratamiento diario de GCI y tratamiento de rescate con solo SABA (mantenimiento del tratamiento),
- grupo con tratamiento de mantenimiento placebo y rescate combinado con GCI y SABA (disminución de dosis GCI o eliminación del tratamiento diario con GCI)
- grupo con mantenimiento placebo y rescate solo con SABA (grupo control con eliminación de GCI del mantenimiento diario).
A pesar de que el estudio fue diseñado para realizar un análisis factorial 2×2 a partir de los cuatro brazos de tratamiento, finalmente se compararon tres de los grupos de intervención con el cuarto que representaba al grupo control. Este hecho afecta a la potencia estadística del estudio y, por tanto, aumenta la incertidumbre sobre sus estimaciones, por lo que se considera una disminución en la calidad del estudio.
Para evaluar el efecto del descenso a un tratamiento con dosis disminuidas de GCI, solo se han considerado las diferencias indirectas entre el grupo con GCI solo en el mantenimiento (y rescate con SABA) (b) y el grupo con GCI solo en rescate (junto al SABA) (c) frente al mismo grupo control (solo tratamiento de rescate con SABA) (d).
El estudio muestra que comparado con el tratamiento único de rescate con SABA, tanto el tratamiento diario con GCI, como el administrado solo como tratamiento de rescate, disminuyen la frecuencia de exacerbaciones, en un 50% y 40% respectivamente, aunque en el último caso la diferencia no es estadísticamente significativa. La frecuencia del fallo del tratamiento si mostró una diferencia significativa en ambos grupos. El porcentaje de días con sintomatología controlada fue similar en los tres grupos, sin embargo, el grupo con tratamiento diario mostró un aumento significativo en el uso diario de GCI, no observándose tal diferencia en el caso del grupo con rescate con GCI. Además, en este último grupo tampoco se observó una diferencia en el crecimiento mientras que en el grupo con tratamiento diario los niños crecieron una media de 1,1cm menos en las 44 semanas del estudio.
Calidad muy baja para todos
Los resultados resumidos proceden de un estudio con una moderada calidad y que, además, nos aportan estimaciones indirectas para responder a nuestra pregunta. El tamaño del estudio tiene riesgos de no ser suficiente y la mayoría de las variables de resultado muestran un número pequeño de eventos, por todo ello se considera que la calidad global de la evidencia es muy baja.
Descenso de escalón desde tratamiento combinado con GCI+LABA
La RS (222) de alta calidad incluye cinco ECA de moderada-alta calidad con pacientes adultos y en alguno adolescentes >15 años. El metaanálisis realizado pretende evaluar la eficacia de la terapia de discontinuación del agonistas b2 de larga duración (LABA), una vez alcanzado el control de los síntomas con la terapia combinada de GCI+LABA, en comparación con el tratamiento combinado de GCI+LABA.
El régimen de discontinuación de LABA aumentó el deterioro del asma, con peores resultados en la puntuación del cuestionario de calidad de vida: DM -0,32 (IC95% -0,12 a -0,51) y en el cuestionario de control del asma: DM 0,24 (IC95% 0,13 a 0,35), además de un mayor riesgo de retirada del estudio debido a la falta de eficacia o pérdida de control del asma, RR 3,27 (IC95% 2,16 a 4,96), y un menor número de días libres de síntomas, DR -9,15% (IC95% -1,62% a -16,69%). La utilización de GC sistémicos y la existencia de algún efecto adverso grave fueron similares en ambos grupos. Por otro lado, el riesgo de exacerbaciones y muertes después de la discontinuación de LABA no pudieron ser evaluados debido al pequeño número de eventos y la corta duración del seguimiento. La revisión concluye que en adultos y niños mayores con asma controlada con tratamiento combinado de GCI y LABA, la interrupción de la terapia con LABA, sugiere un aumento del deterioro asociado al asma.
Calidad muy baja
Calidad baja
Los estudios incluyen población de adultos y altas dosis de GCI+ LABA no utilizadas en poblaciones infantiles, por lo que los resultados no son inferibles a la población de nuestro interés. Por otro lado, los estudios tienen una duración limitada y no queda claro si se mantuvo el control del asma tras la eliminación del tratamiento con LABA. Además, no todos los estudios comprobaron que los pacientes fueron tratados de acuerdo con las recomendaciones actuales para el uso de los LABA.
Cabe mencionar que sigue existiendo controversia no aclarado aun, en relación a la seguridad de los LABA. Desde que se publicaron varios estudios que relacionaban la utilización de los LABA como monoterapia con un mayor riesgo de morbi-mortalidad relacionada con el asma (223) existe un acuerdo generalizado de no utilizarlos como monoterapia, sobre todo hasta tener disponibles los resultados de los grandes estudios promovidos por la FDA. Sin embargo, sigue existiendo debate acerca de su uso en combinación con GCI.
Por un lado, la FDA, realiza su propio meta-análisis que muestra que los beneficios de la administración conjunta de LABA y GCI, utilizadas de manera adecuada, siguen siendo superiores a los riesgos, por lo que considera que dichos medicamentos deberían estar disponibles para el tratamiento del asma. Sin embargo, apuesta por tratamientos no prolongados cuando se utilizan LABA con GCI y recomienda como estrategia de descenso de escalón la interrupción de los LABA tan pronto como se logra el control del asma (224). Además, también emite recomendaciones para la consecución de grandes estudios prospectivos que evalúen con mayor precisión la seguridad de los LABA junto al GCI, frente a estrategias de GCI en monoterapia (225).
Por otro lado, las GPC evaluadas que se pronuncian respecto a este asunto (45, 226), así como la revisión de la agencia reguladora de medicamentos de Gran Bretaña (MH-CPRA) (227) que evalúa la seguridad de los LABA en terapia combinada en niños menores de 12 años, interpretan los datos de manera diferente y no apoyan este enfoque, sino que recomiendan preferentemente la estrategia disminución paulatina del GCI, hasta alcanzar dosis mínimas necesarias para el control, manteniendo la dosificación de los LABA, para discontinuar al alcanzar el mantenimiento del control. Ya que consideran que los beneficios de estos medicamentos cuando se usan en combinación con GCI para el control de los síntomas del asma superan cualquier riesgo aparente.
En resumen, en los pacientes tratados con monoterapia de GCI y un buen control de asma, la evidencia actualizada sigue apoyando la disminución paulatina del 50% del GCI controlado durante tres meses, hasta alcanzar la dosis de mantenimiento mínima necesaria. Se ha incluido un ECA en la que se sugiere un enfoque novedoso de disminuir la dosis de GCI mediante su administración intermitente, utilizado en el tratamiento de rescate junto a SABA. El mantenimiento del tratamiento diario con GCI muestra mayores beneficios que la administración de GCI solo como rescate, aun así, esta última opción sugiere mayores beneficios que el tratamiento único con rescate con solo SABA. Las estimaciones de baja calidad, de estudios pequeños de una duración menor a la establecida en las recomendaciones, justifican la necesidad de nuevos estudios que comparen estas dos estrategias diferentes como estrategias de descenso en el tratamiento del asma moderado a severo.
En los casos más severos de asma infantil que precisan terapia combinada de GCI + LABA el método óptimo de qué agente disminuir en el descenso de escalón, la interrupción de un LABA frente a la disminución de la dosis de GCI, sigue siendo un problema sin resolver y no existen estudios que hayan abordado de manera directa está comparación. Sin embargo, los datos disponibles en la actualidad, solo aplicables en adultos, no apoyan la retirada de LABA como el primer paso y sugieren que la estrategia preferida es la reducción de la dosis de GCI antes de discontinuar el LABA.
Por ello, siguen siendo necesarios nuevos estudios confirmatorios con suficiente duración que comparen diferentes estrategias, en varios niveles de gravedad del asma, en todos los grupos de edad.
Resumen de la evidencia
| Descenso de escalón desde el segundo escalón |
|
Calidad muy baja
|
En niños con asma leve persistente bien controlado con GCI: El mantenimiento del tratamiento diario muestra mayores beneficios (menor frecuencia de exacerbaciones y fallos del tratamiento) que la administración de GCI solo como rescate, aun así, ésta última opción sugiere mayores beneficios que el tratamiento único con rescate con SABA y sin GCI. Con el mantenimiento del tratamiento diario también se observa una mayor utilización diaria de GCI y un menor crecimiento poco relevante (215). |
| Descenso de escalón desde el tercer escalón |
|
Calidad baja
|
En los casos más severos de asma que precisaban terapia combinada de GCI + LABA, el régimen de discontinuación de LABA aumentó el deterioro del asma, con peores resultados de calidad de vida, control del asmático y un mayor riesgo de falta de eficacia y menor número de días libres de síntomas. La utilización de GC sistémicos y la existencia de algún efecto adverso grave fueron similares (222). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es baja.
- C1: GCI diario + rescate: placebo + SABA vs. Placebo diario + rescate con placebo + SABA, muy baja
- C2: Placebo diario + rescate: GCI + SABA vs. Placebo diario + rescate con placebo + SABA, muy baja
- C3: tratamiento con GCI y discontinuación del LABA vs. Tratamiento con GCI + LABA, baja
La evidencia disponible para comparación es la siguiente:
- C1: Riesgo de insuficiente potencia estadística para las comparaciones realizadas, poco número de eventos en grupos de tratamiento de pequeño tamaño. Comparación indirecta, para nuestro interés, frente a grupo control.
- C2: Riesgo de insuficiente potencia estadística para las comparaciones realizadas, poco número de eventos en grupos de tratamiento de pequeño tamaño. Comparación indirecta, para nuestro interés, frente a grupo control.
- C3: Estudios de duración limitada realizado en adultos y a dosis altas, no admisibles en niños. Dudas sobre la adecuación de los criterios clínicos de selección de participantes.
- El balance entre beneficios y riesgos:
Para C1 y C2 los beneficios superan ligeramente los riesgos/ inconvenientes.
Para C3 Los riesgos/ inconvenientes superan ligeramente los beneficios.
La evidencia disponible para comparación es la siguiente:
- C1: En comparación con el grupo placebo, el riesgo para las exacerbaciones del asma (HR), la frecuencia de fallos y el crecimiento fueron menores. El uso de GCI diario fue el doble y no hubo diferencias en los días libres de síntomas.
- C2: En comparación con el grupo placebo, el riesgo para las exacerbaciones del asma (HR) fue menor, pero no alcanzó significación. La frecuencia de fallos de tratamiento fue menor y no hubo diferencias en la utilización diaria de GCI ni en el crecimiento.
- C3: El régimen de discontinuación de LABA aumentó el deterioro del asma en adultos, con peores resultados en la puntuación del cuestionario de calidad de vida, y en el cuestionario de control del asma, además de un mayor riesgo de retirada del estudio debido a la falta de eficacia o pérdida de control del asma y un menor número de días libres de síntomas.
- Valores y preferencias de pacientes y/o sus cuidadores: Incertidumbre o variabilidad importantes en la opinión sobre los desenlaces.
Del estudio realizado para conocer las posibles diferencias en la valoración de la importancia de los desenlaces de interés por las madres y padres de niños con asma y los profesionales sanitarios, se obtiene que la gradación de la importancia de las variables de resultado de los clínicos no difería sustancialmente respecto a la gradación de los familiares de pacientes. (Existe incertidumbre sobre las preferencias de los pacientes en relación a tratamientos con dosis más bajas a cambio de posible incremento de exacerbaciones, así como en relación a la variabilidad de preferencias en nuestro contexto.
- Costes y uso de recursos: Los costes están en el límite en relación a los beneficios.
La disminución de escalón de tratamiento puede incluir una reducción en los costos de medicamentos mediante el uso de agentes menos costosos y una simplificación de los regímenes de tratamiento, tales como la dosificación medicación una vez al día.
Por lo tanto, en niños con asma leve persistente bien controlado con GCI: El mantenimiento del tratamiento diario muestra mayores beneficios que la administración de GCI solo como rescate, aun así, ésta última opción sugiere mayores beneficios que el tratamiento único con rescate con SABA y sin GCI. Las estimaciones de baja calidad, de estudios pequeños de una duración menor a la establecida en las recomendaciones, justifican la necesidad de nuevos estudios que comparen directamente estrategias diferentes propuestas para el descenso en la terapia del asma moderado a severo.
En niños con asma moderada-severa persistente bien controlada con GC+ LABA: los estudios incluyen poblaciones de pacientes adultos con tratamientos a altas dosis no utilizados en niños, por lo que los resultados no son aplicables en la población de nuestro interés.
Recomendaciones
|
√
|
Descenso de escalón desde el segundo escalón:
No hay suficiente evidencia para recomendar una estrategia específica para discontinuar el tratamiento con glucocorticoide inhalado en escolares con asma leve persistente bajo control. |
| Se sugiere como posible estrategia de descenso de escalón de tratamiento en escolares con asma leve persistente bajo control la interrupción del tratamiento diario de mantenimiento con glucocorticoide inhalado y la sustitución de éste por glucocorticoide inhalado a demanda, es decir, utilizado solo durante las crisis junto a los agonistas β2. |
|
Débil
|
Descenso de escalón desde el tercer escalón:
En escolares con asma moderada-severa persistente bien controlada glucocorticoide inhalado y LABA no existe evidencia sobre cómo disminuir de escalón terapéutico. En base a resultados observados en población adulta, se sugiere reducir la dosis de glucocorticoide inhalado como primer paso en la disminución de escalón terapéutico y no la retirada del LABA. |
7.6. Tratamiento de elección como terapia añadida en niños con asma
Preguntas para responder:
- ¿Cuál es el tratamiento de elección como terapia añadida en niños asmáticos?
En la Guía de Práctica Clínica sobre Asma de Osakidetza/Servicio Vasco de Salud de 2005 (21) se recomienda que en niños con asma mal controlada con dosis bajas o medias de GCI, antes de doblar la dosis de GCI se añada un β2 agonista de acción prolongada (LABA). En el caso de niños menores de 4 años, al no estar aprobado el uso de LABA a esta edad, se indica que se puede considerar el uso de antileucotrienos (AL), a pesar de que no haya estudios sobre su eficacia como terapia añadida.
Evidencia científica
La guía SIGN (Scottish Intercollegiate Guidelines Network) (45) recomienda la utilización de LABA como terapia añadida en niños mayores de cinco años. Sin embargo, la guía GEMA (46) y la guía de la Canadian Thoracic Society (228) recomiendan doblar la dosis de glucocorticoides antes de añadir LABA o AL al tratamiento con GCI a dosis bajas.
Se han encontrado siete revisiones (110, 145, 229-233). Tres evalúan la eficacia de los LABA como terapia añadida a bajas dosis de GCI frente a doblar la dosis de GCI (230, 231, 233), dos la eficacia de añadir AL frente a utilizar sólo GCI (145, 229), una la utilización de AL como terapia añadida AL versus LABA(232) y la última las tres opciones (110).
LABA como terapia añadida versus doblar la dosis de GCI
Tres de las cuatro revisiones que responden a esta pregunta indican que ambas estrategias son efectivas para el tratamiento de niños con asma mal controlado. La revisión Cochrane de 2009 GCI (230, 231, 233) añade que no hay un aumento significativo del riesgo de exacerbaciones que requieren glucocorticoides orales, aunque señala un posible mayor riesgo de uso de glucocorticoides orales y hospitalizaciones con LABA. De hecho, la revisión Cochrane de 2010 GCI (230, 231, 233) indica que añadir LABA como terapia añadida se asocia con una tendencia al aumento de riesgo de exacerbaciones que requieren glucocorticoides orales y hospitalizaciones, por lo que concluyen que en vista a la modesta mejora en niños menores de 12 años, se debe examinar la seguridad de estas terapias.
De todos los estudios considerados en las cuatro revisiones se han seleccionado sólo tres estudios que son los que analizan específicamente los LABA como terapia añadida versus doblar la dosis de GCI en niños con asma moderada no controlada (234-236).
Dos de los tres ensayos son de corta duración (de ocho y 12 semanas respectivamente) (234, 235), terminando además uno de ellos de forma prematura (234, 235). Ambos estudios incluyen niños con prueba broncodilatadora positiva, por lo que la probabilidad de que la función pulmonar mejore con la adición de LABA es mayor. El tercer estudio (236) no se limita a niños con broncodilatación positiva y tiene una duración de 26 semanas.
En cuanto a las exacerbaciones que requieren glucocorticoides orales, a pesar de que hay más en el grupo tratado con LABA como terapia añadida que en el que lleva sólo GCI la diferencia no es significativa, siendo el OR de 1,68 (IC95% de 0,53 a 5,29).
Calidad muy baja
En cuanto a las hospitalizaciones, en el grupo con LABA son hospitalizados tres pacientes frente a ninguno en el grupo tratado con dosis mayores de GCI.
Calidad muy baja
Dos de los estudios indican que no hay diferencias tanto en el % de niños sin síntomas como en el % de días sin síntomas, aunque el tercer estudio (12) encuentra una DM significativa favorable al grupo LABA de 8,7% (IC95% de 1,2 a 16,3).
Calidad muy baja
En cuanto al % de días sin uso de β2-agonistas, los dos estudios que analizan esta variable muestran un aumento significativo a favor de la adición de LABA (234, 235) del 1,4% y 8% en el porcentaje de días sin tratamiento de rescate.
Calidad muy baja
En relación con el cambio en el PEF diurno, dos estudios señalan un aumento significativo en los niños tratados con LABA como terapia añadida frente a doblar la dosis de GCI (DM de 7,6 L/min (IC95% de 1,7 a 13,5) y de 8,6 L/min (IC95% de 1,3 a 15,9), respectivamente). Sin embargo, el estudio de Vaessen-Verberne (236) no encontró diferencias significativas en el porcentaje del PEFR (DM de -2,7% (IC95% de -6,7 a 1,4).
Calidad muy baja
En cuanto al aumento del FEV1% (o FEV1) ninguno de los tres estudios encuentra diferencias significativas entre los grupos de tratamiento.
Calidad muy baja
Sólo uno de estos ensayos (236) evalúa el efecto de estos tratamientos sobre el crecimiento tras 26 semanas de tratamiento, encontrando que no hay diferencias entre los dos grupos (DM de -0,01cm (IC95% de -0,05 a 0,04)).
Calidad muy baja
Por otro lado, sigue existiendo controversia en relación a la seguridad de los LABA. Los riesgos observados en monoterapia con LABA han servido para aceptar de forma generalizada la recomendación de no utilizar dichos fármacos en monoterapia, tanto en niños como en adultos (237, 238). Por otro lado, aún no se ha aclarado cuál es la seguridad a largo plazo de la terapia combinada LABA/GCI. Una reciente revisión de revisiones con metaanálisis (239) de estudios realizados en niños con asma concluye que a pesar de sugerir que la terapia de combinación es más segura que la monoterapia en niños, la seguridad en términos de mortalidad de la terapia de combinación con formoterol o salmeterol en niños sigue siendo incierta. Por lo que en esta revisión, se sugiere esperar a los resultados de nuevos estudios (240-242) en marcha para clarificar los riesgos de la terapia combinada en niños y adolescentes con asma.
AL como terapia añadida versus doblar la dosis de GCI.
Se han encontrado dos revisiones (145, 229). En la revisión más actual (8) se identificaron cinco estudios sobre la eficacia de los AL como terapia frente al tratamiento con GCI (132, 136, 243-245).
La revisión más actual (8) concluye que no hay diferencias significativas en el número de pacientes con exacerbaciones que requieren glucocorticoides orales entre los niños tratados con GCI versus los tratados con GCI y AL (RR=0,53; IC95%:0,10-2,74), aunque se basa en dos de los cinco estudios (243, 245) incluidos en la revisión, uno de los cuales (26) no dobla la dosis de GCI en el grupo control, y existe heterogeneidad (I2=86%).
De los cinco estudios incluidos en esa revisión, uno incluye pacientes con asma leve persistente y estable (132), otro estudio incluye pacientes steroid naïve (244) sin síntomas y mide como resultado los niveles de FeNO, y el estudio de Stelmach 2007 (136) incluye pacientes con asma estable. De los cinco estudios sólo dos (243, 245) incluyen niños con asma moderada no controlada: se trata de un estudio cruzado que evalúa los resultados a dos semanas de tratamiento y en el que se compara la adición de AL a 400μg de budesonida frente al tratamiento con 400μg de budesonida (26) y un ECA en el que se compara la adición de montelukast a 200μg de budesonida frente al tratamiento con 400μg de budesonida (243).
Uno de los estudios encuentra diferencias significativas en el número de pacientes con exacerbaciones, siendo el riesgo mayor para el grupo tratado con AL como terapia añadida, OR5 (IC95% de 1,22 a 20,46), aunque se trata en su mayoría de exacerbaciones leves.
Calidad muy baja
La variable principal de ambos estudios es el % de cambio del FEV1, para la que los autores no encuentran diferencias significativas entre los dos grupos de tratamiento.
Calidad baja
El estudio cruzado (245) sí encuentra diferencias significativas en el PEF diurno y nocturno, DM de 9,7L/min (IC95% de 1,4 a 18,1) y 10,7L/min (IC95% de 2,4 a 19), respectivamente.
Calidad muy baja
También encuentra diferencias significativas en el uso de β2-agonistas, con una disminución del uso en el grupo con montelukast de 3,01 a 1,65 pulsaciones/día y de 1,98 a 1,03 pulsaciones/día en el grupo tratado sólo con GCI.
Calidad muy baja
LABA versus AL como terapia añadida al tratamiento con glucocorticoides
Las dos revisiones encontradas (110, 232) identifican el mismo estudio crossover (246) en el que los autores utilizan la regresión logística ordinal para predecir cuál es la terapia añadida con mayor probabilidad de obtener el mejor resultado.
Los autores utilizan una variable compuesta que tiene en cuenta las exacerbaciones que requieren glucocorticoides orales, el número de días sin síntomas y el FEV1, y consideraron que la adición de un tratamiento era mejor que otro si la cantidad total de prednisona recibida durante el tratamiento era al menos 180 mg menor, si el número anual de días de control de asma durante las 12 semanas de tratamiento se incrementaba al menos en 31 días o si el FEV1 final era al menos un 5% mayor. Si no se cumplía ninguno de estos criterios se le daba el mismo rango a cada periodo de tratamiento y se consideraba que el paciente no tenía una respuesta diferencial.
Así se encontró una respuesta diferencial en 161 de los 165 pacientes evaluados, siendo mayor la proporción de pacientes que respondieron mejor a los LABA que a AL (52% vs 34%) o GCI (54% vs 32%).
En este ensayo se indica que de los 120 ciclos de glucocorticoides orales que se administraron 30 tuvieron lugar en el período de tratamiento con LABA, 47 en el período de tratamiento con GCI y 43 en el tratamiento con AL. Sin embargo, no se indica el número de pacientes que tuvo al menos una exacerbación que requirió glucocorticoide oral.
Resultados de las alertas bibliográficas
Se ha identificado una actualización de la revisión Cochrane sobre la eficacia y seguridad de los antileucotrienos como terapia añadida a los GCI frente al uso de GCI en la misma dosis, a una dosis mayor o una dosis decreciente, en niños y adolescentes con asma persistente y síntomas a pesar de tratamiento de mantenimiento con GCI (210).
Este meta-análisis, que no incluye exactamente los estudios considerados en nuestra revisión, concluye que añadir antileucotrienos al tratamiento con GCI versus utilizar una dosis de GCI igual o superior no reduce de forma significativa el uso de glucocorticoide oral o las hospitalizaciones. Por ello, los autores consideran que los antileucotrienos no son una opción eficaz y segura como terapia añadida en niños y adolescentes con asma leve o moderada.
Resumen de la evidencia
|
Calidad muy baja
|
La evidencia indica la no inferioridad de los LABA como terapia añadida frente al uso de dosis altas de GCI en cuanto a la mejora del PEF diurno, pero no así en cuanto a la disminución de exacerbaciones (230, 231, 233). |
|
Calidad muy baja
|
El riesgo de exacerbaciones es mayor con el tratamiento con antileucotrienos, en FEV1 no hay diferencias y los resultados para PEF son inconsistentes (243, 245). |
|
|
Sólo hay un estudio que compara la utilización de los LABA versus antileucotrienos como terapia añadida, pero los datos que presentan no permiten valorar los resultados del estudio de forma binaria (246). |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es la siguiente para cada una de las recomendaciones:
- C-1: LABA + GCI a dosis bajas-medias vs. Doblar dosis GCI, muy baja
- C-2: AL + GCI a dosis bajas-medias vs. Doblar dosis GCI, muy baja
- C-3: LABA + GCI vs. AL + GCI, muy baja
La evidencia disponible para comparación es la siguiente:
- C1: Existe evidencia sobre la no inferioridad de los LABA como terapia añadida versus dosis altas de GCI (mejora el PEF diurno), pero parece que no las exacerbaciones, aunque la evidencia es muy baja.
- C2: Parece que el riesgo de exacerbaciones es mayor con los AL, aunque la calidad es muy baja, en FEV1 no hay diferencias y para PEF hay inconsistencia.
- C3: Sólo hay un estudio que no permite valorar los resultados de forma binaria.
- El balance entre beneficios y riesgos: Tanto para la C1 como para la C2, los riesgos/inconvenientes superan ligeramente los beneficios. La C3 no se puede valorar.
La evidencia disponible para comparación es la siguiente:
- C1: Dos de los tres estudios utilizaron el PEF como variable principal, pero en exacerbaciones puede que con LABA el riesgo sea mayor, y parece que no hay diferencias en el crecimiento frente a dosis más altas de GCI (evidencia de muy baja calidad).
- C2: No hay diferencias en el FEV1, contradicción en el PEF pero puede haber más riesgo de exacerbaciones con los que son tratados con AL.
- C3 No se puede valorar.
- Valores y preferencias de pacientes y/o sus cuidadores: Probable incertidumbre y variabilidad en la opinión sobre los desenlaces.
De los datos del estudio cualitativo realizado en nuestro contexto, se extrajo la dificultad de utilizar los inhaladores/nebulizadores en niños preescolares, y que disponer de un tratamiento administrado vía oral sería más sencillo. También está la preocupación por el crecimiento. Sin embargo, no está tan clara la elección si la eficacia no fuera similar.
- Costes y uso de recursos: Los costes son altos en relación a los beneficios.
El coste de doblar la dosis de glucocorticoides frente a utilizar LABA + GCI sería menor. Además está la incertidumbre sobre la seguridad de los LABA.
Por lo tanto, la evidencia que existe sobre la eficacia de los LABA y los AL como terapia añadida frente a doblar la dosis de glucocorticoides inhalados es de muy baja calidad y no apoya su utilización. Por otra parte, parece que no hay diferencias en el crecimiento al doblar la dosis de glucocorticoides frente a la utilización de los LABA como terapia añadida.
Asimismo, según ficha técnica, los LABA se pueden utilizar en pacientes pediátricos que sean mayores de cuatro años.
En cuanto al estudio cualitativo realizado para esta guía, se extrajo la dificultad de utilizar los inhaladores/nebulizadores en preescolares y que disponer de un tratamiento oral sería más sencillo, aunque la elección no era tan clara si la eficacia no fuera similar.
Por último, el coste de doblar la dosis de glucocorticoides frente a utilizar LABA y GCI sería menor.
Recomendaciones
|
Débil
|
En escolares menores de 12 años con asma no controlada con dosis bajas o medias de glucocorticoide inhalado se sugiere doblar la dosis de glucocorticoide frente a la adición de LABA mientras continúe la incertidumbre sobre la seguridad de añadir formoterol o salmeterol. |
|
Débil
|
Se sugiere la adición de LABA si persiste el mal control en los escolares menores de 12 años a los que se haya doblado previamente la dosis de glucocorticoide inhalado. |
|
|
No hay suficiente evidencia sobre la efectividad de añadir montelukast como terapia añadida en escolares menores de 12 años con asma no controlada con dosis bajas o medias de glucocorticoide inhalado. |
|
Fuerte
|
En niños menores de cuatro años de edad no controlados con dosis bajas o medias de glucocorticoide inhalado se recomienda doblar la dosis de glucocorticoide. |
|
√
|
Se sugiere añadir antileucotrienos al tratamiento si persiste el mal control en los niños menores de cuatro años a los que se haya doblado previamente la dosis de glucocorticoide. |
7.7. Terapia SMART en niños con asma
Preguntas para responder:
- ¿Cuál es la eficacia de la terapia SMART en niños asmáticos?
La terapia de asociación de budesonida y formoterol como tratamiento de mantenimiento y rescate se conoce como la terapia SMART (Single manteinance and reliever therapy) o SiT (Single inhaler Therapy) de asma.
Con relación a su utilización en niños asmáticos, cabe mencionar que en nuestro medio, según la ficha técnica, formoterol no está recomendado en niños menores de seis años y salmeterol tampoco está recomendado en menores de cuatro años. La combinación de un glucocorticoide inhalado más un agonista β2 adrenérgico de acción larga están indicados en la terapia de mantenimiento del asma cuando no hay un control adecuado con escalones de tratamiento previos.
En la guía de asma del 2005 (21) se recoge un ensayo clínico doble ciego (247) que comparó durante un año, en 2760 niños y adultos (4-80 años) con asma leve a moderada, la efectividad de la asociación budesonida/formoterol (80/4,5) como tratamiento de mantenimiento y rescate (SMART-Single maintenance and reliever therapy) frente al tratamiento con iguales dosis de asociación de budesonida/formoterol de mantenimiento más un SABA de rescate y frente al tratamiento con GCI a dosis moderadas y SABA. El estudio mostró resultados favorables al tratamiento SMART, con un menor riesgo de sufrir exacerbaciones graves que en los otros tratamientos, y sin una sobreutilización de la asociación farmacológica como rescate. En la guía no se realiza recomendaciones de la utilización de la terapia en niños, ya que cuando se publicó aún no estaban disponibles los resultados del subgrupo de los niños.
La Agencia Española del Medicamento y Productos Sanitarios (AEMPS), en la ficha técnica de Symbicort Turbuhaler -budesonida 80 microgramos/ formoterol 4,5 microgramos en polvo para inhalación- refleja la recomendación de no utilización en niños menores de seis años de la asociación como terapia de mantenimiento y rescate (SMART).
A pesar de estas indicaciones existentes en la ficha técnica y dado el valor que podría tener este tipo de tratamiento por su mayor simplicidad en el manejo del asma mal controlado en niños, pretendemos identificar si ha habido nueva evidencia sobre la utilización de la terapia SMART en población infantil.
Evidencia científica
En relación a la terapia SMART, las guías SIGN (45) y GEMA (23) recogen evidencia procedente de ensayos posteriores al año 2005 (año en que se publicaron los primeros resultados del primer estudio multicéntrico de gran tamaño), que incluían en su mayoría adultos (248- 252). Los resultados en niños (247) y en adultos con asma (249-253), de moderado a grave, no controlado con dosis medias de GCI, mostraron consistentemente que la terapia SMART reduce exacerbaciones graves que requieren intervención médica y la exposición a los esteroides orales, así como una mejora de la función pulmonar, cuando se compara con la asociación de LABA/GCI o dosis altas de GCI como terapia de mantenimiento junto a SABA como tratamiento de rescate. Solo la guía de GEMA recoge evidencia sobre la utilización de SMART en niños asmáticos mayores de cuatro años. Ambas guías sugieren la necesidad de contrastar más su efectividad en el uso de niños. Ninguna de las guías realiza recomendaciones específicas en relación a la utilización de esta estrategia terapéutica en adultos o niños.
En la búsqueda realizada en diciembre de 2012, se identificaron cuatro RS (254-257) publicadas entre 2009 y 2012 que sintetizan la evidencia sobre la eficacia de la terapia SMART. Todos las RS incluyen los mismos estudios, que los recogidos en las guías de SIGN y GEMA. Una de ellas es la que reporta los resultados del subgrupo de niños (255) y, por tanto, es la que ha sido tenida en cuenta en esta revisión.
La revisión seleccionada era una RS Cochrane de 2009, y las alertas han identificado su actualización publicado en 2013 (258). La revisión evalúa los datos publicados y no publicados de estudios que comparan la terapia SMART con otras alternativas de tratamiento en adultos y niños. Se realizan dos comparaciones, una frente al mejor tratamiento habitual (que también incluye el uso de los LABA) y otra frente a aumento de dosis del GCI utilizado como tratamiento de mantenimiento junto a terbutalina para alivio sintomático. Solamente uno de los ECA (248) incluye a 224 niños de entre cuatro y 11 años con asma no controlado a dosis de 200-500 μg/día de GCI, comparando la terapia SMART frente al aumento de la dosis de GCI de mantenimiento.
En el grupo de niños con tratamiento SMART no hubo hospitalizaciones y solo hubo una en el otro grupo. Con SMART se observó una disminución significativa de exacerbaciones que necesitaban aumento de dosis de GCI y/o tratamientos adicionales: OR 0,33 (IC 95% de 0,15 a 0,77) y ésta fue consistente en todas las edades. A pesar de que los niños de este grupo consumieron en el último año una media diaria menor de GCI u orales (126 μg/día vs. 320 μg/día), los autores no han aportado datos sobre la proporción de la utilización de GC orales. No hubo diferencias significativas frente a efectos adversos graves fatales, sin eventos en ninguno de los grupos y no fatales: OR 0,35 (IC 95% de 0,07 a 1,83). Los niños tratados con la terapia SMART tuvieron un mayor crecimiento que los tratados con dosis más altas de budesonida: DM 1cm (IC 95% de 0,29 a 1,71 cm).
Calidad baja
Calidad baja
Calidad moderada
Los resultados sobre la eficacia de la terapia SMART en niños son considerados de baja calidad debido al pequeño tamaño de la subpoblación de niños, resultados imprecisos por pocos o ningún evento en alguno de los casos, datos incompletos y patrocinio de la industria. Se considera que son necesarios nuevos estudios que evalúen la efectividad de la terapia SMART en niños.
En relación con los resultados de la eficacia de la terapia SMART en adultos, la actualización del 2013 incluye nuevos datos sobre cinco ECA que producen un cambio en las conclusiones de la primera publicación (258). En total se incluyen 13 ECA (n=13 152 adultos).
En adultos con asma no controlado con GCI, el tratamiento SMART frente al mejor tratamiento habitual no mostró diferencias significativas en las hospitalizaciones OR 0,81 (IC95% de 0,45 a 1,44) (ocho estudios n=8841), aunque la incidencia de la misma fue muy baja en ambos grupos (entre 0,3-0,8% vs 0,6%). La probabilidad de sufrir exacerbaciones que requieren tratamiento con GC oral fue menor en el grupo de terapia SMART OR 0,83 (IC95% de 0,70 a 0,98) (8 estudios n=8841). En cambio, en relación a las exacerbaciones que requirieron intervención médica (en cuatro estudios con 5378 pacientes) no se han demostrado ventajas o diferencias significativas: HR 0,94 (IC95% de 0,85 a 1,04) (5 estudios n=7355). También se observó una disminución en la utilización media de GCI con la terapia SMART DM (IC95% 107 μg/día a 385 μg/día.) En resultados de efectos adversos serios no se encontraron diferencias significativas OR 1,20; (IC95% de 0,90 a 1,60) y los efectos adversos fatales fueron muy raros. Sin embargo, los abandonos debido a los efectos adversos fueron más frecuentes en el grupo con tratamiento SMART OR 2,85 (IC95% de 0,89 a 4,30).
Calidad baja
Calidad moderada
Calidad baja
Calidad moderada
Por otro lado, cuando se compara la terapia SMART con dosis mayores de mantenimiento de budesonida y terbutalina como tratamiento de alivio de síntomas, tres estudios que incluían a 4209 pacientes que, en general, tenían pocos riesgos de sesgo aunque incluían pacientes en los que se les suspendió el tratamiento con LABA durante el periodo pre-ensayo, los resultados no mostraron diferencias en las hospitalizaciones: OR 0,56; (IC95% de 0,28 a 1,09). Se observó una reducción significativa de exacerbaciones que requieren GC orales: OR 0,54; (IC95% de 0,45 a 0,64) En resultados de efectos adversos serios no se encontraron diferencias significativas OR 0,97 (IC95% de 0,73 a 1,29) y los efectos adversos fatales fueron muy raros. Los abandonos debido a los efectos adversos también fueron más frecuentes en el grupo con tratamiento SMART OR 0,57 (IC95% de 0,35 a 0,93).
Calidad alta y moderada
Calidad alta
En resumen, los datos adicionales incluidos en la actualización de la RS (258) muestran que la terapia SMART en adultos asmáticos, en comparación con el mejor tratamiento habitual, reduce las exacerbaciones que requieren glucocorticoides orales (DR: del 7% en mejor tratamiento a un 6% (entre 5% y 7%) con SMART), aunque la reducción absoluta es menor que la encontrada cuando se compara grupo de glucocorticoides inhalados de mantenimiento (DR: del 18% con GCI de mantenimiento a un 12% (entre 9% y 12%) con SMART). La evidencia sobre su efecto en la disminución de hospitalizaciones es muy débil. En el grupo con tratamiento SMART comparado con el mejor tratamiento, hubo más abandonos por efectos adversos, aunque sin diferencias significativas en efectos adversos serios.
Cuando se consideran los resultados de estos estudios hay que tener en cuenta ciertas limitaciones observadas: en primer lugar, se trata de estudios dirigidos por la industria con cegamientos inadecuados (abiertos) que dificultan la interpretación de ciertos resultados y algunos muestran alto riesgo de sesgo de detección. En segundo lugar, en los estudios que se comparan regímenes fijos o flexibles (a demanda) de la terapia SMART no se han utilizado sistemas electrónicos de seguimiento de la utilización del inhalador, por lo que no se dispone de datos sobre la adherencia a los tratamientos.
Por último, cabe mencionar que sigue existiendo controversia no aclarada aun, en relación a la seguridad de los LABA. Los riesgos observados con la monoterapia de LABA han servido para la aceptación generalizada de la recomendación de no utilización de dichos fármacos en monoterapia, ni en niños ni en adultos(237, 238). Por otro lado, aún no se ha aclarado la seguridad a largo plazo de la terapia combinada LABA/GCI. Una reciente revisión de revisiones con metaanálisis (259) de estudios realizados en niños con asma concluye que a pesar de sugerirse que la terapia de combinación es más segura que la monoterapia en niños, la seguridad en términos de mortalidad de la terapia de combinación con formoterol o salmeterol en niños sigue siendo incierta. Por lo que, se sugiere esperar a los resultados de nuevos estudios (240-242) en marcha para clarificar los riesgos de la terapia combinada en niños y adolescentes con asma.
Resumen de la evidencia
|
Calidad baja
|
La evidencia procedente del único estudio que incluía 224 niñas y niños asmáticos de entre cuatro a 11 años no controlados con GCI (budesonida 200-500 μg/día) mostró una disminución significativa, consistente en todas las edades, de exacerbaciones que necesitaban aumento de dosis de GCI y/o tratamientos adicionales en niños tratados con la terapia SMART frente a los tratados con dosis incrementadas de budesonida. Además, consumieron una media diaria menor de GCI u orales en el último año, aunque la proporción de GC orales consumidos es desconocida. No hubo diferencias significativas entre los grupos de tratamiento en relación a hospitalizaciones, efectos adversos graves fatales y no fatales. Los niños tratados con la terapia SMART mostraron un crecimiento de un centímetro de media mayor que los tratados con dosis más altas de budesonida (248) |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es baja
- El balance entre beneficios y riesgos: los beneficios y riesgos/ inconvenientes están equilibrados
El balance beneficio/riesgo final se muestra incierta, a pesar de sugerirse resultados de eficacia favorables a la terapia SMART; ya que no se tiene suficiente certidumbre de los resultados de sus riesgos.
En el grupo de niños con tratamiento SMART no hubo hospitalizaciones (solo hubo una en el otro grupo), los autores no han aportado datos sobre la proporción de la utilización de GC orales para las exacerbaciones. No hubo diferencias significativas frente a efectos adversos graves fatales y no fatales. Los tratados con SMART tuvieron un mayor crecimiento que los tratados con dosis más altas de budesonida.
- Valores y preferencias de pacientes y/o sus cuidadores: Incertidumbre o variabilidad importantes en la opinión sobre los desenlaces.
La gradación de la importancia de las variables de resultado de los clínicos no difería sustancialmente respecto a la gradación de los familiares de pacientes. (Ejercicio Grade: clínicos vs. Pacientes)
De los datos del estudio cualitativo realizado en nuestro contexto con madres de niños con asma, se señaló como respuesta unánime la preferencia por la utilización de un único inhalador frente a varios, por su comodidad y ventajas para una correcta adherencia, también denotan razones de ahorro económico que justifican sus preferencias.
Se considera que las preferencias de los pacientes iría a favor de la terapia SMART.
- Costes y uso de recursos: los costes están en el límite en relación a los beneficios. Estudios económicos identificados muestran que los costes totales de utilización de budesonida y formoterol como terapia de mantenimiento y rescate fueron menores que con inhaladores separados que contienen budesonida y formoterol. La dosificaciones flexibles se asocian a costes de tratamiento inferiores, reduciendo costes directos e indirectos en comparación con dosificaciones fijas, tanto de la terapia SMART como en la terapia combinada (260, 261).
No se dispone de datos sobre coste-efectividad, no obstante, el tratamiento durante las crisis, per se supone un menor coste que el tratamiento diario, aunque podría aumentar intervenciones de rescate (GC orales y agonistas β2) debidas a un mal control asmático.
Por lo tanto, en población infantil se considera que el la terapia SMART muestra un balance beneficio/riesgo final incierto. A pesar de sugerir resultados favorables (como mayor crecimiento con SMART), las estimaciones son de baja calidad (solo se dispone de un ECA con pequeño tamaño muestral, financiado por la industria y con resultados imprecisos por pocos o ningún evento en alguno de los casos), y su eficacia en la disminución de exacerbaciones que requiere GC orales, hospitalizaciones o efectos adversos serios es incierta. Se considera que las preferencias de los pacientes irían a favor de la terapia SMART y que los costes de utilización de un único inhalador disminuirían respecto a la utilización de los otros regímenes que requieren de varios inhaladores. Los resultados de estudios realizados en adultos muestran algunos beneficios de la terapia SMART, aunque no se consideran generalizables a población infantil.
Recomendaciones
|
Fuerte
|
Se recomienda no utilizar la terapia SMART en el tratamiento de niños asmáticos menores de 12 años. |
21. Grupo de Trabajo de la Guía de Práctica Clínica sobre Asma. Guía de Práctica Clínica sobre Asma. 2005. Disponible en: http://www9.euskadi.net/sanidad/osteba/datos/gpc_05-1.pdf.
45. British guideline on the management of asthma. A national clinical guideline. 2011.
46. GEMA 2009. Guía española para el manejo del asma. 2009.
110. Boluyt N, Rottier BL, de Jongste JC, Riemsma R, Vrijlandt EJ, Brand PL. Assessment of controversial pediatric asthma management options using GRADE. Pediatrics. 2012;130(3):e658-68.
111. Bisgaard H, Zielen S, Garcia-Garcia ML, Johnston SL, Gilles L, Menten J, et al. Montelukast reduces asthma exacerbations in 2- to 5-year-old children with intermittent asthma. Am J Respir Crit Care Med. 2005;171(4):315-22.
112. Robertson CF, Price D, Henry R, Mellis C, Glasgow N, Fitzgerald D, et al. Short-course montelukast for intermittent asthma in children: a randomized controlled trial. Am J Respir Crit Care Med. 2007;175(4):323-9.
113. Valovirta E, Boza ML, Robertson CF, Verbruggen N, Smugar SS, Nelsen LM, et al. Intermittent or daily montelukast versus placebo for episodic asthma in children. Ann Allergy Asthma Immunol. 2011;106(6):518-26.
114. Knorr B, Franchi LM, Bisgaard H, Vermeulen JH, LeSouef P, Santanello N, et al. Montelukast, a leukotriene receptor antagonist, for the treatment of persistent asthma in children aged 2 to 5 years. Pediatrics. 2001;108(3):E48.
115. van Adelsberg J, Moy J, Wei LX, Tozzi CA, Knorr B, Reiss TF. Safety, tolerability, and exploratory efficacy of montelukast in 6- to 24-month-old patients with asthma. Curr Med Res Opin. 2005;21(6):971-9.
116. Straub DA, Moeller A, Minocchieri S, Hamacher J, Sennhauser FH, Hall GL, et al. The effect of montelukast on lung function and exhaled nitric oxide in infants with early childhood asthma. Eur Respir J. 2005;25(2):289-94.
117. Kooi EM, Schokker S, Marike Boezen H, de Vries TW, Vaessen-Verberne AA, van der Molen T, et al. Fluticasone or montelukast for preschool children with asthma-like symptoms: Randomized controlled trial. Pulm Pharmacol Ther. 2008;21(5):798-804.
118. Bacharier LB, Phillips BR, Zeiger RS, Szefler SJ, Martinez FD, Lemanske RF, et al. Episodic use of an inhaled corticosteroid or leukotriene receptor antagonist in preschool children with moderate-to-severe intermittent wheezing. J Allergy Clin Immunol. 2008;122(6):1127-35.e8.
119. Szefler SJ, Baker JW, Uryniak T, Goldman M, Silkoff PE. Comparative study of budesonide inhalation suspension and montelukast in young children with mild persistent asthma. J Allergy Clin Immunol. 2007;120(5):1043-50.
120. Miceli Sopo S, Onesimo R, Radzik D, Scala G, Cardinale F. Montelukast versus inhaled corticosteroids as monotherapy for prevention of asthma: which one is best? Allergol Immunopathol (Madr). 2009;37(1):26-30.
121. Castro-Rodriguez JA, Rodrigo GJ. The role of inhaled corticosteroids and montelukast in children with mild-moderate asthma: results of a systematic review with meta-analysis. Arch Dis Child. 952010. p. 365-70.
122. Ng D, Salvio F, Hicks G. Anti-leukotriene agents compared to inhaled corticosteroids in the management of recurrent and/or chronic asthma in adults and children. Cochrane Database Syst Rev. 2004 (2):CD002314.
123. Maspero JF, Dueñas-Meza E, Volovitz B, Pinacho Daza C, Kosa L, Vrijens F, et al. Oral montelukast versus inhaled beclomethasone in 6- to 11-year-old children with asthma: results of an open-label extension study evaluating long-term safety, satisfaction, and adherence with therapy. Curr Med Res Opin. 2001;17(2):96-104.
124. Ostrom NK, Decotiis BA, Lincourt WR, Edwards LD, Hanson KM, Carranza Rosenzweig JR, et al. Comparative efficacy and safety of low-dose fluticasone propionate and montelukast in children with persistent asthma. J Pediatr. 2005;147(2):213-20.
125. Szefler SJ, Phillips BR, Martinez FD, Chinchilli VM, Lemanske RF, Strunk RC, et al. Characterization of within-subject responses to fluticasone and montelukast in childhood asthma. J Allergy Clin Immunol. 2005;115(2):233-42.
126. Becker AB, Kuznetsova O, Vermeulen J, Soto-Quiros ME, Young B, Reiss TF, et al. Linear growth in prepubertal asthmatic children treated with montelukast, beclomethasone, or placebo: a 56-week randomized double-blind study. Ann Allergy Asthma Immunol. 2006;96(6):800-7.
127. Sorkness CA, Lemanske RF, Mauger DT, Boehmer SJ, Chinchilli VM, Martinez FD, et al. Long-term comparison of 3 controller regimens for mild-moderate persistent childhood asthma: the Pediatric Asthma Controller Trial. J Allergy Clin Immunol. 2007;119(1):64-72.
128. Garcia Garcia ML, Wahn U, Gilles L, Swern A, Tozzi CA, Polos P. Montelukast, compared with fluticasone, for control of asthma among 6- to 14-year-old patients with mild asthma: the MOSAIC study. Pediatrics. 2005;116(2):360-9.
129. Williams B, Noonan G, Reiss TF, Knorr B, Guerra J, White R, et al. Long-term asthma control with oral montelukast and inhaled beclomethasone for adults and children 6 years and older. Clin Exp Allergy. 2001;31(6):845-54.
130. Stelmach I, Jerzynska J, Kuna P. A randomized, double-blind trial of the effect of glucocorticoid, antileukotriene and beta-agonist treatment on IL-10 serum levels in children with asthma. Clin Exp Allergy. 2002;32(2):264-9.
131. Stelmach I, Majak P, Jerzynska J, Stelmach W, Kuna P. Comparative effect of triamcinolone, nedocromil and montelukast on asthma control in children: A randomized pragmatic study. Pediatr Allergy Immunol. 2004;15(4):359-64.
132. Karaman O, Sünneli L, Uzuner N, Islekel H, Turgut CS, Köse S, et al. Evaluation of montelukast in 8 to 14 year old children with mild persistent asthma and compared with inhaled corticosteroids. Allergol Immunopathol (Madr). 2004;32(1):21-7.
133. Stelmach I, Bobrowska-Korzeniowska M, Majak P, Stelmach W, Kuna P. The effect of montelukast and different doses of budesonide on IgE serum levels and clinical parameters in children with newly diagnosed asthma. Pulm Pharmacol Ther. 2005;18(5):374-80.
134. Zeiger RS, Szefler SJ, Phillips BR, Schatz M, Martinez FD, Chinchilli VM, et al. Response profiles to fluticasone and montelukast in mild-to-moderate persistent childhood asthma. J Allergy Clin Immunol. 2006;117(1):45-52.
135. Kumar V, Ramesh P, Lodha R, Pandey RM, Kabra SK. Montelukast vs. inhaled low-dose budesonide as monotherapy in the treatment of mild persistent asthma: a randomized double blind controlled trial. J Trop Pediatr. 2007;53(5):325-30.
136. Stelmach I, Grzelewski T, Bobrowska-Korzeniowska M, Stelmach P, Kuna P. A randomized, double-blind trial of the effect of anti-asthma treatment on lung function in children with asthma. Pulm Pharmacol Ther. 2007;20(6):691-700.
137. Gradman J, Wolthers OD. A randomized trial of lower leg and height growth in children with asthma treated with inhaled budesonide from a new dry powder inhaler. Pediatr Allergy Immunol. 2010;21(1 Pt 2):e206-12.
138. Jonas D, Wines R, DelMonte M, Amick H, Wilkins T, Einerson B, et al. Drug Class Review: Controller Medications for Asthma: Final Update 1 Report. 2011.
139. Camargos PA, Lasmar LM. Effects of beclomethasone and factors related to asthma on the growth of prepubertal children. Respir Med. 2010;104(7):951-6.
140. Philip G, Hustad CM, Malice MP, Noonan G, Ezekowitz A, Reiss TF, et al. Analysis of behavior-related adverse experiences in clinical trials of montelukast. J Allergy Clin Immunol. 2009;124(4):699-706.e8.
141. Wallerstedt SM, Brunlöf G, Sundström A, Eriksson AL. Montelukast and psychiatric disorders in children. Pharmacoepidemiol Drug Saf. 2009;18(9):858-64.
142. O’Byrne PM, Pedersen S, Carlsson LG, Radner F, Thorén A, Peterson S, et al. Risks of pneumonia in patients with asthma taking inhaled corticosteroids. Am J Respir Crit Care Med. 2011;183(5):589-95.
143. Ahmet A, Kim H, Spier S. Adrenal suppression: A practical guide to the screening and management of this under-recognized complication of inhaled corticosteroid therapy. Allergy Asthma Clin Immunol. 2011;7:13.
144. Chauhan BF, Ducharme FM. Anti-leukotriene agents compared to inhaled corticosteroids in the management of recurrent and/or chronic asthma in adults and children. Cochrane Database Syst Rev. 2012;5:CD002314.
145. Castro-Rodriguez JA, Rodrigo GJ. The role of inhaled corticosteroids and montelukast in children with mild-moderate asthma: results of a systematic review with meta-analysis. Archives of disease in childhood. 2010 May;95(5):365-70.
146. Kelly HW, Sternberg AL, Lescher R, Fuhlbrigge AL, Williams P, Zeiger RS, et al. Effect of inhaled glucocorticoids in childhood on adult height. N Engl J Med. 2012;367(10):904-12.









