- ¿Cuál es la utilidad de la medición de la FeNO en niños mayores de cinco años con síntomas dudosos de asma?
- ¿Cuál es la efectividad de la medición de la FeNO para guiar el tratamiento con glucocorticoides inhalados en niños mayores de cinco años con asma?
¿Cuál es la utilidad de la medición de la FeNO en niños mayores de cinco años con síntomas dudosos de asma?
Evidencia científica
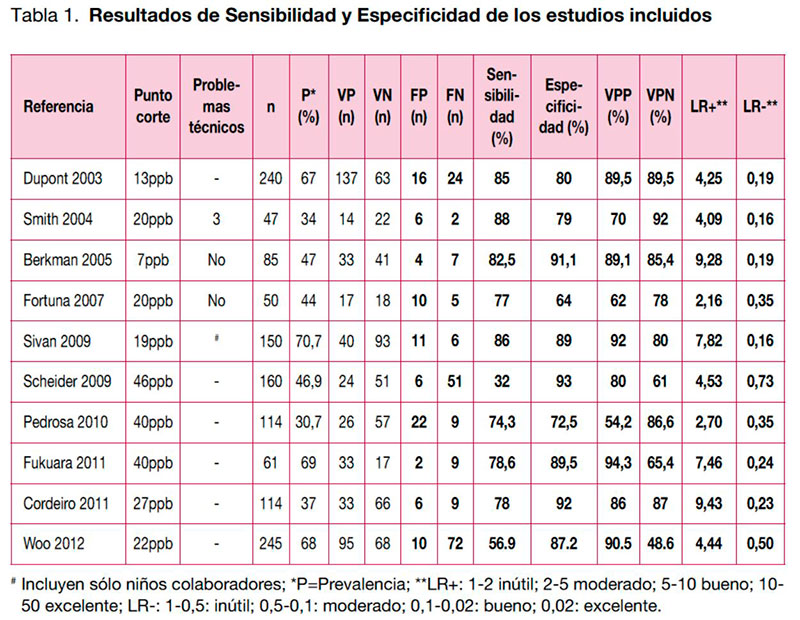
Las recomendaciones de las guías seleccionadas no son consistentes. La guía SIGN (45) no hace una recomendación al respecto, y las guías GEMA (46) y de la ATS (82) recomiendan, aunque de forma débil, la medición de la FeNO en este contexto. Se han identificado dos informes de ETS (88, 89). El primer informe (88) concluye que la medición de la FeNO puede ser utilizada por los neumólogos en el diagnóstico y la monitorización del asma. El segundo informe considera que la medición de la FeNO se encuentra en fase experimental/en investigación y que sigue sin haber un punto de corte validado y estandarizado que permita su utilización en el diagnóstico de asma (89). Se ha encontrado una revisión sistemática (90) que valora la precisión de la medición de la FeNO en el diagnóstico de broncoespasmo inducido por el ejercicio. En esta revisión, en la que se incluyen estudios con pacientes con asma así como pacientes con sospecha de asma, se concluye que la medición de la FeNO puede ser una herramienta importante para evitar la realización de un test del ejercicio cuando se obtiene un resultado negativo. Se han identificado 10 estudios con pacientes consecutivos (99-100), siete de los cuales (91-97) utilizaron como comparación el diagnóstico de asma basado en síntomas, junto con los resultados de las pruebas de broncodilatación e hiperrespuesta bronquial. En el estudio de Berkman et al. 2005 (98) se utiliza como comparador el diagnóstico realizado por síntomas junto con la variabilidad del FEV1 en el seguimiento, tanto en respuesta con glucocorticoides y/u otros medicamentos. Otros estudios (99-100) realizan el diagnóstico de asma mediante síntomas y prueba de hiperrespuesta bronquial. Por otro lado, sólo dos de los 10 estudios incluyen pacientes de entre cinco y 18 años (93-97). En la tabla 1 se presentan los dastos de sensibilidad y especifidad obtenidos en cada uno de los 10 estudios. La sensibilidad oscila entre el 32% y el 88%, siendo mejores los valores de especifidad (entre el 64% y 92%). Los valores predictivos positivos (VPP) van desde el 54,2% hasta el 94,3% y los negativos (VPN) desde el 48,6% al 92%.
Resumen de la evidencia
|
Calidad baja
|
En pacientes con probabilidad pretest del 48%, habrá 336 verdaderos positivos y 144 falsos negativos, es decir 144 pacientes con asma por cada 1000 pacientes que la prueba no ha sido capaz de clasificar como asmáticos. De los 520 pacientes que no tienen asma y a los que se les ha aplicado la prueba, 82 serán falsos positivos, es decir, 82 pacientes de 1000 habrán recibido un falso diagnóstico de asma, mientras que 438 habrán sido bien clasificados como verdaderos negativos (91-100). |
De la Evidencia a la recomendación
- La calidad global de la evidencia es baja.Se considera que la evidencia que existe es de baja calidad debido a que los estudios han sido principalmente realizados en adultos; y la importante heterogeneidad e imprecisión de resultados de sensibilidad y especifidad.
- El balance entre beneficios y riesgos: Los beneficios y riesgos/inconvenientes están equilibrados.La definición de asma en los diferentes estudio es heterogénea, las poblaciones y los valores de corte considerados para el diagnóstico también lo son.No hay homogeneidad en los aparatos de medida de FeNO y en el flujo espiratorio adecuado para medirlo. Hay un excesivo número de falsos positivos y negativos ya que hay mucha incertidumbre en los valores normales del FeNO y que dependen de la edad, la talla, del uso de GCI (Glucocorticoides inhalados) y del estado atópico entre otros.
- Valores y preferencias de pacientes y/o sus ciudadores: Probable incertidumbre y variabilidad en la opinión sobre los desenlaces.No se ha podido extraer información de utilidad del grupo focal realizado. Sin embargo, como se trata de una prueba sencilla de realizar y que no tiene efectos adversos, se piensa que las preferencias son similares para todos los pacientes.
- Costes y uso de recursos: Los costes son altos en relación a los beneficios.Se trata de una prueba cara de realizar. Las unidades de asma ya cuentan con equipos para medir la FeNO. No se considera necesario la implantación en AP.Por lo tanto, debido a la baja calidad de la evidencia disponible y a la falta de estandarización y validación en el punto de corte, así como su validez exclusivamente para asma eosinofílica, no podemos recomendar en el momento actual el uso generalizado de esta prueba.
Recomendaciones
|
Fuerte
|
Se recomienda no utilizar de forma generalizada la medición de la FeNO para el apoyo en el diagnóstico de asma en niños mayores de cinco años. |
|
√
|
Se sugiere la utilización de la medición de la FeNO para apoyar el diagnóstico de asma, sólo en atención especializada, en niños con síntomas dudosos de asma y resultados no concluyentes en las pruebas de función pulmonar. |
¿Cuál es la efectividad de la medición de la FeNO para guiar el tratamiento con glucocorticoides inhalados en niños mayores de cinco años con asma?
Evidencia científica
La guía del SIGN (45) señala que se necesitan más estudios para establecer si se pueden identificar subgrupos de pacientes con asma en los que el tratamiento guiado por biomarcadores sea efectivo. Sin embargo, las guías GEMA (46) y ATS (82) sí la recomiendan (GEMA de forma débil y ATS de forma fuerte). Un informe de evaluación publicado por AETSA (Agencia de Evaluación de Tecnologías Sanitarias de Andalucía) (103) concluye que la validez clínica de la utilización de la determinación de los valores de la FeNO para el control del asma infanto-juvenil no ha sido establecida de forma concluyente, y que su utilización no mejora los resultados. Se ha encontrado una revisión Cochrane (104) y otra revisión más reciente basada en los mismos resultados de la revisión Cochrane, aunque centrada en los ensayos realizados en niños (105). En la tabla GRADE se presentan los resultados de los cuatro estudios en niños (106-109) incluidos en la revisión Cochrane (104), ya que posteriormente no se han identificado nuevos estudios al respecto.
Resumen de la evidencia
|
Calidad moderada
|
La estrategia para guiar el tratamiento con GCI a la que se le añade la medición de la FeNO disminuye el número de pacientes con una o más exacerbaciones (DR de-0,063 (IC95% de -0,124 a 0,002), aunque a expensas de aumentar la dosis glucocorticoides inhalados final (DM de 140,18 µg (IC95% de 28,94 a 251,43) (106-109). |
De la Evidencia a la recomendación
- La calidad global de la evidencia es moderada.Teniendo en cuenta los posibles sesgos y la imprecisión en la estimación de la dosis de GCI final, se considera que la evidencia que existe es de baja calidad.
- El balance entre beneficios y riesgos: Los riesgos/inconvenientes superan ligeramente los beneficios.La estrategia de medir la FeNO para guiar el tratamiento con GCI disminuye el número de pacientes con una o más exacerbaciones (DF de -0,063 (IC95% de -0,124 a 0,002)), pero a expensas de utilizar una mayor dosis de glucocorticoides inhalados final (DM de 140,18 µg (IC95% de 28,94 a 251,43).
- Valores y preferencias de pacientes y/o sus ciudadores: Poca incertidumbre y opiniones similares (sin variabilidad).No se pudo obtener información al respecto en el grupo focal realizado.
- Costes y uso de recursos: Los costes son altos en relación a los beneficios.Por lo tanto, dada la incertidumbre de la evidencia actual, el coste de la prueba y la espera de nuevos estudios, en el momento actual no se recomienda el uso generalizado de la prueba.
Recomendaciones
|
Fuerte
|
Se recomienda no utilizar la medición de la FeNO de forma generalizada para guiar el tratamiento con glucocorticoides de niños con asma. |
|
√
|
Se sugiere la posibilidad de utilizar la medición de la FeNO en el ámbito de la atención especializada en casos seleccionados para poder predecir una posible reagudización en aquellos niños con asma a los que se retira o disminuye el tratamiento con glucocorticoides inhalados. |
Bibliografía 6. Diagnóstico y monitorización del tratamiento
7. Committee. IS. Worldwide variations in the prevalence of asthma symptoms: the International Study of Asthma and Allergies in Childhood (ISAAC). EurRespir J. 1998;12(2):315-35.
45. British guideline on the management of asthma. A national clinical guideline. 2011.
46. GEMA 2009. Guía española para el manejo del asma. 2009.
82. Dweik RA, Boggs PB, Erzurum SC, Irvin CG, Leigh MW, Lundberg JO, et al. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med. 2011;184(5):602-15.
88. Sabirin J, Krishnasamy M. Health Technology Assessment Report: Exhaled nitric oxide measurement using niox or niox mino. 2008.
89. Policies BM. Measurement of Exhaled Nitric Oxide and Exhaled Breath Condensate in the Diagnosis and Management of Asthma and Other Respiratory Disorders. Current Procedural Terminology. March 2012.
90. Feitosa LA, Dornelas de Andrade A, Reinaux CM, Britto MC. Diagnostic accuracy of exhaled nitric oxide in exercise-induced bronchospasm: Systematic review. Rev Port Pneumol. 2012;18(4):198-204.
91. Smith AD, Cowan JO, Filsell S, McLachlan C, Monti-Sheehan G, Jackson P, et al. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med. 2004;169(4):473-8.
92. Dupont LJ, Demedts MG, Verleden GM. Prospective evaluation of the validity of exhaled nitric oxide for the diagnosis of asthma. Chest. 2003;123(3):751-6.
93. Sivan Y, Gadish T, Fireman E, Soferman R. The use of exhaled nitric oxide in the diagnosis of asthma in school children. J Pediatr. 2009;155(2):211-6.
94. Schneider A, Tilemann L, Schermer T, Gindner L, Laux G, Szecsenyi J, et al. Diagnosing asthma in general practice with portable exhaled nitric oxide measurement--results of a prospective diagnostic study: FENO < or = 16 ppb better than FENO < or = 12 ppb to rule out mild and moderate to severe asthma [added]. Respir Res. 2009;10:15. 95. Fukuhara A, Saito J, Sato S, Sato Y, Nikaido T, Saito K, et al. Validation study of asthma screening criteria based on subjective symptoms and fractional exhaled nitric oxide. Ann Allergy Asthma Immunol. 2011;107(6):480-6. 96. Cordeiro D, Rudolphus A, Snoey E, Braunstahl GJ. Utility of nitric oxide for the diagnosis of asthma in an allergy clinic population. Allergy Asthma Proc. 2011;32(2):119-26. 97. Woo SI, Lee JH, Kim H, Kang JW, Sun YH, Hahn YS. Utility of fractional exhaled nitric oxide (F(E)NO) measurements in diagnosing asthma. Respir Med. 2012;106(8):1103-9. 98. Berkman N, Avital A, Breuer R, Bardach E, Springer C, Godfrey S. Exhaled nitric oxide in the diagnosis of asthma: comparison with bronchial provocation tests. Thorax. 2005;60(5):383-8. 99. Pedrosa M, Cancelliere N, Barranco P, López-Carrasco V, Quirce S. Usefulness of exhaled nitric oxide for diagnosing asthma. J Asthma. 2010;47(7):817-21. 100. Fortuna AM, Feixas T, González M, Casan P. Diagnostic utility of inflammatory biomarkers in asthma: exhaled nitric oxide and induced sputum eosinophil count. Respir Med. 2007;101(11):2416-21. 101. Schleich FN, Asandei R, Manise M, Sele J, Seidel L, Louis R. Is FENO50 useful diagnostic tool in suspected asthma? Int J Clin Pract. 2012;66(2):158-65. 102. Smith AD, Cowan JO, Brassett KP, Filsell S, McLachlan C, Monti-Sheehan G, et al. Exhaled nitric oxide: a predictor of steroid response. Am J Respir Crit Care Med. 2005;172(4):453-9. 103. García-Estepa R, Praena-Crespo M, Flores-Moreno S, Ruiz-Canela Cáceres J, Martín-Muñoz P, Beltrán-Calvo C. Revisión sistemática de la utilidad de la determinación del óxido nítrico espirado en el control del asmainfanto-juvenil. Informes de Evaluación de Tecnologías Sanitarias. AETSA 2009/7. Disponible en: http://aunets.isciii.es/ficherosproduc¬tos/388/AETSA_2009-7_Oxido_Nitroso_asma_2.pdf. 104. Petsky HL, Cates CJ, Li A, Kynaston JA, Turner C, Chang AB. Tailored interventions based on exhaled nitric oxide versus clinical symptoms for asthma in children and adults. Cochrane Database Syst Rev. 2009 (4):CD006340. 105. Jartti T, Wendelin-Saarenhovi M, Heinonen I, Hartiala J, Vanto T. Childhood asthma management guided by repeated FeNO measurements: a meta-analysis. Paediatr Respir Rev. 2012;13(3):178-83. 106. Pijnenburg MW, Bakker EM, Hop WC, De Jongste JC. Titrating steroids on exhaled nitric oxide in children with asthma: a randomized controlled trial. Am J Respir Crit Care Med. 2005;172(7):831-6. 107. Szefler SJ, Mitchell H, Sorkness CA, Gergen PJ, O’Connor GT, Morgan WJ, et al. Management of asthma based on exhaled nitric oxide in addition to guideline-based treatment for inner-city adolescents and young adults: a randomised controlled trial. Lancet. 2008;372(9643):1065-72. 108. de Jongste JC, Carraro S, Hop WC, Baraldi E, Group CS. Daily telemonitoring of exhaled nitric oxide and symptoms in the treatment of childhood asthma. Am J Respir Crit Care Med. 2009;179(2):93-7. 109. Fritsch M, Uxa S, Horak F, Putschoegl B, Dehlink E, Szepfalusi Z, et al. Exhaled nitric oxide in the management of childhood asthma: a prospective 6-months study. Pediatr Pulmonol. 2006;41(9):855-62.






