Guía de Práctica Clínica sobre atención paliativa al adulto en situación de últimos días
Guía de Práctica Clínica sobre atención paliativa al adulto en situación de últimos días
Introducción
Los avances científicos y tecnológicos desarrollados en las últimas décadas unidos a las mejoras sociales y de condiciones de vida, han cambiado la epidemiología de las enfermedades y también la epidemiología de la muerte, sobre todo en los países desarrollados. Dos consecuencias de los aspectos mencionados son el aumento de la esperanza de vida y el cambio en las causas y condiciones de muerte, de manera que en la actualidad se estima que 3 de cada 4 muertes podrían producirse por la progresión de uno o más problemas crónicos de salud (1)3. Además de la cronicidad están irrumpiendo en nuestro medio otros condicionantes que hacen aún más compleja la práctica clínica como son los movimientos migratorios, la crisis económica y la desigualdad en la distribución de la riqueza, los cambios en los modelos de familia, el aumento del coste sanitario y el reconocimiento de la finitud de los recursos, lo que conlleva a un escenario complejo, diverso, con poblaciones especialmente vulnerables y en riesgo de exclusión social.
Este nuevo escenario, con la aparición de la cronicidad y los factores sociodemográficos mencionados, obligan a replantear los objetivos de salud y con ellos, el ejercicio de las profesiones sanitarias y sociales.
El abordaje de la cronicidad implica conocer la trayectoria de las diferentes enfermedades para diseñar programas de salud y adecuar los planes de cuidados a cada caso individual (desde el paciente joven con cáncer con su trayectoria vital sin completar, a la persona mayor con enfermedad de órgano terminal), garantizando la continuidad asistencial (2). En este contexto, los cuidados y el enfoque paliativo de la práctica clínica se deben integrar desde el principio del diagnóstico de una enfermedad incurable y progresiva con pronóstico vital limitado, muchas veces impreciso, coexistiendo de modo sinérgico y complementario con aquellos tratamientos específicos de la enfermedad y acrecentándose a medida que las enfermedades van progresando, llegando a la etapa final o de enfermedad en situación terminal (3). Más allá del concepto de “paliativo oncológico y no oncológico” en este momento se prefiere un lenguaje no dicotómico, por lo que se ha propuesto hablar de “enfermedades crónicas avanzadas” incluyéndose en este concepto desde aquellos pacientes con enfermedades activas y avanzadas con pronóstico limitado, donde el objetivo fundamental es la mejora de la calidad de vida, hasta los cuidados de los pacientes con enfermedades de mal pronóstico, pero cuya muerte no parece cercana. Así se incluyen pacientes con diagnóstico reciente de cáncer avanzado, pacientes con enfermedad crónica avanzada de un órgano, demencia senil avanzada, enfermedades degenerativas del sistema nervioso central, ancianos frágiles y comas evolucionados de diferentes causas (4).
Surge así un nuevo paradigma, el de los cuidados paliativos precoces integrados en la cronicidad avanzada, que cambia notablemente el concepto de la medicina paliativa, anteriormente relegada a la etapa final de la vida (últimos 3-6 meses). Con ello, la atención paliativa deja de ser un ámbito exclusivo de los servicios específicos para convertirse en un modelo de atención transversal y multiprofesional, que requiere estrategias formativas y de integración asistencial, que garantice la continuidad asistencial, y una adecuada planificación por parte de los responsables de los servicios de salud (2, 5).
En el año 1996 el prestigioso centro de bioética, Hastings Center, en Nueva York, convocó a un grupo de expertos mundiales para redefinir los fines de la medicina (6) en un contexto de progresivo aumento de las necesidades y posibilidades científicas y técnicas, pero también desde los planteamientos y principios de la bioética. Tres de los cuatro fines planteados tienen que ver con el alivio del dolor y sufrimiento al final de la vida:
- El alivio del dolor y el sufrimiento causado por las enfermedades.
- La atención a la curación de los enfermos y cuidados a los incurables.
- La evitación de la muerte prematura y la búsqueda de una muerte tranquila.
Se ha definido muerte tranquila o buena muerte como: “aquella libre de angustia y sufrimiento evitable, para los pacientes y sus familiares, de acuerdo a sus deseos y razonablemente coherentes con los estándares clínicos, culturales y éticos” (7-11). Facilitar un buen final de la vida define una sociedad avanzada y buena. Aunque el nuevo paradigma de la atención paliativa se extiende temporal y conceptualmente a estadios más precoces de la enfermedad, no podemos olvidar que la atención al moribundo es trascendental. Muchas veces es la última oportunidad de hacer bien las cosas o de mantener la adecuada atención de etapas previas del proceso asistencial.
Sin embargo, ya desde 1995, en que el paradigmático estudio SUPPORT (Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments) (12) puso de manifiesto el sufrimiento que rodea el final de la vida, son numerosos los trabajos que siguen evidenciando que el final de la vida está rodeado de dolor, agresividad terapéutica, inequidad y, en definitiva, gran sufrimiento (13-19). Además, cabe tener en cuenta que el proceso de final de vida y, especialmente, la situación de últimos días, conlleva, no solo el sufrimiento de la persona enferma, sino también el de sus allegados y de los profesionales implicados.
El complejo escenario descrito, justifica que el grupo elaborador de la guía (GEG) decidiera centrar esta guía en la atención a la SUD, excluyendo otros ámbitos como los cuidados paliativos precoces, los cuidados continuos integrados, o la atención al duelo, algunos de ellos contemplados en la guía previa (20), por considerar que cualquiera de ellos debería ser objeto de una guía o documentos específicos.
Existen múltiples denominaciones utilizadas en la literatura para definir el último periodo previo a la muerte: final de vida, agonía, fase terminal o paciente muriendo activamente. El GEG ha adoptado el término situación de últimos días (SUD) que se define como el periodo que precede a la muerte cuando esta se produce de forma gradual y en el que existe deterioro físico intenso, debilidad extrema, alta frecuencia de trastornos cognitivos y de la consciencia, dificultad de relación e ingesta y pronóstico de vida de días u horas.
Para alcanzar un buen final de la vida además de elaborar, actualizar e implementar guías de práctica clínica, algunos otros elementos se convierten en imprescindibles, entre los que destacan:
- Promover un cambio cultural en la sociedad que contemple la muerte como un fenómeno natural consustancial a la vida.
- Diseñar estrategias de gestión del cambio orientadas a todos los agentes implicados (gestores, profesionales y ciudadanía), concienciando de la importancia de realizar una práctica clínica bajo la óptica de un abordaje paliativo.
- Desarrollar estrategias formativas transversales dirigidas a todos los ámbitos sanitarios implicados que favorezcan esta integración de cuidados.
- Dotar adecuadamente los dispositivos y unidades implicadas, siguiendo estándares ya definidos [por ejemplo, los del Ministerio de Sanidad (21)] y trabajar en el desarrollo de nuevos estándares.
- Proveer de una estructura residencial y sociosanitaria adecuada, acorde a los nuevos modelos familiares y sociodemográficos.
- Proveer de observatorios y comisiones institucionales que velen por la adecuada implementación y desarrollo de las guías.
La presente guía tiene como objetivo principal, servir para la orientación y la actuación de todos aquellos profesionales, tanto de unidades específicas como de cualquier otro servicio de atención primaria, hospitalaria o centros residenciales, que asisten a pacientes en SUD, y con el objetivo último de conseguir una buena calidad de vida hasta el final y una buena muerte.
_______________________________________________________________
3. En el momento de publicación de esta guía, con la aparición de la pandemia por SARS-COV-2 es probable que las principales causas de mortalidad cambien.
Alcance y objetivos
Esta Guía de Práctica Clínica (GPC) se enmarca en el Programa de GPC en el Sistema Nacional de Salud (SNS) y se ha realizado como parte de las actividades de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del SNS (RedETS), financiadas por el Ministerio de Sanidad. Actualiza parcialmente la GPC previa sobre Cuidados Paliativos publicada en el año 2006 (20) (específicamente las áreas clínicas de atención en los últimos días y sedación paliativa).
El objetivo de la GPC es servir como instrumento para mejorar la atención sanitaria de las personas en situación de últimos días y de sus familias, en los distintos ámbitos y centros donde sean atendidos (atención hospitalaria, atención primaria, atención en domicilio, servicios de urgencias y centros sociosanitarios).
Nuestra población diana, por tanto, abarca pacientes adultos (mayores de 18 años) durante el periodo que precede a la muerte cuando esta se produce de forma gradual y en el que existe deterioro físico intenso, debilidad extrema, alta frecuencia de trastornos cognitivos y de la consciencia, dificultad de relación e ingesta y pronóstico de vida de días u horas, independientemente de que la persona estuviese o no en un programa de cuidados paliativos. El GEG ha optado por utilizar el término situación de últimos días, en vez de otros términos utilizados en la literatura y a nivel legislativo (agonía, fase terminal o paciente muriendo activamente), por considerar que los otros términos pueden ser ambiguos y llevar a equívocos, tal y como propone la GPC del National Institute for Health and Care Excellence (NICE) sobre el cuidado de adultos en los últimos días (22).
En cuanto al periodo temporal considerado, aunque la GPC del NICE se centra en los últimos 2-3 días, en esta guía el GEG ha extendido el marco temporal hasta los 7-10 días porque se considera un periodo temporal más cercano a la realidad asistencial.
En esta GPC se abordan las siguientes áreas clínicas de la atención al paciente adulto en situación de últimos días:
- Reconocimiento de la situación de últimos días.
- Comunicación e información.
- Toma de decisiones compartida y desarrollo del plan de cuidados.
- Hidratación.
- Manejo de síntomas: dolor, disnea, náuseas y vómitos, ansiedad, delirium y estertores.
- Sedación paliativa.
También se incluyen anexos con información relevante desde el punto de vista clínico (material complementario a los capítulos clínicos y aspectos ético-legales), y un documento de información para familiares y allegados, desarrollado paralelamente a la elaboración de la guía (también incluido en los anexos).
No se abordan la atención a pacientes menores de 18 años, los cuidados paliativos (CP) antes de los últimos días de la vida, la atención al duelo, la organización de los cuidados y modelos de atención, la composición de los equipos multidisciplinares o aspectos referidos al cuidado y autocuidado de los profesionales.
Recomendaciones
Reconocimiento de situación de últimos días
Actualizado a fecha: 01/06/2022
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
¿Qué signos y síntomas se deben evaluar cuando sospechamos que un paciente adulto con enfermedad crónica avanzada puede estar en situación de últimos días?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Cuando se esté atendiendo a personas que padecen enfermedades progresivas, en situación muy avanzada, se recomienda evaluar siempre el pronóstico e identificar si se encuentra en una probable situación de últimos días (diagnóstico situacional), y dejar registro en la historia clínica.
2. Se recomienda apoyar el juicio clínico (pieza clave en el diagnóstico de situación de últimos días) mediante los siguientes aspectos:
- Valoración de las posibles causas reversibles del deterioro, principalmente cuando no hay coherencia entre la evolución esperada y la aparición de síntomas.
- Monitorización de cambios en las necesidades físicas, psicosociales y espirituales de los pacientes.
- Evaluación de la situación funcional y velocidad de declive. En caso de valorar el uso de escalas como apoyo a la evaluación, se sugiere emplear la PPS (Palliative Performance Scale) o la ECOG (Eastern Cooperative Oncology Group).
- Consideración de las opiniones del resto del equipo interdisciplinar, y en caso de dudas contar con el apoyo de profesionales expertos.
Los efectos deseables probablemente superan los efectos no deseables, pero con una incertidumbre apreciable. Eso implica que cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
3. Se sugiere evaluar los siguientes aspectos:
- Cambios cardiovasculares:
- Hipotensión
- Oliguria
- Livideces
- Cambios respiratorios:
- Respiración ruidosa (estertores)
- Cambios en el patrón respiratorio: respiración de Cheyne-Stokes, apneas
- Disnea
- Respiración con movimiento mandibular
- Cambios del estado físico:
- Debilidad profunda y progresiva
- Pérdida de la habilidad de cerrar los ojos
- Indiferencia hacia comida y bebida
- Dificultad para la deglución
- Incontinencia o retención urinaria
- Cambios cognitivos y neurológicos:
- Disminución del nivel de alerta (desde somnolencia al coma)
- Delirium hipoactivo o hiperactivo (con agitación)
- Cambios psicosociales y emocionales:
- Aislamiento
- Cambios en el estado de ánimo
- Cambios en la experiencia espiritual.
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
4. Se recomienda investigar y descartar de forma proporcionada y teniendo en cuenta los valores y preferencias de paciente/allegados, posibles causas reversibles del deterioro: deshidratación, infección, toxicidad por opioides, retirada de esteroides, insuficiencia renal aguda, alteraciones metabólicas, y si es el caso, iniciar el tratamiento correspondiente.
Justificación
Se ha realizado una recomendación débil a favor sobre la evaluación de diferentes signos y síntomas en pacientes con enfermedades progresivas en situación avanzada y una serie de recomendaciones de buena práctica clínica que pretenden favorecer una evaluación sistematizada y un registro de las necesidades y preferencias de los pacientes y sus familiares. El grupo de trabajo ha considerado el balance beneficio-riesgo favorable, la importancia para los pacientes, y que la evaluación podría no suponer un coste añadido relevante con respecto a la práctica clínica habitual.
Justificación detallada
Balance beneficio-riesgo: la evaluación de los signos y síntomas revisados no requiere la realización de pruebas invasivas o complejas, por lo que no debería causar ningún daño al paciente. Debido a ello el grupo considera que el balance beneficio-riesgo es favorable a la evaluación de signos y síntomas, teniendo en cuenta que la estimación apropiada de la entrada en SUD podrá tener un impacto importante en la toma de decisiones sobre el plan de cuidados y los tratamientos, y podría favorecer la planificación de aspectos personales y familiares.
Valoración de los desenlaces por parte de los pacientes: desde el punto de vista del grupo de trabajo, la mayoría de los pacientes, una vez informados de los pros y contras, estarían de acuerdo con la identificación de la SUD.
Recursos requeridos: la mayoría de síntomas y signos que se emplean en la práctica clínica habitual para predecir la SUD pueden hacerse en una evaluación clínica sin costes importantes.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.Evidencia derivada de estudios cuantitativos
La GPC del NICE (22) incluyó siete estudios de cohortes (31-37): dos prospectivos y cinco retrospectivos, con tamaños muestrales que variaron entre 93 y 71 453, y principalmente con pacientes oncológicos (n = 5) (22). En la actualización se localizó un nuevo artículo, derivado de un estudio incluido en la GPC del NICE (Hui et al., 2015) (38) que analiza el rendimiento diagnóstico de una batería de 52 signos físicos adicionales.
Existe evidencia de moderada calidad de dos estudios con pacientes con cáncer sobre la reducción en la puntuación del ECOG score (Eastern Cooperative Oncology Group performance scale) como predictor de la mortalidad a siete días (n = 374 y 459), con OR de 3.45 (IC 1.65, 7.20) y de 2.02 (IC 1.40, 2.92). Un estudio de baja calidad (n = 93) también mostró que la fatiga y la desaturación fueron predictores de la mortalidad a dos semanas en pacientes con cáncer de pulmón [HR 5.90 (2.04, 17.03) y HR 3.30 (1.42, 7.66)], respectivamente. También existe evidencia de baja calidad de un estudio (n = 122) en pacientes oncológicos que acuden al servicio de urgencias por disnea, de una frecuencia cardíaca ≥ 110 y respiración > 28/min como predictores de mortalidad a dos semanas [RR 4.92 (1.42, 17.09) y RR 12.72 (3.08, 52.49)], respectivamente (22).
La evidencia sobre rendimiento diagnóstico procede fundamentalmente de un estudio en pacientes con cáncer terminal derivados a una unidad de CP (n=357) (Hui et al., 2014; Hui et al., 2015). Los resultados indican que existe evidencia de baja a moderada calidad de que varios signos y síntomas (presencia de estertores, apneas, respiración con movimiento mandibular, cianosis periférica, respiración de Cheyne-Stokes, ausencia de pulso radial y las escalas PPS-Palliative Performance Scale– y RASS-Richmond Agitation Sedation Scale) presentan una alta especificidad (81.3-99.2 %), aunque las sensibilidades son altamente variables (11.3-64 %) para la identificación de los últimos tres días de vida (22). En el análisis de los 52 signos y síntomas adicionales, se identificaron ocho nuevos signos y síntomas que presentaron una alta especificidad (>95 %): pupilas no reactivas, respuesta disminuida a estímulos verbales y visuales, incapacidad para cerrar los párpados, caída del pliegue nasolabial, hiperextensión del cuello, quejidos y gruñidos de cuerdas vocales y hemorragia gastrointestinal superior (38).
También existe evidencia, aunque de baja calidad, sobre el rendimiento diagnóstico para identificar la mortalidad a dos días de diferentes pruebas de laboratorio de dos estudios retrospectivos (n=42 701 y 71 453) (urea, creatinina, recuento de glóbulos blancos, bilirrubina, hemoglobina, hematocrito, bicarbonato total, pH y albúmina) con especificidades que oscilaron entre 64-84.7 % y sensibilidades de 36.2-71.8 %. El área bajo la curva de estos test osciló entre 0.53 – 0.80, lo que indica una precisión diagnóstica de muy pobre a moderada (22).
No se identificaron estudios en pacientes no oncológicos en los que el diagnóstico de muerte inminente es más impreciso por el tipo de evolución natural de la enfermedad y la presencia de síntomas propios de la enfermedad no siempre indicadores de muerte inminente (23, 24, 30). Además, la edad media de los participantes se situó en torno a los 60 años, por lo que existe cierta incertidumbre sobre su extrapolación a pacientes mayores.
No se ha identificado evidencia sobre ninguna combinación de signos y síntomas en forma de regla de predicción clínica que prediga con exactitud la situación de últimos días.
Los estudios cualitativos revisados también señalan la importancia de los cambios físicos (respiratorios y vasculares, deterioro de la condición física, reducción de la ingesta oral y empeoramiento del dolor) y psicosociales y espirituales (aislamiento social, cambios en el estado de ánimo y espirituales) (39-48).
Evidencia derivada de estudios cualitativos
La GPC del NICE incluyó 8 estudios cualitativos (3 basados en grupos focales y 5 en entrevistas/encuestas) (39-46). La mayoría de estudios incluyeron profesionales sanitarios (enfermeras y médicos, o equipos multidisciplinares). Solo uno de ellos incluyó también la visión de los cuidadores (43). En el análisis temático de la evidencia identificaron 5 temas principales, con diferentes subtemas, relacionados con las experiencias de los profesionales con el pronóstico en los últimos días de vida (tabla 1).
Tabla 1. Temas y subtemas derivados de la evidencia del reconocimiento de situación de últimos días
| Tema principal | Subtemas |
| Cambios físicos | – Cambios cardiovasculares y respiratorios
– Deterioro físico y funcional – Reducción de la ingesta oral – Empeoramiento del dolor – Cambios cutáneos |
| Cambios espirituales y psicosociales | – Aislamiento social
– Cambios en el estado de ánimo – Cambios en la experiencia espiritual |
| Dificultad en el reconocimiento de los últimos días | – Complejidad de diagnosticar la muerte
– Factores que pueden afectar a la precisión del pronóstico |
| Trayectoria de muerte | – Cambios en el patrón de síntomas en los últimos días
– Variabilidad en el periodo temporal hasta la muerte |
| Manejo de la incertidumbre | – Cambios en el manejo clínico asociados a la identificación de la situación de últimos días |
Fuente: adaptado de NICE 2015 (22).
Tema 1) cambios físicos: la evidencia de 5 estudios de calidad moderada (2 estudios cualitativos, n=33; 2 estudios tipo Delphi, n=324; y 1 estudio observacional, n=474) indica que los síntomas más observados fueron los cambios cardiovasculares y respiratorios, deterioro físico y funcional, reducción de la ingesta, empeoramiento del dolor y cambios cutáneos (22).
Tema 2) cambios espirituales y psicosociales: en dos estudios cualitativos de calidad alta-moderada (n=33), los profesionales identificaron el aislamiento social, y cambios en el estado de ánimo y espirituales como aspectos clave en la identificación de la SUD (22).
Tema 3) dificultad en el reconocimiento de los últimos días: tres estudios de calidad moderada señalaron la complejidad de diagnosticar la muerte (2 entrevistas y 1 encuesta, n=285) y dos señalaron algunos factores que pueden afectar a la precisión del pronóstico (fundamentalmente, la especialidad médica o los años de la relación médico-paciente) (22).
Tema 4) trayectoria de muerte: un estudio de calidad moderada (n=15) señaló que existe variabilidad en los cambios que se producen en los últimos días y se destacaron los síntomas respiratorios y cardiovasculares y el nivel de conciencia. Otro estudio de moderada calidad señaló la variabilidad en el periodo temporal que precede al fallecimiento (22).
Tema 5) manejo de la incertidumbre: se localizó evidencia de baja calidad, derivada de un estudio sobre la incertidumbre en los últimos días (n=8), que indica que los profesionales perciben que el manejo clínico es diferente en función de si se identifica la SUD. Los profesionales destacan la importancia de clarificar con el paciente sus objetivos personales, mejorar la comunicación con las familias, y pasar más tiempo con el paciente (22).
En la actualización de la búsqueda bibliográfica, se localizaron dos nuevos estudios de moderada calidad (47, 48), que complementan la evidencia considerada en el tema “dificultad de reconocimiento de los últimos días”. Fosse et al. (47) realizaron un estudio con profesionales de residencias de mayores (n=679) sobre las barreras y estrategias para la provisión de cuidados en residencias de mayores en Noruega y Países Bajos, y entre ellas se señalan la ausencia de habilidades para el reconocimiento de síntomas y la necesidad de disponer de protocolos para la evaluación de síntomas en esta fase de la atención. Hui et al. (48) realizaron una encuesta a especialistas en oncología (n=182) explorando las diferencias entre hematólogos y oncólogos y encontraron que los primeros perciben que fallan en la estimación de la progresión al final de la vida en mayor medida.
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.La evaluación de los signos y síntomas revisados no requiere la realización de pruebas invasivas o complejas, por lo que no deberían causar ningún daño al paciente.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Baja.Globalmente existe evidencia científica limitada sobre los signos y síntomas que pueden ser empleados en la predicción o identificación de los últimas días o horas de vida.
La calidad de la evidencia cuantitativa localizada es baja-moderada, y se basa en estudios de cohortes retrospectivos y prospectivos, principalmente en pacientes con cáncer.
La calidad de la evidencia cualitativa es moderada, aunque refleja principalmente la visión de los profesionales, dado que no se ha localizado ningún estudio que explore los signos y síntomas desde la perspectiva de los pacientes y solo uno incluye la visión de sus familias. Además, no se ha localizado ningún estudio en España, aunque teniendo en cuenta el objetivo principal de la revisión (identificación de síntomas y signos que pueden ayudar al reconocimiento de SUD) y los principales resultados obtenidos, el grupo de trabajo ha considerado que los resultados son aplicables a nuestro contexto sanitario.
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.No se ha identificado ningún estudio que evalúe la valoración de los desenlaces de interés por parte de los pacientes o sus familias. Solo un estudio (Domeisen et al., 2013 (43)) incluyó la visión de cuidadores, pero su objetivo no fue investigar sus valores sino identificar los síntomas que pueden ser importantes en la predicción o identificación de los últimos días desde el punto de vista de los cuidadores.
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificante.No se ha localizado ningún estudio de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluídos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
No hay estudios incluídos.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Probablemente aumenta.No se ha realizado una revisión sistemática del tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado una revisión sistemática del tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado una revisión sistemática del tema.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
7. Bayés R. Morir en paz: evaluación de los factores implicados. Med Clin (Barc).2004;122(14):539-41. DOI: 10.1016/s0025-7753(04)74299-2.
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
23. Baik D, Russell D, Jordan L, Dooley F, Bowles KH, Masterson Creber RM. Using the Palliative Performance Scale to Estimate Survival for Patients at the End of Life: A Systematic Review of the Literature. J Palliat Med. 2018;21(11):1651-61. DOI: 10.1089/jpm.2018.0141.
24. Ellershaw J, Ward C. Care of the dying patient: the last hours or days of life. Bmj. 2003;326(7379):30-4.
25. Kennedy C, Brooks-Young P, Brunton Gray C, Larkin P, Connolly M, Wilde-Larsson B, et al. Diagnosing dying: an integrative literature review. BMJ Support Palliat Care. 2014;4(3):263- DOI: 10.1136/bmjspcare-2013-000621.
26. Christakis NA, Lamont EB. Extent and determinants of error in doctors’ prognoses in terminally ill patients: prospective cohort study. Bmj. 2000;320(7233):469-72. DOI: 10.1136/ 320.7233.469.
27. Middlewood S, Gardner G, Gardner A. Dying in hospital: medical failure or natural outcome? J Pain Symptom Manage. 2001;22(6):1035-41. DOI: 10.1016/s0885-3924(01)00362-1.
28. Fins JJ, Miller FG, Acres CA, Bacchetta MD, Huzzard LL, Rapkin BD. End-of-life decision-making in the hospital: current practice and future prospects. J Pain Symptom Manage. 1999;17(1):6-15. DOI: 10.1016/s0885-3924(98)00109-2.
29. Toscani F, Di Giulio P, Brunelli C, Miccinesi G, Laquintana D. How people die in hospital general wards: a descriptive study. J Pain Symptom Manage. 2005;30(1):33-40. DOI: 10.1016/j. jpainsymman.2005.01.013.
30. Neuberger J, Guthrie C, Aaronovitch D, Hameed K, Bonser T, Harries R, et al. More care, less pathway: a review of the Liverpool Care Pathway. Liverpool: Independent Review of the Liverpool Care Pathway; 2013
31. Chiang JK, Lai NS, Wang MH, Chen SC, Kao YH. A proposed prognostic 7-day survival formula for patients with terminal cancer. BMC Public Health. 2009;9:365. DOI: 10.1186/1471- 2458-9-365.
32. Kao YH, Chen CN, Chiang JK, Chen SS, Huang WW. Predicting factors in the last week of survival in elderly patients with terminal cancer: a prospective study in southern Taiwan. J Formos Med Assoc. 2009;108(3):231-9. DOI: 10.1016/s0929-6646(09)60057-7.
33. Escalante CP, Martin CG, Elting LS, Price KJ, Manzullo EF, Weiser MA, et al. Identifying risk factors for imminent death in cancer patients with acute dyspnea. J Pain Symptom Manage. 2000;20(5):318-25.
34. Hui D, dos Santos R, Chisholm G, Bansal S, Silva TB, Kilgore K, et al. Clinical signs of impending death in cancer patients. Oncologist. 2014;19(6):681-7. DOI: 10.1634/theoncologist.2013-0457.
35. Loekito E, Bailey J, Bellomo R, Hart GK, Hegarty C, Davey P, et al. Common laboratory tests predict imminent death in ward patients. Resuscitation. 2013;84(3):280-5. DOI: 10.1016/j. resuscitation.2012.07.025.
36. Loekito E, Bailey J, Bellomo R, Hart GK, Hegarty C, Davey P, et al. Common laboratory tests predict imminent medical emergency team calls, intensive care unit admission or death in emergency department patients. Emerg Med Australas. 2013;25(2):132-9. DOI: 10.1111/1742- 12040.
37. Matsunuma R, Tanbo Y, Asai N, Ohkuni Y, Watanabe S, Murakami S, et al. Prognostic factors in patients with terminal stage lung cancer. J Palliat Med. 2014;17(2):189-94. DOI: 10.1089/ jpm.2013.0448.
38. Hui D, Dos Santos R, Chisholm G, Bansal S, Souza Crovador C, Bruera E. Bedside clinical signs associated with impending death in patients with advanced cancer: preliminary findings of a prospective, longitudinal cohort study. Cancer. 2015;121(6):960-7. DOI: 10.1002/cncr.29048.
39. Johnson DC, Kutner JS, Armstrong JD, 2nd. Would you be surprised if this patient died?: Preliminary exploration of first and second year residents’ approach to care decisions in critically ill patients. BMC Palliat Care. 2003;2(1):1.
40. Dendaas NR. Prognostication in advance cancer: nurses’ perceptions of the dying process. Oncol Nurs 2002;29(3):493-9. DOI: 10.1188/02.onf.493-499.
41. van der Werff GF, Paans W, Nieweg RM. Hospital nurses’ views of the signs and symptoms that herald the onset of the dying phase in oncology patients. Int J Palliat Nurs. 2012;18(3):143-9. DOI: 10.12968/ijpn.2012.18.3.143.
42. Abarshi E, Echteld M, Donker G, Van den Block L, Onwuteaka-Philipsen B, Deliens L. Discussing end-of-life issues in the last months of life: a nationwide study among general practitioners. J Palliat Med. 2011;14(3):323-30. DOI: 10.1089/jpm.2010.0312.
43. Domeisen BF, Ostgathe C, Clark J, Costantini M, Daud ML, Grossenbacher-Gschwend B, et al. International palliative care experts’ view on phenomena indicating the last hours and days of life. Support Care Cancer. 2013;21(6):1509-17.
44. Brandt HE, Deliens L, Ooms ME, van der Steen JT, van der Wal G, Ribbe MW. Symptoms, signs, problems, and diseases of terminally ill nursing home patients: a nationwide observational study in the Netherlands. Arch Intern Med. 2005;165(3):314-20. DOI: 10.1001/ 165.3.314.
45. Christakis NA, Lamont EB. Extent and determinants of error in physicians’ prognoses in terminally ill patients: prospective cohort study. West J Med. 2000;172(5):310-3. DOI: 10.1136/ ewjm.172.5.310.
46. Kumagai Y, Maekawa A, Abe M. Prognostic items for the last 10 and 3 days of life of cancer patients at home. Cancer Nurs. 2012;35(5):390-6. DOI: 10.1097/NCC.0b013e318235287d.
47. Fosse A, Zuidema S, Boersma F, Malterud K, Schaufel MA, Ruths S. Nursing Home Physicians’ Assessments of Barriers and Strategies for End-of-Life Care in Norway and The Netherlands. J Am Med Dir Assoc. 2017;18(8):713-8. DOI: 10.1016/j.jamda.2017.03.005.
48. Hui D, Bansal S, Park M, Reddy A, Cortes J, Fossella F, et al. Differences in attitudes and beliefs toward end-of-life care between hematologic and solid tumor oncology specialists. Ann Oncol. 2015;26(7):1440-6. DOI: 10.1093/annonc/mdv028.
¿Cuáles son factores asociados a una buena comunicación en los últimos días de vida entre el paciente, sus allegados y los profesionales sanitarios que lo atienden?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Se recomienda fomentar un clima adecuado basado en la calidez, empatía, asertividad y una actitud de escucha activa, prestando especial atención a la comunicación no verbal. En la medida de lo posible, es importante buscar un espacio físico que mantenga la privacidad, destinar el tiempo necesario, y permitir hacer preguntas y aclarar dudas, dejando también un espacio para la reflexión.
2. Se recomienda identificar las necesidades de comunicación y expectativas de las personas al final de la vida, teniendo en cuenta:
- Si el paciente desea o no que alguna persona determinada esté presente en el momento de tomar decisiones.
- El grado actual de conocimiento acerca de la situación final de vida.
- Cuánta información les gustaría tener acerca de su proceso.
- Sus preferencias y necesidades sociales, culturales, religiosas y espirituales.
- Sus miedos y preocupaciones.
Justificación
Estas recomendaciones pretenden favorecer una comunicación efectiva en los últimos días de vida que pueda mejorar la elaboración del plan de cuidados y la calidad de la atención. Las recomendaciones, aunque son de buena práctica clínica se han basado en estudios cualitativos sobre los factores que influyen en una buena comunicación al final de la vida.
Justificación detallada
Magnitud de los efectos deseables esperados: la evidencia señala diferentes factores relacionados con los pacientes, las familias, los profesionales sanitarios y los recursos disponibles que pueden actuar como barreras o facilitadores de la comunicación, y por lo tanto deben ser tenidos en cuenta para que la comunicación en los últimos días pueda ser efectiva. Los beneficios de una buena comunicación pueden tener un impacto importante en el paciente y en su familia, y por lo tanto es importante prestar atención al contenido, momento y estilo de la comunicación.
Certeza global en la evidencia: la calidad de la evidencia es globalmente baja, debido a las limitaciones metodológicas de los estudios, relacionadas con su propio diseño, que en muchos casos abordan la comunicación en CP y no específicamente la comunicación en los últimos días, y a que ninguno de los estudios se ha realizado en nuestro contexto. A pesar de ello, se ha considerado que los principales hallazgos podrían ser extrapolables a nuestro contexto sanitario y social, y son coherentes con la percepción sobre las barreras y facilitadores que el grupo de trabajo observa en la práctica clínica.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.La GPC del NICE (22) incluyó cuatro estudios cualitativos (50-53) y dos estudios basados en encuestas retrospectivas (54, 55). En la actualización se identificaron cinco nuevos estudios basados en entrevistas semiestructuradas y cuestionarios realizados en UU., Australia y Canadá (56-60).
La evidencia señala diferentes factores relacionados con los pacientes, las familias, los profesionales sanitarios y los recursos disponibles que pueden actuar como barreras o facilitadores de la comunicación, y por lo tanto deben ser tenidos en cuenta para que la comunicación en los últimos días pueda ser efectiva. Los beneficios de una buena comunicación pueden tener un impacto importante en el paciente y en su familia, y por lo tanto es importante prestar atención al contenido, momento y estilo de la comunicación.
En la siguiente tabla (tabla 2) se presentan los temas y subtemas extraídos de la evidencia considerada en la GPC del NICE (6). Para ver una descripción detallada de los estudios y sus resultados se puede consultar el material metodológico.
Tabla 2. Tema y subtemas extraídos de los estudios incluidos sobre barreras y facilitadores de la comunicación
| Tema principal | Subtemas |
| Factores relacionados con los familiares o allegados | – Dificultad para retener y procesar la información
– Familia no consciente del diagnóstico – Evitación – Exclusión del paciente en las conversaciones sobre el pronóstico |
| Factores relacionados con el paciente | – Tiempo
– Diferencias culturales o valores – Nivel de conciencia – Edad |
| Factores relacionados con los profesionales sanitarios | – Incertidumbre en el pronóstico
– Provisión de información a los pacientes – Información compartida entre los profesionales sanitarios – Habilidades de comunicación – Incomodidad con la discusión – Relación con el paciente (poca relación con el paciente como barrera) – Papel de la ambigüedad (relacionado con los roles y responsabilidad de la comunicación de situación de últimos días) – Entrenamiento y experiencia – Dificultades de programación de la comunicación (en relación con el tiempo y los recursos disponibles) |
| Factores relacionados con los recursos | – Privacidad |
Fuente: adaptado de NICE 2015 (22).
En la actualización se identificaron 5 nuevos estudios basados en entrevistas semiestructuradas y cuestionarios realizados en EE. UU., Australia y Canadá. Tres de ellos abordaron la percepción de los familiares y dos la de profesionales sanitarios. Estos estudios aportaron evidencia para los temas factores relacionados con la familia y factores relacionados con los profesionales sanitarios:
- Factores relacionados con la familia: Generous et (2017) (n=107) (56) aportan evidencia adicional sobre la evitación de las conversaciones sobre el pronóstico, siendo los temas más evitados las cuestiones negativas de la propia relación, la muerte en sí, información personal y trámites tras la muerte. Odgers et al. (2018) (n=12) (57) además de poner de manifiesto la evitación sobre temas relacionados con el pronóstico, también destacan la complejidad para retener e interpretar la información por parte de los familiares. La evitación también se extrae como un tema relevante en el estudio de Park et al. (2015) (58) donde además se destaca la necesidad de más y mejor información sobre el pronóstico y los últimos días de vida.
- Factores relacionados con los profesionales: Nouvet et al. (2016) (n=30) (59) identificaron como barreras la evitación, la incertidumbre y una tendencia a intentar mejorar la situación clínica. Rodenbach (2016) (n=33) (60) aporta evidencia sobre cómo la percepción personal de la propia muerte y el proceso de morir afecta a la comunicación con el paciente.
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.La revisión sistemática se ha orientado a barreras y facilitadores para una buena comunicación en la SUD.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Baja.La calidad de la evidencia es globalmente baja, debido a las limitaciones metodológicas de los estudios, relacionadas con el propio diseño de los mismos, que en muchos casos abordan la comunicación en CP y no específicamente la comunicación en los últimos días, y a que ninguno de los estudios se ha realizado en nuestro contexto. A pesar de ello, se ha considerado que los principales hallazgos podrían ser extrapolables a nuestro contexto sanitario y social, y son coherentes con la percepción sobre las barreras y facilitadores que el grupo de trabajo observa en la práctica clínica.
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o variabilidad no son importantes.Se han considerado los factores (barreras y facilitadores) para la comunicación en los últimos días, teniendo en cuenta la experiencia y opiniones de los principales agentes implicados (pacientes, familiares y profesionales sanitarios).
¿El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.La revisión sistemática se ha orientado a barreras y facilitadores para una buena comunicación en la SUD.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificantes.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluídos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Aumenta.No se ha realizado una revisión sistemática del tema.
¿Es aceptable la opción para los agentes implicados?
Sí.Aunque se han identificado barreras en la literatura para la comunicación en la SUD, y puede existir cierto rechazo al intercambio de información, el GEG considera que es aceptable y necesaria para la mayoría de las personas.
¿Es factible la implementación de la opción?
Sí.No se ha realizado una revisión sistemática del tema.
Otras consideraciones
El GEG estima que en la actualidad algunas personas llegan al final de su vida sin conocer su diagnóstico, pronóstico y otras cuestiones que le competen en primera persona. Las razones son variadas, incluido el derecho de la persona a no recibir información si no lo desea. Pero hay ocasiones en que es la familia o entorno, o los propios profesionales, los que ponen barreras para que la información llegue al destinatario, frecuentemente de una forma deliberada o por pactos implícitos de silencio. Es frecuente que los profesionales no informen porque el paciente no hace preguntas, o por una actitud paternalista, muy habitual con personas de edad avanzada. Hay que recordar que para que pueda haber rechazo a la información debe haber oferta de la misma. Desde la deontología y la ética la información es un deber del profesional, y no llevarlo a cabo tiene que estar adecuadamente justificado. Es más, los casos excepcionales en los que sea adecuado no informar a la persona de algo concreto no eximen de informar de otros aspectos del proceso.
El proceso de información debe iniciarse desde el mismo momento del diagnóstico de la enfermedad, utilizando todas las herramientas necesarias para la buena comunicación (ver tablas en anexo 1). Explorar qué sabe o qué desea saber la persona e informar de manera acorde a las necesidades de cada momento debe ser una tarea integrada en el día a día de los profesionales que atienden a los usuarios del sistema sanitario.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
6. The goals of medicine. Setting new priorities. Hastings Cent Rep. 1996;26(6):S1-27.
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
49. Wright AA, Zhang B, Ray A, Mack JW, Trice E, Balboni T, et al. Associations between end- of-life discussions, patient mental health, medical care near death, and caregiver bereavement adjustment. JAMA. 2008;300(14):1665-73. DOI: 10.1001/jama.300.14.1665.
50. Anselm AH, Palda V, Guest CB, McLean RF, Vachon ML, Kelner M, et al. Barriers to communication regarding end-of-life care: perspectives of care providers. J Crit Care. 2005;20(3):214-23. DOI: 10.1016/j.jcrc.2005.05.012.
51. Aslakson RA, Wyskiel R, Thornton I, Copley C, Shaffer D, Zyra M, et al. Nurse-perceived barriers to effective communication regarding prognosis and optimal end-of-life care for surgical ICU patients: a qualitative exploration. J Palliat Med. 2012;15(8):910-5. DOI: 10.1089/jpm.2011.0481.
52. Gutiérrez KM. Experiences and needs of families regarding prognostic communication in an intensive care unit: supporting families at the end of life. Crit Care Nurs Q. 2012;35(3):299-313. DOI: 10.1097/CNQ.0b013e318255ee0d.
53. Jackson A, Purkis J, Burnham E, Hundt GL, Blaxter L. Views of relatives, carers and staff on end of life care pathways. Emerg Nurse. 2010;17(10):22-6. DOI: 10.7748/en2010.03.17.10.22.
54. Houttekier D, Witkamp FE, van Zuylen L, van der Rijt CC, van der Heide A. Is physician awareness of impending death in hospital related to better communication and medical care? J Palliat Med. 2014;17(11):1238-43. DOI: 10.1089/jpm.2014.0203.
55. Sullivan AM, Lakoma MD, Matsuyama RK, Rosenblatt L, Arnold RM, Block SD. Diagnosing and discussing imminent death in the hospital: a secondary analysis of physician interviews. J Palliat Med. 2007;10(4):882-93. DOI: 10.1089/jpm.2007.0189.
56. Generous MA, Keeley M. Wished for and avoided conversations with terminally ill individuals during final conversations. Death Stud.2017;41(3):162-72.DOI: 10.1080/07481187.2016.1236850.
57. Odgers J. No one said he was dying: families’ experiences of end-of-life care in an acute setting. Australian Journal of Advanced Nursing. 2018;35(3):21-31.
58. Park EM, Check DK, Yopp JM, Deal AM, Edwards TP, Rosenstein DL. An exploratory study of end-of-life prognostic communication needs as reported by widowed fathers due to cancer. Psychooncology. 2015;24(11):1471-6. DOI: 10.1002/pon.3757.
59. Nouvet E, Strachan PH, Kryworuchko J, Downar J, You JJ. Waiting for the body to fail: limits to end-of-life communication in Canadian hospitals. Mortality. 2016;21(4):340-56. DOI: 10.1080/13576275.2016.1140133.
60. Rodenbach RA, Rodenbach KE, Tejani MA, Epstein RM. Relationships between personal attitudes about death and communication with terminally ill patients: How oncology clinicians grapple with mortality. Patient Education and Counseling. 2016;99(3):356-63. DOI: http://doi.org/10.1016/j.pec.2015.10.010.
Toma de decisiones compartida y desarrollo del plan de cuidados
Actualizado a fecha: 01/06/2021
¿Cuáles son los factores que pueden favorecer la toma de decisiones compartida sobre el plan de cuidados individualizado para los últimos días de vida?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Se recomienda, a pesar de la incertidumbre pronóstica en muchos casos, iniciar el proceso de toma de decisiones compartida lo antes posible durante el proceso de enfermedad, o al principio de la relación clínica si no ha sido realizado previamente por otros profesionales.
2. Al principio del proceso de toma de decisiones compartida se recomienda explorar el nivel de participación que la persona desea y puede tener, y que las discusiones sobre el desarrollo e implementación del plan de cuidados se realicen de forma honesta y transparente.
3. Durante el proceso de toma de decisiones se recomienda explorar las expectativas, deseos y preferencias del paciente respecto a la atención y los cuidados que desea recibir, según sus valores. En caso de que el paciente se encuentre en una situación que no le permita tomar decisiones, revisar:
- La existencia de un documento de instrucciones previas o voluntades anticipadas.
- Las anotaciones en la historia clínica referidas a un proceso de planificación anticipada y compartida de la asistencia.
- Las preferencias manifestadas a sus familiares y/o allegados acerca de los cuidados que desearía recibir.
- Si existe un representante designado por el paciente. En caso de no existir representante designado ni familiares y/o allegados, la toma de decisiones corresponderá al equipo terapéutico, buscando el mayor consenso y actuando siempre buscando el mejor beneficio o interés para el paciente.
4. Se recomienda registrar los temas tratados y el plan de cuidados en un lugar adecuado para ello en la historia clínica, accesible para todos los profesionales que intervienen en la atención, y compartir esta información, además de con el resto del equipo de atención, con los allegados de la persona enferma implicados en su cuidado y/o acompañamiento.
Justificación
El GEG ha emitido una serie de recomendaciones que pretenden favorecer una adecuada toma de decisiones compartida y la elaboración del plan de cuidados. Las recomendaciones se han basado en la evidencia cualitativa considerada sobre barreras y facilitadores, y en la experiencia del grupo. El GEG considera relevante promover la toma de decisiones compartida y un proceso continuado de planificación durante todo el proceso de enfermedad ya que es frecuente que en los últimos días el paciente pierda la capacidad de tomar decisiones o la voluntad para tomarlas. En cualquier caso, la actitud de los profesionales debería ser la de fomentar la participación del paciente hasta el final mientras sea posible.
Justificación detallada
Magnitud de los efectos esperados: la evidencia señala barreras y facilitadores para una toma de decisiones efectiva que pueden clasificarse en factores relacionados con los profesionales, familiares o allegados, pacientes y recursos disponibles. Desde el punto de vista de todos ellos, es importante la toma de decisiones compartida para mejorar los cuidados al final de la vida, y por tanto es importante reconocer los factores que pueden influir en el proceso.
Un factor clave para la participación del paciente en la toma de decisiones es la planificación compartida de los cuidados. Este proceso permite al paciente ejercer su autonomía hasta el final manteniendo el control de su vida mientras puede. Permite a los profesionales conocer sus valores y preferencias, adecuar las intervenciones y facilitar el fallecimiento en el lugar preferido y de la forma deseada. Además, mejora el conocimiento del paciente sobre su proceso. Esto genera efectos positivos en su autoestima y tranquilidad, y por tanto en facilitar un final de vida en paz. Mejora la satisfacción por el trato recibido. También tiene efectos positivos sobre los familiares y representantes, mejorando su conocimiento sobre la enfermedad, ayuda al representante a conocer su función, disminuye la carga que supone tomar decisiones por otra persona, alivia el proceso de duelo y mejora la satisfacción. En cuanto a los profesionales, la toma de decisiones compartida puede mejorar la relación con el paciente y familia, ayuda a tomar decisiones clínicas y a tener una atención más humanizada y basada en la persona.
Certeza global en la evidencia: la calidad global de la evidencia de los estudios incluidos es baja, fundamentalmente debido a las limitaciones de los estudios y baja aplicabilidad de los hallazgos a nuestro contexto sanitario. La mayor parte de los estudios provienen de EE.UU., Canadá y Reino Unido. Todos los estudios incluyen la visión de familiares y cuidadores, y ninguno de ellos incluye a pacientes. Además, se han considerado estudios que abordan la toma de decisiones compartida fuera del contexto de últimos días, factor que también ha afectado a la disminución de la aplicabilidad de la evidencia. Otro factor a tener en cuenta es que la mayoría de los estudios abordan la toma de decisiones en el ámbito hospitalario, pero hay un déficit en la investigación que aborda la toma de decisiones en la atención domiciliaria. A pesar de todo ello, las barreras y facilitadores identificados en la literatura revisada han permitido al grupo de trabajo modular las recomendaciones.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos esperados?
Grande.Se han considerado estudios cualitativos sobre barreras y facilitadores para una toma de decisiones efectiva desde la perspectiva de profesionales (59, 61, 63-77), y familiares o allegados (76, 78-91).
La guía NICE incluyó 19 estudios cualitativos, ninguno realizado desde la visión de los pacientes, aunque diez de ellos incorporaron a familiares (realizados fundamentalmente en EE.UU. y en Reino Unido). El resto de los estudios abordaron la visión de los profesionales sanitarios. De los 12 nuevos estudios en la actualización de la búsqueda bibliográfica, cuatro abordan la visión de los familiares sobre la toma de decisiones compartida, siete la visión de profesionales sanitarios y 1 la visión de familiares y profesionales. La mayoría de ellos emplean entrevistas en profundidad y grupos focales, dos de ellos emplean cuestionarios y uno realiza un análisis de reuniones grabadas.
Desde el punto de vista de todos ellos, es importante la toma de decisiones compartida para mejorar los cuidados al final de la vida, y por tanto es importante reconocer los factores que pueden influir en el proceso.
En la siguiente tabla (tabla 3) se presentan los temas y subtemas extraídos de la evidencia. Para ver una descripción detallada de los estudios y sus resultados se puede consultar el material metodológico.
Tabla 3. Temas y subtemas extraídos de los estudios incluidos sobre toma de decisiones compartida y desarrollo del plan de cuidados
| Tema principal | Subtemas |
| Factores relacionados con los profesionales sanitarios |
– Habilidades de comunicación – Relación y entendimiento – Provisión de información – Incertidumbre en el pronóstico – Papel de la enfermería – Experiencia clínica – Disponibilidad de los clínicos – Tiempo para la toma de decisiones compartida – Responsabilidad de los diferentes profesionales en el proceso de toma de decisiones compartida – Aceptación del plan de cuidados por parte de todo el equipo – Impacto de las emociones y sentimientos de los profesionales |
| Factores relacionados con los familiares y allegados implicados en la toma de decisiones | – Apoyo de la familia y conflicto
– Falta de conocimientos médicos – Negación del pronóstico – Responsabilidades – Experiencia previa con la toma de decisiones compartida – Conocimiento de la opinión de la persona moribunda – Carga emocional |
| Factores relacionados con los pacientes | – Negación del pronóstico
– Voluntad de discutir |
| Factores relacionados con la disponibilidad de recursos |
– Disponibilidad de espacio privado – Disponibilidad de equipamientos, profesionales y servicios específicos – Herramientas disponibles |
Fuente: adaptado de NICE 2015 (22).
La toma de decisiones compartida y la planificación de los cuidados permite al paciente ejercer su autonomía hasta el final manteniendo el control de su vida mientras puede. Permite a los profesionales conocer sus valores y preferencias, adecuar las intervenciones y facilitar el fallecimiento en el lugar preferido y de la forma deseada. Además, mejora el conocimiento del paciente sobre su proceso. Esto genera efectos positivos en su autoestima y tranquilidad, y por tanto en facilitar una muerte en paz. Mejora la satisfacción por el trato recibido. También tiene efectos positivos sobre los familiares y representantes, mejorando su conocimiento sobre la enfermedad, ayuda al representante a conocer su función, disminuye la carga que supone tomar decisiones por otra persona, alivia el proceso de duelo y mejora la satisfacción.
En cuanto a los profesionales, puede mejorar la relación con el paciente y familia, ayuda a tomar decisiones clínicas y a tener una atención más humanizada y centrada en la persona.
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.No se ha identificado ningún daño asociado a la implicación en la toma de decisiones compartida, ni para los pacientes ni para los profesionales.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Baja.La calidad global de la evidencia de los estudios incluidos es baja, fundamentalmente debido a las limitaciones de los estudios y baja aplicabilidad de los hallazgos a nuestro contexto sanitario. La mayor parte de los estudios provienen de EE.UU., Canadá y Reino Unido. Todos los estudios incluyen la visión de familiares y cuidadores, y ninguno de ellos incluye a pacientes. Además, se han considerado estudios que abordan la toma de decisiones compartida fuera del contexto de últimos días, factor que también ha afectado a la disminución de la aplicabilidad de la evidencia. Otro factor a tener en cuenta es que la mayoría de los estudios abordan la toma de decisiones en el ámbito hospitalario, pero hay un déficit en la investigación que aborda la toma de decisiones en la atención domiciliaria. A pesar de todo ello, las barreras y facilitadores identificados en la literatura revisada han permitido al grupo de trabajo modular las recomendaciones.
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.La revisión sistemática se ha centrado en las barreras y facilitadores para una toma de decisiones compartida efectiva.
¿Son mayores los efectos deseables que los efectos indeseables?
Probablemente sí.Teniendo en cuenta los beneficios del proceso de toma de decisiones compartida y que no se ha identificado ningún daño asociado, el GEG considera el balance riesgo beneficio favorable a la toma de decisiones compartida.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Probablemente son pequeños.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Aumenta.No se ha realizado una revisión sistemática del tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado una revisión sistemática del tema.
¿Es factible la implementación de la opción?
Probablemente sí.No se ha realizado una revisión sistemática del tema.
Otras consideraciones
El GEG discute sobre la relación entre los conceptos de toma de decisiones y planificación anticipada y compartida de la asistencia, y cómo estos procesos pueden favorecer la redacción de un documento de voluntades anticipadas o instrucciones previas. Este tipo de documentos aún no son suficientemente conocidos entre la población general de nuestro país, con la excepción de aquellas regiones donde existen programas específicos de difusión y fomento de su realización. Para ello, y como paso previo y fundamental, es necesario desarrollar procesos de planificación compartida de la atención (PCA) entre los pacientes y sus familias y los profesionales que lideran su asistencia sanitaria.
Este proceso de PCA es un paso más en el respeto por la autonomía de la persona que buscaba la llamada planificación anticipada de la atención (del inglés advance care planning, o planificación de los cuidados para el futuro) (93, 94), adquiriendo una perspectiva de relación terapéutica deliberativa para la realización de un plan de cuidados con una visión integral más allá del ámbito puramente sanitario. Es por ello que esta planificación, buena práctica desde el punto de vista clínico y ético, no se debe dejar sólo para los últimos días, que llegaría tarde en gran medida, sino que debería empezar con el momento mismo del diagnóstico de la enfermedad, siendo éste un proceso continuado y no un acto único.
El objetivo de la planificación anticipada y compartida es adecuar la atención sanitaria a los valores, deseos y preferencias de la persona al final de su vida. Para ello es necesario fomentar el inicio y desarrollo de conversaciones que traten sobre la enfermedad y su evolución, y los tratamientos y cuidados. Es necesario identificar qué aspectos del cuidado y tratamiento son aceptados y cuáles rechazados. También hay que tener en cuenta a la familia y al entorno de cuidado, que pueden opinar y ayudar a la persona enferma a tomar decisiones. Alguno de ellos, u otra persona que el enfermo designe, puede ser su representante en el caso de que, llegado el momento, pierda la capacidad de decidir. Todo ello debe ser registrado en la historia clínica y compartido con el resto de profesionales que intervengan en la atención. Además, el plan puede y debe ser revisado periódicamente para realizar los cambios que la persona enferma estime oportunos y adaptarlo a posibles incidencias o cambios de opinión (95).
Es necesario que los profesionales evalúen previamente la capacidad del paciente para la toma de decisiones. No se debe tratar a la persona como incapaz si no se ha valorado la capacidad o si toma una decisión que no gusta a los que tiene alrededor, y esto es particularmente importante en la atención de los mayores. Para la valoración de su capacidad de decisión deberá tenerse en cuenta si la persona puede entender la información, valorar la situación clínica, comprender las opciones y las consecuencias de cada opción y comunicar su elección de forma razonada. Si se confirma la incapacidad es fundamental respetar la máxima de buscar siempre el mejor interés, tomando decisiones que sean lo menos restrictivas posibles para los derechos del paciente (22).
Este proceso debe realizarse en un clima adecuado, que hay que preparar previamente. Es necesario explorar qué información tiene el paciente en cada momento, qué significan para él las cosas de las que hablamos, y qué nivel de información desea para no excedernos en los datos. Hablar con franqueza y honestidad, recogiendo y acompañando las emociones del paciente y de sus allegados, y planificando en cada momento lo que sea oportuno, dejando la puerta abierta para nuevas conversaciones (96). Debe haber un responsable del proceso para que no quede sin hacer por falta de coordinación de los profesionales implicados. En este punto, el papel del personal de enfermería es fundamental y desarrollar su rol de gestión de casos y su posición cercana al paciente y su familia podría facilitar el inicio y desarrollo de las conversaciones (97).
Para llegar a esto es imprescindible que los profesionales se impliquen y se formen en habilidades de comunicación y herramientas para fomentar la toma de decisiones compartida. Además de aptitud el profesional debe tener ciertas actitudes facilitadoras, como son calidez, concreción, respeto, empatía, baja reactividad y asertividad. También actitud de trabajo en equipo ya que este proceso debería ser realizado en equipo interdisciplinar.
Desde el punto de vista del sistema sanitario también se debería fomentar la realización de la planificación anticipada y compartida de la asistencia, facilitando espacios y recursos adecuados para ello, así como desarrollar la historia clínica para que se pueda registrar esta planificación y pueda ser accesible para los profesionales responsables del paciente en cada momento.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
59. Nouvet E, Strachan PH, Kryworuchko J, Downar J, You JJ. Waiting for the body to fail: limits to end-of-life communication in Canadian hospitals. Mortality. 2016;21(4):340-56. DOI: 10.1080/13576275.2016.1140133.
60. Rodenbach RA, Rodenbach KE, Tejani MA, Epstein RM. Relationships between personal attitudes about death and communication with terminally ill patients: How oncology clinicians grapple with mortality. Patient Education and Counseling. 2016;99(3):356-63. DOI: http:// doi.org/10.1016/j.pec.2015.10.010.
61. Brogan P, Hasson F, McIlfatrick S. Shared decision-making at the end of life: A focus group study exploring the perceptions and experiences of multi-disciplinary healthcare professionals working in the home setting. Palliat Med. 2018;32(1):123-32. DOI: 10.1177/0269216317734434.
62. Belanger E, Rodríguez C, Groleau D. Shared decision-making in palliative care: a systematic mixed studies review using narrative synthesis. Palliat Med. 2011;25(3):242-61. DOI: 10.1177/0269216310389348.
63. Addicott R. Delivering better end-of-life care in England: barriers to access for patients with a non-cancer diagnosis. Health Econ Policy Law. 2012;7(4):441-54. DOI: 10.1017/ s1744133112000230.
64. Boot M, Wilson C. Clinical nurse specialists perspectives on advance care planning conversations: a qualitative study. Int J Palliat Nurs. 2014;20(1):9-14. DOI: 10.12968/ ijpn.2014.20.1.9.
65. Fields A, Finucane AM, Oxenham D. Discussing preferred place of death with patients: staff experiences in a UK specialist palliative care setting. Int J Palliat Nurs. 2013;19(11):558-65. DOI: 12968/ijpn.2013.19.11.558.
66. Minto F, Strickland K. Anticipating emotion: a qualitative study of advance care planning in the community setting. Int J Palliat Nurs. 2011;17(6):278-84. DOI: 10.12968/ijpn.2011.17.6.278.
67. Seymour J, Almack K, Kennedy S. Implementing advance care planning: a qualitative study of community nurses’ views and experiences. BMC Palliat Care. 2010;9:4. DOI: 10.1186/1472- 684x-9-4.
68. Stevens I, Whyte F. Advance care planning: will it work in diseases other than cancer? European Journal of Palliative Care. 2011;18(6):280-4.
69. Tan HM, Lee SF, O’Connor MM, Peters L, Komesaroff PA. A case study approach to investigating end-of-life decision making in an acute health service. Aust Health Rev. 2013;37(1):93-7. DOI: 1071/ah11125.
70. Thompson TD, Barbour RS, Schwartz Health professionals’ views on advance directives: a qualitative interdisciplinary study. Palliat Med. 2003;17(5):403-9. DOI: 10.1191/0269216303pm784oa.
71. Willard C, Luker K. Challenges to end of life care in the acute hospital setting. Palliat Med. 2006;20(6):611-5. DOI: 10.1177/0269216306071064.
72. Dillworth J, Dickson VV, Mueller A, Shuluk J, Yoon HW, Capezuti E. Nurses’ perspectives: hospitalized older patients and end-of-life decision-making. Nurs Crit Care. 2016;21(2):e1-e11. DOI: 10.1111/nicc.12125.
73. Ho A, Jameson K, Pavlish C. An exploratory study of interprofessional collaboration in end-of-life decision-making beyond palliative care settings. J Interprof Care. 2016;30(6):795-803. DOI: 1080/13561820.2016.1203765.
74. Laurent A, Bonnet M, Capellier G, Aslanian P, Hebert P. Emotional Impact of End-of-Life Decisions on Professional Relationships in the ICU: An Obstacle to Collegiality? Crit Care Med. 2017;45(12):2023-30. DOI: 10.1097/ccm.0000000000002710.
75. Romoren M, Pedersen R, Forde R. How do nursing home doctors involve patients and next of kin in end-of-life decisions? A qualitative study from Norway. BMC Med Ethics. 2016;17:5. DOI: 10.1186/s12910-016-0088-2.
76. Washington KT, Oliver DP, Gage LA, Albright DL, Demiris G. A multimethod analysis of shared decision-making in hospice interdisciplinary team meetings including family caregivers. Palliat Med. 2016;30(3):270-8. DOI: 10.1177/0269216315601545.
77. Brooks LA, Manias E, Nicholson P. Communication and Decision-Making About End-of-Life Care in the Intensive Care Unit. Am J Crit Care. 2017;26(4):336-41. DOI: 10.4037/ajcc2017774.
78. Abbott KH, Sago JG, Breen CM, Abernethy AP, Tulsky JA. Families looking back: one year after discussion of withdrawal or withholding of life-sustaining support. Crit Care Med. 2001;29(1):197-201.
79. Almack K, Cox K, Moghaddam N, Pollock K, Seymour J. After you: conversations between patients and healthcare professionals in planning for end of life care. BMC Palliat Care. 2012;11:15. DOI: 1186/1472-684x-11-15.
80. Caron CD, Griffith J, Arcand M. End-of-life decision making in dementia: the perspective of family caregivers. Dementia (14713012). 2005; 4(1):113-136.
81. Hsieh HF, Shannon SE, Curtis JR. Contradictions and communication strategies during end-of-life decision making in the intensive care unit. J Crit Care. 2006;21(4):294-304. DOI: 1016/j.jcrc.2006.06.003.
82. Lind R, Lorem GF, Nortvedt P, Hevroy O. Family members’ experiences of “wait and see” as a communication strategy in end-of-life decisions. Intensive Care Med. 2011;37(7):1143-50. DOI: 10.1007/s00134-011-2253-x.
83. Lind R, Nortvedt P, Lorem G, Hevroy O. Family involvement in the end-of-life decisions of competent intensive care patients. Nurs Ethics. 2013;20(1):61-71. DOI: 10.1177/0969733012448969.
84. Nolan MT, Kub J, Hughes MT, Terry PB, Astrow AB, Carbo CA, et al. Family health care decision making and self-efficacy with patients with ALS at the end of life. Palliat Support Care. 2008;6(3):273-80. DOI: 10.1017/s1478951508000412.
85. Royak-Schaler R, Gadalla S, Lemkau J, Ross D, Alexander C, Scott D. Family perspectives on communication with healthcare providers during end-of-life cancer care. Oncol Nurs Forum. 2006;33(4):753-60. DOI: 1188/06.onf.753-760.
86. Tilden VP, Tolle SW, Garland MJ, Nelson CA. Decisions about life-sustaining treatment. Impact of physicians’ behaviors on the family. Arch Intern Med. 1995;155(6):633-8.
87. Vig EK, Starks H, Taylor JS, Hopley EK, Fryer-Edwards K. Surviving surrogate decision-making: what helps and hampers the experience of making medical decisions for others. J Gen Intern Med. 2007;22(9):1274-9. DOI: 10.1007/s11606-007-0252-y.
88. Lee MC, Sulmasy DP, Gallo J, Kub J, Hughes MT, Russell S, et al. Decision-Making of Patients With Implantable Cardioverter-Defibrillators at End of Life: Family Members’ Experiences. Am J Hosp Palliat Care. 2017;34(6):518-23. DOI: 10.1177/1049909116641622.
89. Nelson JE, Hanson LC, Keller KL, Carson SS, Cox CE, Tulsky JA, et al. The Voice of Surrogate Decision-Makers. Family Responses to Prognostic Information in Chronic Critical Illness. Am J Respir Crit Care Med. 2017;196(7):864-72. DOI: 10.1164/rccm.201701-0201OC.
90. Rosemond C, Hanson LC, Zimmerman S. Goals of Care or Goals of Trust? How Family Members Perceive Goals for Dying Nursing Home Residents. J Palliat Med. 2017;20(4):360-5. DOI: 1089/jpm.2016.0271.
91. Yamamoto S, Arao H, Masutani E, Aoki M, Kishino M, Morita T, et al. Decision Making Regarding the Place of End-of-Life Cancer Care: The Burden on Bereaved Families and Related J Pain Symptom Manage. 2017;53(5):862-70. DOI: 10.1016/j.jpainsymman.2016.12.348.
92. Cross LA. Compassion Fatigue in Palliative Care Nursing: A Concept Analysis. J Hosp Palliat Nurs. 2019;21(1):21-8. DOI: 10.1097/njh.0000000000000477.
93. Sudore RL, Lum HD, You JJ, Hanson LC, Meier DE, Pantilat SZ, et al. Defining Advance Care Planning for Adults: A Consensus Definition From a Multidisciplinary Delphi Panel. J Pain Symptom Manage. 2017;53(5):821-32.e1. DOI: 10.1016/j.jpainsymman.2016.12.331.
94. Rietjens JAC, Sudore RL, Connolly M, van Delden JJ, Drickamer MA, Droger M, et al. Definition and recommendations for advance care planning: an international consensus supported by the European Association for Palliative Lancet Oncol. 2017;18(9):e543-e51. DOI: 10.1016/s1470-2045(17)30582-x.
95. Couceiro Vidal A, Pandiella A. La EPOC: un paradigma para el uso de directivas previas y la planificación anticipada de decisiones. Arch Bronconeumol. 2010;46(6):325-31.
96. Buckman R, Kanson Y. Breaking bad news: a six-step protocol. En: R B, editor. How to break bad news: a guide for heath care professionals. Baltimore: The Johns Hopkins University Press; 1992. p. 65-97.
97. Barrio IM, Simón P, Pascau MJ. El papel de la enfermera en la planificación anticipada de las decisiones: más allá de las instrucciones previas o voluntades anticipadas. Enfermería clínica. 2004;14(4):235-41.
¿En pacientes en sus últimos días de vida, la hidratación artificial es efectiva para mejorar los síntomas y el confort general?
Los efectos no deseables probablemente son mayores que los efectos deseables, pero con una incertidumbre apreciable. Eso significa que la mayoría de los pacientes no deberían recibir la intervención recomendada. Cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
1. Con carácter general no se recomienda la hidratación artificial en la situación de últimos días. Excepcionalmente podría considerarse si:
- Existe mal control de síntomas que pueden estar relacionados con la deshidratación (por delirium) y han fracasado otras medidas de control.
- La reducción de la ingesta oral produce malestar o inquietud emocional en el paciente y su familia a pesar de un adecuado proceso de comunicación con el equipo de atención.
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
2. Si el paciente no está en condiciones de decidir, al considerar la hidratación artificial en un paciente en situación de últimos días, es necesario revisar en su historia clínica si el paciente ha expresado previamente en un documento de instrucciones previas o en un proceso de planificación anticipada y compartida de la asistencia, sus preferencias sobre la hidratación artificial.
3. Si se indica hidratación artificial:
- Se recomienda abordar las inquietudes de paciente y familia e informar sobre la evidencia de los beneficios y riesgos de la hidratación artificial en situación de últimos días.
- Considerarla como una prueba limitada en el tiempo (acordada previamente con paciente/familia).
- Se aconseja no usar cantidades de volumen mayores de 1 litro al día.
- Se recomienda no utilizar la vía enteral. La vía preferente será la subcutánea en caso de atención domiciliaria o de no disponer vía intravenosa ya canalizada.
4. Una vez instaurada la hidratación artificial:
- Monitorizar aproximadamente cada 24 horas los cambios en los síntomas o signos de deshidratación y cualquier evidencia de beneficio o daño.
- Continuar con la hidratación si se percibe un beneficio por paciente y familia.
- Reducir o detener la hidratación si hay signos de posible daño como sobrecarga de líquidos o incremento de secreciones respiratorias, o si el paciente o sus allegados solicitan la retirada.
5. Para las personas que ya tienen instaurada la hidratación artificial (enteral o parenteral) antes de los últimos días de vida:
- Revisar los riesgos y beneficios de continuar con la hidratación artificial en situación de últimos días con el paciente y sus allegados.
- Considerar si continuar, reducir o detener la hidratación artificial a medida que la persona se acerca a la muerte.
Justificación
Estas recomendaciones se han formulado para intentar favorecer un adecuado manejo clínico de la hidratación en los últimos días de vida basado en la evidencia de los riesgos y beneficios y respetando los valores y deseos del paciente y su familia.
Justificación detallada
Balance beneficio-riesgo: la evidencia científica no señala beneficios claros de la HA y podría estar asociada a la aparición de eventos adversos, por lo tanto, el GEG ha considerado que el balance beneficio-riesgo es globalmente desfavorable a la provisión de HA en los últimos días. Sin embargo, es necesario tener en cuenta que la evidencia disponible es insuficiente y puede haber un beneficio percibido por el paciente y su familia. Además, existen circunstancias en las que en la práctica clínica podría obtenerse beneficios con la HA, como en casos de delirium o cuando el paciente presente sed que no mejora con otras medidas. En todo caso la decisión tendrá que ser valorada individualmente sopesando con el paciente y su familia los beneficios frente a la posible aparición de complicaciones o malestar.
Valoración por parte de los pacientes de las variables de resultado: la evidencia señala que la pérdida de la capacidad de usar la vía oral en la SUD tiene un importante impacto psicológico y emocional. La HA tiene un importante valor simbólico, y en diferentes culturas se percibe como un símbolo de cuidado.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Pequeña.Se ha considerado la evidencia incluida en la GPC del NICE (22), que a su vez se basó en una revisión Cochrane (100). En la actualización se añadió un estudio nuevo. La evidencia disponible no es suficiente para extraer conclusiones definitivas, aunque sugiere que no hay mejoras importantes en el bienestar o en el control de síntomas en los grupos que reciben HA frente a los que no.
- Hidratación artificial versus placebo:
En los dos ensayos clínicos aleatorizados (ECA) (n=129 y 51) (102, 103) que compararon 1000 ml día de suero fisiológico o glucosalino subcutáneos frente a 100 ml subcutáneos (grupo placebo) en pacientes con cáncer que no presentaban deshidratación grave no se encontraron diferencias estadísticamente significativas en las variables calidad de vida, bienestar, tiempo de supervivencia o efecto en el control de síntomas (ansiedad, disnea, dolor, náuseas, sedación, somnolencia o delirium). La calidad de la evidencia fue moderada a muy baja (22).
- Hidratación artificial versus cuidados habituales:
El ECA que comparó 1000 ml al día de glucosa con 140 mEq ClNa frente a hidratación oral (104) no encontró diferencias en la supervivencia. La hidratación no incrementó el riesgo de eventos adversos. La calidad de la evidencia fue de muy baja a moderada (22).
Un ensayo aleatorizado no controlado (n=26) (105) que comparó la HA con hialuronidasa frente a los cuidados habituales no encontraron beneficios clínicos informados por los pacientes en el bienestar o el control de síntomas (ansiedad, disnea, dolor, náuseas, sedación o somnolencia). La calidad de la evidencia fue de baja a muy baja (22).
Otro ensayo aleatorizado no controlado (n=226) (106) encontró que la HA no aportó beneficios clínicos en la prevención del delirium, estado de hidratación o resultados en pruebas de laboratorio, frente a la hidratación oral. No se encontró un aumento del riesgo de edema, ascitis o derrame pleural. La calidad de la evidencia fue muy baja (22).
El nuevo estudio localizado (Davies 2018) (n=200) (107) no encontró diferencias estadísticamente significativas entre los grupos en la escala Richmond Agitation Sedation Scale modificada (delirium) ni en la probabilidad de presentar estertores, disnea, náuseas y vómitos, o dolor. El 38.5 % abandonaron la intervención debido a la aparición de eventos adversos, aunque ninguno de ellos se calificó como grave o moderado. Los más frecuentes fueron: edema localizado, edema generalizado y secreciones respiratorias. La calidad de la evidencia fue baja-muy baja.
¿Cuál es la magnitud de los efectos indeseables esperados?
Variable.Algunos estudios analizados informaron de reacciones locales adversas (edema localizado en el sitio de punción o dolor) (104, 107). Un estudio informó de síntomas relacionados con la sobrecarga de líquidos (derrame pleural, edema periférico y ascitis) significativamente más altos en el grupo que recibió HA (106).
¿Cuál es la certeza global en la evidencia sobre los efectos?
Baja/Muy baja.La calidad global de la evidencia es baja. Aunque para algunas de las variables consideradas la evidencia es moderada y proviene de ECA, los pocos estudios disponibles y la variabilidad en los diseños y variables consideradas dificulta la obtención de conclusiones definitivas y afecta a la certeza global en la evidencia. Además, cabe considerar que la mayoría de los estudios se han realizado en pacientes oncológicos con deshidratación leve o moderada (algunos de los estudios excluyen pacientes con deshidratación grave).
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.No se ha realizado una revisión sistemática, pero se han considerado dos revisiones sistemáticas que señalan que la pérdida de la capacidad de hidratación oral en la SUD tiene un importante impacto emocional y la HA tiene un importante valor simbólico, y en diferentes culturas se percibe como un símbolo de cuidado (99, 108).
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Variable.Teniendo en cuenta que la evidencia clínica no señala beneficios claros y que podrían aparecer eventos adversos, el balance podría ser considerado globalmente desfavorable a la provisión de HA en los últimos días. Sin embargo, es necesario tener en cuenta que la evidencia disponible es insuficiente y puede haber un beneficio percibido por el paciente y su familia.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificante.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia de los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Aumenta.No se ha llevado a cabo una búsqueda bibliográfica específica.
¿Es aceptable la opción para los agentes implicados?
Variable.No se ha realizado una revisión sistemática, pero algunas revisiones sistemáticas previas (por ejemplo, (99, 108)), señalan que existen diferentes perspectivas, actitudes y factores emocionales que pueden influir en la percepción de la necesidad de la hidratación clínicamente asistida por parte de los pacientes y sus allegados. La evidencia también muestra que entre los profesionales también existen diferentes opiniones con respecto a la hidratación clínicamente asistida y su papel en los cuidados al final de la vida (99).
Por todo ello, el desarrollo del plan de cuidados y el manejo clínico de la hidratación ha de ser individualizado y considerar aspectos sociales y culturales, que puedan estar afectando al mismo.
¿Es factible la implementación de la opción?
Sí.No se ha llevado a cabo una búsqueda bibliográfica específica.
Otras consideraciones
La HA en la SUD ha generado un intenso debate desde la perspectiva ética, con argumentos en contra y a favor sobre su uso. Las principales discusiones se han centrado en su efecto en la supervivencia, en la conservación de las funciones superiores y en su significado simbólico-religioso (101). Estas cuestiones afectan a importantes principios morales en el final de la vida: respeto por la vida, la muerte, la dignidad, la autonomía y la obligación de proporcionar unos cuidados médicos proporcionados.
El GEG considera que ninguno de los argumentos cuenta con evidencia científica definitiva, por lo que existe consenso en que la decisión de usar HA en SUD debe individualizarse, discutirse en el equipo multidisciplinar y basarse en la promoción del confort del paciente, más que en conseguir una hidratación óptima. En muchos pacientes podría lograrse un confort aceptable con los cuidados de boca seca ya que, en SUD, es frecuente tener la boca seca pero no sed.
El abordaje de la cuestión debe tener la PCA como elemento fundamental. Este proceso, iniciado con tiempo suficiente permite conocer los valores y preferencias de la persona con respecto a la HA. Los profesionales podrán explicar los pros y contras de la misma, los objetivos de la atención y contextualizar el papel de la hidratación en los últimos días.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
98. Raijmakers NJ, van Zuylen L, Costantini M, Caraceni A, Clark J, Lundquist G, et al. Artificial nutrition and hydration in the last week of life in cancer patients. A systematic literature review of practices and effects. Ann Oncol. 2011;22(7):1478-86. DOI: 10.1093/annonc/mdq620.
99. Del Rio MI, Shand B, Bonati P, Palma A, Maldonado A, Taboada P, et al. Hydration and nutrition at the end of life: a systematic review of emotional impact, perceptions, and decision-making among patients, family, and health care staff. Psychooncology. 2012;21(9):913-21. DOI: 10.1002/pon.2099.
100. Good P, Richard R, Syrmis W, Jenkins-Marsh S, Stephens J. Medically assisted hydration for adult palliative care patients. Cochrane Database Syst Rev. 2014 (4):Cd006273. DOI: 10.1002/14651858.CD006273.pub3.
101. Druml C, Ballmer PE, Druml W, Oehmichen F, Shenkin A, Singer P, et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clin Nutr. 2016;35(3):545-56. DOI: 1016/j.clnu.2016.02.006.
102. Bruera E, Hui D, Dalal S, Torres-Vigil I, Trumble J, Roosth J, et al. Parenteral hydration in patients with advanced cancer: a multicenter, double-blind, placebo-controlled randomized trial J Clin Oncol. 2013;31(1):111-8. DOI: 10.1200/jco.2012.44.6518.
103. Bruera E, Sala R, Rico MA, Moyano J, Centeno C,Willey J, et al. Effects of parenteral hydration in terminally ill cancer patients: a preliminary study. J Clin Oncol. 2005;23(10):2366-71. DOI: 10.1200/jco.2005.04.069.
104. Cerchietti L, Navigante A, Sauri A, Palazzo F. Hypodermoclysis for control of dehydration in terminal-stage cancer. Int J Palliat Nurs. 2000;6(8):370-4. DOI: 10.12968/ijpn.2000.6.8.9060.
105. Viola R. Studying Fluid Status and the Dying: The Challenge of Clinical Research in Palliative Care. 1997.
106. Morita T, Hyodo I, Yoshimi T, Ikenaga M, Tamura Y, Yoshizawa A, et al. Association between hydration volume and symptoms in terminally ill cancer patients with abdominal malignancies. Ann Oncol. 2005;16(4):640-7. DOI: 10.1093/annonc/mdi121.
107. Davies AN, Waghorn M, Webber K, Johnsen S, Mendis J, Boyle J. A cluster randomised feasibility trial of clinically assisted hydration in cancer patients in the last days of life. Palliat Med. 2018;32(4):733-43. DOI: 10.1177/0269216317741572.
108. Gent MJ, Fradsham S, Whyte GM, Mayland CR. What influences attitudes towards clinically assisted hydration in the care of dying patients? A review of the literature. BMJ Support Palliat Care. 2015;5(3):223-31. DOI: 10.1136/bmjspcare-2013-000562.
Manejo de síntomas
Actualizado a fecha: 01/02/2025
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
Actualizado a fecha: 01/06/2021
Consideraciones generales
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Para guiar las decisiones sobre manejo de síntomas se recomienda realizar una valoración sistemática de los síntomas principales, para disminuir el riesgo de infraestimación de alguno de ellos, y cuantificar su intensidad mediante escalas que permitan evaluar el resultado de las medidas aplicadas.
2. Se recomienda hacer una revisión rigurosa del tratamiento en la fase final de la vida del paciente y adaptarlo a los objetivos terapéuticos centrados en el bienestar y en el control de síntomas.
3. Se recomienda suspender todos aquellos tratamientos fútiles, que no aporten beneficio a la situación actual del paciente, y discutir los riesgos y beneficios de cualquier medicamento ofrecido, así como transmitir que la retirada de un fármaco se debe a la futilidad en la situación actual del paciente.
4. Se recomienda dejar instrucciones claras y por escrito del tratamiento, indicando pautas fijas y otras condicionadas a momentos de crisis.
Justificación
El GEG ha emitido recomendaciones de buena práctica clínica centradas en principios generales de prescripción en CP. Se han elaborado también una serie de consideraciones clínicas relevantes y relacionadas con la implementación de las recomendaciones.
Justificación detallada
Las recomendaciones emitidas se basan en los principios de prescripción en el ámbito de la atención paliativa.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.¿Cuál es la certeza global en la evidencia sobre los efectos?
Muy baja.No se ha identificado evidencia científica específica para estas recomendaciones, que han sido elaboradas siguiendo la experiencia del GEG y adaptando las recomendaciones realizadas en la GPC del NICE (19).
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha identificado evidencia científica específica para estas recomendaciones.
¿Cuál es la magnitud de los recursos requeridos (costes)?
No aplica.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia de los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
No aplica.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Aumenta.¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado revisión sistemática sobre el tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado una revisión sistemática sobre el tema.
Otras consideraciones
El GEG estima que la polimedicación en los pacientes mayores con enfermedad avanzada constituye un grave problema sanitario, tanto por los efectos adversos asociados como por los costes sanitarios. La mayoría de pacientes que alcanza la etapa final de su vida tiene prescritos gran cantidad de medicamentos para enfermedades crónicas. Aunque no existe un consenso claro sobre qué fármacos son inadecuados en este periodo, algunos no se consideran apropiados, principalmente porque el tiempo necesario para producir beneficio es superior a la expectativa de vida del paciente y por los efectos adversos. Debe valorarse con el paciente y su familia/allegados la retirada de fármacos y transmitir que si se retira un fármaco es porque la situación del paciente lo requiere o por futilidad en la situación actual y en ningún caso por abandono.
Existen diferentes publicaciones que recomiendan la suspensión de determinados medicamentos cuando la esperanza de vida es limitada y el objetivo terapéutico no es la prevención ni la curación, sino el control de los síntomas. Recientemente se han publicado una lista de criterios explícitos (STOPP-Frail) que pueden ayudar al médico prescriptor a la toma de decisiones en la deprescripción de determinados fármacos en pacientes de edad avanzada y con enfermedad en fase terminal (111).
BIBLIOGRAFÍA
19. Díez-Manglano J, Isasi de Isasmendi Pérez S, Rubio Gómez M, Formiga F, Sánchez Muñoz LÁ, Castiella Herrero J, et al. Cuidados en los últimos días de vida en los pacientes hospitalizados en medicina interna. Rev Clin Esp. 2019;219(3):107-15. DOI: 10.1016/j.rce.2018.06.010.
109. Ferris F, Balfour H, Bowen K, Farley J, Hardwick M, Lamontagne C, et al. A Model to Guide Hospice Palliative Care. Ottawa, ON: Canadian Hospice Palliative Care Association, 2002.
110. Carvajal Valcárcel A, Martínez García M, Centeno Cortés C. Versión española del Edmonton Symptom Assessment Sytem</span> (ESAS): un instrumento de referencia para la valoración sintomática del paciente con cáncer avanzado. Medicina Paliativa. 2013;20(4):143-9. DOI: 10.1016/j.medipa.2013.02.001.
111. Delgado-Silveira E, Mateos-Nozal J, Muñoz-García M, Rexach-Canoc L, Vélez-Díaz-Pallarés M, Albeniz-López J, et al. Uso potencialmente inapropiado de fármacos en cuidados paliativos: versión en castellano de los criterios STOPP-Frail (STOPP-Pal). Rev Esp Geriatr Gerontol. 2019;54(3):151–5.
112. Martin-Roselló ML, Fernández-López A, Sanz-Amores R, Gómez-García R, Vidal-España F, Cia-Ramos R. IDC-Pal (Instrumento Diagnóstico de la Complejidad en Cuidados Paliativos) [Internet]. Sevilla: Consejeria de Igualdad, Salud y Politicas sociales. Fundación Cudeca; [consultado 20 sep 2020]. Disponible en: http://www.juntadeandalucia.es/salud/IDCPal.
Para personas en los últimos días de vida, ¿qué fármacos son más efectivos para aliviar el dolor?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Dentro de un enfoque global de los cuidados paliativos, se recomienda promocionar la valoración y el manejo correcto del dolor para que los pacientes lleguen a situación de últimos días con el dolor controlado, manteniendo la medicación con los ajustes de dosis que sean precisos. Se deben anticipar las posibles necesidades analgésicas del paciente y dejar prescrita medicación para su adecuado control con la finalidad de manejar la situación por los familiares, allegados y/o equipo sanitario en el momento necesario.
2. Se recomienda no prescribir analgésicos de forma rutinaria ya que, si bien es un síntoma muy frecuente, no todas las personas en situación de últimos días experimentan dolor.
3. Se recomienda considerar un manejo no farmacológico del dolor en pacientes en situación de últimos días asociado a las medidas farmacológicas.
4. El tratamiento farmacológico de elección cuando el dolor es moderado o grave, una vez descartadas las causas reversibles, serían los opioides. En los casos de dolor leve se sugiere utilizar fármacos de primer escalón excepto que se prevea una mala respuesta o problemas en la vía de administración, en cuyo caso se podría plantear un inicio con opioides a dosis bajas.
5. En caso de instauración de tratamiento opioide, el de elección en SUD es la morfina de acción rápida (oral o parenteral).
6. Se recomienda no retirar o disminuir abruptamente la medicación opioide ya que, tanto esta disminución o retirada como el dolor mal controlado, son factores reconocidos de desorientación y de delirium en pacientes con enfermedad crónica avanzada.
7. En pacientes con dolor neuropático, se recomienda mantener la medicación basal en la medida de lo posible, si bien es frecuente que en SUD se pierda la vía oral, por lo que se tendrá esto en consideración de cara a la dosificación de opioide.
Justificación
Dada la ausencia de evidencia científica sobre la efectividad de los diferentes fármacos para el control de dolor en los últimos días de vida, el GEG ha formulado las recomendaciones basándose en los principios generales del control del dolor y el manejo en etapas previas de la atención paliativa, y en su experiencia clínica. Estas recomendaciones pretenden favorecer la evaluación y control adecuados del dolor en los últimos días de vida, teniendo en cuenta el importante impacto del dolor.
Justificación detallada
Magnitud de los efectos deseables esperados: solo se ha localizado un ECA que comparó la diamorfina con la morfina en pacientes oncológicos incluido en la GPC del NICE (22), que no es aplicable a nuestro contexto dado que la diamorfina no se comercializa ni se usa con esta indicación en España. Por lo tanto, aunque el GEG ha considerado sus resultados, no ha tenido impacto en la formulación de las recomendaciones. Aunque no existe evidencia científica específica en los últimos días de vida, el tratamiento adecuado del dolor puede favorecer la llegada al final de la vida con un nivel de confort y bienestar adecuados. Por lo tanto, el GEG considera que los efectos deseables son sustanciales.
Balance entre efectos deseables e indeseables: a pesar de la ausencia de evidencia científica en esta etapa de la atención, el GEG considera el balance beneficio-riesgo favorable al uso de fármacos del primer escalón de la OMS en casos de dolor leve y de opioides para el control del dolor moderado/grave en la SUD de vida. Las recomendaciones estándar de uso racional de opioides en el dolor crónico (115), teniendo en cuenta a la escalada de dosis, pero también en la desescalada o incluso discontinuación, son aplicables en SUD, y pueden ayudar a optimizar el balance beneficio-riesgo. Además, en SUD, algunos efectos adversos como la somnolencia (y/o sedación) pueden ser mejor tolerados. En cada caso, deben valorarse los beneficios y riesgos esperados de forma individualizada, y tener en cuenta las preferencias de los pacientes y sus familias.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.Sólo se ha localizado un ECA (116) que comparó la diamorfina con la morfina en pacientes oncológicos incluido en la GPC del NICE (22), que no es aplicable a nuestro contexto dado que la diamorfina no se comercializa ni se usa con esta indicación en España. Por lo tanto, aunque el GEG ha considerado sus resultados, no ha tenido impacto en la formulación de las recomendaciones.
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.No se ha identificado ningún estudio en SUD.
¿Cuál es la certeza global en la evidencia sobre los efectos?
No hay estudios incluidos.No se ha identificado ningún estudio relevante en población en SUD.
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o variabilidad probablemente no sean importantes.No se ha identificado ningún estudio.
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha identificado ningún estudio en SUD.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificante.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia de los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
El coste-efectividad de la intervención, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha identificado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Probablemente aumenta.No se ha realizado una revisión sistemática sobre el tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado una revisión sistemática sobre el tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado una revisión sistemática sobre el tema.
Otras consideraciones
El GEG está de acuerdo en la relevancia de los CP precoces y de la atención paliativa como un continuum que desemboca en una SUD, entendiendo que el correcto control del dolor debe comenzar en etapas previas a la SUD. Al igual que en el manejo de otros síntomas, la prescripción anticipada (prescripción de fármacos en previsión de la aparición síntomas, con el objetivo de favorecer un alivio rápido si el paciente desarrolla dichos síntomas), junto con formación específica a la familia/cuidadores para su manejo, son herramientas fundamentales para el control del dolor. Es decir, la etapa final de vida no debería ser sino una etapa más del continuum de los cuidados de las enfermedades avanzadas y progresivas. Por ello la buena práctica clínica en etapas anteriores suele repercutir en una mejor gestión de la SUD.
El GEG ha discutido sobre la relevancia de la formación en manejo del dolor para los profesionales sanitarios implicados en la atención en SUD, y aunque no ha generado una recomendación específica, ha concluido que las carencias actuales en formación reglada podrían suponer una barrera independiente para el correcto manejo del dolor en SUD. Además, se discute sobre la barrera que suponen las creencias de sanitarios, cuidadores y pacientes sobre las consecuencias de emplear dosis altas de opioides, tanto en un supuesto acortamiento del tiempo de supervivencia (no demostrado) (117, 118), como en un aumento de la sedación. Por ello se han considerado estas barreras en el análisis de la aceptabilidad y factibilidad.
El GEG considera que la valoración del dolor es fundamental para su control efectivo. Aunque no se ha llevado a cabo una revisión sistemática específica sobre el tema, se han realizado recomendaciones de buena práctica clínica, siguiendo las recomendaciones generales para la evaluación del dolor. Se considera que la escala visual analógica (EVA), o alguna de las otras escalas unidimensionales de valoración del dolor, siguen siendo de elección. En aquellas situaciones en las que estas escalas no son aplicables no existe un consenso claro sobre cual/es serían de elección, pero las más empleadas en CP son la escala de expresión facial, escala de Campbell o la PAINAD (Pain Assessment in Advanced Dementia) (escalas conductuales) (ver anexo 4). También consideramos que la familia/ cuidadores pueden ser una fuente de información sobre dolor y otras fuentes de inquietud, cuando el deterioro del paciente impide una obtención directa de información o como complemento a esta.
Se expone la sensación basada en la experiencia clínica de los miembros del GEG de una tendencia importante a la indicación de opioides incluso en ausencia de dolor, especialmente en pacientes oncológicos, y por ese motivo se recomienda no prescribir analgésicos de forma sistemática, si no de forma individualizada en función de las necesidades actuales y/o anticipadas.
Se discute que en un dolor de inicio reciente o en una descompensación del dolor basal, aunque se trate de una SUD, debe explorarse la posibilidad de una causa reversible tratable (como la retención urinaria, angustia o la impactación fecal).
El GEG discute la indicación concreta de uno u otro grupo de fármacos. Finalmente, decide establecer los opioides como fármaco de elección en la SUD para el dolor moderado/ grave, siempre sujeto al cumplimiento de las normas estándar de ajuste de tratamiento en función de la intensidad del dolor, balance riesgo-beneficio, efectos secundarios, y descarte previo de causas reversibles y posibilidad de manejo no farmacológico, por:
- la posibilidad de aumento progresivo de dosis según aumento de necesidades sin techo terapéutico,
- la disponibilidad de vías de administración alternativas a la oral, que es reducida en la mayoría de pacientes en SUD,
- la rapidez en lograr un correcto control del dolor.
Si bien no hay una evidencia concreta en situación de últimos días, el grupo considera que la medicación específica para el dolor neuropático debe mantenerse en la medida de lo posible si ya estaba pautada y era efectiva, salvo presencia de efectos adversos no tolerados o pérdida de la vía oral. El inicio de medicación específica para el dolor neuropático en situación de últimos días no parece razonable debido al largo tiempo de inicio de acción que presentan todos estos fármacos.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
113. Supportive PDQ, Palliative Care Editorial B. Last Days of Life (PDQ®): Health Professional Version. PDQ Cancer Information Summaries. Bethesda (MD): National Cancer Institute (US); 2019.
114. Coyne P, Mulvenon C, Paice JA. American Society for Pain Management Nursing and Hospice and Palliative Nurses Association Position Statement: Pain Management at the End of Live. Pain management nursing : official journal of the American Society of Pain Management Nurses. 2018;19(1):3-7. DOI: 10.1016/j.pmn.2017.10.019.
115. Prácticas seguras para el uso de opioides en pacientes con dolor crónico. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2015
116. Twycross RG. Choice of strong analgesic in terminal cancer: diamorphine or morphine? Pain. 1977;3(2):93-104. DOI: 1016/0304-3959(77)90072-0.
117. Sathornviriyapong A, Nagaviroj K, Anothaisintawee T. The association between different opioid doses and the survival of advanced cancer patients receiving palliative care. BMC Palliat Care. 2016;15(1):95-. DOI: 10.1186/s12904-016-0169-5.
118. Bercovitch M, Adunsky A. Patterns of high-dose morphine use in a home-care hospice service: should we be afraid of it? Cancer. 2004;101(6):1473-7. DOI: 10.1002/cncr.20485.
Para personas en los últimos días de vida, ¿qué fármacos son más efectivos para aliviar la disnea?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Se recomienda mantener o iniciar el tratamiento específico si se conoce el problema que causa la disnea (por ejemplo, edema pulmonar o derrame pleural) y el balance beneficio-riesgo individualizado es favorable.
2. Se recomienda realizar inicialmente un manejo no farmacológico de la disnea en una persona en los últimos días de vida, asociado a las medidas farmacológicas en caso de ser necesario.
3. Se recomienda ofrecer una prueba terapéutica de oxigenoterapia independiente de la hipoxemia en caso de que las medidas no farmacológicas no produzcan un alivio de la disnea, y mantenerla si el paciente/familia perciben un beneficio.
Los efectos deseables probablemente superan los efectos no deseables, pero con una incertidumbre apreciable. Eso implica que cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
4. Se recomienda añadir tratamiento sintomático si el control de la disnea es inadecuado con las medidas previas: morfina, midazolam, o la combinación de ambos.
Justificación
Se han emitido tres recomendaciones de buena práctica clínica orientadas a la indicación de tratamiento farmacológico y al inicio de medidas no farmacológicas. La recomendación sobre el uso de fármacos (opioides, benzodiacepina (BDZ) y su combinación) es débil a favor teniendo en cuenta la calidad de la evidencia y el balance beneficio-riesgo.
Justificación detallada
Certeza global en la evidencia sobre los efectos: la calidad global de la evidencia considerada es de moderada a muy baja, y procede de tres estudios (dos ECA y un estudio comparativo no aleatorizado) con limitaciones metodológicas. Los resultados no han podido meta-analizarse teniendo en cuenta la variabilidad en los diseños y variables de resultado. Las variables calidad de vida y supervivencia no se consideraron en ninguno de los estudios, mientras que la sedación solo se consideró en uno de los estudios.
Balance beneficio-riesgo: teniendo en cuenta que la disnea en los últimos días es un síntoma que genera un importante malestar en los pacientes y su relación e interacción con otros síntomas (como por ejemplo la ansiedad) es importante establecer medidas terapéuticas apropiadas y que permitan su control y con ello aliviar el sufrimiento, teniendo en cuenta intervenciones farmacológicas y no farmacológicas. Los opioides, BDZ y su combinación podrían ser opciones terapéuticas beneficiosas, pero siempre será necesario tener en cuenta los efectos adversos asociados.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Variable.Existe evidencia de dos ECA y un estudio comparativo no aleatorizado considerados en la GPC del NICE (22). No se ha localizado ningún estudio posterior que cumpla con los criterios de inclusión.
En la actualización de la búsqueda no se identificó ningún estudio primario adicional ni evaluación económica. Se identificaron dos revisiones Cochrane sobre opioides para la disnea refractaria en pacientes con enfermedad avanzada y terminal (124) y sobre benzodiacepinas para el tratamiento de la disnea en enfermedades oncológicas y no oncológicas (125), pero solo se incluyó un único estudio con pacientes en situación terminal (Navigante et al., 2006) (126) (ya incluido en la GPC del NICE).
Morfina versus midazolam versus combinación de morfina y midazolam
Existe evidencia de moderada-baja calidad derivada del ECA realizado por Navigante et al. (126) (n=101, pacientes con cáncer hospitalizados y pronóstico de menos de una semana) que sugiere que la combinación de morfina y midazolam fue más beneficiosa clínicamente que ambos fármacos de forma individual para conseguir un alivio de la disnea a las 24 y 48 horas de su inicio. Sin embargo, en este mismo estudio no se encontraron diferencias entre la combinación de morfina y midazolam frente a la morfina sola en la intensidad de la disnea a las 24 o 48 horas.
Oxígeno versus aire
Existe evidencia de muy baja calidad de un ECA cruzado en pacientes con cáncer terminal (Booth et al., 1996 (127), n=38, media de supervivencia 19 días) que sugiere que no hay diferencias entre oxígeno y aire proporcionados por cánula nasal en la intensidad de la disnea (medida a los 15 minutos de la administración). No se reportaron efectos adversos en ninguno de los grupos.
Oxígeno versus morfina o hidromorfona versus aire
Existe evidencia de muy baja calidad de un estudio prospectivo no aleatorizado [Clemens et al., 2009 (128)]; en personas con enfermedad incurable (n=46) a las que se les proporcionaron las intervenciones secuencialmente, que sugiere que los opioides son más beneficiosos en comparación con el oxígeno o el aire en la reducción de la disnea. También existe evidencia de muy baja calidad del mismo estudio, que sugiere que no hay diferencias entre el oxígeno y aire en la reducción de la disnea.
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.Los estudios incluidos no reportaron efectos adversos.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Baja.La calidad global de la evidencia considerada es de moderada a muy baja, y procede de tres estudios [dos ECA (126, 127) y un estudio comparativo no aleatorizado (128)] con limitaciones metodológicas. Los resultados no han podido meta-analizarse teniendo en cuenta la variabilidad en los diseños y variables de resultado. Las variables calidad de vida y supervivencia no se consideraron en ninguno de los estudios, mientras que la sedación solo se consideró en uno de los estudios.
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o variabilidad probablemente no sean importantes.No se ha realizado una revisión sistemática sobre el tema.
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.Teniendo en cuenta que la disnea en los últimos días es un síntoma que genera un importante malestar en los pacientes y su relación e interacción con otros síntomas (como por ejemplo la ansiedad) es importante establecer medidas terapéuticas apropiadas y que permitan su control y con ello aliviar el sufrimiento, teniendo en cuenta intervenciones farmacológicas y no farmacológicas. Los opioides, BDZ y su combinación podrían ser opciones terapéuticas beneficiosas, pero siempre será necesario tener en cuenta los efectos adversos asociados.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificante.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Probablemente aumenta.No se ha realizado una revisión sistemática sobre el tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado una revisión sistemática sobre el tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado una revisión sistemática sobre el tema.
Otras consideraciones
El GEG discute que a pesar de la ausencia de evidencia científica está de acuerdo en que el tratamiento de la disnea en la SUD es similar al de etapas anteriores de la atención paliativa y debe basarse en:
- Medidas no farmacológicas (que hay que aplicar siempre y desde el inicio) (ver anexo 4).
- Tratamiento específico de la etiología, que implicará en ocasiones la realización de pruebas. Su aplicación dependerá de una valoración cuidadosa e individualizada de beneficios/inconvenientes en esta fase de SUD, así como de la aceptación por parte del paciente/familia.
- Administración de oxígeno solo si produce una mejoría de la disnea, independientemente de datos objetivos como la hipoxemia o la taquipnea.
- Tratamiento paliativo sintomático (que es el que se desarrolla en esta pregunta clínica) que incluye oxígeno, opioides y benzodiacepinas. Su aplicación será progresiva en función de la intensidad de la disnea y grado de control.
- Sedación De aplicación en disnea refractaria a las medidas anteriores.
En cuanto al tratamiento etiológico (por ejemplo, antibióticos, corticoesteroides, broncodilatadores) el GEG está de acuerdo en que, aunque su beneficio (eficacia) se puede extrapolar de estudios realizados en pacientes con mayor supervivencia, el beneficio real para el paciente en SUD puede ser menor que en fases previas de su enfermedad, así como pueden cambiar los deseos/valores del paciente y su familia. El GEG considera que algunas intervenciones invasivas como la toracocentesis no son apropiadas en el escenario de SUD, y en el caso del uso de ventilación no invasiva con presión positiva u oxígeno a alto flujo, su balance beneficio-riesgo podría ser desfavorable en la mayoría de los pacientes.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
113. Supportive PDQ, Palliative Care Editorial B. Last Days of Life (PDQ®): Health Professional Version. PDQ Cancer Information Summaries. Bethesda (MD): National Cancer Institute (US); 2019.
119. Seow H, Barbera L, Sutradhar R, Howell D, Dudgeon D, Atzema C, et al. Trajectory of performance status and symptom scores for patients with cancer during the last six months of life. J Clin Oncol. 2011;29(9):1151-8. DOI: 10.1200/JCO.2010.30.7173.
120. Tishelman C, Petersson L-M, Degner LF, Sprangers MAG. Symptom prevalence, intensity, and distress in patients with inoperable lung cancer in relation to time of death. J Clin Oncol. 2007;25(34):5381-9. DOI: 10.1200/JCO.2006.08.7874.
121. The Criteria Committee of the New York Heart Association. Nomenclature and Criteria for Diagnosis of Diseases of the Heart and Great Vessels. 9ª ed. Boston: Little, Brown & Co; 1994. p. 253-6.
122. Borg G. Simple rating methods for estimation of perceived exertion. Wenner-Gren Center International Symposium. 1976;Series 28:39-47.
123. Campbell ML,Templin T,Walch A Respiratory Distress Observation Scale for patients unable to self-report dyspnea. J Palliat Med. 2010 Mar;13(3):285-90. DOI: 10.1089/jpm.2009.0229.
124. Barnes H, McDonald J, Smallwood N, Manser R. Opioids for the palliation of refractory breathlessness in adults with advanced disease and terminal illness. Cochrane Database Syst Rev. 2016;3(3):Cd011008. DOI: 10.1002/14651858.CD011008.pub2.
125. Simon ST, Higginson IJ, Booth S, Harding R, Weingärtner V, Bausewein C. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev. 2016;10(10):Cd007354. DOI: 10.1002/14651858.CD007354. pub3.
126. Navigante AH, Cerchietti LC, Castro MA, Lutteral MA, Cabalar ME. Midazolam as adjunct therapy to morphine in the alleviation of severe dyspnea perception in patients with advanced cancer. J Pain Symptom Manage. 2006;31(1):38-47. DOI: 10.1016/j.jpainsymman.2005.06.009.
127. Booth S, Kelly MJ, Cox NP, Adams L, Guz A. Does oxygen help dyspnea in patients with cancer? Am J Respir Crit Care Med. 1996;153(5):1515-8. DOI: 10.1164/ajrccm.153.5.8630595.
128. Clemens KE, Quednau I, Klaschik E. Use of oxygen and opioids in the palliation of dyspnoea in hypoxic and non-hypoxic palliative care patients: a prospective study. Support Care Cancer. 2009;17(4):367-77. DOI: 10.1007/s00520-008-0479-0.
Para personas en los últimos días de vida, ¿qué fármacos son más efectivos para aliviar las náuseas y vómitos?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Se recomienda evaluar las causas de las náuseas y vómitos en situación de últimos días de manera proporcionada. Entre las causas podrían incluirse:
- Algunos fármacos.
- Quimioterapia y radioterapia.
- Causas psicológicas.
- Causas bioquímicas, por ejemplo, hipercalcemia.
- Presión intracraneal elevada.
- Trastornos de la motilidad gastrointestinal.
- Obstrucción intestinal.
2. Se recomienda considerar medidas no farmacológicas para tratar las náuseas y vómitos en personas en situación de los últimos días de vida.
Los efectos deseables probablemente superan los efectos no deseables, pero con una incertidumbre apreciable. Eso implica que cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
3. Para el tratamiento de las náuseas y vómitos en personas con obstrucción intestinal se sugiere, además del resto de medidas farmacológicas y no farmacológicas:
- Butilbromuro de hioscina o escopolamina como tratamiento antisecretor de primera línea.
- Octreótido si los síntomas no mejoran a las 24 horas del tratamiento con butilbromuro de hioscina.
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
4. En el resto de situaciones clínicas se sugiere emplear la medicación antiemética estándar en la atención paliativa: neurolépticos, antihistamínicos, procinéticos, antagonistas 5 HT3, corticoides y benzodiacepinas.
Justificación
Se han emitido dos recomendaciones de buena práctica clínica orientadas a la evaluación de las causas de náuseas y vómitos y al inicio de medidas no farmacológicas. En casos de obstrucción intestinal se ha emitido una recomendación débil a favor teniendo en cuenta la calidad de la evidencia; para el resto de escenarios clínicos se ha realizado una recomendación de buena práctica clínica debido a la ausencia de estudios en la situación de últimos días.
Justificación detallada
Calidad de la evidencia (certeza): no se han encontrado ECAs para los antieméticos estándar en SUD. Globalmente la calidad de la evidencia es muy baja para todas las variables evaluadas, y centrada en la efectividad de la hioscina butilbromuro y el octeótrido en personas con obstrucción intestinal. Ningún estudio incluyó resultados sobre el efecto de los tratamientos en calidad de vida y la sedación se valoró en dos estudios, pero con medidas subrogadas (somnolencia y fatiga). Las muestras de los estudios eran pacientes con cáncer y obstrucción intestinal no candidatos a cirugía, en uno de ellos los pacientes no se encontraban en los últimos días de vida (aunque se incluyó porque se recogieron los resultados hasta el último día de vida). El tamaño muestral de dos de los estudios incluidos era muy pequeño (n=15 y n=17), y en el que incluyó una muestra mayor (n=68) hubo una alta tasa de abandonos. Además, los datos no han podido agregarse debido a las diferencias en las dosis y pautas de tratamiento.
Balance entre los efectos deseables e indeseables esperados: la evidencia sobre la eficacia de los dos fármacos evaluados no es concluyente. Dos de los ECA incluidos encontraron un beneficio clínico del octreótido en comparación con la hioscina butilbromuro en el control de las náuseas y la frecuencia de los vómitos, aunque uno de ellos solo mostró beneficios cuando se empleó en el ámbito domiciliario y no en el hospitalario. El tercer ECA no encontró diferencias entre los dos fármacos en el control de las náuseas. En cuanto a la seguridad, en dos de los estudios no se encontraron diferencias en los síntomas boca seca y mareo.
Desde el punto de vista del GEG la medicación antiemética en los últimos días presenta un balance beneficio-riesgo favorable (y en el caso específico de obstrucción intestinal tanto la hioscina butilbromuro como el octreótido).
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.La GPC del NICE incluyó 3 ECA (132-135) que compararon hioscina butilbromuro frente a octreótido (ambos por vía subcutánea) en pacientes oncológicos con obstrucción intestinal. En la actualización de la búsqueda no se identificó ningún estudio primario adicional ni evaluación económica.
Se identificaron 5 revisiones Cochrane sobre diferentes fármacos (levopremomazina, droperidol, corticoides, haloperidol y olanzapina) para el tratamiento de las náuseas/vómitos en atención paliativa (136-140) pero ninguna de ellas abordó específicamente los últimos días de vida, ni incluyeron estudios que cumpliesen los criterios de inclusión/exclusión de esta revisión.
De los estudios incluidos en la GPC del NICE, uno de ellos (n=15) mostró mayor beneficio clínico del octreótrido tanto en el ámbito hospitalario como en el domiciliario (134, 135). Sin embargo, otro estudio (n=17) encontró beneficios en el manejo de las náuseas para el octreótido en el ámbito domiciliario, pero no en el hospital (133). El tercer estudio (n=68), realizado únicamente en el ámbito domiciliario, no encontró diferencias clínicas entre ambos fármacos en el efecto en las náuseas y los vómitos (132).
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.Dos de los estudios incluídos analizaron las diferencias entre el butilbromuro de hioscina y el octeótrido, y no encontraron diferencias entre ambos en los efectos adversos boca seca y sedación/mareo (133-135).
¿Cuál es la certeza global en la evidencia sobre los efectos?
Muy baja.No se han encontrado ECAs para los antieméticos estándar en SUD. Globalmente la calidad de la evidencia es muy baja para todas las variables evaluadas, y centrada en la efectividad de la hioscina butilbromuro y el octeótrido en personas con obstrucción intestinal. Ningún estudio incluyó resultados sobre el efecto de los tratamientos en calidad de vida y la sedación se valoró en dos estudios, pero con medidas subrogadas (somnolencia y fatiga). Las muestras de los estudios son pacientes con cáncer y obstrucción intestinal no candidatos a cirugía, en uno de ellos los pacientes no se encontraban en los últimos días de vida (aunque se incluyó porque se recogieron los resultados hasta el último día de vida).
El tamaño muestral de dos de los estudios es muy pequeño (n=15 y n=17), y en el que incluyó una muestra mayor (n=68) hubo una alta tasa de abandonos. Además, los datos no han podido agregarse debido a las diferencias en las dosis y pautas de tratamiento.
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o variabilidad probablemente no sean importantes.No se ha realizado una revisión sistemática sobre el tema.
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.La evidencia sobre la eficacia de los dos fármacos evaluados no es concluyente. Dos de los ECA incluidos encontraron un beneficio clínico del octreótido en comparación con la hioscina butilbromuro en el control de las náuseas y la frecuencia de los vómitos, aunque uno de ellos solo mostró beneficios cuando se empleó en el ámbito domiciliario y no en el hospitalario. El tercer ECA no encontró diferencias entre los dos fármacos en el control de las náuseas. En cuanto a la seguridad, en dos de los estudios no se encontraron diferencias en los síntomas boca seca y mareo.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Variable.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Probablemente aumenta.No se ha realizado una revisión sistemática sobre el tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado una revisión sistemática sobre el tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado una revisión sistemática sobre el tema.
Otras consideraciones
Aunque el tratamiento de las náuseas y vómitos relacionados con la quimioterapia y radioterapia está apoyado en evidencia derivada de ensayos controlados aleatorizados, no existe evidencia de buena calidad para otras indicaciones de náuseas y vómitos, especialmente en la situación de últimos días. Por ello, una de las aproximaciones más extendidas en otras guías es la recomendación de diferentes tratamientos según la causa de las náuseas y/o vómitos, por ejemplo (20, 141, 142).
Por ello, el GEG enfatiza la importancia de una adecuada valoración de los mecanismos etiológicos y los factores implicados para poder iniciar un tratamiento individualizado, considerando los riesgos y beneficios de la medicación. A la hora de la selección de un fármaco determinado es importante considerar que puede ser efectivo para más de un síntoma que esté experimentando el paciente.
Se resalta la importancia de la prevención de la aparición de náuseas y vómitos vigilando, sobre todo en los casos en los que las causas puedan ser potencialmente evitables o tratables, los efectos secundarios de los tratamientos, la presencia de ileo adinámico, estreñimiento u obstrucción intestinal. Al igual que en el resto de síntomas en el final de la vida, será importante considerar medidas no farmacológicas.
En aquellos casos en los que los pacientes llegan a los últimos días con algún tratamiento antiemético, puede producirse un empeoramiento debido a la progresión de la enfermedad. En estos casos puede ser necesario valorar un aumento de dosis o el cambio a otras alternativas terapéuticas o cambio en la vía de administración.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
20. Grupo de Trabajo de la Guía de Práctica Clínica sobre Cuidados Paliativos. Guía de Práctica Clínica sobre Cuidados Paliativos. Vitoria: Agencia de Evaluación de Tecnologías Sanitarias del País Vasco; 2008. Guías de Práctica Clínica en el SNS: OSTEBA Nº 2006/08.
129. Twycross R, Back I. Nausea and vomiting in advanced cancer. Eur J Palliat Care. 1998;5:39-45.
130. Edmonds P, Karlsen S, Khan S, Addington-Hall J. A comparison of the palliative care needs of patients dying from chronic respiratory diseases and lung cancer. Palliat Med. 2001;15(4):287- 95. DOI: 10.1191/026921601678320278.
131. Klinkenberg M, Willems DL, van der Wal G, Deeg DJ. Symptom burden in the last week of life. J Pain Symptom Manage. 2004;27(1):5-13. DOI: 10.1016/j.jpainsymman.2003.05.008.
132. Mystakidou K, Tsilika E, Kalaidopoulou O, Chondros K, Georgaki S, Papadimitriou L. Comparison of octreotide administration vs conservative treatment in the management of inoperable bowel obstruction in patients with far advanced cancer: a randomized, double-blind, controlled clinical trial. Anticancer Res. 2002;22(2b):1187-92.
133. Ripamonti C, Mercadante S, Groff L, Zecca E, De Conno F, Casuccio A. Role of octreotide, scopolamine butylbromide, and hydration in symptom control of patients with inoperable bowel obstruction and nasogastric tubes: a prospective randomized trial. J Pain Symptom Manage. 2000;19(1):23-34. DOI: 10.1016/s0885-3924(99)00147-5.
134. Mercadante S, Casuccio A, Fulfaro F. The course of symptom frequency and intensity in advanced cancer patients followed at home. J Pain Symptom Manage. 2000;20(2):104-12. DOI: 10.1016/s0885-3924(00)00160-3.
135. Mercadante S, Casuccio A, Agnello A, Serretta R, Calderone L, Barresi L. Morphine versus methadone in the pain treatment of advanced-cancer patients followed up at home. J Clin Oncol. 1998;16(11):3656-61. DOI: 10.1200/jco.1998.16.11.3656.
136. Cox L, Darvill E, Dorman S. Levomepromazine for nausea and vomiting in palliative care. Cochrane Database Syst Rev. 2015;2015(11):Cd009420. DOI: 10.1002/14651858.CD009420.
137. Storrar J, Hitchens M, Platt T, Dorman S. Droperidol for treatment of nausea and vomiting in palliative care patients. Cochrane Database Syst Rev. 2014;2014(11):Cd006938. DOI: 10.1002/14651858.CD006938.pub3.
138. Vayne-Bossert P, Haywood A, Good P, Khan S, Rickett K, Hardy JR. Corticosteroids for adult patients with advanced cancer who have nausea and vomiting (not related to chemotherapy, radiotherapy, or surgery). Cochrane Database Syst Rev. 2017;7(7):Cd012002. DOI: 10.1002/14651858.CD012002.pub2.
138. Sutherland A, Naessens K, Plugge E, Ware L, Head K, Burton MJ, et al. Olanzapine for the prevention and treatment of cancer-related nausea and vomiting in adults. Cochrane Database Syst Rev. 2018;9(9):Cd012555. DOI: 10.1002/14651858.CD012555.pub2.
140. Murray-Brown F, Dorman S. Haloperidol for the treatment of nausea and vomiting in palliative care patients. Cochrane Database Syst Rev. 2015;2015(11):Cd006271. DOI: 10.1002/14651858. CD006271.pub3.
141. Levy M, Smith T, Alvarez-Perez A, Back A, Baker JN, Beck AC, et al. Palliative Care Version 1.2016. J Natl Compr Canc Netw. 2016;14(1):82-113. DOI: 10.6004/jnccn.2016.0009.
142. Guidelines and Protocols Advisory Committee (BC). Part 2: Pain and symptom management. 2017. En: Palliative care for the patient with incurable cancer or advanced disease [Monografía en internet]. Victoria: BC; 2017. [consultado 20 sept 2020]. Disponible en: https://www2.gov.bc.ca.
Para personas en los últimos días de vida, ¿qué fármacos son más efectivos para aliviar la ansiedad, delirium y agitación?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Se recomienda evaluar la presencia de ansiedad y delirium (con o sin agitación) en todo paciente en situación de últimos días.
2. Se recomienda explorar y manejar de manera proporcionada a la situación de últimos días y deseos del paciente y sus allegados, las posibles causas de ansiedad o delirium, por ejemplo, dolor, retención urinaria o impactación fecal.
3. Se recomienda aplicar medidas no farmacológicas de prevención y manejo de la ansiedad y el delirium. Se recomienda realizar soporte y educación a la familia.
4. Se recomienda considerar el uso de benzodiazepinas para controlar la ansiedad.
5. Se recomienda considerar el uso de un medicamento antipsicótico clásico para controlar el delirium, y en caso de ausencia de respuesta su combinación con benzodiacepinas.
Justificación
Se han emitido cinco recomendaciones de buena práctica clínica orientadas a mejorar la evaluación y la aplicación de medidas no farmacológicas. Dado que no se han localizado estudios que evalúen la efectividad y seguridad de los fármacos para el tratamiento de la ansiedad y el delirium en situación de últimos días, se recomiendan los fármacos más empleados en la práctica clínica y con más experiencia en su uso en esta fase.
Justificación detallada
No aplicable.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.¿Cuál es la magnitud de los efectos indeseables esperados?
Variable.¿Cuál es la certeza global en la evidencia sobre los efectos?
No hay estudios incluidos.No se ha localizado ningún estudio que cumpliese los criterios de inclusión sobre el manejo de la ansiedad y el delirium en la situación de últimos días.
En la GPC del NICE (22) tampoco localizaron ningún estudio para el manejo de estos síntomas, al igual que otras revisiones recientes (151-153).
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.No se ha realizado una revisión sistemática del tema.
El balance entre los efectos deseables e indeseables, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.El GEG está de acuerdo en que es importante el manejo de estos síntomas debido a su importante impacto y en que el balance beneficio-riesgo de los fármacos más empleados es favorable. Además, el adecuado manejo de la ansiedad y el delirium puede prevenir estados de agitación.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificante.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Aumenta.No se ha realizado revisión sistemática del tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado revisión sistemática del tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado revisión sistemática del tema.
Otras consideraciones
EL GEG discute sobre la relevancia de las medidas no farmacológicas en la prevención y control de la ansiedad, el delirium y la agitación. También en que deben ser tenidos en cuenta aquellos factores que pueden desencadenar estos síntomas y en las medidas para la prevención de accidentes o autolesiones no intencionadas.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
22. National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
110. Carvajal Valcárcel A, Martínez García M, Centeno Cortés C. Versión española del Edmonton Symptom Assessment Sytem</span> (ESAS): un instrumento de referencia para la valoración sintomática del paciente con cáncer avanzado. Medicina Paliativa. 2013;20(4):143-9. DOI: 10.1016/j.medipa.2013.02.001.
143. Kehl KA, Kowalkowski JA. A systematic review of the prevalence of signs of impending death and symptoms in the last 2 weeks of life. Am J Hosp Palliat Care. 2013;30(6):601-16. DOI: 10.1177/1049909112468222.
144. Hosie A, Davidson PM, Agar M, Sanderson CR, Phillips J. Delirium prevalence, incidence, and implications for screening in specialist palliative care inpatient settings: a systematic review. Palliat Med. 2013;27(6):486-98. DOI: 10.1177/0269216312457214.
145. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983;67(6):361-70. DOI: 1111/j.1600-0447.1983.tb09716.x.
146. McCleary E, Cumming P. Improving early recognition of delirium using SQiD (Single Question to identify Delirium): a hospital based quality improvement project. BMJ Qual Improv Rep. 2015;4(1). DOI: 10.1136/bmjquality.u206598.w2653.
147. Tobar E, Romero C, Galleguillos T, Fuentes P, Cornejo R, Lira MT, et al. Método para la evaluación de la confusión en la unidad de cuidados intensivos para el diagnóstico de delírium: adaptación cultural y validación de la versión en idioma español. Med Intensiva. 2010;34(1):4- DOI: 10.1016/j.medin.2009.04.003.
148. Bellelli G, Morandi A, Davis DH, Mazzola P, Turco R, Gentile S, et al. Validation of the 4AT, a new instrument for rapid delirium screening: a study in 234 hospitalised older people. Age Ageging. 2014 Jul;43(4):496-502. DOI: 10.1093/ageing/afu021.
149. Noguera A, Carvajal A, Alonso-Babarro A, Chisholm G, Bruera E, Centeno C. First Spanish version of the Memorial Delirium Assessment Scale: psychometric properties, responsiveness, and factor loadings. J Pain Symptom Manage. 2014;47(1):189-97. DOI: 10.1016/j.jpainsymman.2013.02.020.
150. Trzepacz PT, Mittal D, Torres R, Kanary K, Norton J, Jimerson N. Validation of the Delirium Rating Scale-revised-98: comparison with the delirium rating scale and the cognitive test for delirium. J Neuropsychiatry Clin Neurosci. 2001 Spring;13(2):229-42. DOI: 10.1176/ jnp.13.2.229.
151. Finucane AM, Jones L, Leurent B, Sampson EL, Stone P, Tookman A, et al. Drug therapy for delirium in terminally ill adults. Cochrane Database Syst Rev. 2020;1(1):Cd004770. DOI: 10.1002/14651858.CD004770.pub3.
152. Jansen K, Haugen DF, Pont L, Ruths S. Safety and Effectiveness of Palliative Drug Treatment in the Last Days of Life-A Systematic Literature Review. J Pain Symptom Manage. 2018;55(2):508-21.e3. DOI: 10.1016/j.jpainsymman.2017.06.010.
153. Salt S, Mulvaney CA, Preston NJ. Drug therapy for symptoms associated with anxiety in adult palliative care patients. Cochrane Database Syst Rev. 2017;5(5):Cd004596. DOI: 10.1002/14651858.CD004596.pub3.
Para personas en los últimos días de vida, ¿qué fármacos son más efectivos para aliviar los estertores?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
1. Se recomienda, cuando una persona entra en situación de últimos días, evaluar la aparición de estertores para valorar el inicio de un manejo precoz.
2. Se recomienda informar sobre las causas de los estertores y resolver las dudas que puedan surgir, incidiendo en que, aunque el ruido puede ser angustiante, es poco probable que cause molestias a la persona enferma por el bajo nivel de conciencia.
3. Se recomienda iniciar medidas no farmacológicas para aliviar los estertores, para reducir cualquier malestar en las personas al final de la vida y en su entorno.
4. Se recomienda considerar tratamiento farmacológico de los estertores cuando la aplicación de las medidas no farmacológicas y un correcto proceso comunicativo con el paciente y su familia son insuficientes.
Los efectos deseables probablemente superan los efectos no deseables, pero con una incertidumbre apreciable. Eso implica que cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
5. Se sugiere el uso de butilbromuro de escopolamina como primera opción, aunque la atropina o bromhidrato de escopolamina pueden emplearse como alternativas.
Justificación
Se ha emitido una recomendación débil a favor sobre el empleo de fármacos para los estertores en la SUD, teniendo en cuenta la calidad de la evidencia, muy baja según GRADE, y el balance riesgo-beneficio de los tratamientos. Esta recomendación se acompaña de una serie de recomendaciones de práctica clínica enfocadas a la identificación y manejo temprano de los estertores, a la mejora del proceso comunicativo y a la puesta en marcha de medidas no farmacológicas.
Justificación detallada
Certeza global en la evidencia: se consideró evidencia de calidad moderada a muy baja de cinco ECA (n=524) (155-159) y tres estudios de cohortes (n=374) (160-163) en personas en los últimos días de vida con cáncer avanzado (n=822) y enfermedades no oncológicas (n=76). A pesar de que dos de los ECA fueron mejores teniendo en cuenta su diseño y tamaño muestral, el resto de ECA fueron pequeños o ensayos piloto y los estudios observacionales fueron retrospectivos. La variable de resultado crítica, mejoría de los estertores, fue considerada en los 8 estudios (n=898). Ninguno de los estudios consideró la variable calidad de vida. Los resultados no pudieron metanalizarse debido a la variabilidad en las variables de resultado, en el diseño y tiempos de seguimiento. Las escalas empleadas para la valoración de los estertores en los estudios en algunos casos se describieron de forma pobre y son subjetivas.
Balance entre los efectos deseables e indeseables esperados: el GEG, tras revisar la evidencia científica disponible ha concluido que los fármacos revisados son igual de eficaces para el manejo de los estertores, y no pudo priorizar un fármaco sobre el otro (se ha recomendado como primera opción el butilbromuro de escopolamina por ser uno de los más empleados). Desde el punto de vista del GEG en general los fármacos evaluados son bien tolerados, y algunos efectos secundarios, como la reducción del nivel de alerta pueden ser beneficiosos en la SUD. Aunque la efectividad de los fármacos es modesta, no existen otros tratamientos (salvo las medidas no farmacológicas).
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Moderada.Se consideró evidencia de calidad moderada a muy baja de cinco ECA (n=524) (155-159) y tres estudios de cohortes (160- 163) (n=374) en personas en los últimos días de vida con cáncer avanzado (n=822) y enfermedades no oncológicas (n=76). La variable de resultado crítica mejoría de los estertores fue considerada en los ocho trabajos (n=898). Cuatro estudios no encontraron diferencias en la mejoría de ruidos respiratorios entre medicamentos (155, 158, 160, 161), un estudio encontró resultados favorables al placebo (159), un estudio encontró resultados favorables a la atropina (158) y dos estudios encontraron resultados favorables al glicopirronio (157, 163). Un ECA (n=130) encontró que, en personas con cáncer, la atropina era menos sedante que el butilbromuro de hioscina o el bromhidrato de hioscina (158). Ningún estudio informó sobre calidad de vida.
La evidencia no permite establecer la superioridad del bromuro de atropina, bromuro de glicopirronio, escopolamina bromhidrato y butilbromuro de escopolamina para el tratamiento de los estertores en los últimos días, y la magnitud de los efectos es globalmente modesta. El octreótrido solo fue evaluado en un pequeño ensayo (n=21) que lo comparó con escopolamina bromhidrato y obtuvo peores resultados en el control de los estertores (155).
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.La escopolamina bromhidrato ha sido asociada a un peor perfil de seguridad teniendo en cuenta el nivel de conciencia (podría producir una mayor disminución de consciencia), y también se ha asociado a la aparición de agitación, y por lo tanto deberá tenerse en cuenta a la hora de su prescripción.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Muy baja.Se consideró evidencia de calidad moderada a muy baja de cinco ECA (n=524) (155-159) y tres estudios de cohortes (160- 163) (n=374) en personas en los últimos días de vida con cáncer avanzado (n=822) y enfermedades no oncológicas (n = 76). A pesar de que dos de los ECA fueron mejores teniendo en cuenta su diseño y tamaño muestral, el resto de los ECA fueron pequeños o ensayos piloto y los estudios observacionales fueron retrospectivos. La variable de resultado crítica mejoría de los estertores fue considerada en los ocho trabajos (n=898). Ninguno de los estudios consideró la variable calidad de vida. Los resultados no pudieron metanalizarse debido a la variabilidad en las variables de resultado, en el diseño y tiempos de seguimiento.
Las escalas empleadas para la valoración de los estertores en los estudios en algunos casos se describieron de forma pobre y son subjetivas (habitualmente cumplimentadas por enfermería).
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.No se ha realizado revisión sistemática del tema.
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Probablemente favorece a la intervención.El GEG, tras revisar la evidencia científica disponible ha concluido que los fármacos revisados son igual de eficaces para el manejo de los estertores, y no pudo priorizar un fármaco sobre el otro.
Desde el punto de vista del GEG en general los fármacos evaluados son bien tolerados, y, algunos efectos secundarios, como la reducción del nivel de alerta pueden ser beneficiosos en la SUD. Aunque la efectividad de los fármacos es modesta, no existen otros tratamientos (salvo las medidas no farmacológicas).
¿Cuál es la magnitud de los recursos requeridos (costes)?
Costes y reducción de costes insignificante.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluidos.No se ha localizado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
La relación coste-efectividad, ¿favorece a la intervención o a la comparación?
No aplica.No se ha localizado ningún estudio de evaluación económica.
¿Cuál sería el impacto en equidad en salud?
Aumenta.No se ha realizado revisión sistemática del tema.
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.No se ha realizado revisión sistemática del tema.
¿Es factible la implementación de la opción?
Sí.No se ha realizado revisión sistemática del tema.
Otras consideraciones
El GEG considera relevante enfatizar la importancia de la comunicación y toma de decisiones compartida sobre el manejo de los estertores, que deberá comenzar lo antes posible en el proceso de SUD. También considera relevante enfatizar la importancia del manejo no farmacológico y de su inicio precoz.
Los cuidados no farmacológicos son importantes como intervención única o como adyuvantes al tratamiento farmacológico. Aunque no se ha realizado una revisión sistemática sobre su efectividad como parte de esta guía, las intervenciones no farmacológicas más recomendadas son la colocación en posición lateral y la retirada de secreciones manualmente o con aspiración poco profunda (esta última medida deberá ponerse en marcha con cautela debido a que puede provocar malestar). Aunque se han publicado dos estudios observacionales que no encontraron mejoras en la reducción de los estertores relacionadas con la hidratación (164), desde el punto de vista del GEG, el adecuado manejo de líquidos y alimentación, puede ser una estrategia que ayude a prevenir y reducir las secreciones.
En cuanto a los fármacos, en España el fármaco más usado en la práctica clínica es el butilbromuro de escopolamina y por lo tanto existe más experiencia en su uso. La atropina y la escopolamina bromhidrato son menos usados, pero pueden ser una opción para el manejo de los estertores teniendo en cuenta la evidencia científica disponible. La GPC del NICE también recomienda el bromuro de glicopirronio, pero en España en la actualidad solo se comercializa de forma inhalada, y por lo tanto no se recomienda.
Todos los fármacos recomendados suponen un uso off-label, puesto que ninguno de ellos tiene recogida esta indicación en su ficha técnica.
Un enfoque que está siendo investigado recientemente es la instauración de tratamiento farmacológico de forma profiláctica, antes de la aparición de las secreciones. En la búsqueda se ha identificado un ECA y un protocolo de ECA que investigan esta aproximación (165, 166). Aunque este estudio no se ha incluido en la revisión realizada al no cumplir criterios de inclusión (todos los estudios analizados incluyen pacientes con secreciones respiratorias), este enfoque todavía no cuenta con la evidencia suficiente en la actualidad que la respalde.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
154. Lokker ME, van Zuylen L, van der Rijt CCD, van der Heide A. Prevalence, impact, and treatment of death rattle: a systematic review. J Pain Symptom Manage. 2014;47(1):105-22. DOI: 10.1016/j.jpainsymman.2013.03.011.
155. Clark K, Currow DC, Agar M, Fazekas BS, Abernethy AP. A pilot phase II randomized, cross-over, double-blinded, controlled efficacy study of octreotide versus hyoscine hydrobromide for control of noisy breathing at the end-of-life. J Pain Palliat Care Pharmacother. 2008;22(2):131- DOI: 10.1080/15360280801992058.
156. Likar R, Molnar M, Rupacher E, Pipam W, Deutsch J, Mörtl M, et al. Klinische Untersuchung über die Wirkung von Scopolamin-Hydrobromicum beim terminalen Rasseln (randomisierte, doppelblind, plazebokontrollierte Studie). Palliativmedizin. 2002;3(01):15-9.
157. Likar R, Rupacher E, Kager H, Molnar M, Pipam W, Sittl R. [Efficacy of glycopyrronium bromide and scopolamine hydrobromide in patients with death rattle: a randomized controlled study]. Wien Klin Wochenschr. 2008;120(21-22):679-83. DOI: 10.1007/s00508-008-1094-2.
158. Wildiers H, Dhaenekint C, Demeulenaere P, Clement PM, Desmet M, Van Nuffelen R, et al. Atropine, hyoscine butylbromide, or scopolamine are equally effective for the treatment of death rattle in terminal care. J Pain Symptom Manage. 2009;38(1):124-33. DOI: 10.1016/j. jpainsymman.2008.07.007.
159. Heisler M, Hamilton G, Abbott A, Chengalaram A, Koceja T, Gerkin R. Randomized double-blind trial of sublingual atropine vs. placebo for the management of death rattle. J Pain Symptom Manage. 2013;45(1):14-22. DOI: 10.1016/j.jpainsymman.2012.01.006.
160. Back IN, Jenkins K, Blower A, Beckhelling J. A study comparing hyoscine hydrobromide and glycopyrrolate in the treatment of death rattle. Palliat Med. 2001;15(4):329-36. DOI: 10.1191/026921601678320313.
161. Hugel H,Ellershaw J,Gambles M. Respiratory tract secretions in the dying patient: a comparison between glycopyrronium and hyoscine hydrobromide. J Palliat Med. 2006;9(2):279-84. DOI: 10.1089/jpm.2006.9.279.
162. Kåss RM, Ellershaw J. Respiratory tract secretions in the dying patient: a retrospective study. J Pain Symptom Manage. 2003;26(4):897-902. DOI: 10.1016/s0885-3924(03)00292-6.
163. Hughes A, Wilcock A, Corcoran R, Lucas V, King A. Audit of three antimuscarinic drugs for managing retained secretions. Palliat Med.2000;14(3):221-2.DOI: 10.1191/026921600670188257.
164. Star A, Boland JW. Updates in palliative care-recent advancements in the pharmacological management of symptons. Clinical medicine (London, England). 2018;18(1):11-6. DOI: 10.7861/clinmedicine.18-1-11.
165. Mercadante S, Marinangeli F, Masedu F, Valenti M, Russo D, Ursini L, et al. Hyoscine Butylbromide for the Management of Death Rattle: Sooner Rather Than Later. J Pain Symptom Manage. 2018 Dec;56(6):902-7. DOI: 10.1016/j.jpainsymman.2018.08.018.
166. van Esch HJ, van Zuylen L, Oomen-de Hoop E, van der Heide A, van der Rijt CCD. Scopolaminebutyl given prophylactically for death rattle: study protocol of a randomized double-blind placebo-controlled trial in a frail patient population (the SILENCE study). BMC Palliat Care. 2018;17(1):105. DOI: 10.1186/s12904-018-0359-4.
En pacientes en situación de últimos días, ¿es beneficiosa la sedación paliativa para aliviar el sufrimiento causado por síntomas refractarios?
Los efectos deseables probablemente superan los efectos no deseables, pero con una incertidumbre apreciable. Eso implica que cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
1. Se sugiere aplicar sedación paliativa en pacientes en situación de últimos días con sufrimiento causado por uno o más síntomas refractarios.
Justificación
El GEG ha formulado una recomendación débil a favor de aplicar sedación paliativa en esta población (pacientes en SUD con sufrimiento causado por uno o más síntomas refractarios) debido a que la calidad de la evidencia sobre los efectos es globalmente muy baja y a que probablemente la incertidumbre o la variabilidad sobre como los pacientes y familiares valoran los desenlaces son importantes.
Se han elaborado también una serie de consideraciones clínicas relevantes y relacionadas con la implementación de la recomendación realizada. Estas están orientadas a favorecer el proceso de sedación paliativa, incluyendo: la necesidad de consenso en el equipo multidisciplinar sobre la indicación de sedación, la obtención del consentimiento informado, el tipo de sedación, la monitorización, medidas de adecuación terapéutica y de confort, la actitud de los profesionales, así como el registro del proceso en la historia clínica.
Justificación detallada
Calidad de la evidencia: la calidad de la evidencia sobre los beneficios de la sedación paliativa es globalmente muy baja, debido a que solo se han identificado estudios observacionales (series de casos consecutivas) con grupo de comparación. La calidad de la evidencia de los estudios cualitativos sobre las experiencias y preferencias de los pacientes y familiares es moderada-baja. El principal problema de la evidencia cualitativa revisada son algunas limitaciones metodológicas de los estudios y las dudas relacionadas con la aplicabilidad, porque solo uno de los estudios incluye a pacientes y familiares de España. Las revisiones sistemáticas sobre indicaciones y recomendaciones son de calidad moderada, aunque pocas de las guías incluidas cumplen los estándares de calidad actuales.
Incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales: la evidencia cualitativa revisada indica que tanto para los pacientes como para los familiares el bienestar y el alivio del sufrimiento es una de las prioridades en los últimos días. Sin embargo, pueden existir diferencias entre los pacientes y sus propios familiares al valor otorgado a estar consciente, y también diferencias entre pacientes.
Balance riesgo-beneficio: a pesar de la ausencia de evidencia científica de calidad, el GEG está de acuerdo en que los beneficios de la sedación paliativa en los pacientes en situación de últimos días (alivio del malestar provocado por síntomas refractarios que no son controlados con otros métodos) probablemente superan a los riesgos en la mayoría de los casos. Los fármacos sedantes empleados (principalmente BDZ) pueden ser titulados para alcanzar el nivel de sedación requerido y deseado (que puede ser superficial, intermedio o profundo), el nivel de sedación puede ser mantenido y los efectos son reversibles.
De la evidencia a la recomendación
¿Cuál es la magnitud de los efectos deseables esperados?
Grande.Se ha identificado una revisión Cochrane (6) que cumple los criterios de inclusión predefinidos por el grupo de trabajo para la pregunta sobre los beneficios de los fármacos empleados para realizar una sedación paliativa en situación de últimos días, y por lo tanto se ha actualizado su búsqueda bibliográfica (año 2014 en adelante). Solo se ha localizado un estudio posterior que aporta evidencia para la variable supervivencia (Prado et al., 2018) (68). Esto es congruente con la revisión realizada por los autores de la revisión Cochrane en noviembre del 2018, en la que no identificaron ningún estudio relevante, y por lo tanto consideraron la revisión estable hasta el año 2024.
No se ha localizado ningún estudio cuantitativo que evalúe el efecto de la sedación paliativa en la calidad de vida o bienestar/confort. Los cuatro estudios observacionales que evaluaron el control de síntomas incluidos en una revisión Cochrane mostraron que fue similar entre pacientes sedados y no sedados, aunque en algunos estudios el delirium y la disnea siguieron presentes a pesar de la sedación (174). En cuanto a la supervivencia, 14 estudios (175-188) evidenciaron que no hubo diferencias significativas entre sedados y no sedados en el tiempo transcurrido desde la hospitalización hasta la muerte (174). El único estudio localizado en la actualización encontró que la supervivencia en el grupo de pacientes sedados fue más del doble que en pacientes no sedados (189). La satisfacción fue abordada en solo un estudio cuantitativo (178), que encontró que tanto los familiares como los pacientes estuvieron satisfechos con la sedación (174). Solo un estudio cuantitativo evaluó la seguridad (178), y no informó de ningún efecto adverso en el grupo que recibió la sedación (174).
La evidencia cualitativa sobre las experiencias de pacientes y familiares señala que la mayoría de los familiares estaban satisfechos con la sedación y el proceso (190- 199).
¿Cuál es la magnitud de los efectos indeseables esperados?
Pequeña.Sólo un estudio incluido en la revisión Cochrane evaluó la seguridad de los fármacos empleados para la sedación paliativa, y no encontró efectos adversos mayores (178). La revisión Cochrane no encontró que la sedación paliativa tuviese ningún efecto en acortar la vida, ya que no hubo diferencias entre sedados y no sedados en la supervivencia (174).
¿Existe incertidumbre o variabilidad importante sobre cómo los pacientes valoran los desenlaces principales?
La incertidumbre o la variabilidad probablemente sean importantes.Se han identificado 11 estudios que han explorado las experiencias y perspectivas de los pacientes y familiares con la sedación paliativa, aunque solo dos de ellos incluyeron la visión de pacientes (en los dos casos de pacientes oncológicos en la fase final). La evidencia cualitativa revisada indica que, tanto para los pacientes como para los familiares, el bienestar y el alivio del sufrimiento es una de las prioridades en los últimos días. Sin embargo, pueden existir diferencias entre los pacientes y sus propios familiares al valor otorgado a estar consciente, y diferencias entre pacientes, que pueden depender de las preferencias individuales y/o de factores culturales y sociales (190-199).
¿Cuál es la certeza global en la evidencia sobre los efectos?
Muy baja.La calidad de la evidencia sobre los beneficios de la sedación paliativa es globalmente muy baja, debido a que solo se han identificado estudios observacionales (series de casos consecutivas) con grupo de comparación. Solo tres de los estudios fueron prospectivos y únicamente uno de ellos intentó controlar el sesgo de selección a través del control de las características clínicas de base, y seis estudios informaron de diferencias entre sedados versus no sedados en las características de los pacientes. El resto de estudios no informaron de las características basales de los participantes en los estudios. Más del 95 % de la muestra total en los estudios fueron pacientes oncológicos.
Ningún estudio evaluó la calidad de vida o bienestar de los pacientes, una de las variables clave. El control de síntomas fue medido de forma diferente entre los estudios (como prevalencia de cada síntoma en los últimos siete días, prevalencia de síntomas, puntuación media y adecuación del control de síntomas), por lo que no fue posible obtener una medida agregada. Además, la prevalencia de síntomas podría considerarse una variable indirecta debido a que no informa sobre el efecto de la sedación en síntomas concretos.
Tampoco se pudo obtener una medida agregada de supervivencia y, además, fue medida como el periodo desde la hospitalización o el inicio de los CP hasta la muerte, por lo que también puede considerarse una medida indirecta del efecto de la sedación en la supervivencia.
Estudios cualitativos
La calidad de la evidencia de los estudios cualitativos es moderada-baja. El principal problema de la evidencia revisada son algunas limitaciones metodológicas de los estudios y las dudas relacionadas con la aplicabilidad, porque solo uno de los estudios incluye a pacientes y familiares de España. Sin embargo, cabe destacar que globalmente los temas identificados son relevantes desde el punto de vista del grupo de trabajo.
¿Son mayores los efectos deseables que los efectos indeseables?
Probablemente sí.¿Cuál es la magnitud de los recursos requeridos (costes)?
Probablemente pequeña.No se ha identificado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Cuál es la certeza en torno a la evidencia de los recursos requeridos?
No hay estudios incluídos.No se ha identificado ningún estudio que describa de forma explícita el uso de recursos (costes) o estudios de evaluación económica.
¿Es pequeño el incremento del coste en relación con los beneficios netos?
Probablemente sí.No se ha identificado ningún estudio de coste-efectividad ni análisis de evaluación económica.
¿Cuál sería el impacto en la equidad en salud?
Aumenta.No se ha realizado una revisión sistemática del tema. Existe evidencia que sugiere que algunos factores sociodemográficos como la edad, el género o el nivel educativo podrían afectar a la equidad (200).
¿Es aceptable la opción para los agentes implicados?
Probablemente sí.Según la evidencia revisada, la sedación paliativa para el alivio de los síntomas refractarios es generalmente aceptable para los pacientes y los familiares en SUD. Cabe tener en cuenta que las situaciones en las que un familiar es sedado suelen ser difíciles para sus familiares y allegados y ser una causa de importante malestar. Es relevante considerar que algunos pacientes y familiares querrán una oportunidad para despedirse de sus seres queridos (190-199). Los estudios también señalan la importancia de una adecuada toma de decisiones compartida y de dar respuesta a las posibles preocupaciones que pueden surgir en los familiares en el proceso (190-199).
La evidencia cualitativa sobre la experiencia de los profesionales sugiere la existencia de algunas discrepancias entre expertos en la indicación de sedación paliativa en casos de sufrimiento existencial y demencias, y también diferencias en los tipos y niveles de sedación para casos concretos. También se encontró preocupación de los profesionales sobre la sedación paliativa establecida de modo definitivo al final del continuum de atención paliativa como equivalente a la eutanasia (201-203). Todo ello sugiere que para algunos profesionales todavía pueden existir preocupaciones conceptuales, clínicas o éticas, relacionadas con la sedación paliativa y por ello es importante mejorar la formación en cuidados paliativos y bioética, y disponer de GPC o protocolos específicos que ayuden a la toma de decisiones (201-203).
¿Es factible la implementación de la opción?
Sí.A pesar de la insuficiente evidencia derivada de estudios primarios, existe consenso en la mayor parte de las guías sobre las indicaciones, tipos de sedación y fármacos empleados. El fármaco más frecuentemente recomendado es el midazolam, aunque existen variaciones (204, 205).
Otras consideraciones
Uno de los aspectos más relevantes en el proceso de toma de decisiones para la indicación de sedación paliativa es la determinación de refractariedad. En la práctica clínica, se considera que un síntoma es refractario cuando no existen métodos para su control en un marco temporal aceptable para la persona en SUD y sin provocar efectos adversos intolerables (172, 207). El documento de sedación paliativa de la Organización Médica Colegial (OMC) y la Sociedad Española de Cuidados Paliativos (SECPAL) define síntoma refractario como aquel que no puede ser adecuadamente controlado con los tratamientos disponibles, aplicados por médicos expertos, en un plazo de tiempo razonable (en la fase agónica breve) (207).
Los síntomas refractarios más frecuentes son el delirium, la disnea, el dolor y las convulsiones. En ocasiones pueden aparecer procesos agudos como la hemorragia masiva o la asfixia (172). Un síntoma refractario que merece especial atención es el sufrimiento existencial o psicoexistencial. Se refiere a la “pérdida de sentido y propósito en la vida”. Se incluye en este concepto: un sentimiento profundo de sinsentido y desesperanza, ansiedad o miedo a la muerte, sentimiento de carga para los seres queridos, desesperanza por la pérdida de control o dependencia, consideración de pérdida de dignidad, sufrimiento por la falta de soporte social o por la soledad. Parece existir consenso en la literatura, en que en casos de sufrimiento existencial debería exigirse un mayor rigor en la determinación de la refractariedad, la implicación de un equipo interdisciplinar y a ser posible, con valoración por profesionales de la salud mental (208, 209). A este respecto, el marco de la EAPC (del inglés European Association for Palliative Care) también propone que, en estos casos, la sedación profunda debería considerarse después de ensayos repetidos de sedación de respiro o intermitente (172).
En cuanto a la obtención del consentimiento informado, en situaciones en las que el paciente tenga la capacidad de decidir, deberían discutirse los objetivos, beneficios y consecuencias de la sedación paliativa. Sin embargo, obtener el consentimiento explícito en la SUD, podría resultar maleficente por lo que es deseable que el consentimiento se obtenga previamente, en un proceso de planificación anticipada y compartida de las decisiones, y así quede registrado en la historia clínica. Por otro lado, uno de los principales síntomas refractarios es el delirium con lo que el consentimiento en esa situación no sería posible, tratándose en este caso de un consentimiento por representación. En este caso, la decisión corresponde al representante asignado legalmente o en un documento de instrucciones previas, o a las personas vinculadas por razones familiares o de hecho, siempre atendiendo al mayor beneficio para el paciente.
En cuanto al nivel y profundidad de la sedación es necesario considerar que el objetivo de la sedación es el alivio del síntoma y que el descenso del nivel de conciencia es la herramienta o medio para conseguir ese fin (210, 211). Por ello un enfermo al final de la vida con un síntoma refractario que consigue el alivio de este con sedación superficial es un enfermo aliviado y el objetivo de la sedación se ha conseguido. Por regla general se asume que el nivel de sedación debería ser el mínimo necesario para el alivio del sufrimiento (172). Sin embargo, ante eventos catastróficos como una hemorragia masiva o asfixia y en situaciones muy cercanas al final de la vida (agonía) la sedación debe ser profunda y continua desde el inicio. En situaciones de emergencia en la que la vida peligra rápidamente, como un sangrado masivo, no sería preciso el consentimiento por representación para instaurar una SP profunda, continua y rápida.
En ocasiones ocurre que el familiar o cuidador del paciente pide una sedación más profunda pese al adecuado control del síntoma. Esto puede deberse al desbordamiento emocional del familiar y debe ser manejado en un proceso continuo de comunicación y tratado en la aproximación informativa con los familiares. También sucede el caso contrario: el familiar solicita la retirada de una sedación ya instaurada o disminución de la misma para que el paciente recupere el nivel de consciencia. El GEG está de acuerdo en que la información continuada sobre el proceso de sedación y el acompañamiento a familiares disminuye considerablemente las dudas y el sufrimiento familiar al respecto.
Respecto a la temporalidad de la sedación en algunos escenarios clínicos (principalmente en fases anteriores a la SUD) puede ser intermitente, sobre todo cuando el síntoma refractario es de predominio nocturno de modo prioritario. En la práctica clínica no es infrecuente la sedación intermitente nocturna durante unos días como preludio de la sedación continua.
Para revisar el nivel de sedación, el GEG recomienda la escala de Richmond (Richmond Agitation-Sedation Scale, RASS) (212) (recomendada por la EAPC y validada en población española (213)) o la escala de Ramsay que, aunque no ha sido validada en población española, es de uso frecuente y fácil aplicabilidad (20).
El GEG considera relevante considerar que las circunstancias y estatus del paciente en últimos días y en situación de indicación de sedación paliativa dificulta la realización de estudios. Esto explica, la ausencia de estudios de calidad que hayan evaluado resultados como el confort/bienestar o calidad de vida, y la existencia de resultados discrepantes, además de la incertidumbre en los hallazgos. Por ello, es importante disponer de GPC y marcos conceptuales de referencia, así como tener en cuenta los principios de la ética clínica.
Recientemente, y con motivo de la pandemia por SARS-COV-2, el Ministerio de Sanidad ha publicado un documento con recomendaciones con el objetivo de ayudar a los profesionales de Atención Primaria en la toma de decisiones para la aplicación de Sedación Paliativa en domicilio en situación de últimos días (SUD) para pacientes con sospecha o confirmación de COVID-19 (214). Este documento también contempla alternativas farmacológicas en caso de desabastecimiento.
En cuanto a la eutanasia cabe considerar que, en nuestro país, ha sido aprobada recientemente a través de la Ley Orgánica 3/2021 de 24 de marzo, de regulación de eutanasia, lo que conllevará su puesta en práctica en los próximos meses.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
6. The goals of medicine. Setting new priorities. Hastings Cent Rep. 1996;26(6):S1-27.
20. Grupo de Trabajo de la Guía de Práctica Clínica sobre Cuidados Paliativos. Guía de Práctica Clínica sobre Cuidados Paliativos. Vitoria: Agencia de Evaluación de Tecnologías Sanitarias del País Vasco; 2008. Guías de Práctica Clínica en el SNS: OSTEBA Nº 2006/08.
68. Stevens I, Whyte F. Advance care planning: will it work in diseases other than cancer? European Journal of Palliative Care. 2011;18(6):280-4.
143. Kehl KA, Kowalkowski JA. A systematic review of the prevalence of signs of impending death and symptoms in the last 2 weeks of life. Am J Hosp Palliat Care. 2013;30(6):601-16. DOI: 10.1177/1049909112468222.
167. A controlled trial to improve care for seriously ill hospitalized patients. The study to understand prognoses and preferences for outcomes and risks of treatments (SUPPORT). The SUPPORT Principal Investigators. JAMA. 1995;274(20):1591-8.
168. Doyle D, Woodruff R. The IAHCP Manual of Palliative Care. 2ª ed. International Association for Hospice and Palliative Care Press; 2008.
169. Morita T, Chinone Y, Ikenaga M, Miyoshi M, Nakaho T, Nishitateno K, et al. Efficacy and safety of palliative sedation therapy: a multicenter, prospective, observational study conducted on specialized palliative care units in Japan. J Pain Symptom Manage. 2005;30(4):320-8. DOI: 10.1016/j.jpainsymman.2005.03.017.
170. Cowan JD, Clemens L, Palmer T. Palliative sedation in a southern Appalachian community. Am J Hosp Palliat Care. 2006;23(5):360-8. DOI: 10.1177/1049909106292173.
171. de Graeff A, Dean Palliative sedation therapy in the last weeks of life: a literature review and recommendations for standards. J Palliat Med. 2007;10(1):67-85. DOI: 10.1089/jpm.2006.0139.
172. Cherny NI, Radbruch L, Board of the European Association for Palliative C. European Association for Palliative Care (EAPC) recommended framework for the use of sedation in palliative care. Palliat Med. 2009;23(7):581-93. DOI: 10.1177/0269216309107024.
173. Cherny NI, Portenoy RK. Sedation in the management of refractory symptoms: guidelines for evaluation and treatment. J Palliat Care. 1994;10(2):31-8.
174. Beller EM, van Driel ML, McGregor L, Truong S, Mitchell G. Palliative pharmacological sedation for terminally ill adults. Cochrane Database Syst Rev. 2015;1(1):CD010206-CD. DOI: 10.1002/14651858.CD010206.pub2.
175. Alonso-Babarro A, Varela-Cerdeira M, Torres-Vigil I, Rodríguez-Barrientos R, Bruera E. At-home palliative sedation for end-of-life cancer patients. Palliat Med. 2010;24(5):486-92. DOI: 10.1177/0269216309359996.
176. Bulli F, Miccinesi G, Biancalani E, Fallai M, Mannocci M, Paci E, et al. Continuous deep sedation in home palliative care units: case studies in the Florence area in 2000 and in 2003-2004. Minerva Anestesiol. 2007;73(5):291-8.
177. Caraceni A, Zecca E, Martini C, Gorni G, Campa T, Brunelli C, et al. Palliative sedation at the end of life at a tertiary cancer center. Support Care Cancer. 2012;20(6):1299-307. DOI: 10.1007/s00520-011-1217-6.
178. Chiu TY, Hu WY, Lue BH, Cheng SY, Chen CY. Sedation for refractory symptoms of terminal cancer patients in Taiwan. J Pain Symptom Manage. 2001;21(6):467-72. DOI: 10.1016/s0885- 3924(01)00286-x.
179. Fainsinger RL, Landman W, Hoskings M, Bruera E. Sedation for uncontrolled symptoms in a South African hospice. J Pain Symptom Manage. 1998;16(3):145-52. DOI: 10.1016/s0885- 3924(98)00066-9.
180. Kohara H, Ueoka H, Takeyama H, Murakami T, Morita T. Sedation for terminally ill patients with cancer with uncontrollable physical distress. J Palliat Med. 2005;8(1):20-5. DOI: 10.1089/ jpm.2005.8.20.
181. Maltoni M, Pittureri C, Scarpi E, Piccinini L, Martini F, Turci P, et al. Palliative sedation therapy does not hasten death: results from a prospective multicenter study. Ann Oncol. 2009;20(7):1163-9. DOI: 10.1093/annonc/mdp048.
182. Maltoni M, Miccinesi G, Morino P, Scarpi E, Bulli F, Martini F, et al. Prospective observational Italian study on palliative sedation in two hospice settings: differences in casemixes and clinical care. Support Care Cancer. 2012;20(11):2829-36. DOI: 10.1007/s00520-012-1407-x.
183. Muller-Busch HC, Andres I, Jehser T. Sedation in palliative care – a critical analysis of 7 years experience. BMC Palliat Care. 2003;2(1):2-. DOI: 10.1186/1472-684X-2-2.
184. Radha Krishna LK, Poulose VJ, Goh C. The use of midazolam and haloperidol in cancer patients at the end of life. Singapore medical journal. 2012;53(1):62-6.
185. Rietjens JAC, van Zuylen L, van Veluw H, van der Wijk L, van der Heide A, van der Rijt CCD. Palliative sedation in a specialized unit for acute palliative care in a cancer hospital: comparing patients dying with and without palliative sedation. J Pain Symptom Manage. 2008;36(3):228- 34. DOI: 10.1016/j.jpainsymman.2007.10.014.
186. Stone P, Phillips C, Spruyt O,Waight C. A comparison of the use of sedatives in a hospital support team and in a hospice. Palliat Med. 1997;11(2):140-4. DOI: 10.1177/026921639701100208.
187. Sykes N, Thorns A. Sedative use in the last week of life and the implications for end-of-life decision making. Arch Intern Med. 2003;163(3):341-4. DOI: 10.1001/archinte.163.3.341.
188. Vitetta L,Kenner D, Sali A. Sedation and analgesia-prescribing patterns in terminally ill patients at the end of life. Am J Hosp Palliat Care. 2005;22(6):465-73.DOI: 10.1177/104990910502200601.
189. Prado BL, Gomes DBD, Usón Júnior PLS, Taranto P, França MS, Eiger D, et al. Continuous palliative sedation for patients with advanced cancer at a tertiary care cancer center. BMC Palliat Care. 2018;17(1):13-. DOI: 10.1186/s12904-017-0264-2.
190. Boulanger A, Chabal T, Fichaux M, Destandau M, La Piana JM, Auquier P, et al. Opinions about the new law on end-of-life issues in a sample of french patients receiving palliative care. BMC Palliat Care. 2017;16(1):7-. DOI: 10.1186/s12904-016-0174-8.
191. Bruinsma SM, Brown J, van der Heide A, Deliens L, Anquinet L, Payne SA, et al. Making sense of continuous sedation in end-of-life care for cancer patients: an interview study with bereaved relatives in three European countries. Support Care Cancer. 2014;22(12):3243-52. DOI: 10.1007/s00520-014-2344-7.
192. Bruinsma SM, van der Heide A, van der Lee ML, Vergouwe Y, Rietjens JAC. No Negative Impact of Palliative Sedation on Relatives’ Experience of the Dying Phase and Their Wellbeing after the Patient’s Death: An Observational Study. PloS one. 2016;11(2):e0149250-e. DOI: 1371/journal.pone.0149250.
193. Eun Y, Hong I-W, Bruera E, Kang JH. Qualitative Study on the Perceptions of Terminally Ill Cancer Patients and Their Family Members Regarding End-of-Life Experiences Focusing on Palliative Sedation. J Pain Symptom Manage. 2017;53(6):1010-6. DOI: 10.1016/j. jpainsymman.2016.12.353.
194. Fainsinger RL, Núñez-Olarte JM, Demoissac DM. The cultural differences in perceived value of disclosure and cognition: Spain and Canada. J Palliat Care. 2003;19(1):43-8.
195. Morita T, Ikenaga M, Adachi I, Narabayashi I, Kizawa Y, Honke Y, et al. Family experience with palliative sedation therapy for terminally ill cancer patients. J Pain Symptom Manage. 2004;28(6):557-65. DOI: 10.1016/j.jpainsymman.2004.03.004.
196. Shen H-S, Chen S-Y, Cheung DST, Wang S-Y, Lee JJ, Lin C-C. Differential Family Experience of Palliative Sedation Therapy in Specialized Palliative or Critical Care Units. J Pain Symptom Manage. 2018;55(6):1531-9. DOI: 10.1016/j.jpainsymman.2018.02.007.
197. Tursunov O, Cherny NI, Ganz FD. Experiences of Family Members of Dying Patients Receiving Palliative Sedation. Oncol Nurs Forum. 2016;43(6):E226-E32. DOI: 10.1188/16. ONF.E226-E232.
198. van Dooren S, van Veluw HTM, van Zuylen L, Rietjens JAC, Passchier J, van der Rijt CCD. Exploration of concerns of relatives during continuous palliative sedation of their family members with cancer. J Pain Symptom Manage. 2009;38(3):452-9. DOI: 10.1016/j. jpainsymman.2008.11.011.
199. Vayne-Bossert P, Zulian GB. Palliative sedation: from the family perspective. Am J Hosp Palliat Care. 2013;30(8):786-90. DOI: 10.1177/1049909112472930.
200. Rietjens JAC, Deschepper R, Pasman R, Deliens L. Medical end-of-life decisions: does its use differ in vulnerable patient groups? A systematic review and meta-analysis. Social science & medicine (1982). 2012;74(8):1282-7. DOI: 10.1016/j.socscimed.2011.12.046.
201. Benítez-Rosario MA, Morita T. Palliative sedation in clinical scenarios: results of a modified Delphi study. Support Care Cancer. 2019;27(5):1647-54. DOI: 10.1007/s00520-018-4409-5.
202. Raus K, Brown J, Seale C, Rietjens JAC, Janssens R, Bruinsma S, et al. Continuous sedation until death: the everyday moral reasoning of physicians, nurses and family caregivers in the UK, The Netherlands and Belgium. BMC Med Ethics. 2014;15:14-. DOI: 10.1186/1472-6939- 15-14.
203. Papavasiliou EE, Payne S, Brearley S, Euroimpact. Current debates on end-of-life sedation: an international expert elicitation study. Support Care Cancer. 2014;22(8):2141-9. DOI: 10.1007/ s00520-014-2200-9.
204. Abarshi E, Rietjens J, Robijn L, Caraceni A, Payne S, Deliens L, et al. International variations in clinical practice guidelines for palliative sedation: a systematic review. BMJ Support Palliat Care. 2017;7(3):223-9. DOI: 10.1136/bmjspcare-2016-001159.
205. Schildmann EK, Schildmann J, Kiesewetter I. Medication and monitoring in palliative sedation therapy: a systematic review and quality assessment of published guidelines. J Pain Symptom Manage. 2015;49(4):734-46. DOI: 10.1016/j.jpainsymman.2014.08.013.
206. Sedación paliativa del prcpex, uso y recomendaciones. Guía clínica [Internet]. Mérida: Servicio Extremeño de Salud. FundeSalud; 2014. [consultado 04 feb 2020]. Disponible en: https://saludextremadura.ses.es.
207. Sedación paliativa. Guía [Internet] Madrid: Consejo General de Colegios Oficiales de Médicos; 2012. [consultado 04 feb 2020]. Disponible en: https://www.cgcom.es.
208. Voeuk A, Nekolaichuk C, Fainsinger R, Huot A. Continuous Palliative Sedation for Existential Distress? A Survey of Canadian Palliative Care Physicians’ Views. J Palliat Care. 2017;32(1):26-33. DOI: 10.1177/0825859717711301.
209. Rodrigues P, Crokaert J, Gastmans C. Palliative Sedation for Existential Suffering: A Systematic Review of Argument-Based Ethics Literature. J Pain Symptom Manage. 2018;55(6):1577-90. DOI: 10.1016/j.jpainsymman.2018.01.013.
210. Henry B. A systematic literature review on the ethics of palliative sedation: an update (2016). Current opinion in supportive and palliative care. 2016;10(3):201-7. DOI: 10.1097/ SPC.0000000000000224.
211. Twycross R. Reflections on palliative sedation. Palliative care. 2019;12:1178224218823511-. DOI: 1177/1178224218823511.
212. Ely EW, Truman B, Shintani A, Thomason JWW, Wheeler AP, Gordon S, et al. Monitoring sedation status over time in ICU patients: reliability and validity of the Richmond Agitation- Sedation Scale (RASS). JAMA. 2003;289(22):2983-91. DOI: 10.1001/jama.289.22.2983.
213. Benítez-Rosario MA, Castillo-Padrós M, Garrido-Bernet B, González-Guillermo T, Martínez- Castillo LP, González A, et al. Appropriateness and reliability testing of the modified Richmond Agitation-Sedation Scale in Spanish patients with advanced cancer. J Pain Symptom Manage. 2013;45(6):1112-9. DOI: 10.1016/j.jpainsymman.2012.05.015.
214. Sacristán Rodea A, Peláez Moya S, Bullich Marín I, García Aparicio M, Coords. Manejo en domicilio de pacientes al final de la vida que requieran sedación paliativa en el contexto de la pandemia por COVID-19. Madrid: Ministerio de Sanidad; 2020. Disponible en: https://www.mscbs.gob.es.
Estrategias diagnósticas y terapéuticas (algoritmos)
Dada la complejidad de la situación de últimos días no se ha realizado un algoritmo diagnóstico-terapéutico detallado. En el material complementario al capítulo de sedación paliativa se incluye un algoritmo para el uso de fármacos en la sedación (anexo 11).
En la figura a continuación se presenta una representación esquemática de los principales aspectos que aborda la guía.
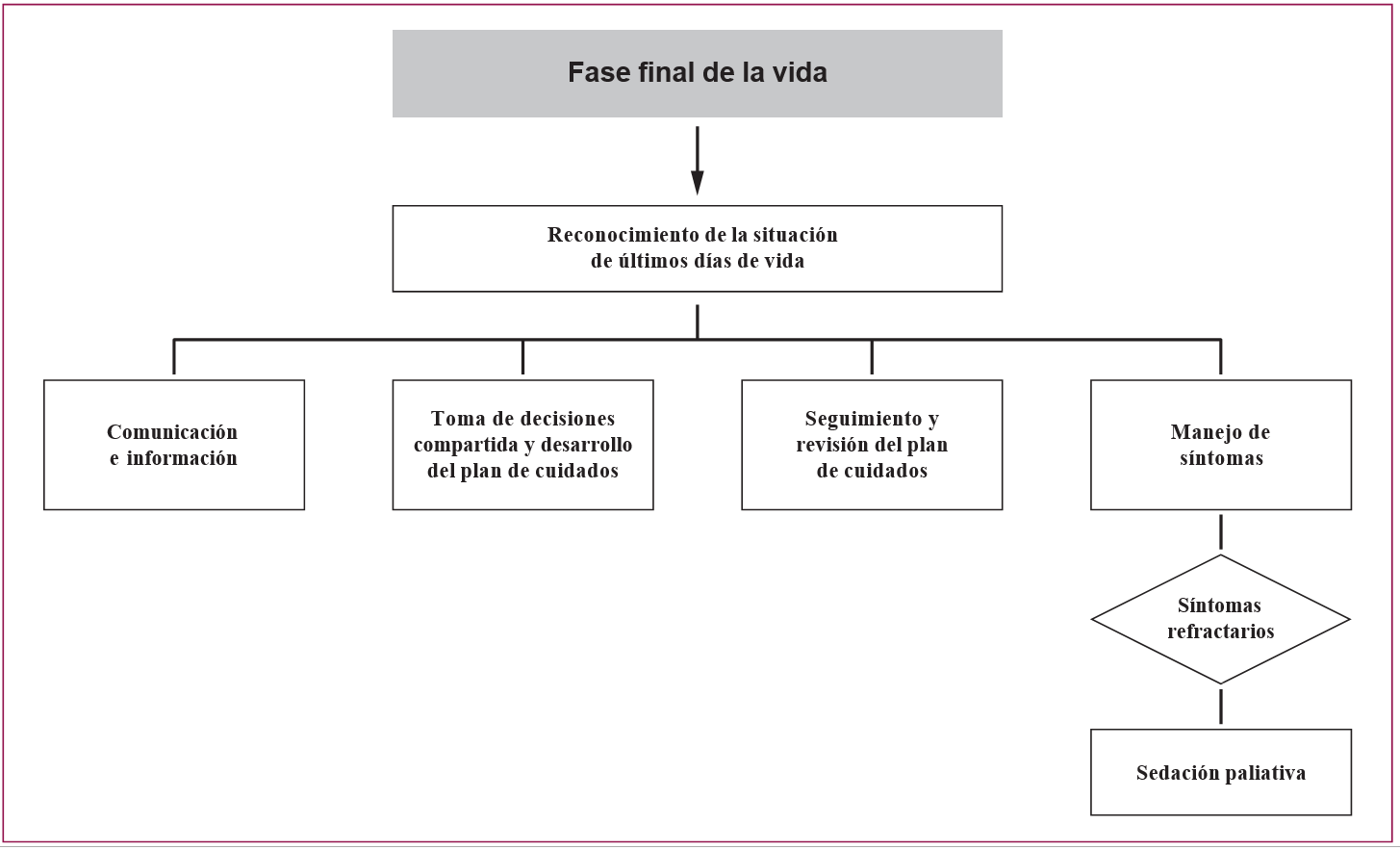
Información para pacientes
Información para familiares y allegados de personas en situación de últimos días
Afrontar la recta final en la vida de un ser querido es una situación dura en la que nuestra prioridad ha de ser acompañarle aliviando su sufrimiento y procurándole el mayor bienestar posible, al tiempo que también cuidamos de nosotros mismos.
El propósito de esta guía es ayudar a las familias y las personas del círculo más próximo a afrontar los últimos días de la vida de un ser querido, mediante recomendaciones prácticas para favorecer su cuidado y reconfortarle. Esta es una información genérica que servirá de complemento a las orientaciones y consejos que le ofrecerá el equipo asistencial.
Los aspectos que se tratan a continuación son los que habitualmente se plantean familiares y personas cercanas. Esperamos que a usted también le sean de utilidad.
Toda la información está disponible en formato PDF en el siguiente documento:
Información para familiares y allegados de personas en situación de últimos días
También pueden acceder a la infografía en castellano y gallego a través de estos enlaces:
Qué es la situación de últimos días y cómo se reconoce
La agonía o situación de últimos días es el estado natural que precede a la muerte. Se debe al fracaso de los órganos principales del cuerpo a causa del avance de la enfermedad y es irreversible.
La duración de este proceso es variable: puede resolverse en horas o alargarse varios días. Se reconoce a través de un deterioro muy importante del estado general, que se manifiesta en una gran debilidad muscular, encamamiento, pérdida de la capacidad para comer y beber, cambios en las funciones corporales, somnolencia profunda y, en ocasiones, agitación.
En este momento, la atención tanto de los profesionales como de las personas cuidadoras debe centrarse en mantener el máximo confort físico, emocional y espiritual, así como en proporcionar cuidados básicos al ser querido, respondiendo a sus deseos, tranquilizando sus temores y administrando solo los fármacos imprescindibles.
Consulte a los profesionales todas las dudas que tenga.
Qué puede hacer para reconfortar a su ser querido en sus últimos días
Cuidar el ambiente
- Procure una ubicación cómoda y tranquila, con luz tenue y sin ruidos.
- Limite las visitas, evitando aquellas que resulten innecesarias o que puedan alterar y molestar.
- Cree un clima de afecto, serenidad y gratitud que facilite la despedida.
Favorecer una buena postura
- Si es posible, debe mantener a la persona en posición cómoda, preferentemente de lado.
- Procure moverla lo menos posible, buscando siempre su confort.
Adaptar la higiene
- Evite las molestias que pueda suponer un ajetreo excesivo, dando prioridad al aseo superficial en la cama.
- Mantenga la boca de la persona limpia e hidratada para evitar incomodidades.
Mimar la comunicación
- Háblele con serenidad, usando frases cortas y sencillas, tratando de que su familiar o amigo/a se sienta escuchado y querido. Saber escuchar es una parte fundamental de la comunicación en este momento.
- Si expresa angustia, temor o tristeza, es importante aceptar estas emociones sin negarlas ni minimizarlas, transmitiéndole que en todo momento va a estar cuidado/a y acompañado/a.
- Si le resulta difícil encontrar palabras para responderle, cójale de la mano y corresponda a sus emociones desde la comunicación no verbal. De esta manera se sentirá acompañado/a en su dolor.
- La persona enferma puede oír y sentir la mano de quienes le acompañan hasta el último momento, dado que los sentidos del tacto y el oído se conservan hasta el fin de la vida. Si bien puede llegar un momento en que parezca desconectada del entorno y probablemente no pueda percibir lo que ocurre a su alrededor como antes, escuchar la voz de sus personas más cercanas y sentir su contacto físico le trasmitirá tranquilidad y seguridad.
- Las expresiones de dolor y tristeza son normales, pero evite aquellas que puedan provocarle intranquilidad y priorice las que, según su criterio y el conocimiento que tiene de la persona, contribuyan a la serenidad y la aceptación.
Favorecer la espiritualidad
- Aunque no lo expresen, muchas personas son capaces de intuir que su final está cerca. En este momento pueden surgir pensamientos trascendentales o preguntas que no tienen respuesta. Facilite a su ser querido hablar, despedirse, expresar sentimientos (amor, perdón, tristeza, felicidad), hacer un repaso de lo que ha sido su vida, buscar sentido, etc.
- En caso de que le transmita el deseo de dejar un legado a sus seres queridos, ayúdele a hacerlo como él o ella elija: a través de gestos, conversaciones, regalos, instrucciones finales, etc. Comprenda que es su forma de trascender en los demás cuando ya no esté. Aunque no lo expresen, muchas personas son capaces de intuir que su final está cerca. En este momento pueden surgir pensamientos trascendentales o preguntas que no tienen respuesta. Facilite a su ser querido hablar, despedirse, expresar sentimientos (amor, perdón, tristeza, felicidad), hacer un repaso de lo que ha sido su vida, buscar sentido, etc.
- Facilite las prácticas rituales según las creencias de su ser querido.
Respetar sus decisiones
- Respete sus deseos y preferencias, entendiendo que las personas tienen derecho a tomar sus propias decisiones hasta el final (tratamientos que desea o que rechaza, lugar de atención y fallecimiento, etc.).
- En caso de que la persona ya no sea capaz de tomar decisiones, puede hacerlo quien haya sido designado por él o ella de forma expresa mediante un documento de voluntades anticipadas o instrucciones previas, durante el proceso de planificación compartida con el equipo sanitario, etc.
- Si su ser querido no ha expresado sus preferencias sobre el lugar de fallecimiento, considere la importancia de valorarlo cuanto antes. En caso de que las condiciones lo permitan, él o ella lo desee y la familia sea capaz de afrontar la situación con apoyo de profesionales sanitarios, fallecer en el domicilio ha de contemplarse como una posibilidad.
Incluir a los más pequeños
- Si hay niños y niñas en casa, facilíteles que expresen sus emociones, sentimientos, miedos y preocupaciones. Los menores ven lo que pasa y sufren a su manera este proceso.
- Permítales estar presentes en la medida en que ellos quieran.
- Hábleles con tranquilidad sobre la situación, adaptando el lenguaje a su comprensión y evitando inventar historias inverosímiles.
Cuidar de uno/a mismo/a
- Sea consciente de que esta situación puede ser muy estresante y agotadora, tanto física como emocionalmente, y de que si usted no se cuida difícilmente va a poder cuidar bien de otra persona. Busque ayuda en su entorno para compartir los cuidados y poder encontrar momentos de descanso.
- Apóyese en el equipo sanitario, que conoce bien la situación por la que está pasando. Consúltele cualquier duda o acuda a sus profesionales simplemente para desahogarse. Tenga en cuenta que puede ser de gran ayuda hablar con un psicólogo o psicóloga.
- Acepte la situación sin autoimponerse nada. Algunas personas aseguran que haber cuidado y acompañado a alguien a lo largo de una enfermedad avanzada o en su proceso de final de vida ha sido una experiencia que a la larga resultó positiva, reconfortante y satisfactoria. Sin embargo, no tiene por qué ocurrir de esta manera.
Cómo actuar ante los síntomas y cambios físicos más frecuentes
En la etapa final de la vida toda persona necesita tranquilidad, confort y alivio ante los posibles sufrimientos derivados de la enfermedad. En esto consisten los cuidados paliativos.
En el aspecto físico, durante los últimos días de vida el cuerpo comienza un proceso en el que se van apagando todas sus funciones. Por lo general esto ocurre de forma paulatina, con cambios progresivos que no precisan de tratamientos ni intervenciones agresivas. Estos cambios son normales y naturales y lo mejor es proporcionar cuidados orientados al alivio, el confort y el bienestar.
En el terreno emocional, es importante asumir que nuestro ser querido comienza el proceso final de distanciamiento sobre su propio cuerpo y su entorno (trabajo, familia, amigos, etc.). Estar en paz con la propia historia de vida, haber resuelto asuntos pendientes y sentir que obtiene el “permiso” de las personas queridas para dejar este mundo son facilitadores de un buen final de vida.
Los síntomas y los cambios que a continuación se describen no ocurren todos al mismo tiempo ni tampoco necesariamente de forma consecutiva. En cada apartado se proponen una serie de cuidados que pueden ayudar. Consulte al personal sanitario para plantear cualquier duda o resolver cualquier situación no contemplada en los siguientes puntos.
Disminución o falta de apetito
Un tema que suele preocupar mucho a las familias es que la persona enferma deje de comer y/o beber. Culturalmente consideramos la comida como algo fundamental para el bienestar de nuestros seres queridos, pero debemos ser conscientes de que en la etapa final de la vida las necesidades de energía son mínimas o nulas.
Piense que no es una cuestión de fuerza de voluntad. La debilidad de su ser querido es consecuencia de la enfermedad y no de dejar de comer o beber. En este momento su alimento principal ha de ser la tranquilidad y la compañía de sus seres queridos.
Forzarle a comer o beber solo conseguiría provocar incomodidad o incluso, cuando la persona se encuentra ya con bajo nivel de conciencia, llegar a ser peligroso, ya que podría atragantarse. La sensación de ahogo es muy desagradable y aumenta el sufrimiento.

Dolor
Hay enfermedades que pueden provocar dolor y es probable que en los últimos días aumenten las necesidades de analgesia. Además, la debilidad extrema puede hacer que la persona enferma sufra con cualquier movimiento, incluso con el roce en la piel.
Existen diferentes medicamentos para el alivio del dolor. Los analgésicos más potentes se llaman opioides. Entre ellos están la morfina, el fentanilo y la oxicodona, que se pueden administrar por vía oral o nasal, por vena, subcutáneos, en parches pegados a la piel, etc. Hay muchos prejuicios con respecto a los opioides, especialmente la morfina, pero son medicamentos muy útiles para el control del dolor y la sensación de falta de aire y no solo se utilizan al final de la vida, sino en otras muchas situaciones. Ante una enfermedad incurable lo más importante es evitar el sufrimiento y estos medicamentos pueden ayudar. En todo caso, tenga en cuenta que no aceleran ni frenan la evolución natural de la enfermedad, como tampoco adelantan ni retrasan el momento de la muerte.

Sensación de falta de aire (disnea)
En esta fase es frecuente que la persona sienta que le falta el aire, dificultad para respirar o sensación de ahogo, habitualmente acompañado de ansiedad y angustia. Esta sensación no siempre se asocia a niveles bajos de oxígeno.
 Náusea y vómitos
Náusea y vómitos
A veces la persona enferma puede sentir náuseas o vomitar. Esto es desagradable tanto para él o ella como para su entorno. Además, existe el peligro de que se atragante con su propio vómito.

Cambios en el ritmo respiratorio
En los últimos días, la forma de respirar puede volverse irregular, con periodos sin respiración durante bastantes segundos, seguidos de otros en los que se produce una respiración rápida. También es posible que aparezcan otros fenómenos como el hipo.

Desorientación e inquietud
La persona puede parecer confundida sobre la hora, el lugar o incluso sobre quiénes son los miembros de su familia, sobre todo a partir del atardecer. En ocasiones aparecen alucinaciones, desorientación y agitación. Las causas pueden ser múltiples: desde estreñimiento, retención de la orina o infecciones hasta alteraciones de la sangre o como efecto de los fármacos. A esto contribuye también el mal funcionamiento de los órganos (riñones, hígado, cerebro).

Ruidos y secreciones respiratorias (estertores)
En las fases más próximas a la muerte, la persona podría producir sonidos de gorgoteo o murmullo al respirar, como si tuviera burbujas de líquido en el pecho o la garganta. Estos ruidos no significan que tenga más dolor o sufra más y, aunque pueden ser molestos para las personas acompañantes, no lo so querido, que tiene su conciencia disminuida.
 Somnolencia
Somnolencia
Es normal que su ser querido se encuentre más callado que de costumbre y con poco interés por lo que le rodea. También que pase gran parte del tiempo durmiendo, mucho más de lo habitual, hasta el punto de que llegue a ser difícil despertarle.

Cambios en la piel
Las manos, los pies, los brazos y las piernas suelen estar frías al tacto. Al mismo tiempo, hay cambios en el color de la piel, que se vuelve pálida y con manchas, a causa de que la sangre se concentra en los órganos vitales y se reduce su circulación por las extremidades.

Fiebre
En esta fase puede aparecer fiebre elevada (39-40 °C). Las causas más frecuentes son infecciones, alteraciones de las zonas del cerebro que regulan nuestra temperatura o bien sustancias que son liberadas por tumores en caso de pacientes oncológicos. A veces esta fiebre no responde a la medicación, que en todo caso ha de ser indicada por el equipo sanitario.

Incontinencia
Debido a la relajación de los músculos, en los momentos finales la persona puede perder el control de la expulsión de orina y heces.

Reducción de la orina
La cantidad de orina disminuirá en volumen y tomará un color cada vez más oscuro, debido a que cada vez estará más concentrada. Esto se debe a la reducción en el consumo de líquidos y a que los riñones funcionan cada vez menos.

Estreñimiento
Los analgésicos, la inmovilidad y la escasa ingesta de líquidos suelen provocar estreñimiento en el final de la vida.

Qué hacer en caso de emergencia
Cuando el final de la vida está cerca se pueden dar situaciones que generen mucho sufrimiento en la persona enferma y mucho estrés en las personas cercanas. Los profesionales sanitarios que atienden a su ser querido en el domicilio le darán recomendaciones sobre cómo actuar en distintas situaciones, pero ante cualquier imprevisto o en una situación en la que no sepa cómo actuar puede hacer lo siguiente:

En todo caso, cuando tenga dudas sobre si una situación es o no una emergencia, trate de guardar la calma para poder identificar las señales. Cuando se acercan las últimas horas de vida de una persona, su aspecto y sus manifestaciones físicas pueden ser impactantes para los demás, especialmente si no tienen experiencias previas de ver morir a alguien.
La palidez, la delgadez, la apariencia de falta de vida y los ruidos respiratorios no son agradables, pero lo más importante es que no le generan sufrimiento. Aunque en principio puedan provocarnos angustia a quienes le rodeamos, no representan una emergencia.
Intente superar el impacto de lo que ve y procure ver a su ser querido como una persona que experimenta con tranquilidad un momento único y especial: la despedida de la vida. Concéntrese en acompañarle y transmitirle serenidad, paz y gratitud.
Qué ocurre con la medicación
En esta fase final de la vida, el tratamiento farmacológico que recibe su ser querido se centra en su bienestar y en el control de sus síntomas. Esto significa que se suspenderán aquellos tratamientos que no aporten beneficio a la situación actual del paciente (por ejemplo, el protector gástrico o tratamientos para controlar la tensión arterial y reducir el colesterol o el riesgo de fracturas). En definitiva, se busca simplificar al máximo tanto los medicamentos como la forma de administrarlos, buscando siempre el mayor confort del paciente.
En los últimos días, el equipo asistencial está más presente y disponible. Realiza una valoración continua, ajustando el tratamiento según las necesidades para asegurar un buen control de síntomas. La persona enferma y la familia podrán participar activamente en la toma de decisiones con base en sus preferencias, incluyendo el derecho a rechazar la opción terapéutica que se plantee. De esta manera, antes de iniciar un nuevo tratamiento, el médico o médica les informará acerca de sus posibles beneficios y efectos secundarios para que puedan valorarlo y decidir. Para algunas personas no son aceptables, por ejemplo, la somnolencia o las náuseas provocadas por algunas medicaciones que se usan para controlar el dolor.
La forma elegida para administrar el tratamiento será la que resulte menos molesta para el paciente (generalmente oral o subcutánea, es decir, mediante una palomita insertada en la piel).
Resulta de gran utilidad tener instrucciones claras y por escrito sobre la medicación, que incluyan pautas fijas y otras específicas para momentos de crisis. Asegúrese de que su equipo sanitario se las proporciona. En caso de dudas, si los síntomas no mejoran o hay efectos secundarios indeseables, consulte a los profesionales (ver apartado Qué hacer en caso de emergencia).
Qué es la sedación paliativa
La sedación paliativa consiste en administrar fármacos que disminuyen el nivel de conciencia de una persona en estado terminal para aliviar el sufrimiento físico o psíquico que no ha podido controlarse de ninguna otra manera. Puede ser puntual (para aliviar un momento concreto de sufrimiento) o continua. Además, puede tener carácter superficial o profundo.
Se trata de un procedimiento médico aceptado ética y jurídicamente. Requiere del consentimiento de la persona enferma o de su representante, si esta no se encuentra en condiciones de tomar una decisión.
En la sedación paliativa los fármacos se van ajustando a la respuesta del paciente y a sus necesidades, buscando el alivio de su sufrimiento y bajo el acuerdo entre el equipo asistencial y la persona afectada o su familia. A lo largo de este proceso el nivel de conciencia irá disminuyendo, pudiendo llegar a pasar todo el día dormido/a. Aunque la persona parezca completamente desconectada del entorno, escuchar la voz de sus familiares y amigos y sentir su contacto físico le trasmitirá tranquilidad y seguridad.
La sedación, la eutanasia y el suicidio asistido son cosas distintas. El objetivo de la sedación paliativa no es provocar la muerte, sino únicamente disminuir la conciencia con el objetivo de reducir el sufrimiento que no ha podido ser aliviado con otras medidas.
La eutanasia consiste en la administración de una medicación a dosis letales para provocar la muerte inmediata del paciente, a petición de este y en un contexto sanitario. No se trata de un proceso, como ocurre con la terapia de sedación, sino que las dosis administradas garantizan una muerte rápida.
Al igual que la eutanasia, el suicidio asistido busca provocar la muerte para liberar del sufrimiento a través de la administración de fármacos en dosis letales que garanticen un final rápido. En el suicidio asistido es el propio paciente el que se administra el fármaco.
Qué puede hacer cuando llega la muerte
Aunque crea estar preparado para el momento de la muerte, si no ha tenido experiencias previas puede que le resulte difícil saber cuándo se aproxima. Conviene que pregunte al equipo sanitario si tiene alguna duda, pero lo primero es asumir que la muerte es algo normal y natural. De hecho, si aceptamos el final y tomamos conciencia de su trascendencia, puede ser un momento de paz y serenidad.
Incluso en los últimos segundos de vida puede acompañar a su ser querido dándole la mano, acariciándolo y transmitiéndole tranquilidad (“vamos a estar bien”, “ve tranquila”, “gracias por ser tan buen padre”, etc.).
Con frecuencia, las familias prefieren permanecer al lado de la persona enferma el mayor tiempo posible, esperando poder estar allí en el momento en que se produce la muerte. Sin embargo, a veces la persona fallece justo en el momento en que nos hemos ausentado, aunque sea por unos minutos. Esto pasa muy a menudo y es importante que no nos sintamos culpables por ello.
En algunos casos, también ocurre que queremos que todo se acabe cuanto antes. Esto no significa que se desee la muerte de nuestro familiar o amigo. Es un pensamiento normal, ya que forma parte de la esencia humana buscar el alivio del sufrimiento del otro y el de uno mismo.
Las señales de que la muerte se ha producido son falta de espiración y de pulso, ausencia de respuesta a los estímulos (al tacto o al sonido), ojos entreabiertos sin parpadear, pupilas dilatadas, boca entreabierta y cambio de coloración.
Los primeros momentos tras la muerte
Tómese su tiempo para despedirse de su ser querido antes de llamar a los servicios sanitarios y funerarios. Si lo desea, pase unos minutos a solas con la persona fallecida.
Este momento puede generar nerviosismo, pero intente mantener la calma y avisar a algún familiar o amigo. Mientras se despide, estas otras personas pueden ocuparse de llamar al médico, que tendrá que certificar el fallecimiento, y también a la funeraria. Tenga a mano el DNI del fallecido, ya que se lo van a pedir, y algún informe médico reciente.
Información relativa a trámites
Los trámites se desarrollan de forma diferente dependiendo del lugar en el que se haya producido el fallecimiento:

Es de gran ayuda saber con antelación si la persona fallecida tenía contratada una funeraria o un seguro de decesos. En caso de no disponer de ninguna de estas opciones, sería conveniente consultar en las funerarias o tanatorios de la zona, incluso antes del fallecimiento, para hacer los preparativos oportunos.
Cuando se sienta preparado/a, deberá iniciar los trámites posteriores, como los relativos a los certificados de últimas voluntades, el certificado de seguros con cobertura de fallecimiento, prestaciones económicas y pensiones de viudedad y orfandad, cambios de titularidad de vivienda, contratos de luz y gas, etc. Tenga en cuenta que para cualquiera de estos trámites necesitará el DNI de la persona fallecida y el certificado de defunción.
El proceso de duelo
El duelo es el proceso que experimentamos cuando perdemos a alguien importante para nosotros. Durante este proceso aprendemos a vivir sin la persona fallecida.
Se trata de una etapa normal y necesaria, de duración variable. En ella aparecen sentimientos, pensamientos y comportamientos naturales como tristeza, enfado, culpa, autorreproche, ansiedad, soledad, fatiga, incredulidad, confusión, sensación de presencia de la persona fallecida, trastornos del sueño y de la alimentación, problemas de concentración, aislamiento y llanto. También pueden aparecer síntomas físicos como opresión en el pecho y dolores musculares o de cabeza.
Hay personas a las que les cuesta más adaptarse a la pérdida. Si cree que este puede ser su caso no dude en consultar con su equipo de salud. En principio el duelo no precisa de medicamentos, pero si se complica puede ser necesaria atención especializada.
Si hay menores que hayan sufrido la pérdida de cerca es bueno que les deje expresar sus sentimientos, hablando de la persona fallecida con naturalidad y permitiéndoles participar en los ritos funerarios si lo desean. Si tiene cualquier duda sobre este tema consúltelo también con los profesionales.
Clicando en los siguientes links tendrá acceso a más información sobre el proceso de duelo:
Cómo comunicarse con otras personas a medida que se aproxima el final de la vida.
https://www.cancer.org/es/tratamiento/atencion-en-la-etapa-final-de-lavida/cuando-el-final-de-la-vida-esta-cerca/comunicacion.html
Explícame qué ha pasado. Guía para ayudar a los adultos a hablar de la muerte y el duelo con los niños.
http://www.codajic.org/sites/www.codajic.org/files/Explicame%20que%20ha%20pasado.%20Gu%C3%ADa%20para%20adultos%
20para%20trabajar%20duelo%20en%20ni%C3%B1os%20-%20FMLC.pdf
Pérdida de un ser querido.
https://www.aecc.es/es/todo-sobre-cancer/viviendo-con-cancer/final-vida/perdida-ser-querido
Hay niños delante. Cáncer en la familia: cómo informar a tus hijos.
www.chospab.es/cursos_jornadas/2018/hay_ninos_delante/ninos_delante.pdf
Modelo IDA para la intervención en duelo infantil.
https://dialnet.unirioja.es/descarga/articulo/6114011.pdf
Fuentes consultadas y de interés
Care of dying adults in the last days of life. Information for the public. NICE; 2016.
https://www.nice.org.uk/guidance/ng31/ifp/chapter/About-this-information
Recomendaciones para el acompañamiento en los últimos días. Govern de les Illes Balears; 2015.
https://www.universidadpopular.es/images/PDFs/Acompanamiento-ultimos-dias-Versio-final.pdf
Guía de orientación a la familia y personas cuidadoras de últimos días. Dirección Territorial de Ceuta; 2017.
http://www.carehome.com.ar/uploads/Guia_Cuidadoras.pdf
Pacientes al final de su vida. Guía informativa y de divulgación para familias y personas cuidadoras. Gobierno de Cantabria; 2009.
https://saludcantabria.es/uploads/pdf/ciudadania/cp_cantabria-pacientes.pdf
Guía práctica para a familia en coidados paliativos. Sociedade Galega de Coidados Paliativos.
Guía sobre o dó. Sociedade Galega de Coidados Paliativos; 2005.
At the End. Australian Department of Health; 2020.
https://www.caresearch.com.au/caresearch/tabid/1073/Default.aspx
Guía Secpal para familiares en duelo.
http://ico.gencat.cat/web/.content/minisite/ico/professionals/documents/qualy/arxius/doc_guia_para_familiares_en_duelo.pdf
Guía SECPAL de acompañamiento espiritual.
http://www.secpal.com/%5CDocumentos%5CBlog%5Carchivo_7.pdf
Neimeyer RA. Aprender de la pérdida. Barcelona: Paidós; 2002.
Worden W. El tratamiento del duelo. Barcelona: Paidos Ibérica; 2013.
Metodología
La metodología empleada para elaborar la GPC, se recoge en el documento “Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico” (215).
Constitución del grupo de trabajo
Se constituyó un grupo de trabajo multidisciplinar, formado por profesionales de perfil clínico y metodológico. Además, se contó con colaboradores expertos y con un amplio grupo de revisores externos propuestos por distintas asociaciones de pacientes, sociedades científicas y por el propio grupo de trabajo.
Los distintos participantes se relacionan en el apartado de autoría y colaboraciones:
- Coordinación: llevada a cabo por tres miembros del grupo de trabajo, dos de perfil clínico y uno metodológico.
- Grupo de trabajo: formado por 3 técnicos (metodólogos con experiencia en la elaboración y actualización de guías), 2 familiares y 11 profesionales sanitarios de diferentes especialidades y niveles asistenciales con experiencia en CP y asistencia a personas en la fase final de la vida.
- Colaboración experta: 9 profesionales con conocimiento y experiencia en elaboración de GPC y/o expertos en CP.
- Grupo de revisión externa: formado por 22 profesionales propuestos por las diferentes sociedades científicas y asociaciones de pacientes directamente relacionadas con los CP.
- Exposición Pública: el borrador de la GPC fue revisado por organizaciones del ámbito de la salud que no participaron en la revisión externa, registradas previamente e interesadas en hacer aportaciones al mismo. En el caso de esta GPC han participado 7 organizaciones cuyas aportaciones y comentarios están disponibles para su consulta en el siguiente documento: https://portal.guiasalud.es/wp-content/uploads/2022/08/gpc_612_sud_exposicion_publica.pdf
- Documentación y difusión: participaron 2 documentalistas y 2 administrativas.
Revisión de la GPC de base y decisión sobre la actualización
Esta GPC es una actualización parcial de la GPC sobre paliativos del SNS (20). El proceso para la revisión de la GPC base y la decisión sobre la actualización fue:
- Se realizó una búsqueda de la literatura sobre evidencia secundaria (revisiones sistemáticas y GPC) relacionada con los temas incluidos en la guía de paliativos a actualizar.
- Se realizó un análisis del impacto de la evidencia en las recomendaciones.
- Se priorizaron las preguntas clínicas susceptibles de ser actualizadas en base a lo anterior y los aspectos clínicos.
- Se consensuó actualizar la atención en los últimos días y sedación paliativa.
Para la atención en los últimos días se identificó una GPC elaborada por el NICE (22) que abordaba las áreas clínicas más relevantes y cumplía el criterio metodológico para valorar su adaptación (puntuación superior al 80 % en el «dominio 3: rigor en la elaboración» del instrumento AGREE-II (216)), y por lo tanto se decidió proceder a su adaptación siguiendo el método GRADE-ADOLOPMENT (217).
Para la sedación paliativa también se identificó una revisión Cochrane (174) de alta calidad según la herramienta (AMSTAR-II (218)) por lo que también se procedió a su actualización.
Preguntas clínicas y variables de resultado
Se empleó un proceso de revisión y priorización formal (a través de discusiones presenciales) de las preguntas clínicas y variables de resultado tanto de la GPC del NICE como de la revisión Cochrane identificadas.
Búsquedas bibliográficas y criterios de selección
Se actualizaron las búsquedas bibliográficas empleando las mismas estrategias de búsqueda que la guía del NICE (22) y la revisión Cochrane (174) seleccionada para la pregunta clínica de sedación paliativa. Las búsquedas se realizaron en las bases de datos Medline, Embase, Cochrane y PsycInfo y se activaron alertas que estuvieron activas hasta la edición de la GPC (junio 2021).
Se emplearon los mismos criterios de selección y se siguió una metodología de revisión sistemática estándar que incluyó un análisis duplicado e independiente para la selección de títulos y resúmenes, la selección del texto completo y la extracción de datos. En caso de desacuerdo entre los revisores se implicó a un tercer revisor.
Evaluación de la calidad de la evidencia
La evaluación de la calidad de la evidencia se desarrolló según el método “Grading of Recommendations Assessment, Development and Evaluation” (GRADE) (219) y GRADE- CERQual (220) para los estudios cualitativos.
Para la evaluación del riesgo de sesgo de los estudios se siguieron los criterios empleados en la GPC del NICE (fundamentalmente herramienta RoB para estudios de intervención, QUADAS para estudios de pruebas diagnósticas y herramienta CASPe para estudios cualitativos). Todas estas herramientas, así como los criterios para la evaluación de la calidad según GRADE y GRADE-CERQual, se describen en el manual metodológico (215).
Preparación de perfiles de evidencia y marcos de la Evidencia a la Recomendación
Para cada pregunta clínica se prepararon los perfiles de evidencia GRADE y los marcos de la evidencia a la recomendación.
- Perfiles de evidencia: proporcionan para cada una de las variables o resultados de interés un resumen de la evidencia y la calificación de la certeza de la evidencia (disponibles en el documento de material metodológico).
- Marcos de la evidencia a la recomendación: tienen como objetivo facilitar el proceso de toma de decisiones del GEG para pasar de la evidencia a la recomendación al resumir de manera estructurada y transparente la evidencia de los siguientes factores: magnitud de los efectos deseables y no deseables esperados, certeza global de la evidencia, variabilidad en cómo los pacientes valoran los desenlaces principales, balance entre los efectos deseables e indeseables esperados, magnitud de los recursos requeridos (costes), certeza en torno a los recursos requeridos, coste-efectividad de la intervención, impacto en la equidad en salud, aceptabilidad para los agentes implicados y factibilidad de la implementación. En el caso de las preguntas adaptadas de la GPC del NICE (22) se adaptaron sus marcos al contexto de la presente guía (SNS). En el caso de la pregunta sobre sedación paliativa se desarrollaron recomendaciones basadas en marcos EtD de novo, originalmente elaborados para esta guía.
Elaboración de las recomendaciones
Para cada pregunta clínica, el GEG revisó los perfiles de evidencia y proporcionó información de interés antes de las reuniones presenciales. Durante las reuniones se emplearon los marcos Evidence to Recommendations (EtR) de GRADE para ayudar al grupo de trabajo a emitir las recomendaciones finales.
Con el proceso de GRADE-ADOLOPMENT se llegó a tres posibles resultados:
- Adopción de la recomendación, es decir, el uso de la recomendación original;
- Adaptación de la recomendación, es decir, la modificación de la recomendación original;
- Desarrollo de novo de la recomendación, es decir, la creación de una nueva recomendación.
Cada recomendación fue etiquetada según su origen como adoptada, adaptada o nueva, y según el método GRADE como fuertes o débiles (a favor/en contra). El GEG también ha emitido recomendaciones de Buena Práctica Clínica (BPC) y consideraciones clínicas relevantes para la implementación de las recomendaciones.
Los niveles de evidencia y la fuerza de las recomendaciones, se pueden consultar en el siguiente documento: https://portal.guiasalud.es/wp-content/uploads/2022/09/gpc_612_sud_avaliat_evidencia.pdf.
El material metodológico de la GPC está disponible en el siguiente documento: https://portal.guiasalud.es/wp-content/uploads/2021/09/gpc_612_atencion_paliativa_avaliat_mat_met.pdf
Revisión externa
En la revisión de la guía participaron profesionales expertos a propuesta de las diferentes sociedades científicas y asociaciones de pacientes involucradas en el tema objeto de la guía, así como otros considerados relevantes desde el punto de vista clínico por el propio grupo de actualización de la GPC.
Exposición pública
En la exposición pública participaron organizaciones del ámbito de la salud que no participaron en la revisión externa, registradas previamente e interesadas en hacer aportaciones al mismo. El informe sobre la Exposición Pública está disponible en la URL: https://portal.guiasalud.es/wp-content/uploads/2022/03/gpc_612_atencion_paliativa_avaliat_exposicion_publica.pdf
Declaración de intereses
Todos los miembros del grupo de trabajo de la GPC, así como los miembros del grupo de revisión externa firmaron una declaración de intereses. La gestión de los potenciales conflictos de interés se realizó de acuerdo al procedimiento planteado para las guías del Programa de GPC en el SNS.
Actualización
Está previsto actualizar la guía siguiendo un procedimiento de actualización continuada que consiste en la realización de búsquedas bibliográficas y evaluación de la nueva evidencia cada 6–12 meses.
La información sobre las actualizaciones está disponible en la URL: https://portal.guiasalud.es/guia-en-capas/gpc_612__atencion_paliativa_sud-2/#cptguidelayer-main8.
Material complementario
PREGUNTAS Y RECOMENDACIONES
Preguntas, recomendaciones y consideraciones clínicas relevantes
INVESTIGACIÓN FUTURA
Líneas de investigación futura
DIFUSIÓN E IMPLEMENTACIÓN
Difusión e implementación de la GPC
ANEXOS
Anexo 1. Material complementario al capítulo de comunicación
Anexo 2. Material complementario al capítulo de hidratación
Anexo 4. Material complementario al capítulo de manejo clínico de síntomas: dolor
Anexo 5. Material complementario al capítulo de manejo clínico de síntomas: disnea
Anexo 6. Material complementario al capítulo de manejo clínico de síntomas: náuseas y vómitos
Anexo 7. Material complementario al capítulo de manejo clínico de síntomas: ansiedad y delirium
Anexo 8. Material complementario al capítulo de manejo clínico de síntomas: estertores
Anexo 9. Uso de la vía subcutánea en cuidados paliativos
Anexo 10. Vademécum de fármacos utilizados en SUD
Anexo 11. Material complementario al capítulo de sedación paliativa
Anexo 12. Aspectos éticos, legales y deontológicos
Anexo 13. Abreviaturas
Anexo 14. Declaración de interés
Anexo 15. Información para familiares y allegados de personas en situación de últimos días
EXPOSICIÓN PÚBLICA
Informe de la Exposición pública de la GPC
Actualización
INFORME PRIMER CICLO DE ACTUALIZACIÓN (ABRIL 2023)
Informe primer ciclo de actualización (abril 2023), (pdf 175KB)
INFORME SEGUNDO, TERCER Y CUARTO CICLO DE ACTUALIZACIÓN (FEBRERO 2024)
Informe segundo, tercer y cuarto ciclo de actualización continuada (febrero 2024). (pdf 332KB)
INFORME QUINTO CICLO DE ACTUALIZACIÓN (JULIO 2024)
Informe quinto ciclo de actualización (julio 2024), (pdf 276KB)
INFORME SEXTO CICLO DE ACTUALIZACIÓN (FEBRERO 2025)
Informe sexto ciclo de actualización (febrero 2025), (pdf 209 KB)
PLAN DE ACTUALIZACIÓN
Está previsto actualizar la guía siguiendo un procedimiento de actualización continuada planteado para las guías del Programa de GPC en el SNS, que consiste en la realización de búsquedas bibliográficas y evaluación de la nueva evidencia cada 6–12 meses.
- Integrantes del Grupo de Actualización de la GPC: formarán parte del grupo de actualización continuada una documentalista, los coordinares clínicos y la coordinadora metodológica y tres integrantes más del grupo de trabajo.
- El GEG ha considerado que deben monitorizarse en el proceso de actualización continuada las siguientes preguntas clínicas:
- Para personas en los últimos días de vida, ¿qué fármacos son más efectivos para aliviar el dolor, la disnea, las náuseas y vómitos, la ansiedad y el delirium, y los estertores?
- En pacientes en situación de últimos días con sufrimiento por síntomas refractarios, ¿cuáles son los beneficios de la sedación paliativa en el alivio del sufrimiento y el control de síntomas refractarios?
- Listado de preguntas clínicas que no fueron priorizadas para ser monitorizadas:
- ¿Qué signos y síntomas se deben evaluar cuándo sospechamos que un paciente adulto con enfermedad crónica avanzada puede estar en situación de últimos días?
- ¿Cuáles son los factores asociados a una buena comunicación en los últimos días de vida entre el paciente, sus allegados y los profesionales sanitarios?
- ¿Cuáles son los factores que pueden favorecer la toma de decisiones compartida sobre el plan de cuidados individualizado para los últimos días de vida?
- ¿En pacientes en sus últimos días de vida, la hidratación artificial es efectiva para mejorar los síntomas y el confort general?
- Fuentes de información que se consultarán: se activarán alertas en Medline.
- Cronograma de ejecución de las búsquedas y evaluación del impacto de la nueva evidencia: se realizará el primer ciclo de actualización transcurridos doce meses desde la fecha de cierre de las búsquedas de la GPC y los siguientes ciclos de actualización con una periodicidad de seis meses, tal y como se contempla en la metodología de actualización continuada de las GPC del programa.
Las actualizaciones se realizarán en ésta versión electrónica de la guía.
Autores
Grupo de trabajo de la GPC (por orden alfabético)
Alfonso Alonso Fachado. Médico especialista en Medicina Familiar y
Comunitaria. Subdirección Xeral de Ordenación Asistencial. Dirección
Xeral de Asistencia Sanitaria. Consellería de Sanidade de Galicia.
Luisa Andaluz Corujo. Trabajadora social. Complexo
Hospitalario Universitario de A Coruña.
Rocío Basanta Matos. Psicóloga especialista en Psicología
Clínica. Hospital Universitario Lucus Augusti.
Francisco Barón Duarte. Médico especialista en Oncología.
Complexo Hospitalario Universitario de A Coruña.
Rosendo Bugarín González. Médico especialista en Medicina Familiar
y Comunitaria. Centro de salud de Monforte de Lemos.
Catalina Caamaño Isorna. Farmacéutica de Atención Primaria.
Centro de Salud de Burela.
Paula Cantero Muñoz. Técnica. Farmacéutica. Unidad de Asesoramiento
Científico-técnico, Avalia-t. Agencia de Conocimiento en Salud (ACIS).
José Álvaro Fernández Rial. Médico especialista en Medicina Interna.
Hospital Universitario Lucus Augusti.
Arantza García Martínez. Médica especialista en Medicina Familiar y
Comunitaria. Servicio de Hospitalización a Domicilio (HADO) y Unidad
de Cuidados Paliativos. Hospital Universitario Lucus Augusti.
Pablo López Pais. Médico especialista en Anestesia y Reanimación.
Complexo Hospitalario Universitario de Santiago de Compostela.
Ángel López Triguero. Enfermero del Servicio de Hospitalización a Domicilio
y Cuidados Paliativos. Hospital do Salnés. Vilagarcía de Arousa.
Sabela Maceda García. Psicóloga especialista en Psicología Clínica.
Salud Mental. Complexo Hospitalario Universitario A Coruña.
María del Carmen Maceira Rozas. Técnica. Farmacéutica. Unidad de Asesoramiento
Científico-técnico, Avalia-t. Agencia de Conocimiento en Salud (ACIS).
Marcelino Mosquera Pena. Médico especialista en Geriatría. Unidad de
Cuidados Paliativos. Complejo Hospitalario Universitario de Ferrol.
Begoña Palacio Verdini. Familiar.
Yolanda Triñanes Pego. Técnica. Psicóloga. Unidad de Asesoramiento Científico-
técnico, Avalia-t. Agencia de Conocimiento en Salud (ACIS). Santiago de Compostela.
Marta Vega Lorenzo. Familiar.
Coordinación
Rosendo Bugarín González. Médico especialista en Medicina Familiar y
Comunitaria. Centro de Salud de Monforte de Lemos. Coordinación clínica.
José Álvaro Fernández Rial. Médico especialista en Medicina Interna.
Hospital Universitario Lucus Augusti. Coordinación clínica.
Yolanda Triñanes Pego. Técnica. Psicóloga. Unidad de Asesoramiento Científico-técnico,
Avalia-t. Agencia de Conocimiento en Salud (ACIS). Coordinación metodológica.
Colaboración
Beatriz Casal Acción. Documentalista. Unidad de Asesoramiento Científico-técnico,
Avalia-t. Agencia de Conocimiento en Salud (ACIS).
Teresa Mejuto Martí. Documentalista. Unidad de Asesoramiento Científico-técnico,
Avalia-t. Agencia de Conocimiento en Salud (ACIS).
Noemí Raña Villar. Administrativa. Unidad de Asesoramiento Científico-técnico,
Avalia-t. Agencia de Conocimiento en Salud (ACIS).
Cristina Rey Varela. Administrativa. Unidad de Asesoramiento Científico-técnico,
Avalia-t. Agencia de Conocimiento en Salud (ACIS).
Colaboración experta
Eduardo Bruera. MD Anderson Cancer Center de Houston.
Ingrid Bullich Marín. Enfermera especialista en Enfermería Geriátrica.
Coordinadora científica de la Estrategia en Cuidados Paliativos
del Sistema Nacional de Salud. Grup Mutuam. Barcelona.
Itziar Etxeandia Ikobaltzeta. Doctora en Farmacia. Investigadora Independiente-
freelance en elaboración de GPC y revisiones sistemáticas, asociada a la
American College of Physicians (ACP), entre otras instituciones.
Manuel Mejías Estévez. Médico especialista en Medicina Familiar y Comunitaria.
Sociedad Española de Médicos de Atención Primaria (SEMERGEN) Andalucía.
Alberto Meléndez Gracia. Médico especialista en Medicina Familiar y Comunitaria.
Vicepresidente de la Sociedad Española de Cuidados Paliativos (SECPAL).
Celia Muñoz Fernández. Economista de la Salud.
Instituto Aragonés de Ciencias de la Salud.
Sonia Peláez Moya. Subdirección General de Promoción, Prevención y
Calidad. Dirección General de Salud Pública. Ministerio de Sanidad.
Rafael Rotaeche del Campo. Médico especialista en Medicina Familiar y Comunitaria.
Centro de Salud de Alza (San Sebastián). Coordinador metodológico de la GPC base.
Antonio Sacristán Rodea. Médico especialista en Oncología. Centro de
Salud Jazmín. Dirección Asistencial Este. Atención Primaria. Madrid.
Revisión externa
Enrique Álvarez Porta. Médico especialista en Medicina Familiar y Comunitaria.
Unidad de Cuidados Paliativos, Hospital Joan March. Mallorca.
Francisco Eugenio Apolo Carvajal. Farmacéutico especialista en Farmacia Hospitalaria.
Subdirección General de Farmacia y Productos Sanitarios. Servicio Madrileño de
Salud (SERMAS). Farmacéutico de Atención a Centros Sociosanitarios. Madrid.
Jacinto Bátiz Cantera. Doctor en Medicina y Cirugía. Hospital San
Juan de Dios de Santurtzi. Director del Instituto de Sensibilización,
Formación, Investigación e Innovación para cuidar mejor. Bizkaia.
Rosario Baydal Carmona. Coordinadora de la Unidad de Hospitalización
a Domicilio (HADO). Hospital de Denia. Alicante.
Marisa de la Rica Escuín. Enfermera. Instituto de Investigación
Sanitaria de Aragón. Enfermera de Investigación. Zaragoza.
Ramón de las Peñas Bataller. Coordinador de la Sección de Cuidados
Continuos de la Sociedad Española de Oncología Médica (SEOM).
Leyre Díez Porres. Médica especialista en Medicina Interna. Unidad
de Cuidados Paliativos. Hospital Universitario La Paz. Madrid.
María Elviro Lloréns. Farmacéutica especialista en Farmacia Hospitalaria. Doctora en
Farmacia. Coordinadora Nacional del Grupo de Trabajo de Dolor de la SEFH. Jefa del
Servicio de Farmacia de la Fundación Vianorte Laguna, Cuidados Paliativos. Madrid.
Ángel Estella García. Médico especialista en Medicina Intensiva.
Hospital Universitario de Jerez de la Frontera.
Carlos José Ferrer Albiach. Médico especialista en Oncología Radioterápica.
Consorcio Hospitalario provincial de Castellón. Instituto Oncológico de Castellón.
Inés González Bolaños. Médica especialista en Medicina Familiar y
Comunitaria. Unidad de Cuidados Paliativos, Complejo Hospitalario
Universitario Insular Materno Infantil. Las Palmas
César González-Blanch Bosch. Facultativo Especialista de Área (FEA) en
Psicología Clínica. Hospital Universitario Marqués de Valdecilla. Santander.
Natalia López-Casero Beltrán. Diplomada Universitaria de
Enfermería. Unidad de Cuidados Paliativos Domiciliaria. Hospital
Mancha Centro de Alcázar de San Juan. Ciudad Real.
Nieves Martín López. Psicóloga InfoCancer. Asociación
Española Contra el Cáncer (AECC). Madrid.
Víctor Mayoral Rojals. Médico especialista en Anestesiología y Reanimación.
Hospital Universitario de Bellvitge; Instituto Catalán de Oncología. Barcelona.
Manuel José Mejías Estévez. Médico especialista en Medicina Familiar
y Comunitaria. Centro de Salud Ronda Histórica. Sevilla.
Pedro Pérez Segura. Miembro del Comité Ejecutivo de la Sección de Cuidados
Continuos de la Sociedad Española de Oncología Médica (SEOM).
Susana Plaza Canteli. Medica especialista en Medicina Interna. Unidad de
Cuidados Paliativos. Hospital Universitario Severo Ochoa. Madrid.
Amador Priede Díaz. Psicólogo especialista en Psicología
Clínica Hospital de Laredo. Santander.
Paloma Romero Martín. Psicóloga InfoCancer. Asociación
Española Contra el Cáncer (AECC). Madrid.
Olga Rubio Sanchiz. Médico especialista en Cuidados Intensivos.
Althaia Xarxa Universitaria Hospitalaria de Manresa. Barcelona.
Ana María Tordable Ramírez. Enfermera de apoyo técnico Gerencia Asistencial
de Atención Primaria del Servicio Madrileño de Salud. Vocal de Enfermería
de la Sociedad Española de Cuidados Paliativos (SECPAL). Madrid.
Agradecimientos
A María José Faraldo Vallés, de la Unidad de Asesoramiento Científico-técnico, Avalia-t
de la Agencia de Conocimiento en Salud (ACIS), por su labor de dirección y gestión.
A Patricia Gavín Benavent y María Bono Vega de GuíaSalud, y al
Centro Cochrane Iberoamericano por el apoyo metodológico.
Sociedades Colaboradoras
Miembros de estas sociedades han participado en la autoría,
colaboración experta y revisión externa de la GPC
Sociedad Española de Cuidados Paliativos (SECPAL)
Sociedad Española de Farmacéuticos de Atención Primaria (SEFAP)
Sociedad Española del Dolor (SED)
Sociedad Española de Hospitalización a Domicilio (SEHAD)
Sociedad Española de Medicina de Familia y Comunitaria (SEMFYC)
Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC)
Sociedad Española de Medicina Interna (SEMI)
Sociedad Española de Oncología Médica (SEOM)
Sociedad Española de Médicos Generales y de Familia (SEMG)
Sociedad Española de Médicos de Atención Primaria (SEMERGEN)
Sociedad Española de Oncología Radioterápica (SEOR)
Sociedad Española de Farmacia Hospitalaria (SEFH)
Asociación de Enfermería Comunitaria (AEC)
Asociación Nacional de Psicólogos Clínicos y Residentes de Psicología (ANPIR)
Asociación Española de Enfermería en Cuidados Paliativos (AECPAL)
Asociación Española Contra el Cáncer (AECC) (sección cuidados paliativos)
Exposición Pública
Esta GPC ha sido sometida a un proceso de Exposición Pública. El listado completo de los grupos de interés que han participado en el proceso de exposición pública está disponible en la siguiente URL: https://portal.guiasalud.es/wp-content/uploads/2022/08/gpc_612_sud_exposicion_publica.pdf
Declaración de interés: todos los miembros del Grupo de Trabajo, así como las personas que han participado en la colaboración experta y en la revisión externa, han realizado la declaración de interés que se presenta en el anexo 14.
Bibliografía
- McNamara B, Rosenwax LK, Holman CD. A method for defining and estimating the palliative care population. J Pain Symptom Manage. 2006;32(1):5-12. DOI: 10.1016/j. jpainsymman.2005.12.018.
- Ministerio de Sanidad Servicio Sociales e Igualdad. Estrategia para el abordaje de la cronicidad del Sistema Nacional de Salud [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2012 [consultado 23 sep 2020]. Disponible en: https://www.mscbs.gob.es
- Haun MW, Estel S, Rücker G, Friederich HC, Villalobos M, Thomas M, et al. Early palliative care for adults with advanced cancer. Cochrane Database Syst Rev. 2017;6(6):Cd011129. DOI: 10.1002/14651858.CD011129.pub2.
- Meléndez A, Limón E, Coords. Del «paliativo no oncológico» al «paciente crónico avanzado». Más allá de las palabras. El reto de los cuidados paliativos del siglo xxi. 2018. En: Cronicidad avanzada [Monografía en internet]. 2018. [consultado 24 may 2021]. Disponible en: http://secpal.com.
- Kelley AS, Morrison RS. Palliative Care for the Seriously Ill. N Engl J Med. 2015;373(8):747-55. DOI: 10.1056/NEJMra1404684.
- The goals of medicine. Setting new priorities. Hastings Cent Rep. 1996;26(6):S1-27.
- Bayés R. Morir en paz: evaluación de los factores implicados. Med Clin (Barc).2004;122(14):539-41. DOI: 10.1016/s0025-7753(04)74299-2.
- Bayés R, Limonero JT, Romero E, Arranz P. Qué puede ayudarnos a morir en paz? Med Clin (Barc). 2000;115(15):579-82. DOI: 10.1016/s0025-7753(00)71630-7.
- Emanuel EJ, Emanuel LL. The promise of a good death. Lancet. 1998;351 Suppl 2:Sii21-9. DOI: 1016/s0140-6736(98)90329-4.
- Meier EA, Gallegos JV, Thomas LP, Depp CA, Irwin SA, Jeste DV. Defining a Good Death (Successful Dying): Literature Review and a Call for Research and Public Dialogue. Am J Geriatr Psychiatry. 2016;24(4):261-71. DOI: 10.1016/j.jagp.2016.01.135.
- Weisman AD, Hackett TP. Predilection to death. Death and dying as a psychiatric problem. Psychosom Med. 1961; 23:232-56.
- The SUPPORT Principal Investigators. A controlled trial to improve care for seriously ill hospitalized patients. The study to understand prognoses and preferences for outcomes and risks of treatments (SUPPORT) JAMA. 1995;274(20):1591-8.
- Ameneiros-Lago E, Carballada-Rico C, Garrido-Sanjuán JA. Mortalidad esperable en Medicina Interna: ¿cómo son los últimos días de vida en los pacientes en los que la muerte es previsible? Medicina Paliativa. 2017:63-71.
- CIS. Atención a pacientes con enfermedades en fase terminal. Madrid: CIS; 2009. Informe Nº.: 2803. Disponible en: http://www.cis.es.
- Woitha K, Garralda E, Martin-Moreno JM, Clark D, Centeno C. Ranking of Palliative Care Development in the Countries of the European Union. J Pain Symptom Manage. 2016;52(3):370-7. DOI: 10.1016/j.jpainsymman.2016.03.008.
- Barón-Duarte FJ. La agresividad terapéutica y los tratamientos limitados en el tiempo en pacientes oncológicos al final de la vida: fundamentos éticos y aplicación clínica [Tesis Doctoral]. Santiago de Compostela: Universidad de Santiago de Compostela; 2015.
- Asociación Española contra el Cáncer. Informe de la situación actual en cuidados paliativos. Fact 2014.
- Plaza Canteli S, Marco Martínez J. Internists and death in the hospital. Rev Clin Esp. 2019;219(3):145-6. DOI: 10.1016/j.rce.2019.01.002.
- Díez-Manglano J, Isasi de Isasmendi Pérez S, Rubio Gómez M, Formiga F, Sánchez Muñoz LÁ, Castiella Herrero J, et al. Cuidados en los últimos días de vida en los pacientes hospitalizados en medicina interna. Rev Clin Esp. 2019;219(3):107-15. DOI: 10.1016/j.rce.2018.06.010.
- Grupo de Trabajo de la Guía de Práctica Clínica sobre Cuidados Paliativos. Guía de Práctica Clínica sobre Cuidados Paliativos. Vitoria: Agencia de Evaluación de Tecnologías Sanitarias del País Vasco; 2008. Guías de Práctica Clínica en el SNS: OSTEBA Nº 2006/08.
- Bernal Sobrino JL, Elola Somoza J, Palanca Sánchez I, Paniagua Caparrós JL, Pascual López A. Unidad de cuidados paliativos. Estándares y recomendaciones. Madrid: Ministerio de Sanidad y Política Social; 2009.
- National Institute for Health and Care Excellence. Care of dying adults in the last days of life. London: National Institute for Health and Care Excellence; 2015. [consultado 12 oct 2018]. Disponible en: https://www.nice.org.uk/guidance/ng31.
- Baik D, Russell D, Jordan L, Dooley F, Bowles KH, Masterson Creber RM. Using the Palliative Performance Scale to Estimate Survival for Patients at the End of Life: A Systematic Review of the Literature. J Palliat Med. 2018;21(11):1651-61. DOI: 10.1089/jpm.2018.0141.
- Ellershaw J, Ward C. Care of the dying patient: the last hours or days of life. Bmj. 2003;326(7379):30-4.
- Kennedy C, Brooks-Young P, Brunton Gray C, Larkin P, Connolly M, Wilde-Larsson B, et al. Diagnosing dying: an integrative literature review. BMJ Support Palliat Care. 2014;4(3):263- DOI: 10.1136/bmjspcare-2013-000621.
- Christakis NA, Lamont EB. Extent and determinants of error in doctors’ prognoses in terminally ill patients: prospective cohort study. Bmj. 2000;320(7233):469-72. DOI: 10.1136/ 320.7233.469.
- Middlewood S, Gardner G, Gardner A. Dying in hospital: medical failure or natural outcome? J Pain Symptom Manage. 2001;22(6):1035-41. DOI: 10.1016/s0885-3924(01)00362-1.
- Fins JJ, Miller FG, Acres CA, Bacchetta MD, Huzzard LL, Rapkin BD. End-of-life decision-making in the hospital: current practice and future prospects. J Pain Symptom Manage. 1999;17(1):6-15. DOI: 10.1016/s0885-3924(98)00109-2.
- Toscani F, Di Giulio P, Brunelli C, Miccinesi G, Laquintana D. How people die in hospital general wards: a descriptive study. J Pain Symptom Manage. 2005;30(1):33-40. DOI: 10.1016/j. jpainsymman.2005.01.013.
- Neuberger J, Guthrie C, Aaronovitch D, Hameed K, Bonser T, Harries R, et al. More care, less pathway: a review of the Liverpool Care Pathway. Liverpool: Independent Review of the Liverpool Care Pathway; 2013
- Chiang JK, Lai NS, Wang MH, Chen SC, Kao YH. A proposed prognostic 7-day survival formula for patients with terminal cancer. BMC Public Health. 2009;9:365. DOI: 10.1186/1471- 2458-9-365.
- Kao YH, Chen CN, Chiang JK, Chen SS, Huang WW. Predicting factors in the last week of survival in elderly patients with terminal cancer: a prospective study in southern Taiwan. J Formos Med Assoc. 2009;108(3):231-9. DOI: 10.1016/s0929-6646(09)60057-7.
- Escalante CP, Martin CG, Elting LS, Price KJ, Manzullo EF, Weiser MA, et al. Identifying risk factors for imminent death in cancer patients with acute dyspnea. J Pain Symptom Manage. 2000;20(5):318-25.
- Hui D, dos Santos R, Chisholm G, Bansal S, Silva TB, Kilgore K, et al. Clinical signs of impending death in cancer patients. Oncologist. 2014;19(6):681-7. DOI: 10.1634/theoncologist.2013-0457.
- Loekito E, Bailey J, Bellomo R, Hart GK, Hegarty C, Davey P, et al. Common laboratory tests predict imminent death in ward patients. Resuscitation. 2013;84(3):280-5. DOI: 10.1016/j. resuscitation.2012.07.025.
- Loekito E, Bailey J, Bellomo R, Hart GK, Hegarty C, Davey P, et al. Common laboratory tests predict imminent medical emergency team calls, intensive care unit admission or death in emergency department patients. Emerg Med Australas. 2013;25(2):132-9. DOI: 10.1111/1742- 12040.
- Matsunuma R, Tanbo Y, Asai N, Ohkuni Y, Watanabe S, Murakami S, et al. Prognostic factors in patients with terminal stage lung cancer. J Palliat Med. 2014;17(2):189-94. DOI: 10.1089/ jpm.2013.0448.
- Hui D, Dos Santos R, Chisholm G, Bansal S, Souza Crovador C, Bruera E. Bedside clinical signs associated with impending death in patients with advanced cancer: preliminary findings of a prospective, longitudinal cohort study. Cancer. 2015;121(6):960-7. DOI: 10.1002/cncr.29048.
- Johnson DC, Kutner JS, Armstrong JD, 2nd. Would you be surprised if this patient died?: Preliminary exploration of first and second year residents’ approach to care decisions in critically ill patients. BMC Palliat Care. 2003;2(1):1.
- Dendaas NR. Prognostication in advance cancer: nurses’ perceptions of the dying process. Oncol Nurs 2002;29(3):493-9. DOI: 10.1188/02.onf.493-499.
- van der Werff GF, Paans W, Nieweg RM. Hospital nurses’ views of the signs and symptoms that herald the onset of the dying phase in oncology patients. Int J Palliat Nurs. 2012;18(3):143-9. DOI: 10.12968/ijpn.2012.18.3.143.
- Abarshi E, Echteld M, Donker G, Van den Block L, Onwuteaka-Philipsen B, Deliens L. Discussing end-of-life issues in the last months of life: a nationwide study among general practitioners. J Palliat Med. 2011;14(3):323-30. DOI: 10.1089/jpm.2010.0312.
- Domeisen BF, Ostgathe C, Clark J, Costantini M, Daud ML, Grossenbacher-Gschwend B, et al. International palliative care experts’ view on phenomena indicating the last hours and days of life. Support Care Cancer. 2013;21(6):1509-17.
- Brandt HE, Deliens L, Ooms ME, van der Steen JT, van der Wal G, Ribbe MW. Symptoms, signs, problems, and diseases of terminally ill nursing home patients: a nationwide observational study in the Netherlands. Arch Intern Med. 2005;165(3):314-20. DOI: 10.1001/ 165.3.314.
- Christakis NA, Lamont EB. Extent and determinants of error in physicians’ prognoses in terminally ill patients: prospective cohort study. West J Med. 2000;172(5):310-3. DOI: 10.1136/ ewjm.172.5.310.
- Kumagai Y, Maekawa A, Abe M. Prognostic items for the last 10 and 3 days of life of cancer patients at home. Cancer Nurs. 2012;35(5):390-6. DOI: 10.1097/NCC.0b013e318235287d.
- Fosse A, Zuidema S, Boersma F, Malterud K, Schaufel MA, Ruths S. Nursing Home Physicians’ Assessments of Barriers and Strategies for End-of-Life Care in Norway and The Netherlands. J Am Med Dir Assoc. 2017;18(8):713-8. DOI: 10.1016/j.jamda.2017.03.005.
- Hui D, Bansal S, Park M, Reddy A, Cortes J, Fossella F, et al. Differences in attitudes and beliefs toward end-of-life care between hematologic and solid tumor oncology specialists. Ann Oncol. 2015;26(7):1440-6. DOI: 10.1093/annonc/mdv028.
- Wright AA, Zhang B, Ray A, Mack JW, Trice E, Balboni T, et al. Associations between end- of-life discussions, patient mental health, medical care near death, and caregiver bereavement adjustment. JAMA. 2008;300(14):1665-73. DOI: 10.1001/jama.300.14.1665.
- Anselm AH, Palda V, Guest CB, McLean RF, Vachon ML, Kelner M, et al. Barriers to communication regarding end-of-life care: perspectives of care providers. J Crit Care. 2005;20(3):214-23. DOI: 10.1016/j.jcrc.2005.05.012.
- Aslakson RA, Wyskiel R, Thornton I, Copley C, Shaffer D, Zyra M, et al. Nurse-perceived barriers to effective communication regarding prognosis and optimal end-of-life care for surgical ICU patients: a qualitative exploration. J Palliat Med. 2012;15(8):910-5. DOI: 10.1089/jpm.2011.0481.
- Gutiérrez KM. Experiences and needs of families regarding prognostic communication in an intensive care unit: supporting families at the end of life. Crit Care Nurs Q. 2012;35(3):299-313. DOI: 10.1097/CNQ.0b013e318255ee0d.
- Jackson A, Purkis J, Burnham E, Hundt GL, Blaxter L. Views of relatives, carers and staff on end of life care pathways. Emerg Nurse. 2010;17(10):22-6. DOI: 10.7748/en2010.03.17.10.22.
- Houttekier D, Witkamp FE, van Zuylen L, van der Rijt CC, van der Heide A. Is physician awareness of impending death in hospital related to better communication and medical care? J Palliat Med. 2014;17(11):1238-43. DOI: 10.1089/jpm.2014.0203.
- Sullivan AM, Lakoma MD, Matsuyama RK, Rosenblatt L, Arnold RM, Block SD. Diagnosing and discussing imminent death in the hospital: a secondary analysis of physician interviews. J Palliat Med. 2007;10(4):882-93. DOI: 10.1089/jpm.2007.0189.
- Generous MA, Keeley M. Wished for and avoided conversations with terminally ill individuals during final conversations. Death Stud.2017;41(3):162-72.DOI: 10.1080/07481187.2016.1236850.
- Odgers J. No one said he was dying: families’ experiences of end-of-life care in an acute setting. Australian Journal of Advanced Nursing. 2018;35(3):21-31.
- Park EM, Check DK, Yopp JM, Deal AM, Edwards TP, Rosenstein DL. An exploratory study of end-of-life prognostic communication needs as reported by widowed fathers due to cancer. Psychooncology. 2015;24(11):1471-6. DOI: 10.1002/pon.3757.
- Nouvet E, Strachan PH, Kryworuchko J, Downar J, You JJ. Waiting for the body to fail: limits to end-of-life communication in Canadian hospitals. Mortality. 2016;21(4):340-56. DOI: 10.1080/13576275.2016.1140133.
- Rodenbach RA, Rodenbach KE, Tejani MA, Epstein RM. Relationships between personal attitudes about death and communication with terminally ill patients: How oncology clinicians grapple with mortality. Patient Education and Counseling. 2016;99(3):356-63. DOI: http:// doi.org/10.1016/j.pec.2015.10.010.
- Brogan P, Hasson F, McIlfatrick S. Shared decision-making at the end of life: A focus group study exploring the perceptions and experiences of multi-disciplinary healthcare professionals working in the home setting. Palliat Med. 2018;32(1):123-32. DOI: 10.1177/0269216317734434.
- Belanger E, Rodríguez C, Groleau D. Shared decision-making in palliative care: a systematic mixed studies review using narrative synthesis. Palliat Med. 2011;25(3):242-61. DOI: 10.1177/0269216310389348.
- Addicott R. Delivering better end-of-life care in England: barriers to access for patients with a non-cancer diagnosis. Health Econ Policy Law. 2012;7(4):441-54. DOI: 10.1017/ s1744133112000230.
- Boot M, Wilson C. Clinical nurse specialists perspectives on advance care planning conversations: a qualitative study. Int J Palliat Nurs. 2014;20(1):9-14. DOI: 10.12968/ ijpn.2014.20.1.9.
- Fields A, Finucane AM, Oxenham D. Discussing preferred place of death with patients: staff experiences in a UK specialist palliative care setting. Int J Palliat Nurs. 2013;19(11):558-65. DOI: 12968/ijpn.2013.19.11.558.
- Minto F, Strickland K. Anticipating emotion: a qualitative study of advance care planning in the community setting. Int J Palliat Nurs. 2011;17(6):278-84. DOI: 10.12968/ijpn.2011.17.6.278.
- Seymour J, Almack K, Kennedy S. Implementing advance care planning: a qualitative study of community nurses’ views and experiences. BMC Palliat Care. 2010;9:4. DOI: 10.1186/1472- 684x-9-4.
- Stevens I, Whyte F. Advance care planning: will it work in diseases other than cancer? European Journal of Palliative Care. 2011;18(6):280-4.
- Tan HM, Lee SF, O’Connor MM, Peters L, Komesaroff PA. A case study approach to investigating end-of-life decision making in an acute health service. Aust Health Rev. 2013;37(1):93-7. DOI: 1071/ah11125.
- Thompson TD, Barbour RS, Schwartz Health professionals’ views on advance directives: a qualitative interdisciplinary study. Palliat Med. 2003;17(5):403-9. DOI: 10.1191/0269216303pm784oa.
- Willard C, Luker K. Challenges to end of life care in the acute hospital setting. Palliat Med. 2006;20(6):611-5. DOI: 10.1177/0269216306071064.
- Dillworth J, Dickson VV, Mueller A, Shuluk J, Yoon HW, Capezuti E. Nurses’ perspectives: hospitalized older patients and end-of-life decision-making. Nurs Crit Care. 2016;21(2):e1-e11. DOI: 10.1111/nicc.12125.
- Ho A, Jameson K, Pavlish C. An exploratory study of interprofessional collaboration in end-of-life decision-making beyond palliative care settings. J Interprof Care. 2016;30(6):795-803. DOI: 1080/13561820.2016.1203765.
- Laurent A, Bonnet M, Capellier G, Aslanian P, Hebert P. Emotional Impact of End-of-Life Decisions on Professional Relationships in the ICU: An Obstacle to Collegiality? Crit Care Med. 2017;45(12):2023-30. DOI: 10.1097/ccm.0000000000002710.
- Romoren M, Pedersen R, Forde R. How do nursing home doctors involve patients and next of kin in end-of-life decisions? A qualitative study from Norway. BMC Med Ethics. 2016;17:5. DOI: 10.1186/s12910-016-0088-2.
- Washington KT, Oliver DP, Gage LA, Albright DL, Demiris G. A multimethod analysis of shared decision-making in hospice interdisciplinary team meetings including family caregivers. Palliat Med. 2016;30(3):270-8. DOI: 10.1177/0269216315601545.
- Brooks LA, Manias E, Nicholson P. Communication and Decision-Making About End-of-Life Care in the Intensive Care Unit. Am J Crit Care. 2017;26(4):336-41. DOI: 10.4037/ajcc2017774.
- Abbott KH, Sago JG, Breen CM, Abernethy AP, Tulsky JA. Families looking back: one year after discussion of withdrawal or withholding of life-sustaining support. Crit Care Med. 2001;29(1):197-201.
- Almack K, Cox K, Moghaddam N, Pollock K, Seymour J. After you: conversations between patients and healthcare professionals in planning for end of life care. BMC Palliat Care. 2012;11:15. DOI: 1186/1472-684x-11-15.
- Caron CD, Griffith J, Arcand M. End-of-life decision making in dementia: the perspective of family caregivers. Dementia (14713012). 2005; 4(1):113-136.
- Hsieh HF, Shannon SE, Curtis JR. Contradictions and communication strategies during end-of-life decision making in the intensive care unit. J Crit Care. 2006;21(4):294-304. DOI: 1016/j.jcrc.2006.06.003.
- Lind R, Lorem GF, Nortvedt P, Hevroy O. Family members’ experiences of “wait and see” as a communication strategy in end-of-life decisions. Intensive Care Med. 2011;37(7):1143-50. DOI: 10.1007/s00134-011-2253-x.
- Lind R, Nortvedt P, Lorem G, Hevroy O. Family involvement in the end-of-life decisions of competent intensive care patients. Nurs Ethics. 2013;20(1):61-71. DOI: 10.1177/0969733012448969.
- Nolan MT, Kub J, Hughes MT, Terry PB, Astrow AB, Carbo CA, et al. Family health care decision making and self-efficacy with patients with ALS at the end of life. Palliat Support Care. 2008;6(3):273-80. DOI: 10.1017/s1478951508000412.
- Royak-Schaler R, Gadalla S, Lemkau J, Ross D, Alexander C, Scott D. Family perspectives on communication with healthcare providers during end-of-life cancer care. Oncol Nurs Forum. 2006;33(4):753-60. DOI: 1188/06.onf.753-760.
- Tilden VP, Tolle SW, Garland MJ, Nelson CA. Decisions about life-sustaining treatment. Impact of physicians’ behaviors on the family. Arch Intern Med. 1995;155(6):633-8.
- Vig EK, Starks H, Taylor JS, Hopley EK, Fryer-Edwards K. Surviving surrogate decision-making: what helps and hampers the experience of making medical decisions for others. J Gen Intern Med. 2007;22(9):1274-9. DOI: 10.1007/s11606-007-0252-y.
- Lee MC, Sulmasy DP, Gallo J, Kub J, Hughes MT, Russell S, et al. Decision-Making of Patients With Implantable Cardioverter-Defibrillators at End of Life: Family Members’ Experiences. Am J Hosp Palliat Care. 2017;34(6):518-23. DOI: 10.1177/1049909116641622.
- Nelson JE, Hanson LC, Keller KL, Carson SS, Cox CE, Tulsky JA, et al. The Voice of Surrogate Decision-Makers. Family Responses to Prognostic Information in Chronic Critical Illness. Am J Respir Crit Care Med. 2017;196(7):864-72. DOI: 10.1164/rccm.201701-0201OC.
- Rosemond C, Hanson LC, Zimmerman S. Goals of Care or Goals of Trust? How Family Members Perceive Goals for Dying Nursing Home Residents. J Palliat Med. 2017;20(4):360-5. DOI: 1089/jpm.2016.0271.
- Yamamoto S, Arao H, Masutani E, Aoki M, Kishino M, Morita T, et al. Decision Making Regarding the Place of End-of-Life Cancer Care: The Burden on Bereaved Families and Related J Pain Symptom Manage. 2017;53(5):862-70. DOI: 10.1016/j.jpainsymman.2016.12.348.
- Cross LA. Compassion Fatigue in Palliative Care Nursing: A Concept Analysis. J Hosp Palliat Nurs. 2019;21(1):21-8. DOI: 10.1097/njh.0000000000000477.
- Sudore RL, Lum HD, You JJ, Hanson LC, Meier DE, Pantilat SZ, et al. Defining Advance Care Planning for Adults: A Consensus Definition From a Multidisciplinary Delphi Panel. J Pain Symptom Manage. 2017;53(5):821-32.e1. DOI: 10.1016/j.jpainsymman.2016.12.331.
- Rietjens JAC, Sudore RL, Connolly M, van Delden JJ, Drickamer MA, Droger M, et al. Definition and recommendations for advance care planning: an international consensus supported by the European Association for Palliative Lancet Oncol. 2017;18(9):e543-e51. DOI: 10.1016/s1470-2045(17)30582-x.
- Couceiro Vidal A, Pandiella A. La EPOC: un paradigma para el uso de directivas previas y la planificación anticipada de decisiones. Arch Bronconeumol. 2010;46(6):325-31.
- Buckman R, Kanson Y. Breaking bad news: a six-step protocol. En: R B, editor. How to break bad news: a guide for heath care professionals. Baltimore: The Johns Hopkins University Press; 1992. p. 65-97.
- Barrio IM, Simón P, Pascau MJ. El papel de la enfermera en la planificación anticipada de las decisiones: más allá de las instrucciones previas o voluntades anticipadas. Enfermería clínica. 2004;14(4):235-41.
- Raijmakers NJ, van Zuylen L, Costantini M, Caraceni A, Clark J, Lundquist G, et al. Artificial nutrition and hydration in the last week of life in cancer patients. A systematic literature review of practices and effects. Ann Oncol. 2011;22(7):1478-86. DOI: 10.1093/annonc/mdq620.
- Del Rio MI, Shand B, Bonati P, Palma A, Maldonado A, Taboada P, et al. Hydration and nutrition at the end of life: a systematic review of emotional impact, perceptions, and decision-making among patients, family, and health care staff. Psychooncology. 2012;21(9):913-21. DOI: 10.1002/pon.2099.
- Good P, Richard R, Syrmis W, Jenkins-Marsh S, Stephens J. Medically assisted hydration for adult palliative care patients. Cochrane Database Syst Rev. 2014 (4):Cd006273. DOI: 10.1002/14651858.CD006273.pub3.
- Druml C, Ballmer PE, Druml W, Oehmichen F, Shenkin A, Singer P, et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clin Nutr. 2016;35(3):545-56. DOI: 1016/j.clnu.2016.02.006.
- Bruera E, Hui D, Dalal S, Torres-Vigil I, Trumble J, Roosth J, et al. Parenteral hydration in patients with advanced cancer: a multicenter, double-blind, placebo-controlled randomized trial J Clin Oncol. 2013;31(1):111-8. DOI: 10.1200/jco.2012.44.6518.
- Bruera E, Sala R, Rico MA, Moyano J, Centeno C,Willey J, et al. Effects of parenteral hydration in terminally ill cancer patients: a preliminary study. J Clin Oncol. 2005;23(10):2366-71. DOI: 10.1200/jco.2005.04.069.
- Cerchietti L, Navigante A, Sauri A, Palazzo F. Hypodermoclysis for control of dehydration in terminal-stage cancer. Int J Palliat Nurs. 2000;6(8):370-4. DOI: 10.12968/ijpn.2000.6.8.9060.
- Viola R. Studying Fluid Status and the Dying: The Challenge of Clinical Research in Palliative Care. 1997.
- Morita T, Hyodo I, Yoshimi T, Ikenaga M, Tamura Y, Yoshizawa A, et al. Association between hydration volume and symptoms in terminally ill cancer patients with abdominal malignancies. Ann Oncol. 2005;16(4):640-7. DOI: 10.1093/annonc/mdi121.
- Davies AN, Waghorn M, Webber K, Johnsen S, Mendis J, Boyle J. A cluster randomised feasibility trial of clinically assisted hydration in cancer patients in the last days of life. Palliat Med. 2018;32(4):733-43. DOI: 10.1177/0269216317741572.
- Gent MJ, Fradsham S, Whyte GM, Mayland CR. What influences attitudes towards clinically assisted hydration in the care of dying patients? A review of the literature. BMJ Support Palliat Care. 2015;5(3):223-31. DOI: 10.1136/bmjspcare-2013-000562.
- Ferris F, Balfour H, Bowen K, Farley J, Hardwick M, Lamontagne C, et al. A Model to Guide Hospice Palliative Care. Ottawa, ON: Canadian Hospice Palliative Care Association, 2002.
- Carvajal Valcárcel A, Martínez García M, Centeno Cortés C. Versión española del Edmonton Symptom Assessment Sytem</span> (ESAS): un instrumento de referencia para la valoración sintomática del paciente con cáncer avanzado. Medicina Paliativa. 2013;20(4):143-9. DOI: 10.1016/j.medipa.2013.02.001.
- Delgado-Silveira E, Mateos-Nozal J, Muñoz-García M, Rexach-Canoc L, Vélez-Díaz-Pallarés M, Albeniz-López J, et al. Uso potencialmente inapropiado de fármacos en cuidados paliativos: versión en castellano de los criterios STOPP-Frail (STOPP-Pal). Rev Esp Geriatr Gerontol. 2019;54(3):151–5.
- Martin-Roselló ML, Fernández-López A, Sanz-Amores R, Gómez-García R, Vidal-España F, Cia-Ramos R. IDC-Pal (Instrumento Diagnóstico de la Complejidad en Cuidados Paliativos) [Internet]. Sevilla: Consejeria de Igualdad, Salud y Politicas sociales. Fundación Cudeca; [consultado 20 sep 2020]. Disponible en: http://www.juntadeandalucia.es/salud/IDCPal.
- Supportive PDQ, Palliative Care Editorial B. Last Days of Life (PDQ®): Health Professional Version. PDQ Cancer Information Summaries. Bethesda (MD): National Cancer Institute (US); 2019.
- Coyne P, Mulvenon C, Paice JA. American Society for Pain Management Nursing and Hospice and Palliative Nurses Association Position Statement: Pain Management at the End of Live. Pain management nursing : official journal of the American Society of Pain Management Nurses. 2018;19(1):3-7. DOI: 10.1016/j.pmn.2017.10.019.
- Prácticas seguras para el uso de opioides en pacientes con dolor crónico. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2015
- Twycross RG. Choice of strong analgesic in terminal cancer: diamorphine or morphine? Pain. 1977;3(2):93-104. DOI: 1016/0304-3959(77)90072-0.
- Sathornviriyapong A, Nagaviroj K, Anothaisintawee T. The association between different opioid doses and the survival of advanced cancer patients receiving palliative care. BMC Palliat Care. 2016;15(1):95-. DOI: 10.1186/s12904-016-0169-5.
- Bercovitch M, Adunsky A. Patterns of high-dose morphine use in a home-care hospice service: should we be afraid of it? Cancer. 2004;101(6):1473-7. DOI: 10.1002/cncr.20485.
- Seow H, Barbera L, Sutradhar R, Howell D, Dudgeon D, Atzema C, et al. Trajectory of performance status and symptom scores for patients with cancer during the last six months of life. J Clin Oncol. 2011;29(9):1151-8. DOI: 10.1200/JCO.2010.30.7173.
- Tishelman C, Petersson L-M, Degner LF, Sprangers MAG. Symptom prevalence, intensity, and distress in patients with inoperable lung cancer in relation to time of death. J Clin Oncol. 2007;25(34):5381-9. DOI: 10.1200/JCO.2006.08.7874.
- The Criteria Committee of the New York Heart Association. Nomenclature and Criteria for Diagnosis of Diseases of the Heart and Great Vessels. 9ª ed. Boston: Little, Brown & Co; 1994. p. 253-6.
- Borg G. Simple rating methods for estimation of perceived exertion. Wenner-Gren Center International Symposium. 1976;Series 28:39-47.
- Campbell ML,Templin T,Walch A Respiratory Distress Observation Scale for patients unable to self-report dyspnea. J Palliat Med. 2010 Mar;13(3):285-90. DOI: 10.1089/jpm.2009.0229.
- Barnes H, McDonald J, Smallwood N, Manser R. Opioids for the palliation of refractory breathlessness in adults with advanced disease and terminal illness. Cochrane Database Syst Rev. 2016;3(3):Cd011008. DOI: 10.1002/14651858.CD011008.pub2.
- Simon ST, Higginson IJ, Booth S, Harding R, Weingärtner V, Bausewein C. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev. 2016;10(10):Cd007354. DOI: 10.1002/14651858.CD007354. pub3.
- Navigante AH, Cerchietti LC, Castro MA, Lutteral MA, Cabalar ME. Midazolam as adjunct therapy to morphine in the alleviation of severe dyspnea perception in patients with advanced cancer. J Pain Symptom Manage. 2006;31(1):38-47. DOI: 10.1016/j.jpainsymman.2005.06.009.
- Booth S, Kelly MJ, Cox NP, Adams L, Guz A. Does oxygen help dyspnea in patients with cancer? Am J Respir Crit Care Med. 1996;153(5):1515-8. DOI: 10.1164/ajrccm.153.5.8630595.
- Clemens KE, Quednau I, Klaschik E. Use of oxygen and opioids in the palliation of dyspnoea in hypoxic and non-hypoxic palliative care patients: a prospective study. Support Care Cancer. 2009;17(4):367-77. DOI: 10.1007/s00520-008-0479-0.
- Twycross R, Back I. Nausea and vomiting in advanced cancer. Eur J Palliat Care. 1998;5:39-45.
- Edmonds P, Karlsen S, Khan S, Addington-Hall J. A comparison of the palliative care needs of patients dying from chronic respiratory diseases and lung cancer. Palliat Med. 2001;15(4):287- 95. DOI: 10.1191/026921601678320278.
- Klinkenberg M, Willems DL, van der Wal G, Deeg DJ. Symptom burden in the last week of life. J Pain Symptom Manage. 2004;27(1):5-13. DOI: 10.1016/j.jpainsymman.2003.05.008.
- Mystakidou K, Tsilika E, Kalaidopoulou O, Chondros K, Georgaki S, Papadimitriou L. Comparison of octreotide administration vs conservative treatment in the management of inoperable bowel obstruction in patients with far advanced cancer: a randomized, double-blind, controlled clinical trial. Anticancer Res. 2002;22(2b):1187-92.
- Ripamonti C, Mercadante S, Groff L, Zecca E, De Conno F, Casuccio A. Role of octreotide, scopolamine butylbromide, and hydration in symptom control of patients with inoperable bowel obstruction and nasogastric tubes: a prospective randomized trial. J Pain Symptom Manage. 2000;19(1):23-34. DOI: 10.1016/s0885-3924(99)00147-5.
- Mercadante S, Casuccio A, Fulfaro F. The course of symptom frequency and intensity in advanced cancer patients followed at home. J Pain Symptom Manage. 2000;20(2):104-12. DOI: 10.1016/s0885-3924(00)00160-3.
- Mercadante S, Casuccio A, Agnello A, Serretta R, Calderone L, Barresi L. Morphine versus methadone in the pain treatment of advanced-cancer patients followed up at home. J Clin Oncol. 1998;16(11):3656-61. DOI: 10.1200/jco.1998.16.11.3656.
- Cox L, Darvill E, Dorman S. Levomepromazine for nausea and vomiting in palliative care. Cochrane Database Syst Rev. 2015;2015(11):Cd009420. DOI: 10.1002/14651858.CD009420.
- Storrar J, Hitchens M, Platt T, Dorman S. Droperidol for treatment of nausea and vomiting in palliative care patients. Cochrane Database Syst Rev. 2014;2014(11):Cd006938. DOI: 10.1002/14651858.CD006938.pub3.
- Vayne-Bossert P, Haywood A, Good P, Khan S, Rickett K, Hardy JR. Corticosteroids for adult patients with advanced cancer who have nausea and vomiting (not related to chemotherapy, radiotherapy, or surgery). Cochrane Database Syst Rev. 2017;7(7):Cd012002. DOI: 10.1002/14651858.CD012002.pub2.
- Sutherland A, Naessens K, Plugge E, Ware L, Head K, Burton MJ, et al. Olanzapine for the prevention and treatment of cancer-related nausea and vomiting in adults. Cochrane Database Syst Rev. 2018;9(9):Cd012555. DOI: 10.1002/14651858.CD012555.pub2.
- Murray-Brown F, Dorman S. Haloperidol for the treatment of nausea and vomiting in palliative care patients. Cochrane Database Syst Rev. 2015;2015(11):Cd006271. DOI: 10.1002/14651858. CD006271.pub3.
- Levy M, Smith T, Alvarez-Perez A, Back A, Baker JN, Beck AC, et al. Palliative Care Version 1.2016. J Natl Compr Canc Netw. 2016;14(1):82-113. DOI: 10.6004/jnccn.2016.0009.
- Guidelines and Protocols Advisory Committee (BC). Part 2: Pain and symptom management. 2017. En: Palliative care for the patient with incurable cancer or advanced disease [Monografía en internet]. Victoria: BC; 2017. [consultado 20 sept 2020]. Disponible en: https://www2.gov.bc.ca.
- Kehl KA, Kowalkowski JA. A systematic review of the prevalence of signs of impending death and symptoms in the last 2 weeks of life. Am J Hosp Palliat Care. 2013;30(6):601-16. DOI: 10.1177/1049909112468222.
- Hosie A, Davidson PM, Agar M, Sanderson CR, Phillips J. Delirium prevalence, incidence, and implications for screening in specialist palliative care inpatient settings: a systematic review. Palliat Med. 2013;27(6):486-98. DOI: 10.1177/0269216312457214.
- Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983;67(6):361-70. DOI: 1111/j.1600-0447.1983.tb09716.x.
- McCleary E, Cumming P. Improving early recognition of delirium using SQiD (Single Question to identify Delirium): a hospital based quality improvement project. BMJ Qual Improv Rep. 2015;4(1). DOI: 10.1136/bmjquality.u206598.w2653.
- Tobar E, Romero C, Galleguillos T, Fuentes P, Cornejo R, Lira MT, et al. Método para la evaluación de la confusión en la unidad de cuidados intensivos para el diagnóstico de delírium: adaptación cultural y validación de la versión en idioma español. Med Intensiva. 2010;34(1):4- DOI: 10.1016/j.medin.2009.04.003.
- Bellelli G, Morandi A, Davis DH, Mazzola P, Turco R, Gentile S, et al. Validation of the 4AT, a new instrument for rapid delirium screening: a study in 234 hospitalised older people. Age Ageging. 2014 Jul;43(4):496-502. DOI: 10.1093/ageing/afu021.
- Noguera A, Carvajal A, Alonso-Babarro A, Chisholm G, Bruera E, Centeno C. First Spanish version of the Memorial Delirium Assessment Scale: psychometric properties, responsiveness, and factor loadings. J Pain Symptom Manage. 2014;47(1):189-97. DOI: 10.1016/j.jpainsymman.2013.02.020.
- Trzepacz PT, Mittal D, Torres R, Kanary K, Norton J, Jimerson N. Validation of the Delirium Rating Scale-revised-98: comparison with the delirium rating scale and the cognitive test for delirium. J Neuropsychiatry Clin Neurosci. 2001 Spring;13(2):229-42. DOI: 10.1176/ jnp.13.2.229.
- Finucane AM, Jones L, Leurent B, Sampson EL, Stone P, Tookman A, et al. Drug therapy for delirium in terminally ill adults. Cochrane Database Syst Rev. 2020;1(1):Cd004770. DOI: 10.1002/14651858.CD004770.pub3.
- Jansen K, Haugen DF, Pont L, Ruths S. Safety and Effectiveness of Palliative Drug Treatment in the Last Days of Life-A Systematic Literature Review. J Pain Symptom Manage. 2018;55(2):508-21.e3. DOI: 10.1016/j.jpainsymman.2017.06.010.
- Salt S, Mulvaney CA, Preston NJ. Drug therapy for symptoms associated with anxiety in adult palliative care patients. Cochrane Database Syst Rev. 2017;5(5):Cd004596. DOI: 10.1002/14651858.CD004596.pub3.
- Lokker ME, van Zuylen L, van der Rijt CCD, van der Heide A. Prevalence, impact, and treatment of death rattle: a systematic review. J Pain Symptom Manage. 2014;47(1):105-22. DOI: 10.1016/j.jpainsymman.2013.03.011.
- Clark K, Currow DC, Agar M, Fazekas BS, Abernethy AP. A pilot phase II randomized, cross-over, double-blinded, controlled efficacy study of octreotide versus hyoscine hydrobromide for control of noisy breathing at the end-of-life. J Pain Palliat Care Pharmacother. 2008;22(2):131- DOI: 10.1080/15360280801992058.
- Likar R, Molnar M, Rupacher E, Pipam W, Deutsch J, Mörtl M, et al. Klinische Untersuchung über die Wirkung von Scopolamin-Hydrobromicum beim terminalen Rasseln (randomisierte, doppelblind, plazebokontrollierte Studie). Palliativmedizin. 2002;3(01):15-9.
- Likar R, Rupacher E, Kager H, Molnar M, Pipam W, Sittl R. [Efficacy of glycopyrronium bromide and scopolamine hydrobromide in patients with death rattle: a randomized controlled study]. Wien Klin Wochenschr. 2008;120(21-22):679-83. DOI: 10.1007/s00508-008-1094-2.
- Wildiers H, Dhaenekint C, Demeulenaere P, Clement PM, Desmet M, Van Nuffelen R, et al. Atropine, hyoscine butylbromide, or scopolamine are equally effective for the treatment of death rattle in terminal care. J Pain Symptom Manage. 2009;38(1):124-33. DOI: 10.1016/j. jpainsymman.2008.07.007.
- Heisler M, Hamilton G, Abbott A, Chengalaram A, Koceja T, Gerkin R. Randomized double-blind trial of sublingual atropine vs. placebo for the management of death rattle. J Pain Symptom Manage. 2013;45(1):14-22. DOI: 10.1016/j.jpainsymman.2012.01.006.
- Back IN, Jenkins K, Blower A, Beckhelling J. A study comparing hyoscine hydrobromide and glycopyrrolate in the treatment of death rattle. Palliat Med. 2001;15(4):329-36. DOI: 10.1191/026921601678320313.
- Hugel H,Ellershaw J,Gambles M. Respiratory tract secretions in the dying patient: a comparison between glycopyrronium and hyoscine hydrobromide. J Palliat Med. 2006;9(2):279-84. DOI: 10.1089/jpm.2006.9.279.
- Kåss RM, Ellershaw J. Respiratory tract secretions in the dying patient: a retrospective study. J Pain Symptom Manage. 2003;26(4):897-902. DOI: 10.1016/s0885-3924(03)00292-6.
- Hughes A, Wilcock A, Corcoran R, Lucas V, King A. Audit of three antimuscarinic drugs for managing retained secretions. Palliat Med.2000;14(3):221-2.DOI: 10.1191/026921600670188257.
- Star A, Boland JW. Updates in palliative care-recent advancements in the pharmacological management of symptons. Clinical medicine (London, England). 2018;18(1):11-6. DOI: 10.7861/clinmedicine.18-1-11.
- Mercadante S, Marinangeli F, Masedu F, Valenti M, Russo D, Ursini L, et al. Hyoscine Butylbromide for the Management of Death Rattle: Sooner Rather Than Later. J Pain Symptom Manage. 2018 Dec;56(6):902-7. DOI: 10.1016/j.jpainsymman.2018.08.018.
- van Esch HJ, van Zuylen L, Oomen-de Hoop E, van der Heide A, van der Rijt CCD. Scopolaminebutyl given prophylactically for death rattle: study protocol of a randomized double-blind placebo-controlled trial in a frail patient population (the SILENCE study). BMC Palliat Care. 2018;17(1):105. DOI: 10.1186/s12904-018-0359-4.
- A controlled trial to improve care for seriously ill hospitalized patients. The study to understand prognoses and preferences for outcomes and risks of treatments (SUPPORT). The SUPPORT Principal Investigators. JAMA. 1995;274(20):1591-8.
- Doyle D, Woodruff R. The IAHCP Manual of Palliative Care. 2ª ed. International Association for Hospice and Palliative Care Press; 2008.
- Morita T, Chinone Y, Ikenaga M, Miyoshi M, Nakaho T, Nishitateno K, et al. Efficacy and safety of palliative sedation therapy: a multicenter, prospective, observational study conducted on specialized palliative care units in Japan. J Pain Symptom Manage. 2005;30(4):320-8. DOI: 10.1016/j.jpainsymman.2005.03.017.
- Cowan JD, Clemens L, Palmer T. Palliative sedation in a southern Appalachian community. Am J Hosp Palliat Care. 2006;23(5):360-8. DOI: 10.1177/1049909106292173.
- de Graeff A, Dean Palliative sedation therapy in the last weeks of life: a literature review and recommendations for standards. J Palliat Med. 2007;10(1):67-85. DOI: 10.1089/jpm.2006.0139.
- Cherny NI, Radbruch L, Board of the European Association for Palliative C. European Association for Palliative Care (EAPC) recommended framework for the use of sedation in palliative care. Palliat Med. 2009;23(7):581-93. DOI: 10.1177/0269216309107024.
- Cherny NI, Portenoy RK. Sedation in the management of refractory symptoms: guidelines for evaluation and treatment. J Palliat Care. 1994;10(2):31-8.
- Beller EM, van Driel ML, McGregor L, Truong S, Mitchell G. Palliative pharmacological sedation for terminally ill adults. Cochrane Database Syst Rev. 2015;1(1):CD010206-CD. DOI: 10.1002/14651858.CD010206.pub2.
- Alonso-Babarro A, Varela-Cerdeira M, Torres-Vigil I, Rodríguez-Barrientos R, Bruera E. At-home palliative sedation for end-of-life cancer patients. Palliat Med. 2010;24(5):486-92. DOI: 10.1177/0269216309359996.
- Bulli F, Miccinesi G, Biancalani E, Fallai M, Mannocci M, Paci E, et al. Continuous deep sedation in home palliative care units: case studies in the Florence area in 2000 and in 2003-2004. Minerva Anestesiol. 2007;73(5):291-8.
- Caraceni A, Zecca E, Martini C, Gorni G, Campa T, Brunelli C, et al. Palliative sedation at the end of life at a tertiary cancer center. Support Care Cancer. 2012;20(6):1299-307. DOI: 10.1007/s00520-011-1217-6.
- Chiu TY, Hu WY, Lue BH, Cheng SY, Chen CY. Sedation for refractory symptoms of terminal cancer patients in Taiwan. J Pain Symptom Manage. 2001;21(6):467-72. DOI: 10.1016/s0885- 3924(01)00286-x.
- Fainsinger RL, Landman W, Hoskings M, Bruera E. Sedation for uncontrolled symptoms in a South African hospice. J Pain Symptom Manage. 1998;16(3):145-52. DOI: 10.1016/s0885- 3924(98)00066-9.
- Kohara H, Ueoka H, Takeyama H, Murakami T, Morita T. Sedation for terminally ill patients with cancer with uncontrollable physical distress. J Palliat Med. 2005;8(1):20-5. DOI: 10.1089/ jpm.2005.8.20.
- Maltoni M, Pittureri C, Scarpi E, Piccinini L, Martini F, Turci P, et al. Palliative sedation therapy does not hasten death: results from a prospective multicenter study. Ann Oncol. 2009;20(7):1163-9. DOI: 10.1093/annonc/mdp048.
- Maltoni M, Miccinesi G, Morino P, Scarpi E, Bulli F, Martini F, et al. Prospective observational Italian study on palliative sedation in two hospice settings: differences in casemixes and clinical care. Support Care Cancer. 2012;20(11):2829-36. DOI: 10.1007/s00520-012-1407-x.
- Muller-Busch HC, Andres I, Jehser T. Sedation in palliative care – a critical analysis of 7 years experience. BMC Palliat Care. 2003;2(1):2-. DOI: 10.1186/1472-684X-2-2.
- Radha Krishna LK, Poulose VJ, Goh C. The use of midazolam and haloperidol in cancer patients at the end of life. Singapore medical journal. 2012;53(1):62-6.
- Rietjens JAC, van Zuylen L, van Veluw H, van der Wijk L, van der Heide A, van der Rijt CCD. Palliative sedation in a specialized unit for acute palliative care in a cancer hospital: comparing patients dying with and without palliative sedation. J Pain Symptom Manage. 2008;36(3):228- 34. DOI: 10.1016/j.jpainsymman.2007.10.014.
- Stone P, Phillips C, Spruyt O,Waight C. A comparison of the use of sedatives in a hospital support team and in a hospice. Palliat Med. 1997;11(2):140-4. DOI: 10.1177/026921639701100208.
- Sykes N, Thorns A. Sedative use in the last week of life and the implications for end-of-life decision making. Arch Intern Med. 2003;163(3):341-4. DOI: 10.1001/archinte.163.3.341.
- Vitetta L,Kenner D, Sali A. Sedation and analgesia-prescribing patterns in terminally ill patients at the end of life. Am J Hosp Palliat Care. 2005;22(6):465-73.DOI: 10.1177/104990910502200601.
- Prado BL, Gomes DBD, Usón Júnior PLS, Taranto P, França MS, Eiger D, et al. Continuous palliative sedation for patients with advanced cancer at a tertiary care cancer center. BMC Palliat Care. 2018;17(1):13-. DOI: 10.1186/s12904-017-0264-2.
- Boulanger A, Chabal T, Fichaux M, Destandau M, La Piana JM, Auquier P, et al. Opinions about the new law on end-of-life issues in a sample of french patients receiving palliative care. BMC Palliat Care. 2017;16(1):7-. DOI: 10.1186/s12904-016-0174-8.
- Bruinsma SM, Brown J, van der Heide A, Deliens L, Anquinet L, Payne SA, et al. Making sense of continuous sedation in end-of-life care for cancer patients: an interview study with bereaved relatives in three European countries. Support Care Cancer. 2014;22(12):3243-52. DOI: 10.1007/s00520-014-2344-7.
- Bruinsma SM, van der Heide A, van der Lee ML, Vergouwe Y, Rietjens JAC. No Negative Impact of Palliative Sedation on Relatives’ Experience of the Dying Phase and Their Wellbeing after the Patient’s Death: An Observational Study. PloS one. 2016;11(2):e0149250-e. DOI: 1371/journal.pone.0149250.
- Eun Y, Hong I-W, Bruera E, Kang JH. Qualitative Study on the Perceptions of Terminally Ill Cancer Patients and Their Family Members Regarding End-of-Life Experiences Focusing on Palliative Sedation. J Pain Symptom Manage. 2017;53(6):1010-6. DOI: 10.1016/j. jpainsymman.2016.12.353.
- Fainsinger RL, Núñez-Olarte JM, Demoissac DM. The cultural differences in perceived value of disclosure and cognition: Spain and Canada. J Palliat Care. 2003;19(1):43-8.
- Morita T, Ikenaga M, Adachi I, Narabayashi I, Kizawa Y, Honke Y, et al. Family experience with palliative sedation therapy for terminally ill cancer patients. J Pain Symptom Manage. 2004;28(6):557-65. DOI: 10.1016/j.jpainsymman.2004.03.004.
- Shen H-S, Chen S-Y, Cheung DST, Wang S-Y, Lee JJ, Lin C-C. Differential Family Experience of Palliative Sedation Therapy in Specialized Palliative or Critical Care Units. J Pain Symptom Manage. 2018;55(6):1531-9. DOI: 10.1016/j.jpainsymman.2018.02.007.
- Tursunov O, Cherny NI, Ganz FD. Experiences of Family Members of Dying Patients Receiving Palliative Sedation. Oncol Nurs Forum. 2016;43(6):E226-E32. DOI: 10.1188/16. ONF.E226-E232.
- van Dooren S, van Veluw HTM, van Zuylen L, Rietjens JAC, Passchier J, van der Rijt CCD. Exploration of concerns of relatives during continuous palliative sedation of their family members with cancer. J Pain Symptom Manage. 2009;38(3):452-9. DOI: 10.1016/j. jpainsymman.2008.11.011.
- Vayne-Bossert P, Zulian GB. Palliative sedation: from the family perspective. Am J Hosp Palliat Care. 2013;30(8):786-90. DOI: 10.1177/1049909112472930.
- Rietjens JAC, Deschepper R, Pasman R, Deliens L. Medical end-of-life decisions: does its use differ in vulnerable patient groups? A systematic review and meta-analysis. Social science & medicine (1982). 2012;74(8):1282-7. DOI: 10.1016/j.socscimed.2011.12.046.
- Benítez-Rosario MA, Morita T. Palliative sedation in clinical scenarios: results of a modified Delphi study. Support Care Cancer. 2019;27(5):1647-54. DOI: 10.1007/s00520-018-4409-5.
- Raus K, Brown J, Seale C, Rietjens JAC, Janssens R, Bruinsma S, et al. Continuous sedation until death: the everyday moral reasoning of physicians, nurses and family caregivers in the UK, The Netherlands and Belgium. BMC Med Ethics. 2014;15:14-. DOI: 10.1186/1472-6939- 15-14.
- Papavasiliou EE, Payne S, Brearley S, Euroimpact. Current debates on end-of-life sedation: an international expert elicitation study. Support Care Cancer. 2014;22(8):2141-9. DOI: 10.1007/ s00520-014-2200-9.
- Abarshi E, Rietjens J, Robijn L, Caraceni A, Payne S, Deliens L, et al. International variations in clinical practice guidelines for palliative sedation: a systematic review. BMJ Support Palliat Care. 2017;7(3):223-9. DOI: 10.1136/bmjspcare-2016-001159.
- Schildmann EK, Schildmann J, Kiesewetter I. Medication and monitoring in palliative sedation therapy: a systematic review and quality assessment of published guidelines. J Pain Symptom Manage. 2015;49(4):734-46. DOI: 10.1016/j.jpainsymman.2014.08.013.
- Sedación paliativa del prcpex, uso y recomendaciones. Guía clínica [Internet]. Mérida: Servicio Extremeño de Salud. FundeSalud; 2014. [consultado 04 feb 2020]. Disponible en: https://saludextremadura.ses.es.
- Sedación paliativa. Guía [Internet] Madrid: Consejo General de Colegios Oficiales de Médicos; 2012. [consultado 04 feb 2020]. Disponible en: https://www.cgcom.es.
- Voeuk A, Nekolaichuk C, Fainsinger R, Huot A. Continuous Palliative Sedation for Existential Distress? A Survey of Canadian Palliative Care Physicians’ Views. J Palliat Care. 2017;32(1):26-33. DOI: 10.1177/0825859717711301.
- Rodrigues P, Crokaert J, Gastmans C. Palliative Sedation for Existential Suffering: A Systematic Review of Argument-Based Ethics Literature. J Pain Symptom Manage. 2018;55(6):1577-90. DOI: 10.1016/j.jpainsymman.2018.01.013.
- Henry B. A systematic literature review on the ethics of palliative sedation: an update (2016). Current opinion in supportive and palliative care. 2016;10(3):201-7. DOI: 10.1097/ SPC.0000000000000224.
- Twycross R. Reflections on palliative sedation. Palliative care. 2019;12:1178224218823511-. DOI: 1177/1178224218823511.
- Ely EW, Truman B, Shintani A, Thomason JWW, Wheeler AP, Gordon S, et al. Monitoring sedation status over time in ICU patients: reliability and validity of the Richmond Agitation- Sedation Scale (RASS). JAMA. 2003;289(22):2983-91. DOI: 10.1001/jama.289.22.2983.
- Benítez-Rosario MA, Castillo-Padrós M, Garrido-Bernet B, González-Guillermo T, Martínez- Castillo LP, González A, et al. Appropriateness and reliability testing of the modified Richmond Agitation-Sedation Scale in Spanish patients with advanced cancer. J Pain Symptom Manage. 2013;45(6):1112-9. DOI: 10.1016/j.jpainsymman.2012.05.015.
- Sacristán Rodea A, Peláez Moya S, Bullich Marín I, García Aparicio M, Coords. Manejo en domicilio de pacientes al final de la vida que requieran sedación paliativa en el contexto de la pandemia por COVID-19. Madrid: Ministerio de Sanidad; 2020. Disponible en: https://www.mscbs.gob.es.
- Grupo de trabajo para la actualización del Manual de Elaboración de GPC. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; Zaragoza: Instituto Aragonés de Ciencias de la Salud (IACS); 2016.
- AGREE Next Steps Consortium. Appraisal of guidelines for research and evaluation II: AGREE II instrument [Internet]. Disponible en: http://www.agreetrust.org.
- Schünemann HJ, Wiercioch W, Brozek J, Etxeandia-Ikobaltzeta I, Mustafa RA, Manja V, et al. GRADE Evidence to Decision (EtD) frameworks for adoption, adaptation, and de novo development of trustworthy recommendations: GRADE-ADOLOPMENT. J Clin Epidemiol. 2017;81:101-10. DOI: 10.1016/j.jclinepi.2016.09.009.
- Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. Bmj. 2017;358:j4008. DOI: 10.1136/bmj.j4008.
- GRADE working group. Grading of Recommendations of Assessment Development and Evaluations[Internet].[consultado 25 sep 2020].Disponible en: http://www.gradeworkinggroup.org/.
- Lewin S, Glenton C, Munthe-Kaas H, Carlsen B, Colvin CJ, Gülmezoglu M, et al. Using qualitative evidence in decision making for health and social interventions: an approach to assess confidence in findings from qualitative evidence syntheses (GRADE-CERQual). PLoS Med. 2015;12(10):e1001895. DOI: 10.1371/journal.pmed.1001895.
- Melzack R. The McGill Pain Questionnaire: major properties and scoring methods. Pain. 1975;1(3):277-99. DOI: 10.1016/0304-3959(75)90044-5.
- Cleeland CS, Ryan KM. Pain assessment: global use of the Brief Pain Inventory. Ann Acad Med Singap. 1994;23(2):129-38.
- Monsalve V, Soriano J, De Andrés J. Utilidad del Índice de Lattinen (IL) en la evaluación del dolor crónico: relaciones con afrontamiento y calidad de vida. Rev Soc Esp Dolor. 2006;4:216-29.
- González-Escalada JR, Camba A, Muriel C, Rodríguez M, Contreras D, Barutell Cd. Validación del índice de Lattinen para la evaluación del paciente con dolor crónico. Rev Soc Esp Dolor. 2012;19(4):181-8.
- Bouhassira D, Attal N, Alchaar H, Boureau F, Brochet B, Bruxelle J, et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain. 2005;114(1-2):29-36. DOI: 10.1016/j. pain.2004.12.010.
- Perez C, Galvez R, Huelbes S, Insausti J, Bouhassira D, Diaz S, et al. Validity and reliability of the Spanish version of the DN4 (Douleur Neuropathique 4 questions) questionnaire for differential diagnosis of pain syndromes associated to a neuropathic or somatic component. Health Qual Life Outcomes. 2007;5:66. DOI: 10.1186/1477-7525-5-66.
- Bennet M. The LANSS Pain Scale: the Leeds assessment of neuropathic symptoms and signs. Rev Soc Esp Dolor. 2002;9:74-87.
- Kunz M, Scharmann S, Hemmeter U, Schepelmann K, Lautenbacher S. The facial expression of pain in patients with dementia. Pain. 2007;133(1):221-8.
- Campbell JP, Dunnette MD, Arvey RD, Hellervik LV. The development and evaluation of behaviorally based rating scales. Journal of Applied Psychology. 1973;57(1):15–22.
- Warden V, Hurley AC, Volicer L. Development and psychometric evaluation of the Pain Assessment in Advanced Dementia (PAINAD) scale. J Am Med Dir Assoc. 2003;4(1):9-15. DOI: 10.1097/01.jam.0000043422.31640.f7.
- Sociedad española de cuidados paliativos. Guía de cuidados paliativos. Madrid: SECPAL. Disponible en: http://www.secpal.com//Documentos/Paginas/guiacp.pdf.
- Mc Closkey Dochterman J, Bulechek GM. Ed. lit. Nursing Interventions Classification (NIC). Iowa: The University of Iowa; 2017
- Materiales informativos y de apoyo para cuidadores y profesionales. Paliex (Programa Regional de Cuidados Paliativos de Extremadura) [Internet]. Cáceres: Servicio Extremeño de Salud; 2017 [consultado 20 sep 2020]. Disponible en: https://saludextremadura.ses.es/paliex/materiales-informativos-y-de-apoyo-para-cuidadores-y-profesionales.
- Pérez-Hernández C, Alonso-Babarro A, Ramo-Aguerri A, Villegas-Estévez F, Virizuela-Echaburu JA. Guía para el Abordaje Interdisciplinar del Dolor Oncológico. Disponible en: http://www.aeasarcomas.org/media/files/Documentos%20pdf/Guia-GADO-Interactiva.pdf.
- Álvaro Pardo M, Bavestrello Aljaro P, Bleda Pérez M, Calsina-Berna A, Casas Homs E, Corcoy de Febrer B, et al. Control de síntomas en pacientes con cáncer. 4 ed. Madrid: Arán Ediciones; 2019.
- González-Barboteo J, Trelis-Navarro J, Tuca-Rodríguez A, Gómez-Batiste X. Rotación de opioides: una alternativa en el tratamiento del dolor refractario en pacientes con cáncer. Med Clin (Barc). 2010;135 (13):617-22.
- Mercadamte S. Death rattle: critical review and research agenda. Support Care Cancer. 2014;22(2):571-5. DOI: 10.1007/s00520-013-2047-5.
- Ruíz Márquez MP, Alonso Prado ME. Guía Clínica. Uso y recomendaciones de la Vía Subcutánea en Cuidados Paliativos [Monografía en internet]: Observatorio Regional de Cuidados Paliativos de Extremadura; 2010 [consultado 13 ene 2021]. Disponible en: http://www.secpal.com///Documentos/Blog/via%20subcutanea.pdf.
- Gallardo Avilés R, Gamboa Antiñolo F. Uso de la vía subcutánea en Cuidados Paliativos [Monografía en internet]; 2013. Disponible en: http://www.secpal.com/%5CDocumentos%5CBlog%5Cmonografia_secpal_04.pdf.
- National Ethics Committee VHA. The ethics of palliative sedation as a therapy of last resort. Am J Hosp Palliat Care. 2006;23(6):483-91. DOI: 10.1177/1049909106294883.
- Hastings Center. Los fines de la medicina. 2ª ed. Barcelona: Fundació Víctor Grifols i Lucas; 2007.
- Marí-Klose M, Miguel JM. El canon de la muerte. Política y Sociedad. 2000;35:15-43.
- Comité de Bioética de España. Atención al final de la vida: necesaria acreditación de los profesionales [Internet]. [consultado 29 sep 2018]. Disponible en: http://assets.es/files/documentacion/Declaracion%20Cuidados%20Paliativos%20-%20CBE.pdf.
- Barbero J. El derecho del paciente a la información: el arte de comunicar. Anales del Sistema Sanitario de Navarra. 2006 (Supl 3):19-27.
- Alonso BA. Atención a la familia. Aten Primaria. 2006;38(Supl 2):14-20.
- Barrio I, Simón P, Júdez J. De las voluntades anticipadas o Instrucciones Previas a la planificación de las decisiones. Nure Investigacion. 2004 (5).
- Emanuel EJ, Emanuel LL. Four models of the physician-patient relationship. JAMA. 1992;267(16):2221-6.
- Earle CC, Park ER, Lai B, Weeks JC, Ayanian JZ, Block S. Identifying potential indicators of the quality of end-of-life cancer care from administrative data. J Clin Oncol. 2003;21(6):1133- DOI: 10.1200/jco.2003.03.059.
- Comisión Gallega de Bioética. Los cuidados al final de la vida. Santiago de Compostela: Xunta de Galicia, Consellería de Sanidad, Servicio Gallego de Salud; 2012.
- Ameneiros-Lago E, Carballada-Rico C, Garrido-Sanjuán JA, García Martínez A. Adecuación de las intervenciones clínicas en pacientes con enfermedad avanzada y compleja. Propuesta de algoritmo para la toma de decisiones. Rev Calid Asist. 2015;30(1):38-43. DOI: 10.1016/j. cali.2014.12.010.
- Quill TE, Holloway R. Time-limited trials near the end of life. JAMA. 2011;306(13):1483-4. DOI: 10.1001/jama.2011.1413.
- Lipton HL. Do-not-resuscitate decisions in a community hospital. Incidence, implications, and outcomes. JAMA. 1986;256(9):1164-9.
- Ouslander J, Osterweil D, Morley J. Medical Care in the nursing home. Ethical and legal issues: McGraw-Hill; 1997.
- Couceiro A. Ética en Cuidados Paliativos. Triacastela: Madrid; 2004.
- Grupo de Trabajo Atención Médica al Final de la Vida, Organización Médica Colegial, Sociedad Española de Cuidados Paliativos. Ética de la alimentación e hidratación al final de la vida. Madrid; 2016. Disponible en: http://infocuidadospaliativos.com/wp-content/uploads/2016/10/etica_alimentacioo%CC%81n_fin_de_la_vida_octubre16.pdf
- Hart JT. The inverse care law. Lancet. 1971;1(7696):405-12. DOI: 10.1016/s0140- 6736(71)92410-x.
- Watt G. The inverse care law today. Lancet. 2002;360(9328):252-4. DOI: 10.1016/S0140- 6736(02)09466-7.
- Amor-Pan JR, Barón-Duarte FJ, Regueiro-García A, Vázquez-Rivera F. Bioética y Oncología. Una puerta abierta a la oportunidad. Vigo: Sociedad Oncológica de Galicia; 2017.



