Guía de Práctica Clínica sobre Cuidados Paliativos en Pediatría
Guía de Práctica Clínica sobre Cuidados Paliativos en Pediatría
Introducción
1.1. Definición y población diana de los cuidados paliativos pediátricos. Particularidades de los cuidados paliativos pediátricos.
La Organización Mundial de la Salud (OMS) define los cuidados paliativos pediátricos (CPP) como el “cuidado total activo del cuerpo, la mente y el espíritu del niño, niña o adolescente, y la prestación de apoyo a la familia”1. La definición se completa con los siguientes principios:
- Comienzan cuando se diagnostica una enfermedad amenazante para la vida y prosiguen al margen de si el niño, niña o adolescente recibe o no tratamiento específico de la propia enfermedad.
- Los profesionales sanitarios deben evaluar y aliviar el sufrimiento físico, psicológico y social del niño, niña o adolescente.
- Para que los cuidados paliativos sean eficaces es preciso aplicar un enfoque multidisciplinar amplio que incluya a la familia y recurra a los recursos disponibles en la comunidad; pueden ponerse en práctica con eficacia incluso si los recursos son limitados, y dispensarse en centros de atención terciaria, en centros de salud comunitarios e incluso en el propio hogar.
Los cuidados paliativos para niños son únicos y específicos; requieren habilidades, organización y recursos diferentes a los de los adultos. Uno de los aspectos que distinguen la atención paliativa en la edad pediátrica es la amplia variedad de enfermedades amenazantes para la vida o de pronóstico letal que son candidatas a ser objeto de CPP. Los pacientes se clasifican en 4 grupos según su enfermedad2:
- Grupo 1. Sufren enfermedades graves, para las cuales el tratamiento curativo existe, pero puede fracasar. Ejemplo: cancer, transplante por fallo de órganos vitales (corazón, hígado y pulmón),
- Grupo 2. Sufren enfermedades en las que la muerte prematura es inevitable, pero, con el tratamiento adecuado, se prolonga la vida durante largos periodos de tiempo. Ejemplo: fibrosis quística, distrofia muscular de Duchenne, epidermólisis bullosa.
- Grupo 3. Sufren enfermedades progresivas sin opciones de tratamiento curativo, sólo paliativo. Ejemplos: trastornos neuromusculares o neurodegenerativos, trastornos metabólicos progresivos, cáncer avanzado con metástasis en el momento del diagnóstico.
- Grupo 4. Sufren procesos irreversibles, pero no progresivos, asociados con discapacidad grave, que conllevan una extrema vulnerabilidad de padecer complicaciones que den lugar a una muerte prematura. Ejemplo: parálisis cerebral grave, síndromes polimalformativos.
Otras características distintivas, responsables de la complejidad de la atención paliativa en la edad pediátrica, son3:
- El número de casos que requieren cuidados paliativos pediátricos es inferior al de los adultos. Esto, unido a la dispersión geográfica, influye de manera importante en el diseño y organización de los CPP y en la dotación de recursos necesarios.
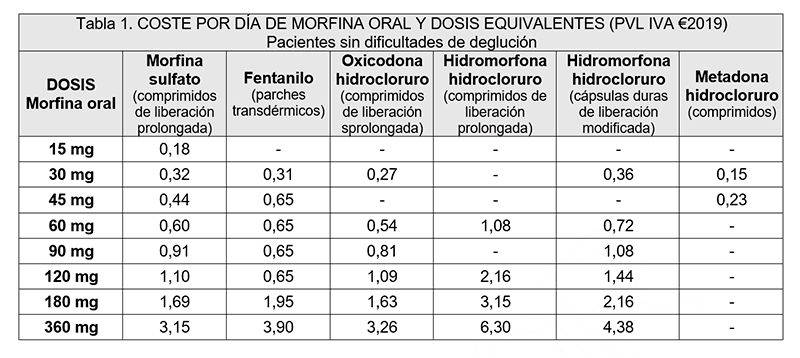
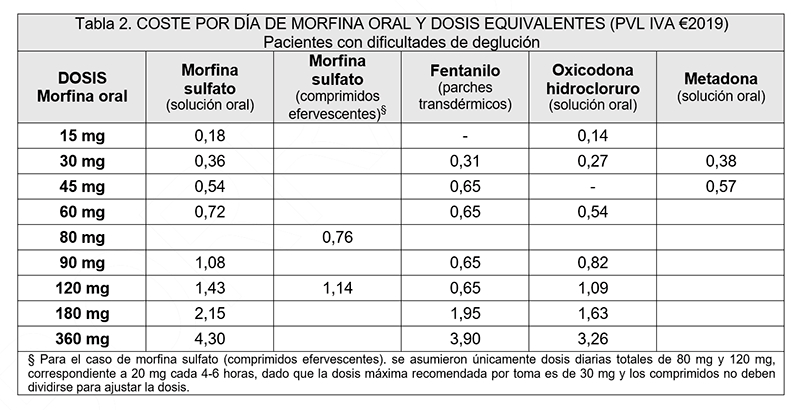
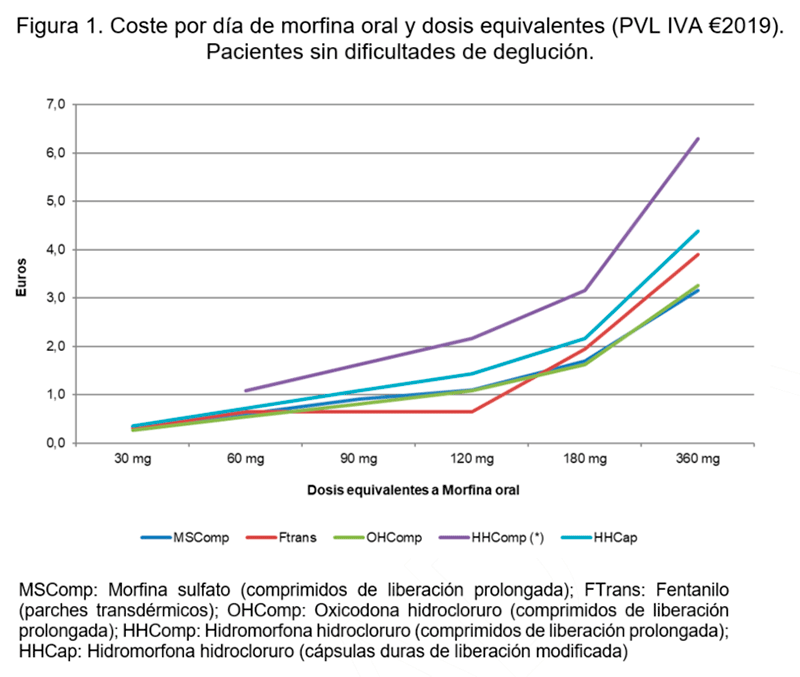
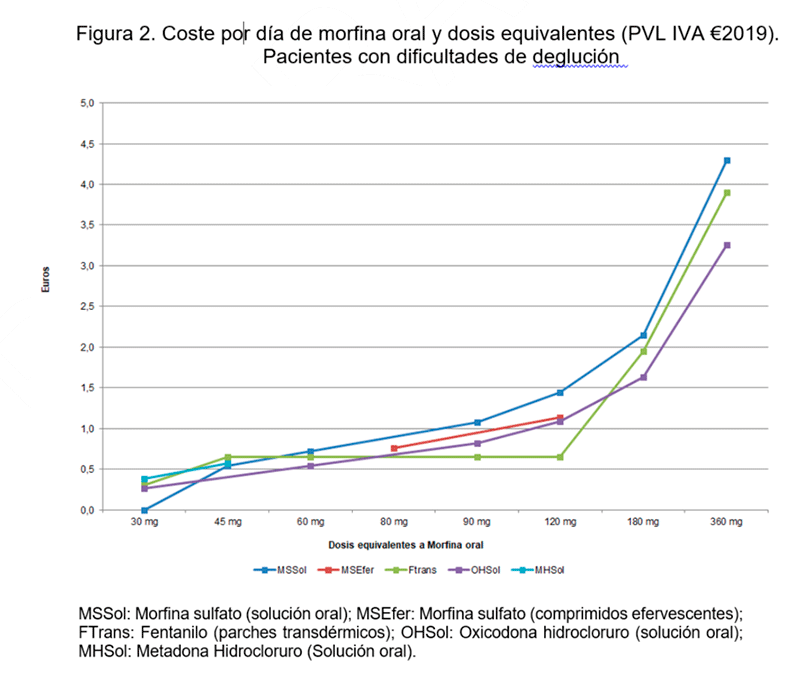
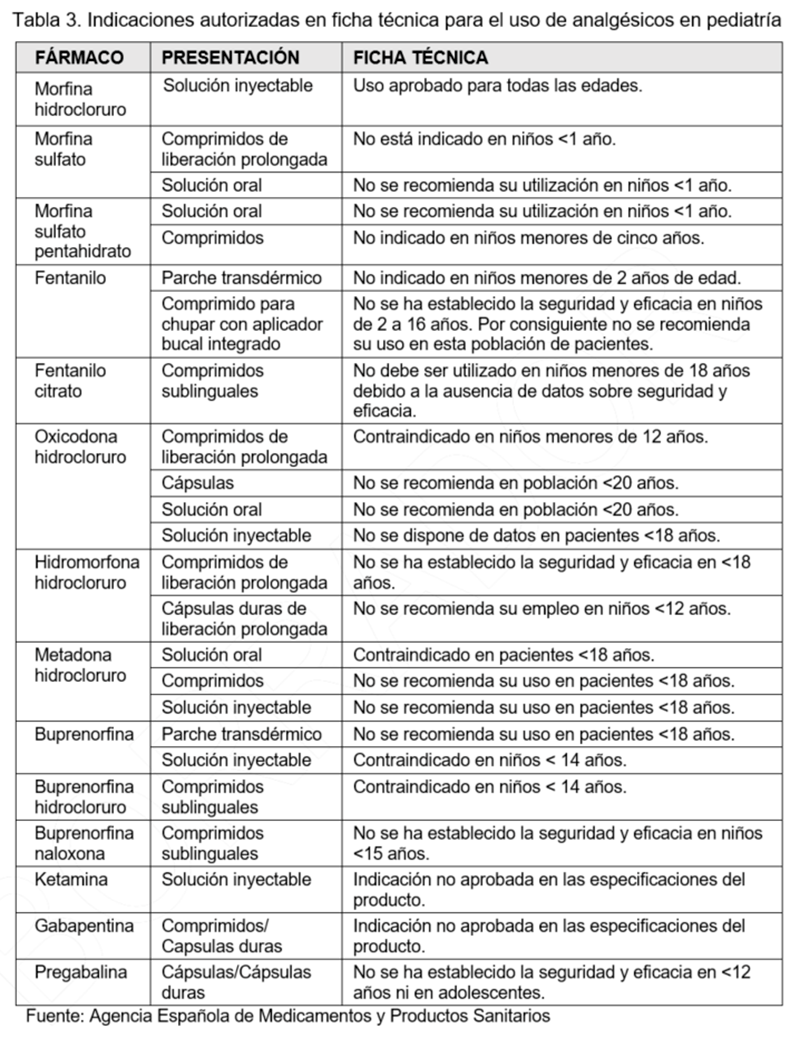
- La disponibilidad de fármacos específicos para menores de edad es muy limitada. En ausencia de alternativas adecuadas, el tratamiento se prescribe al margen de la ficha técnica. La presentación en forma de suspensión, más fácil de administrar, raramente está disponible (por ejemplo, opioides de liberación prolongada para el tratamiento del dolor).
- Aunque los referentes legales son los padres o tutores, deben respetarse los derechos del niño, niña o adolescente, sus deseos y su participación en la toma de decisiones sobre cuestiones que afectan a su propia salud. Puede haber conflictos entre la ética, la conducta profesional y la legislación, especialmente en lo que concierne a los menores de edad.
- El desarrollo físico, cognitivo, emocional y social en la etapa infantil es constante. Las distintas etapas del desarrollo madurativo afectan a todo lo relacionado con el cuidado del paciente, desde la dosis de la medicación, a la forma de comunicación, educación y apoyo.
- La implicación emocional de la familia, los cuidadores y los profesionales hace más difícil aceptar la irreversibilidad de la enfermedad y la muerte. Tras la muerte, es más probable que el duelo sea prolongado y que, en ocasiones, se complique.
Debe enfatizarse el enorme impacto emocional que supone para el paciente y su familia afrontar un acontecimiento que no es habitual en esta etapa de la vida. Es necesario prestar la atención psicológica adecuada a cada uno de los integrantes de la unidad familiar con el fin de facilitar la adaptación a la nueva situación (cambios en las funciones propias de la familia, en sus roles y nivel de comunicación) y atender la posible aparición de alteraciones psicopatológicas secundarias, así como el afrontamiento al final de la vida. Los cuidados paliativos pueden resultar una labor gratificante y, a la vez, muy exigente, por lo que atender al cuidado psicológico de los profesionales que trabajan en este ámbito es también necesario.
1.2. Epidemiología
En los últimos años, el mundo desarrollado ha asistido a un aumento en la prevalencia de enfermedades incurables y discapacidades. Los avances médicos y tecnológicos han reducido la mortalidad en la infancia y han mejorado la supervivencia de los pacientes en edad pediátrica con patologías graves y potencialmente letales, que requieren cuidados paliativos complejos.
Los CPP pueden comenzar en la etapa prenatal y, en algunos casos, prolongarse más allá de los 18 años, cuando dan soporte en la transición a los cuidados paliativos en adultos. Abarcan toda la trayectoria de la enfermedad, generalmente desde el diagnóstico hasta los cuidados al final de la vida, y se mantienen durante el proceso de duelo (apoyo a la familia). El rango de posibles diagnósticos es muy amplio (más de 300); sin embargo, una proporción significativa de pacientes con necesidad de CPP (hasta un 15%) no tienen un diagnóstico de base definitivo4.
La mayoría de las muertes ocurren dentro del primer año de vida (un tercio de las cuales tienen lugar en los primeros 28 días de vida) debido, principalmente, a malformaciones congénitas, deformidades y anomalías cromosómicas. Después del primer año de vida es más probable que la causa de la muerte sea una enfermedad neurodegenerativa o neoplásica5.
Según un estudio que investiga las necesidades de CPP a nivel global, asumiendo una prevalencia similar a países de nuestro entorno, en España se estima una prevalencia de 25-30 menores con enfermedades que limitan o amenazan sus vidas por cada 10.000 niños6. De ellos, mueren al año entre 930 y 1.500. El cáncer es responsable del 30% de las muertes, mientras que el 70% de las muertes es debido a enfermedades neurodegenerativas, metabólicas y genéticas5,7.
Disponer de datos epidemiológicos precisos y exhaustivos que ayuden a estimar las necesidades de cuidados paliativos en todos los ámbitos de edad (perinatal y neonatal, infancia y adolescencia), es un aspecto clave para poder organizar la atención paliativa pediátrica especializada.
1.3. Niveles de atención en cuidados paliativos en pediatría
El paciente pediátrico en cuidados paliativos y su familia constituyen la unidad de atención. La asistencia debe prestarse por un equipo multidisciplinar de profesionales de diferentes especialidades que cooperen desde una perspectiva integral y multidimensional para asegurar los objetivos terapéuticos consensuados entre el equipo, el paciente y su familia. La complejidad de cuidados y la multiplicidad de especialistas hace imprescindible la figura del médico responsable, “profesional que tiene a su cargo coordinar la información y la asistencia sanitaria del paciente o del usuario, con el carácter de interlocutor principal del mismo en todo lo referente a su atención e información durante el proceso asistencial, sin perjuicio de las obligaciones de otros profesionales que participan en las actuaciones asistenciales” (Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica)8,9.
Los CPP deben comenzar de forma temprana, tras el diagnóstico de la enfermedad incapacitante o amenazante para la vida y continuar a lo largo de toda la enfermedad. Esto significa que la atención paliativa está indicada, incluso, en fases de tratamiento activo. Agotar todos los recursos curativos antes de emplear los cuidados paliativos, supone que éstos se iniciarán demasiado tarde5.
Los CPP se dividen en niveles de atención según la complejidad de los cuidados y el grado de especialización en atención paliativa10.
- El primer nivel o enfoque paliativo, compete a todos los profesionales sanitarios. Hace referencia a la aceptación de la irreversibilidad del proceso y la posibilidad de fallecimiento, proporcionando al paciente y su familia los cuidados que necesiten para estar bien, en cualquier ámbito de atención.
- El segundo nivel o cuidados paliativos generales, corresponde a los profesionales con especialidades que atienden a un mayor número de pacientes al final de su vida (Cuidados Intensivos, Oncología, Neuropediatría, Enfermería Pediátrica, etc.). Estos profesionales tienen formación específica en cuidados paliativos. Aunque no se dediquen a la atención paliativa de forma exclusiva, los pacientes y sus familias pueden beneficiarse de su experiencia y conocimientos en el control de síntomas, implicación en la toma de decisiones y atención al final de la vida.
- El tercer nivel o cuidados paliativos específicos, está dirigido a enfermedades o situaciones muy complejas que requieren de los cuidados continuados de un equipo multidisciplinar especializado, que dedica su actividad asistencial exclusivamente a los cuidados paliativos.
Debe existir una relación fluida entre los tres niveles, con una comunicación constante. En este sentido es fundamental el trabajo activo de los responsables de la asistencia sanitaria del menor para establecer y mantener mecanismos de coordinación y de intercambio de información entre todos los niveles y recursos implicados. Conviene tener presente que la atención paliativa debe cumplir objetivos dirigidos a respetar el mejor interés para el paciente tales como: permanecer asintomático o con los menores síntomas posibles, vivir en el domicilio, mantener la escolarización y las relaciones con los seres queridos9.
El paciente pediátrico precisa la atención específica de un equipo de cuidados paliativos cuando su trayectoria clínica alcanza el punto de inflexión, manifestado como una aceleración en el empeoramiento clínico, disminución de los intervalos libres de síntomas, incremento de los ingresos hospitalarios y ausencia de respuesta a la escalada de tratamientos11. Es importante reconocer que el paciente ha iniciado la fase final de su enfermedad para adaptar los objetivos terapéuticos, que se orientarán a reforzar o instaurar cuidados que aseguren el alivio y el confort del paciente cuando se acerca el final de su vida5,9.
1.4. Prestación de CPP en el Sistema Nacional de Salud
La publicación en 2014 del documento Cuidados Paliativos Pediátricos en el Sistema Nacional de Salud: Criterios de Atención5 supone un punto de inflexión en la historia reciente de los CPP en España. Este documento define un marco de referencia para la atención de los pacientes en edad pediátrica con necesidades de cuidados paliativos. Propone un modelo de atención integral que contempla las esferas física, psicológica, espiritual y social del paciente y su familia. En lo referente a la organización de los CPP, formula una serie de criterios que tienen en cuenta la diversidad entre Comunidades Autónomas (CCAA) respecto a población infantil, dispersión y organización de los recursos. A continuación, se describen algunos de los criterios más relevantes:
- Se insta a las CCAA al desarrollo de un apartado específico de Cuidados Paliativos Pediátricos dentro de los Planes Integrales de Cuidados Paliativos.
- Cada CCAA debe contar, al menos, con un equipo interdisciplinar pediátrico de referencia con formación específica. Existe la posibilidad de establecer redes con equipos de otras CCAA limítrofes para atender a estos pacientes y sus familias.
- La atención domiciliaria se realizará por medio de equipos específicos pediátricos u otros recursos asistenciales como pueden ser los equipos avanzados con formación en CPP.
- Se ofrecerá, al menos, atención telefónica 24 horas al día, los 365 días del año, para pacientes, familias y profesionales.
En nuestro medio, existen distintos recursos asistenciales de atención especializada en CPP como los equipos de atención domiciliaria y hospitalización a domicilio, los equipos de soporte hospitalarios o las unidades de CPP (UCPP). Las UCPP son unidades de hospitalización específicas de CPP, atendidas por un equipo interdisciplinar compuesto, como mínimo, por un profesional médico y otro de enfermería con formación específica en CPP, un/a psicólogo/a clínico/a y un/a trabajador/a social. Con frecuencia, las UCPP realizan también labores de equipo de soporte hospitalario, atención domiciliaria y consulta externa12.
Tras la publicación del documento de criterios de atención en CPP5 algunas comunidades autónomas han actualizado o puesto en marcha recursos destinados a cubrir la atención paliativa pediátrica. Sin embargo, todavía existe una importante heterogeneidad organizativa y en recursos asistenciales12,13.
Alcance y objetivos
Los cuidados paliativos pediátricos son: “Cuidados activos totales del cuerpo, la mente y el espíritu del niño incluyendo también el apoyo a la familia. Comienzan cuando se diagnostica una enfermedad amenazante para la vida y continúan independientemente de si el niño recibe o no tratamiento de la propia enfermedad”5.
OBJETIVOS
- Objetivo general
El objetivo de la GPC sobre Cuidados Paliativos en Pediatría es ofrecer un conjunto de recomendaciones basadas en la evidencia científica para mejorar la atención integral prestada a la población infantil y adolescente con enfermedad amenazante y/o limitante para la vida, desde su inicio, y a su familia.
- Objetivos específicos
- Disminuir la variabilidad injustificada en la práctica clínica en aspectos clave del manejo terapéutico de los síntomas en CPP.
- Ofrecer al profesional recomendaciones basadas en la evidencia científica para mejorar la asistencia en los distintos niveles de atención de los CPP.
- Proporcionar información útil para mejorar la comunicación entre el paciente, los familiares y/o cuidadores y los profesionales relacionados con la atención en CPP en alguno de sus aspectos.
- Detectar áreas para las que es necesario generar evidencia científica y establecer recomendaciones para futuras líneas de investigación en CPP.
ALCANCE
- Población diana
La población diana de la guía son los niños, niñas y adolescentes hasta la edad de 18 años con enfermedad amenazante y/o limitante para la vida, sus familiares y/o cuidadores. Entre estas situaciones se encuentran un amplio rango de enfermedades neurológicas, metabólicas, digestivas, cromosómicas, cardiológicas, respiratorias e infecciosas, oncológicas, complicaciones por prematuridad, y trauma5.
- Aspectos contemplados en la GPC
Esta GPC aborda cuestiones relacionadas con el control de síntomas en CPP y con la comunicación de los profesionales sanitarios con el paciente y su familia y/o cuidadores.
No se abordan aspectos organizativos de los CPP. Tampoco es objeto de la GPC la aflicción y duelo después de la muerte, ni el abordaje de las consecuencias físicas y emocionales que sufren los profesionales involucrados en el cuidado de estos pacientes.
- Niveles asistenciales
La GPC se centra en el ámbito del Sistema Nacional de Salud, en Atención Primaria y Atención Especializada y en todos los ámbitos donde se proporcionan CPP.
- Usuarios a los que va dirigida la GPC
La GPC se dirige a todos los profesionales que atienden en un determinado momento a la población diana: Pediatras de Atención Primaria y Hospitalaria, Médicos de Familia, Psicólogos/as Clínicos/as y Psicólogos/as Generales Sanitarios/as, Enfermeros/as de Atención Primaria y Hospitalaria y de centros sociosanitarios, Farmacéuticos/as, Paliativistas de adultos, Trabajadores/as Sociales, Acompañantes Espirituales, Terapeutas ocupacionales, Fisioterapeutas, Rehabilitadores, Traumatólogos y Profesionales que trabajan en Cuidados Paliativos de Adultos (que atiendan población pediátrica).
Asimismo, esta guía está dirigida a los pacientes y a sus familiares, a sociedades científicas y asociaciones de pacientes, así como a gestores sanitarios.
Recomendaciones
Tratamiento farmacológico del dolor moderado o grave en cuidados paliativos pediátricos
Actualizado a fecha: 30/06/2022
¿Qué analgésicos y a qué dosis son más efectivos y seguros para el tratamiento del dolor moderado o grave en cuidados paliativos pediátricos?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
- En la atención al dolor en CPP se propone un abordaje integral, con medidas farmacológicas y no farmacológicas, que tenga en cuenta la etiología del dolor, su fisiopatología (dolor nociceptivo, neuropático o mixto), su intensidad, y las características particulares del paciente y su familia.
- Se propone el uso de analgésicos opioides mayores para aliviar el dolor moderado o intenso en pacientes en CPP.
- Se propone la morfina como opioide mayor de primera elección para tratar el dolor persistente moderado o intenso en pacientes en CPP.
- No usar opioides menores (tramadol, codeína) para tratar el dolor moderado en pacientes en CPP. En pacientes en CPP con dolor moderado valorar el uso de analgésicos opioides mayores a dosis bajas .
- Si el tratamiento con un opioide no proporciona un alivio adecuado del dolor o si causa efectos adversos no tolerables, se propone cambiar a otro opioide.
- Las dosis de analgésicos opioides deben ajustarse (titularse) de forma individualizada y progresiva hasta que se encuentre la dosis mínima eficaz. Se deben monitorizar la respuesta al tratamiento y la aparición de efectos adversos.
- El tratamiento debe pautarse a intervalos regulares para proporcionar una analgesia de base, con dosis a demanda si hay exacerbaciones (dolor intercurrente), y por vía oral/enteral siempre que sea posible.
- Ante la sospecha de dolor neuropático, considerar el tratamiento con gabapentinoides, dosis bajas de antidepresivos tricíclicos o inhibidores selectivos de la recaptación de serotonina (ISRS) o un agente anti-NMDA (ketamina).
- Informar al paciente y su familia sobre los beneficios y los potenciales efectos adversos del tratamiento del dolor. Elaborar el plan terapéutico teniendo en cuenta las preferencias personales y las necesidades únicas de cada paciente y su familia.
Justificación
El grupo elaborador de la GPC (GEG) ha decidido formular una serie de consideraciones prácticas generales porque entiende que no es posible recomendar intervenciones concretas a partir de la evidencia encontrada, escasa y de muy baja calidad.
El GEG ha tenido en cuenta las directrices de la OMS sobre el tratamiento farmacológico del dolor persistente en niños con enfermedades médicas, además de su propia experiencia clínica. El tratamiento analgésico de los pacientes en CPP sigue una estrategia bifásica basada en la intensidad y duración del dolor.
El GEG reconoce que el manejo del dolor en estos pacientes es complejo por su etiología diversa y por los factores biológicos, cognitivos, psicológicos, socioculturales y espirituales que influyen en la percepción del dolor en el niño. Aunque no son objetivo de la pregunta, considera necesario recordar la importancia de las medidas no farmacológicas como garantizar un ambiente tranquilo, cambios posturales, calor o frío local, fisioterapia, etc.
Justificación detallada
La certidumbre sobre el efecto de las intervenciones se valoró como muy baja. Esto es consecuencia de las limitaciones metodológicas inherentes al diseño de los estudios. La evidencia identificada se limita a 8 estudios observacionales sin grupo control que comparan los resultados obtenidos antes y después de llevar a cabo la intervención17-24 . La intervención consiste en la modificación del tratamiento analgésico en pacientes pediátricos con dolor moderado o grave que no tienen un control adecuado del dolor y/o presentan efectos adversos graves asociados al uso de opioides. En concreto, investigan el cambio de un opioide oral (morfina u otro) a fentanilo transdérmico17,18 o metadona oral21,24; el cambio desde paracetamol o AINEs a fentanilo intravenoso20 o buprenorfina transdérmica23 como analgésico principal; y el tratamiento del dolor neuropático mediante la adición de ketamina al régimen analgésico19. Por último, un estudio investiga la efectividad y seguridad de la monoterapia con pregabalina en el tratamiento del dolor neuropático inducido por quimioterapia22. El GEG concluyó que las limitaciones de la evidencia no permiten formular recomendaciones en base a ella.
El GEG ha tenido en cuenta las recomendaciones de la Organización Mundial de la Salud (OMS)15 sobre el tratamiento farmacológico del dolor persistente en niños con enfermedades médicas. Estas recomendaciones se basan en evidencia indirecta procedente de estudios realizados en adultos con dolor crónico no oncológico y en comparaciones entre diferentes opioides y vías de administración en el dolor agudo y el dolor postoperatorio en niños. El panel de expertos de la GPC de la OMS recomienda la morfina como opioide potente de primera elección para tratar el dolor persistente moderado a intenso (recomendación fuerte). En esta recomendación tienen en cuenta la amplia experiencia clínica con su uso en niños, el hecho de que está disponible hace tiempo, los riesgos están bien descritos y que es poco probable que aparezca nueva evidencia de gran calidad. Se indica que no hay datos suficientes para recomendar ningún otro opioide alternativo a la morfina como opioide de primera elección. Entre los fármacos adyuvantes, no recomiendan el uso de corticosteroides ni bifosfonatos (recomendación débil) y alegan falta de información para las otras clases de fármacos adyuvantes (antidepresivos, anticonvulsivantes, etc.).
Se han tenido en consideración aspectos relacionados con la aceptabilidad. Los estándares de buenas prácticas en CPP sugieren limitar al máximo el uso de la vía intravenosa, intramuscular o subcutánea al dar el tratamiento analgésico. Los procedimientos invasivos pueden provocar ansiedad en el niño.
De la evidencia a la recomendación
¿Es prioritario este problema?
SíExiste cada vez más evidencia de que el dolor en los pacientes en CPP no se maneja adecuadamente. Un estudio transversal en población pediátrica con cáncer en cuidados paliativos observa que el 91,5% de los 164 pacientes del estudio experimentaron dolor en el último mes25. En otro estudio, el 87% de 47 pacientes con cáncer sintieron dolor durante el ‘estadio final’26. En otro estudio, el 60-70% de los padres consideraron que el alivio del dolor de sus hijos e hijas al final de la vida no fue adecuado27.
Estos datos indican que los pacientes en CPP con frecuencia sufren innecesariamente por falta de un buen control del dolor.
Aunque en España no conocemos datos concretos al respecto, el GEG considera que estos datos serían extrapolables a nuestro entorno. La práctica clínica nos dice que el dolor está infravalorado, sobre todo cuando la atención paliativa no se lleva a cabo en unidades especializadas en CPP.
¿Cuál es la magnitud de los efectos deseables esperados?
DesconocidaVariable de resultado: dolor (8 estudios)
- Un estudio realizado en pacientes pediátricos con cáncer (n=132) o enfermedad no maligna (n=67) muestra una disminución en la escala visual analógica (EVA) desde 3,7 ± 0,26 (puntuación basal media) a 3,1 ± 0,26 (puntuación media del día 16) al cambiar el tratamiento analgésico con opioide oral a fentanilo transdérmico18.
- Un estudio en pacientes pediátricos con cáncer o enfermedad neurológica o neuromuscular consigue un buen control del dolor (según escala propia) en el 73% (n=19) de los pacientes a los 15 días de cambiar a fentanilo transdérmico, frente al 61,5% (n=16) con morfina oral17.
- Un estudio realizado en 16 pacientes pediátricos con cáncer observa un 68,75% (n=11) de respuesta (puntuación escala Wong-Baker faces ≤2 y medicación de rescate ≤2 al día), al cambiar de opioide oral a buprenorfina transdérmica, a las 2 semanas del cambio23.
- Un estudio encuentra una disminución estadísticamente significativa en la puntuación media, tanto en la escala EVA (68,5 ± 0,2 frente a 40; p<0,001) como en la Affective Facial Scale (6,5 ± 0,8 frente a 4,18; p<0,001), después de 48 horas de analgesia intravenosa con fentanilo, en pacientes pediátricos (n=18) con cáncer avanzado que no responden a paracetamol ni a AINEs20.
- Un estudio observó mejoría analgésica en 16 (94%) pacientes pediátricos con cáncer al cambiar el tratamiento previo (otro opioide) a metadona21.
- Un estudio observó una disminución estadísticamente significativa en las puntuaciones medias (escala ‘ad hoc’) a los 17 días (n=33) (3,59 ± 0,61 vs. 1,80 ± 1,13, p<0,0001) y 55 días (n=20) (3,59 ± 0,61 vs. 1,15 ± 1,27) del inicio del tratamiento con metadona24.
- Un estudio observó, en 8 de 11 (73%) pacientes pediátricos con cáncer avanzado, un mejor control del dolor y la necesidad de menos dosis de opioides al añadir dosis bajas de ketamina (0,1 mg/kg/h a 0,2 mg/kg/h) al tratamiento analgésico19.
- Un estudio que evalúa la monoterapia con pregabalina oral (dosis media de 225 mg/día) del dolor neuropático inducido por quimioterapia, muestra una disminución del 59% respecto a la basal, en la puntuación EVA media (p<0,001)22.
Variable de resultado: calidad de vida (4 estudios)
- Un estudio realizado en pacientes pediátricos con cáncer (n=132) o enfermedad no maligna (n=67), observa un incremento respecto a la puntuación basal, en las puntuaciones de 11 de los 12 dominios del Child Health Questionnaire realizado por los padres o cuidadores (n=36), al mes y a los 3 meses del cambio de opioide oral a fentanilo transdérmico18.
- Un estudio en pacientes pediátricos con cáncer o enfermedad neurológica o neuromuscular muestra mayor “capacidad de realizar su actividad habitual” en 26 pacientes a los 15 días de cambiar el tratamiento con morfina oral a fentanilo transdérmico17.
- Un estudio realizado en 16 pacientes pediátricos con cáncer muestra mejoría (según escala de medición propia) en la calidad/cantidad del sueño, alimentación, juego, habla y llanto (p<0,001) durante el tratamiento con buprenorfina transdérmica23.
- En un estudio, al añadir dosis bajas de ketamina (0,1 mg/kg/h a 0,2 mg/kg/h) al tratamiento analgésico, los pacientes parecían más alerta e interaccionaban más, según los padres y el personal sanitario19.
Variable resultado: analgesia de rescate (2 estudios)
- Un estudio realizado en pacientes pediátricos con cáncer (n=132) o enfermedad no maligna (n=67), observa un incremento en la proporción fentanilo transdérmico/dosis total de opioides de 0,88 ± 0,01 mg/kg a 0,91 ± 0,01 mg/kg (día 16)18.
- En un estudio observacional en pacientes pediátricos con cáncer tratados con buprenorfina transdérmica, 14 (87,5%) pacientes necesitaron medicación de rescate al 4º día frente a 6 (46,2%) pacientes a las 4 semanas de tto. (p=0,087)23.
¿Cuál es la magnitud de los efectos indeseables esperados?
Desconocida- Un estudio realizado en pacientes pediátricos con cáncer (n=132) o enfermedad no maligna (n=67), observó los siguientes efectos adversos relacionados con el uso de fentanilo transdérmico (seguimiento: rango 15 días a 3,5 meses): vómitos (16,1%), náuseas (10,6%), prurito (7,5%), reacción en el sitio de aplicación del parche (7,5%), cefalea (7%), estreñimiento (6%), y somnolencia (5,5%). El 9,5% (n=19) de los pacientes presentó efectos adversos graves relacionados con el tratamiento, que incluyeron vómitos, dolor, disnea, y somnolencia grave (un caso que cedió al retirar el tratamiento)18.
- Un estudio registró síntomas neurológicos en el 32% (n=13) de los pacientes en edad pediátrica durante los 15 días de tratamiento con fentanilo transdérmico17.
- En un estudio, el cambio de opioide oral a buprenorfina transdérmica redujo el porcentaje de pacientes pediátricos en tratamiento antiemético de 50% a 7,7% (día 60) (p=0,125), y aumentó la necesidad de laxantes al final del mismo (p=0,039)23.
- Un estudio registró efectos adversos leves en 7/18 (38%) pacientes pediátricos con cáncer avanzado después de 48 horas de analgesia intravenosa con fentanilo. No se registraron efectos adversos graves ni estreñimiento20.
- Un estudio registró un abandono de tratamiento (6%) por los efectos adversos y falta de eficacia, al cambiar el tratamiento previo (otro opioide) a metadona21.
- Un estudio no registró efectos adversos secundarios al tratamiento con metadona durante el periodo de seguimiento, como somnolencia, alucinaciones, mioclonías, o arritmias cardíacas24.
- Un estudio no observa ni alucinaciones ni efectos adversos psicotrópicos (profilaxis con lorazepam 0,025 mg/kg cada 12 horas) al añadir dosis bajas de ketamina (0,1 mg/kg/h a 0,2 mg/kg/h) a pacientes pediátricos con cáncer avanzado en tratamiento con opioides19.
- Un estudio que evalúa la monoterapia con pregabalina oral (dosis media de 225 mg/día) del dolor neuropático inducido por quimioterapia, observa efectos adversos en 4 pacientes en edad pediatrica (14%), transitorios y de intensidad leve o moderada (náuseas y somnolencia)22.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Muy baja,Son estudios observacionales sin grupo control que comparan los resultados obtenidos antes y después de llevar a cabo la intervención. La intervención consiste en la modificación del tratamiento analgésico en pacientes pediátricos con dolor moderado o grave que no tienen un control adecuado del dolor y/o presentan efectos adversos graves asociados al uso de opioides.
La calidad global de la evidencia es muy baja. Esto es consecuencia de las limitaciones metodológicas inherentes al diseño de los estudios. En dos estudios existen, además, problemas relacionados con la aplicabilidad (indirectness) ya que incluyen pacientes sin enfermedades amenazantes para la vida18 o que no recibían cuidados paliativos22. El tiempo de seguimiento de un estudio20, inferior a una semana, fue insuficiente para detectar la aparición de estreñimiento como complicación del tratamiento con fentanilo.
¿Existe incertidumbre o variabilidad importante sobre cómo valoran los pacientes o los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.Se ha identificado un estudio28 que describe cómo valoran los niños y niñas con cáncer avanzado el impacto de síntomas emocionales y físicos en la calidad de vida relacionada con la salud. Entre estos últimos se incluyeron dolor, fatiga, somnolencia, náuseas, anorexia, tos, diarrea, vómitos, prurito, estreñimiento, disfagia, sequedad de boca, entumecimiento, sudoración, disnea y disuria.
Diez síntomas se asociaron con reducciones significativas en las puntuaciones del Cuestionario de Calidad de Vida Pediátrica (Peds QL): dificultad para concentrarse, preocupación, sequedad de boca, dolor, tristeza irritabilidad, insomnio, fatiga, vómitos y anorexia. Destacar que, en las subescalas, varios síntomas mostraron reducciones significativas superiores al umbral mínimo de significación clínica. En concreto, dolor y sequedad de boca en el PedsQL físico; y preocupación, alteración del sueño e irritabilidad en el PedsQL emocional.
¿El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Desconocido.Consultar los criterios previos: magnitud de los efectos deseables esperados y magnitud de los efectos indeseables esperados.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Baja.La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
No hay estudios incluidos.La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
El coste-efectividad de la intervención, ¿favorece a la intervención o a la comparación?
Desconocido.La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
¿Cuál sería el impacto en la equidad en salud?
Reducido.No se han identificado estudios que respondieran a la pregunta.
¿Es aceptable la opción para los agentes implicados?
VariableNo se han identificado estudios que respondieran a la pregunta.
¿Es factible la implementación de la opción?
Probablemente sí.No se han identificado estudios que respondieran a la pregunta.
Tablas GRADE
Resumen de la evidencia
Bibliografía
14. García de Paso M. Analgesia y sedación en Cuidados Paliativos Pediátricos. Bol pediatr. 2013; 53: 68-73.
15. World Health Organization. WHO Guidelines on the Pharmacological Treatment of Persisting Pain in Children with Medical Illnesses. Geneva: WHO; 2012.
16. Navarro S, Martino RJ. Cuidados Paliativos Pediátricos: Epidemiología, organización. Fallecimiento en el hospital. Sedación. Actualizaciones Sociedad Española de Pediatría Hospitalaria (SEPHO). 2016.
17. Hunt A, Goldman A, Devine T, Phillips M. Transdermal fentanyl for pain relief in a paediatric palliative care population. Palliat Med. 2001;15(5):405-12. https://doi.org/10.1191/026921601680419456.
18. Finkel JC, Finley A, Greco C, Weisman SJ, Zeltzer L. Transdermal fentanyl in the management of children with chronic severe pain: results from an international study. Cancer. 2005;104(12):2847-57. https://doi.org/10.1002/cncr.21497.
19. Finkel JC, Pestieau SR, Quezado ZM. Ketamine as an adjuvant for treatment of cancer pain in children and adolescents. J Pain. 2007;8(6):515-21. https://doi.org/10.1016/j.jpain.2007.02.429.
20. Ruggiero A, Barone G, Liotti L, Chiaretti A, Lazzareschi I, Riccardi R. Safety and efficacy of fentanyl administered by patient controlled analgesia in children with cancer pain. Support Care Cancer. 2007;15(5):569-73. https://doi.org/10.1007/s00520-006-0193-8.
21. Davies D, DeVlaming D, Haines C. Methadone analgesia for children with advanced cancer. Pediatr Blood Cancer. 2008;51(3):393-7. https://doi.org/10.1002/pbc.21584.
22. Vondracek P, Oslejskova H, Kepak T, Mazanek P, Sterba J, Rysava M, et al. Efficacy of pregabalin in neuropathic pain in paediatric oncological patients. Eur J Paediatr Neurol. 2009;13(4):332-6. https://doi.org/10.1016/j.ejpn.2008.06.011.
23. Ruggiero A, Coccia P, Arena R, Maurizi P, Battista A, Ridola V, et al. Efficacy and safety of transdermal buprenorphine in the management of children with cancer-related pain. Pediatr Blood Cancer. 2013;60(3):433-7. https://doi.org/10.1002/pbc.24332.
24. Madden K, Mills S, Dibaj S, Williams JL, Liu D, Bruera E. Methadone as the Initial Long-Acting Opioid in Children with Advanced Cancer. J Palliat Med. 2018;21(9):1317-21. https://doi.org/10.1089/jpm.2017.0712.
25. Goldman A, Hewitt M, Collins GS, Childs M, Hain R. Symptoms in children/young people with progressive malignant disease: United Kingdom Children’s Cancer Study Group/Paediatric Oncology Nurses Forum survey. Pediatrics. 2006;117(6):e1179-86. https://doi.org/10.1542/peds.2005-0683.
26. Beecham E, Candy B, Howard R, McCulloch R, Laddie J, Rees H, et al. Pharmacological interventions for pain in children and adolescents with life-limiting conditions. Cochrane Database Syst Rev. 2015;2015(3):Cd010750. https://doi.org/10.1002/14651858.CD010750.pub2.
27. Womer J, Zhong W, Kraemer FW, Maxwell LG, Ely EA, Faerber JA, et al. Variation of opioid use in pediatric inpatients across hospitals in the U.S. J Pain Symptom Manage. 2014;48(5):903-14. https://doi.org/10.1016/j.jpainsymman.2013.12.241.
28. Rosenberg AR, Orellana L, Ullrich C, Kang T, Geyer JR, Feudtner C, et al. Quality of Life in Children With Advanced Cancer: A Report From the PediQUEST Study. J Pain Symptom Manage. 2016;52(2):243-53. https://doi.org/10.1016/j.jpainsymman.2016.04.002.
29. Reglamento (CE) nº 1901/2006 del Parlamento Europeo y del Consejo, de 12 de diciembre de 2006, sobre medicamentos para uso pediátrico. Diario Oficial de la Unión Europea, nº 378 (27 de diciembre de 2006).
Quimioterapia y radioterapia paliativa
Actualizado a fecha: 30/06/2022
Actualizado a fecha: 31/08/2022
El uso de quimioterapia/radioterapia paliativa en niños, niñas y adolescentes en CPP ¿aumenta la supervivencia, calidad de vida, y/o mejora el control de los síntomas?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
- Los profesionales sanitarios deben explicar al paciente (según su nivel de desarrollo), y a la familia, los beneficios, los riesgos, y la posibilidad de presencia de sufrimiento asociado de las opciones de tratamiento (radioterapia paliativa, quimioterapia paliativa, o medidas de soporte), de manera honesta, sencilla, cercana, accesible, y coherente, expresando toda la información pertinente para que participen en la decisión. Además de una escucha activa y silencios apropiados, para poder conocer sus necesidades en cada momento.
- Los profesionales sanitarios deben reforzar la información sobre el pronóstico del paciente en CPP y las opciones de tratamiento disponibles en cada momento del curso de la enfermedad, adaptándose a las necesidades individuales del paciente y la familia, con la finalidad de generar unas expectativas realistas.
Para los aspectos relacionados con los procesos de comunicación y de toma de decisiones sobre el tratamiento, se sugiere consultar las recomendaciones de los capítulos Participación del menor en la toma de decisiones y cuidados al final de la vida y Comunicación con el paciente y la familia de la guía.
Los efectos deseables probablemente superan los efectos no deseables, pero con una incertidumbre apreciable. Eso implica que cada paciente debería ser ayudado a llegar a la decisión más adecuada a sus valores y preferencias. LEER MÁS
3. En la atención a los síntomas en CPP se propone una evaluación individualizada para diagnosticar y, en la medida de lo posible, tratar las causas específicas. En pacientes pediátricos con cáncer avanzado en cuidados paliativos debería valorarse en cada caso concreto, según la localización y el tipo de tumor, el uso de la radioterapia paliativa.
Justificación
El GEG considera que la RT paliativa puede integrarse en el proceso de atención al final de la vida de los niños, niñas y adolescentes con cáncer incurable. Aunque la evidencia es de muy baja calidad, todas las series muestran que la RT paliativa mejora los síntomas en la mayoría de los pacientes, sin asociarse con una toxicidad significativa.
El GEG ha decidido no formular ninguna recomendación sobre la QT paliativa a partir de la evidencia identificada. Será necesario disponer de más estudios sobre la efectividad y seguridad de su uso en la edad pediátrica.
Finalmente, se han formulado consideraciones prácticas generales sobre la necesidad de clarificar el objetivo del tratamiento al paciente y la familia para evitar, en la medida de lo posible, expectativas poco realistas que resulten en tratamientos innecesarios.
Justificación detallada
La certidumbre sobre el efecto de las intervenciones se valoró como muy baja debido a las limitaciones metodológicas inherentes al diseño observacional retrospectivo y sin grupo control de la mayoría de los estudios.
- La evidencia identificada incluye 7 estudios observacionales retrospectivos sin grupo control34-40 que investigan los efectos de la RT paliativa sobre el control de los síntomas (dolor, síntomas neurológicos, disnea, etc.), así como la proporción y grado de toxicidad radioinducida, en pacientes pediátricos con cáncer avanzado. También se han identificado un ensayo clínico controlado y aleatorizado (ECA)41 y un estudio observacional prospectivo sin grupo control42 que investigan el efecto de la QT metronómica* en la supervivencia libre de progresión y la calidad de vida en pacientes pediátricos con cáncer recurrente o metastásico.
- Al comparar las series entre sí se observan amplias diferencias en las medianas de las dosis de radiación (oscilan entre 15 Gy y 40 Gy) y en las medianas de los tiempos de los cursos de RT (oscilan entre 9 y 16 días). Los pacientes tratados con QT metronómica recibieron dosis bajas por vía oral de talidomida, celecoxib, etopósido y ciclofosfamida en régimen ininterrumpido41,42. Los regímenes de tratamiento de los dos estudios difieren en las dosis y la combinación de fármacos administrados.
- Los estudios incluyen grupos de pacientes con diferentes tipos de neoplasias, excepto dos estudios que consideran pacientes con osteosarcoma35 y neuroblastoma40, respectivamente. Los pacientes presentaban en su mayoría una neoplasia extracraneal no hematológica como neuroblastoma, rabdomiosarcoma, sarcoma de Ewing, osteosarcoma, etc.
*La quimioterapia metronómica es un tipo de quimioterapia cuya toxicidad es mínima. Consiste en administrar agentes antineoplásicos habituales a intervalos muy próximos uno del otro y a dosis relativamente bajas durante un tiempo prolongado y sin periodos de descanso farmacológico43.
La evidencia sugiere un balance de los efectos deseables e indeseables favorable a la RT paliativa. La tasa de respuesta parcial o completa al tratamiento de los síntomas oscila entre el 60,6%37 y el 77%38, frente a una tasa de efectos adversos que se encuentra entre el 6% y el 54%, la mayoría de ellos leves (Grado 1 o 2 y ninguno >3). Cabe señalar que un estudio muestra una tasa de respuesta al tratamiento significativamente inferior en los pacientes que se encontraban en los últimos 30 días de vida38.
En el caso de la QT paliativa, el ECA que compara el tratamiento con QT metronómica frente a tratamiento de soporte más placebo no observa diferencias en la supervivencia libre de progresión ni en la supervivencia global. La toxicidad grado 3 o 4 mostró los siguientes resultados (control vs. intervención): anemia (7,1% vs 11,7%), neutropenia (0% vs 10,7%), trombocitopenia (0%vs 10,7%), neutropenia febril (0% vs 8,8%). Una serie de 17 casos observa una mejoría transitoria de la calidad de vida en el 35% (n=7) de los pacientes. El 76% de los pacientes presentaron efectos adversos grado III o IV.
Además, el GEG tuvo en cuenta la importancia de clarificar el objetivo del tratamiento a los pacientes y sus familias. Los padres de los niños, niñas y adolescentes con cáncer tienen respuestas complejas a las recomendaciones de los profesionales sanitarios, lo que les puede generar dificultades para distinguir entre el tratamiento directo de la enfermedad y el dirigido al alivio de los síntomas.
De la evidencia a la recomendación
¿Es prioritario este problema?
SíLa indicación de quimioterapia (QT) paliativa, radioterapia (RT) paliativa o recibir sólo tratamiento de soporte se fundamenta en el criterio médico, y es consensuada con la familia y el paciente. Es una decisión muy importante y difícil para las familias de los niños, niñas y adolescentes con un cáncer avanzado. A pesar de ello, los resultados tras la administración de QT o RT paliativa en pacientes en edad pediátrica no se conocen de forma precisa y rigurosa.
¿Cuál es la magnitud de los efectos deseables esperados?
Variable de resultado: control de síntomas (RT paliativa: 5 estudios)
- Un estudio que incluyó 50 pacientes en edad pediátrica con cáncer avanzado observó una resolución de los síntomas parcial o completa en el 77% (61/79) de los cursos de RT. La respuesta fue parcial o completa en el 80% (n=37) de los cursos de RT indicados por dolor, en el 71% (n=10) de los indicados por síntomas neurológicos, y en el 62% (n=5) de los indicados por disnea. Los pacientes en los últimos 30 días de vida respondieron significativamente peor que los pacientes que sobrevivieron >30 días tras la RT [28% (n=4) vs. 89% (n=57), p<0,0001]38.
- Un estudio realizado en Brasil (39 pacientes) y EEUU (49 pacientes) muestra que el 67% (65/102) de los cursos de RT tuvieron una respuesta favorable, parcial o completa, al tratamiento de los síntomas. El alivio del dolor tuvo lugar en el 83% (52/63) de los casos, de los cuales el 46% (24/52) disminuyeron o cesaron el uso de opioides34.
- Un estudio que incluyó 20 pacientes con osteosarcoma observa un 75% (24/32 cursos de RT) de resolución de los síntomas, parcial o completa. Respondió el 75% (n=18) de los casos tratados por dolor; 6 de 17 pacientes interrumpieron el tratamiento con opioides35.
- Un estudio que investiga el resultado del tratamiento paliativo con RT hipofraccionada (>1 pero <5 fracciones con >3 Gy por fracción una vez al día) en 62 pacientes pediátricos con cáncer recurrente o metastásico, muestra que la respuesta de los síntomas a la RT fue completa o parcial en el 60,6% (63/104) de las lesiones irradiadas. Por indicación, el 63,2% (43/68) de los casos experimentó alivio del dolor, y el 100% (7/7) mejoró los síntomas neurológicos37.
- Un estudio encuentra una resolución total o parcial de los síntomas en el 73% (60/82) de los cursos de RT que recibieron 44 pacientes pediátricos con cáncer avanzado. El 80% (n=33) respondió al tratamiento del dolor, el 58% (n=14) al tratamiento de los síntomas neurológicos y el 55% (n=6) mejoró su disnea39.
Variable de resultado: tiempo de control de los síntomas (RT paliativa: 2 estudios)
- Un estudio que incluyó 20 pacientes con osteosarcoma que recibieron RT paliativa obtiene una mediana de duración del control de los síntomas de 140 días (rango 1-882). La mediana de duración del alivio del dolor fue de 77 días (rango 1-785)35.
- Un estudio (46 pacientes) que analiza los resultados del tratamiento de síntomas con RT paliativa observa que el 58,7% (27/46) mejora durante la RT y el 56,5% (26/46) a los 0-3 meses. A los 3-6 meses esta cifra desciende a 17,4% (8/46), y a los 6-12 meses sólo el 6,5% (3/46) permanece estable36.
Variable de resultado: supervivencia libre de progresión (RT paliativa: 1 estudio, QT paliativa: 1 estudio)
- Un estudio que investiga el resultado del tratamiento paliativo con RT hipofraccionada (>1 pero <5 fracciones con >3 Gy por fracción una vez al día) en 62 pacientes pediátricos con cáncer recurrente o metastásico, observa una tasa de supervivencia libre de progresión al año y a los dos años de 31% y 20%, respectivamente37.
- Un estudio realizado en 108 pacientes con neoplasia extracraneal no hematológica avanzada que compara el tratamiento con QT metronómica frente a placebo, obtiene un HR de supervivencia libre de progresión de 0,69 (IC95% 0,47 a 1,03; p= 0,07)41.
Variable de resultado: supervivencia global (RT paliativa: 1 estudio, QT paliativa: 1 estudio)
- Un estudio que investiga el resultado del tratamiento paliativo con RT hipofraccionada (>1 pero <5 fracciones con >3 Gy por fracción una vez al día) en 62 pacientes pediátricos con cáncer recurrente o metastásico, observa una tasa de supervivencia global al año y a los dos años de 44% y 28%, respectivamente37.
- Un estudio realizado en 108 pacientes con neoplasia extracraneal no hematológica avanzada que compara el tratamiento con QT metronómica frente a placebo, muestra una supervivencia global de 85 días (IC95% 61 a 123 días) en el grupo placebo y 85 días (IC95%, 69 a 113 días) en el grupo intervención (p=0,13)41.
Variable de resultado: calidad de vida (QT paliativa: 1 estudio)
- Los resultados de un estudio que incluye a 17 pacientes pediátricos con neoplasias refractarias que recibieron QT metronómica sugieren una mejoría transitoria de la calidad de vida en el 35% (n=6) de los pacientes, según las escalas de Karnofsky–Lansky* (10 puntos en 5 pacientes y 20 puntos en 1 paciente). La diferencia respecto a las puntuaciones basales fue estadísticamente significativa (p = 0,02)42.
* Miden el estado funcional o performance status de un paciente que se define como el nivel de actividad que puede realizar un individuo y su capacidad para autocuidado. La escala Karnofsky ha sido diseñada para >16 años, la escala Lansky para ≤16 años. Rango de puntuaciones de 10 (restricción grave) – 100 (actividad normal)44,45.
¿Cuál es la magnitud de los efectos indeseables esperados?
Evidencia procedente de la investigación: (RT paliativa: 6 estudios, QT paliativa: 2 estudios)
- Un estudio realizado en Brasil (39 pacientes) y EEUU (49 pacientes) muestra que un 54% (n=53) de los pacientes presentaron toxicidad de grado 1 o 2 y sólo 4 pacientes toxicidad de grado 334.
- En un estudio que incluyó pacientes con osteosarcoma que recibieron RT paliativa, el 12,5% (4/20) presentó toxicidad de grado 1 y 1 paciente toxicidad de grado 235.
- Un estudio que analiza los resultados del tratamiento de síntomas con RT paliativa registra un 24% (18/76) de toxicidad en el total de cursos de RT, la mayoría de grado 1-2 (16/76)36.
- Un estudio que investiga el resultado del tratamiento paliativo con RT hipofraccionada (>1 pero <5 fracciones con >3 Gy por fracción una vez al día) registra 7 cursos de 104 (6,7%) con toxicidad de grado ≥3 de las que 5 fueron grado 3. No hubo toxicidad grado 537.
- Un estudio en 44 pacientes pediátricos con cáncer avanzado que recibieron RT paliativa observa efectos adversos agudos y de grado <3: nausea leve y autolimitada (3,6%), dermatitis (6 %), y fatiga (3,6%)39.
- Un estudio que analiza los resultados del uso de RT paliativa en 34 pacientes con neuroblastoma metastásico encuentra un solo caso de toxicidad (grado 3) asociada a la RT40.
- En un estudio que compara el tratamiento con QT metronómica (n=56) frente a placebo (n=52), la toxicidad grado 3 o 4 en ambos grupos mostró los siguientes resultados (control vs. intervención): anemia (7,1% vs 11,7%), neutropenia (0% vs 10,7%), trombocitopenia (0%vs 10,7%), neutropenia febril (0% vs 8,8%). El efecto adverso no hematológico más frecuente fue la mucositis (grado 1-2, 8,8%; grado 3-4, 5,3%) en el grupo intervención41.
- Los resultados de toxicidad de un estudio en pacientes pediátricos con neoplasias refractarias que recibieron QT metronómica muestran que 13 (76%) pacientes presentaron efectos adversos grado 3 o 4, principalmente neutropenia e infecciones (53%, n=9). Dos pacientes tuvieron una infección que les causó la muerte (grado 5), una de ellas atribuible al tratamiento42.
¿Cuál es la certeza global en la evidencia sobre los efectos?
Muy bajaLa calidad global de la evidencia es muy baja debido a las limitaciones metodológicas inherentes al diseño observacional retrospectivo y sin grupo control de los estudios. El ECA que compara el tratamiento con QT metronómica frente a placebo fue considerado de calidad alta.
¿Existe incertidumbre o variabilidad importante sobre cómo valoran los pacientes los desenlaces principales?
La incertidumbre o la variabilidad probablemente no sean importantes.La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
El balance entre los efectos deseables e indeseables esperados, ¿favorece a la intervención o a la comparación?
Radioterapia paliativa: probablemente favorece a la intervención. Quimioterapia paliativa: Desconocido.El uso de radiación con fines paliativos mejoró los síntomas en la mayoría de los pacientes (entre el 77%38 y el 60,6%37), sin asociarse con toxicidad significativa. Esto sugiere la existencia de un balance beneficio/riesgo favorable al uso de la RT paliativa.
Una de las series observa una tasa de respuesta favorable de sólo el 28% en los pacientes que recibieron radioterapia durante los últimos 30 días de vida. Este resultado sugiere que el uso de RT paliativa durante los últimos 30 días de vida podría no estar justificado.
No es posible evaluar la relación beneficio-riesgo de la administración de QT paliativa en pacientes en edad pediátrica a partir de la evidencia identificada.
¿Cuál es la magnitud de los recursos requeridos (costes)?
La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
¿Cuál es la certeza en torno a la evidencia sobre los recursos requeridos?
La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
El coste-efectividad de la intervención, ¿favorece a la intervención o a la comparación?
Desconocido.La revisión sistemática no ha identificado estudios que respondieran a la pregunta.
¿Cuál sería el impacto en la equidad en salud?
No se han identificado estudios que respondieran a la pregunta.
¿Es aceptable la opción para los agentes implicados?
Un estudio que explora las expectativas acerca de los beneficios de la RT paliativa observó que el 76% de los padres esperaba que el tratamiento aumentara el tiempo de supervivencia, mientras que el 40% esperaba la curación, todo ello a pesar de haber sido informados previamente sobre las indicaciones y posibles resultados de la RT paliativa47.
Un estudio que comparaba las preferencias de tratamiento al final de la vida de profesionales sanitarios y padres de pacientes pediátricos (QT paliativa o sólo tratamiento de soporte), observó que significativamente más padres (42/77, 54,5%) que profesionales sanitarios (20/128, 15,6%) apoyaban la QT paliativa (Wilcoxon rank-sum test, p<0,0001). Además, observa que los padres priorizan la esperanza como el factor más importante para tomar la decisión48.
¿Es factible la implementación de la opción?
No se han identificado estudios que respondieran a la pregunta.
Tablas GRADE
BIBLIOGRAFÍA
30. McCulloch,R, Berde C. Difficult pain. Adjuvants or co-analgesics. En: Oxford Textbook of Palliative Medicine 3. Hain R, Goldman A, ed. 2021, p. 188-201.
31. Stachelek GC, Terezakis SA, Ermoian R. Palliative radiation oncology in pediatric patients. Ann Palliat Med. 2019;8(3):285-92. https://doi.org/10.21037/apm.2019.05.01.
32. Murphy JD, Nelson LM, Chang DT, Mell LK, Le QT. Patterns of care in palliative radiotherapy: a population-based study. J Oncol Pract. 2013;9(5):e220-7. https://doi.org/10.1200/jop.2012.000835.
33. Rao AD, Chen Q, Ermoian RP, Alcorn SR, Figueiredo MLS, Chen MJ, et al. Practice patterns of palliative radiation therapy in pediatric oncology patients in an international pediatric research consortium. Pediatr Blood Cancer. 2017;64(11). https://doi.org/10.1002/pbc.26589.
34. Rao AD, Figueiredo MLS, Yegya-Raman N, Sehgal S, Chen Q, Alcorn SR, et al. Clinical practice and outcomes of palliative radiation therapy in pediatric oncology patients: An international comparison of experiences from two distinct countries and health care systems. Radiother Oncol. 2019;140:1-5. https://doi.org/10.1016/j.radonc.2019.05.017.
35. Chen EL, Yoo CH, Gutkin PM, Merriott DJ, Avedian RS, Steffner RJ, et al. Outcomes for pediatric patients with osteosarcoma treated with palliative radiotherapy. Pediatr Blood Cancer. 2020;67(1):e27967. https://doi.org/10.1002/pbc.27967.
36. Mak KS, Lee SW, Balboni TA, Marcus KJ. Clinical outcomes and toxicity following palliative radiotherapy for childhood cancers. Pediatr Blood Cancer. 2018;65(1). https://doi.org/10.1002/pbc.26764.
37. Lazarev S, Kushner BH, Wolden SL. Short Hypofractionated Radiation Therapy in Palliation of Pediatric Malignancies: Outcomes and Toxicities. Int J Radiat Oncol Biol Phys. 2018;102(5):1457-64. https://doi.org/10.1016/j.ijrobp.2018.07.2012.
38. Varma S, Friedman DL, Stavas MJ. The role of radiation therapy in palliative care of children with advanced cancer: Clinical outcomes and patterns of care. Pediatr Blood Cancer. 2017;64(5). https://doi.org/10.1002/pbc.26359.
39. Rahn DA, Mundt AJ, Murphy JD, Schiff D, Adams J, Murphy KT. Clinical outcomes of palliative radiation therapy for children. Pract Radiat Oncol. 2015;5(3):183-7. https://doi.org/10.1016/j.prro.2014.08.015.
40. Caussa L, Hijal T, Michon J, Helfre S. Role of palliative radiotherapy in the management of metastatic pediatric neuroblastoma: a retrospective single-institution study. Int J Radiat Oncol Biol Phys. 2011;79(1):214-9. https://doi.org/10.1016/j.ijrobp.2009.10.031.
41. Pramanik R, Agarwala S, Gupta YK, Thulkar S, Vishnubhatla S, Batra A, et al. Metronomic Chemotherapy vs Best Supportive Care in Progressive Pediatric Solid Malignant Tumors: A Randomized Clinical Trial. JAMA Oncol. 2017;3(9):1222-7. https://doi.org/10.1001/jamaoncol.2017.0324.
42. Porkholm M, Toiviainen-Salo S, Seuri R, Lönnqvist T, Vepsäläinen K, Saarinen-Pihkala UM, et al. Metronomic therapy can increase quality of life during paediatric palliative cancer care, but careful patient selection is essential. Acta Paediatr. 2016;105(8):946-51. https://doi.org/10.1111/apa.13338.
43. Cazzaniga ME, Biganzoli L, Cortesi L, De Placido S, Donadio M, Fabi A, Ferro A, Generali D, Lorusso V, Milani A, Montagna E, Munzone E, Orlando L, Pizzuti L, Simoncini E, Zamagni C, Pappagallo GL; Metronomic Chemotherapy in Advanced Breast Cancer Study Group. Treating advanced breast cancer with metronomic chemotherapy: what is known, what is new and what is the future? Onco Targets Ther. 2019 Apr 23;12:2989-2997.
44. Karnofsky DA, Burchenal JH. The clinical evaluation of chemotherapeutics in cancer. En: MacLeod CM, ed. Evaluation of Chemotherapeutic Agents. Columbia University Press: New York, 1949, pp 191-205.
45. Lansky SB, List MA, Lansky LL, Ritter-Sterr C, Miller DR. The measurement of performance in childhood cancer patients. Cancer. 1987 Oct 1;60(7):1651-6.
46. Sociedad Española de Hematología y Oncología Pediátricas. Centros informantes del RETI-SEHOP [Internet]. [citado mayo 2022]. Disponible en: https://www.uv.es/rnti/pdfs/Listado%20CI.pdf
47. Lee BKY, Apkon D, Wolfe J, Marcus KJ. Palliative Radiation Therapy for Pediatric Patients: Parental Perceptions. International Journal of Radiation Oncology, Biology, Physics. 2017;99(2):S86. https://doi.org/10.1016/j.ijrobp.2017.06.208.
48. Tomlinson D, Bartels U, Gammon J, Hinds PS, Volpe J, Bouffet E, et al. Chemotherapy versus supportive care alone in pediatric palliative care for cancer: comparing the preferences of parents and health care professionals. CMAJ. 2011;183(17):E1252-8. https://doi.org/10.1503/cmaj.110392.
Participación del menor en la toma de decisiones y cuidados al final de la vida
Actualizado a fecha: 30/06/2022
¿Cuáles son los facilitadores y las barreras para que el niño, niña o adolescente en situación final de vida participe en la toma de decisiones terapéuticas (incluso en contra de la opinión de los padres o cuidadores)?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
- Todos los profesionales sanitarios que atienden al paciente candidato a recibir CPP deben reconocer que tiene un papel central en el proceso de toma de decisiones.
- Los profesionales deberían explicar a los niños, niñas o adolescentes, y a sus familias, que su contribución en la TDD sobre los cuidados al final de la vida es muy importante, y que no tienen que decidir ellos solos, sino que el equipo multidisciplinar participará y les asistirá en todo momento, asumiendo la responsabilidad en función de su competencia profesional.
- Los profesionales deben determinar la competencia o madurez del paciente para tomar decisiones teniendo en cuenta la complejidad e importancia de la decisión y sus circunstancias personales y familiares, además del marco normativo y legal.
- Consultar a los pacientes sobre cómo quieren participar (grado de implicación) en la toma de decisiones terapéuticas y con quién quieren compartir el proceso de TDD. Repetir la consulta en cada TDD porque las preferencias del paciente pueden variar según el momento de la enfermedad y el alcance de la decisión.
- Registrar de manera sistemática las decisiones terapéuticas consensuadas con el paciente y su familia en la historia clínica del paciente en CPP.
- Para facilitar que el paciente participe en la TDD se sugiere que el profesional tenga en cuenta lo siguiente:
- Generar la máxima cercanía y confianza posibles.
- Dirigirse directamente al paciente, para hacer patente que es el centro de la conversación.
- Dar información clara y honesta, expresada en un lenguaje fácilmente comprensible, adaptado a la madurez del paciente. Valorar el uso de apoyos visuales y soportes tecnológicos.
- Asegurarse de que el paciente entiende y comprende la información recibida, manteniendo una actitud de escucha activa. Las explicaciones orales pueden acompañarse con información adicional por escrito.
- Propiciar un diálogo abierto y honesto, sobre todo si se trata de una decisión compleja o existe incertidumbre sobre el pronóstico.
- Apoyar a los padres para que faciliten la participación de los pacientes en la TDD:
- Ayudarles a identificar sus propios temores y sufrimiento y a distinguirlos de los de sus hijos e hijas.
- Aconsejarles que busquen activamente y con frecuencia los sentimientos y opiniones de sus hijos e hijas.
- Sugerirles que el paciente puede estar presente en las conversaciones con el equipo sanitario.
- Se recomienda la formación de los profesionales en el proceso de toma de decisiones compartidas con los pacientes.
- En ausencia de contraindicaciones médicas, durante el proceso de toma de decisiones, se sugiere explorar el deseo de donación de órganos y tejidos como parte de los cuidados al final de la vida.
Justificación
Además de las actitudes, conductas, comportamientos y sentimientos en torno a la toma de decisiones al final de la vida y la participación del paciente en el proceso, el GEG ha tenido en cuenta un aspecto práctico fundamental como es la necesidad de evaluar la capacidad para decidir del paciente.
Justificación detallada
Para identificar qué factores facilitan o dificultan la participación del niño, niña o adolescente en la toma de decisiones terapéuticas al final de la vida se ha tenido en cuenta la perspectiva de todos los implicados en el proceso, el paciente, la familia y los profesionales sanitarios. El GEG reconoce la importancia de incorporar las preferencias del niño, niña o adolescente y de sus padres siempre que sean coherentes con el mejor interés del paciente, que puede cambiar según su estado y circunstancias. La implicación del niño, niña o adolescente en el proceso no debería generarle mayor preocupación, ansiedad o tristeza.
Es fundamental que los profesionales determinen el grado de madurez del niño, niña o adolescente para participar en la TDD terapéuticas al final de la vida que conllevan un riesgo. La decisión deberá o no tomarla el paciente, según las situaciones, pero en cualquier caso siempre debería ser oído con antelación. Es preciso tener en cuenta que un niño, niña con capacidad para tomar decisiones fáciles o de bajo riesgo puede no tener la madurez necesaria para decidir sobre tratamientos complejos que implican un riesgo elevado y consecuencias graves.
El GEG destaca la labor fundamental del equipo multidisciplinar de CPP a la hora de acompañar a los pacientes y la familia en la toma de decisiones, atendiendo a sus necesidades.
Aunque es una cuestión que no se ha abordado específicamente en la literatura revisada, el GEG reconoce la necesidad de capacitar a los profesionales sanitarios en la toma de decisiones compartida.
Según la evidencia identificada, en ocasiones las decisiones del paciente y la familia se ven influidas por la posibilidad de ayudar a otros. En este sentido, la donación de órganos y tejidos puede ser una iniciativa de los pacientes y sus familiares a la que los profesionales deben estar atentos y facilitar en la medida de lo posible.
De la evidencia a la recomendación
¿Cuál es la evidencia identificada?
Se incluyeron 7 estudios cuyo objetivo principal fue analizar las experiencias y opiniones de los niños, niñas y adolescentes que precisan CPP, de sus padres o cuidadores y de los profesionales sanitarios, sobre la participación en la toma de decisiones terapéuticas. Los 7 estudios identificados utilizaron métodos cualitativos de recogida y análisis de los datos54-60; 4 de ellos investigaron la perspectiva de los padres55-57,60,2 estudios analizaron la perspectiva de los pacientes, padres y clínicos54,58, y 1 estudio entrevistó a pacientes con una enfermedad amenazante para la vida59.
Temas que emergieron del análisis de los estudios identificados:
1. Factores que influyen en la toma de decisiones (4 estudios)
En un estudio realizado en Australia y EEUU participaron 20 pacientes con cáncer avanzado de 10 a 20 años de edad, 19 padres y 14 profesionales. Los pacientes estuvieron recientemente implicados en una de las siguientes decisiones: participación en un ensayo, orden de no reanimar y adecuación de las medidas terapéuticas. El objetivo del estudio era identificar las preferencias de cuidados de los niños, niñas con cáncer avanzado al final de su vida y los factores que influyen en la TDD. Los factores que según los pacientes influyen con más frecuencia en su decisión son los que se basan en las relaciones, la preocupación y el cuidado de los demás. La TDD de pacientes, padres y profesionales presenta importantes similitudes, como la sensibilidad a las preferencias de los demás54.
Un estudio realizado en Holanda en el que participaron padres de 23 pacientes (6 meses a 18 años) con cáncer incurable investigó la influencia de los procesos por los que transitan los padres, cuando no hay posibilidad de curación, a la hora de tomar decisiones relacionadas con el tratamiento y el cuidado del niño, niña y adolescente. Para los padres hacer frente a la pérdida constituye la esencia del proceso paliativo. El estudio muestra que los padres que realizan la transición de “preservarle” a “dejarle ir” son más receptivos a la situación real y a las necesidades del menor56.
Un estudio realizado en Japón en el que participaron 23 padres de 17 pacientes pediátricos que fallecieron por cáncer en 1 a 3 años antes del estudio, exploró las ideas y sentimientos de los padres respecto a las medidas a adoptar para su hijo tras conocer que su cáncer es incurable. Los padres que expresaron ideas como “deseo de poner fin al sufrimiento de mi hijo y deseo que esté cómodo” o ‘‘valorar los deseos y la dignidad de mi hijo’’ podrían estar recordando algún deseo o preferencia manifestado por el menor antes o durante la terapia contra el cáncer57.
Un estudio realizado en Holanda en el que participaron 24 pacientes (8 a 18 años) con cáncer, 26 padres y 15 profesionales sanitarios, muestra que en el curso de un tratamiento de larga duración “el mejor interés para el niño” está sujeto a cambios y, para las familias, abarca otras esferas además del ámbito médico58.
2. Rol de los padres (2 estudios)
Un estudio realizado en Suiza entrevistó a padres de 15 pacientes pediátricos en cuidados paliativos o que habían fallecido en un periodo máximo de 2 años antes de la entrevista, para explorar sus percepciones y necesidades. Los padres refieren que a menudo han de luchar por lograr una atención más individualizada, adaptada a las necesidades de cuidado de su hijo/a. Valoran cuando el personal sanitario los respeta como expertos en el cuidado del niño, niña y los implican activamente en los procesos de toma de decisiones55.
Un estudio realizado en Holanda entrevistó a 44 padres de 23 pacientes (0 – 18 años) con cáncer en cuidados paliativos para describir y explicar las acciones de los padres a la hora de expresar la “voz del niño, niña”. Los padres que buscan activamente entender la perspectiva del niño, niña utilizan estrategias directas e indirectas. Prefieren las estrategias indirectas cuando el niño evita el tema o cuando consideran la conversación amenazante para el menor o para ellos mismos. Según los autores, la incapacidad de los padres para tener en cuenta la perspectiva del niño, niña se debería en gran medida a la lucha por afrontar la pérdida60.
A continuación, figuran tres temas identificados a partir de un único estudio que se describe después.
3. Participación activa en la toma de decisiones (1 estudio)59
4. Actitudes/conductas de apoyo de los padres (1 estudio)59
5. Actitudes/conductas de apoyo de los clínicos (1 estudio)59
Un estudio realizado en EEUU en el que participaron 40 adolescentes (12 a 18 años) con cáncer (34 pacientes con un primer diagnóstico, 6 pacientes con diagnóstico de recidiva), explora su nivel preferido de implicación en la toma de decisiones y las actitudes y comportamientos de los padres y los clínicos que consideran que son de ayuda en el proceso. La mayoría de los entrevistados eligió tener un rol activo, pero también expresaron su reconocimiento/aprecio por la visión de la familia, la presencia de los padres y la orientación de los profesionales. El estudio muestra conductas, actitudes y comportamientos de los padres, como discutir en familia las opciones antes de comunicárselas al equipo sanitario, y de los profesionales, como la honestidad y el uso de un lenguaje comprensible, que los adolescentes perciben como facilitadoras59.
Los temas y subtemas que emergieron del análisis de los estudios identificados para responder a esta pregunta se describen en detalle en el anexo II.
¿Cuál es la confianza en la evidencia?
La calidad de la evidencia fue juzgada como baja o muy baja. Las principales razones que llevaron a disminuir la calidad fueron las limitaciones metodológicas y la incertidumbre sobre la suficiencia y la relevancia de los datos.
La selección de los participantes se realizó mediante muestreo por conveniencia. La tasa de respuesta fue baja y el riesgo de autoselección elevado. Quienes decidieron participar en los estudios pudieron ser diferentes de quienes rehusaron ser entrevistados. Ningún estudio reflexiona sobre la relación entre el investigador y el tema de la investigación (reflexividad). Tampoco se verificaron los hallazgos en ninguno de los estudios incluidos.
En la mayoría de los casos existe incertidumbre sobre la riqueza y cantidad de los datos que contribuyen a los temas/hallazgos. Además, los estudios individuales no informaron sobre la saturación de la información. Al analizar la evidencia en conjunto se observa que algunos de los temas se identificaron en un único estudio.
En ocasiones la evidencia no es directamente aplicable a la población diana de la GPC. Dos estudios se centraron en pacientes y padres de pacientes con una enfermedad amenazante para la vida (cáncer), no en situación final de vida, que estaban recibiendo tratamiento con intención curativa en lugar de los cuidados propios del final de la vida. Además, un estudio incluyó a pacientes mayores de 18 años de edad. Algunos estudios54,58 incluyen niños, niñas y adolescentes, pero no diferencian entre ellos. Sin embargo, los adolescentes son diferentes desde el punto de vista biológico y psicosocial. Además, los estudios identificados se han desarrollado en entornos culturales diferentes al nuestro lo que limita la generalización de los resultados.
Los estudios se centran en población pediátrica con cáncer; el estudio de Inglin et al.55 es el único que incluye otras enfermedades.
Equidad, aceptabilidad y factibilidad
La participación del menor en la TDD responde al principio bioético de autonomía según el cual debe respetarse que las personas tomen sus propias decisiones respecto a la aceptación o rechazo de todo lo que afecte a su salud y su enfermedad.
En España la Ley Orgánica de Modificación del Sistema de Protección a la Infancia y a la Adolescencia establece el marco general que regula la capacidad de los menores para tomar decisiones. Los menores con 16 años cumplidos tienen derecho a decidir; sin embargo, cuando se trate de una actuación de grave riesgo para la vida o salud del menor, según el criterio del facultativo, el consentimiento lo prestará el representante legal del menor, una vez oída y tenida en cuenta la opinión del mismo50. Algunas normativas autonómicas reconocen el derecho a decidir del menor a una edad inferior a los 16 años61,62.
Independientemente de este marco ajustado a edades, es obligación del equipo multidisciplinar valorar la madurez del menor ante una decisión clínica. La relación estrecha que mantienen los profesionales sanitarios con los niños, niñas y adolescentes suele aportar información suficiente para conocer la madurez y el grado de participación que pueden tener estos pacientes en la toma de decisiones terapéuticas. Solamente si existen dudas razonables por parte de los profesionales que atienden habitualmente al paciente, se utilizan escalas de competencia validadas63,64, o se lleva a cabo una evaluación protocolizada de la madurez del menor con un especialista en psicología clínica.
Una cuestión distinta al derecho a decidir es el derecho a recibir información. Es muy importante tener en cuenta que todos los niños, niñas y adolescentes en el final de la vida tienen derecho a ser informados independientemente de la edad que tengan. Es frecuente que la familia plantee resistencia a la realización de este derecho en un intento de proteger a su hijo o hija. Es responsabilidad de los profesionales ser capaces de evitar este tipo de conductas trasladando a la familia lo beneficioso que resulta para el paciente recibir la información necesaria adaptada a su edad y capacidad de comprensión.
La figura del profesional sanitario es clave como garante de los derechos del menor en aspectos tan trascendentes como su capacidad para tomar decisiones o entender la información que se les debe dar, así como preservar la confidencialidad y la propia intimidad.
Otras consideraciones
Los profesionales sanitarios deberían informar de manera abierta y honesta al paciente y la familia sobre el pronóstico y los tratamientos disponibles para facilitar la TDD. La incertidumbre sobre el pronóstico, en caso de existir, también debería ser discutida.
Según la evidencia, los pacientes quieren y valoran el rol materno y paterno y la experiencia de los clínicos para guiarles en el proceso de TDD, lo que indica a los clínicos la necesidad de contextualizar la TDD en el marco de las relaciones interpersonales establecidas. El grado de implicación preferido puede variar de unos pacientes a otros, según el tipo de decisión, o incluso durante el curso de la enfermedad. El GEG considera importante interrogar al paciente sobre su grado preferido de participación ante cada nueva TDD en lugar de hacer asunciones basadas en preferencias previas. Los profesionales han de respetar los deseos del paciente y su familia, sin embargo, el GEG coincide en que se debería instar firmemente a que el niño, niña o adolescente pueda manifestar sus preferencias, según su capacidad, cuando se discute sobre aspectos relacionados con su tratamiento.
Para una comunicación efectiva con el paciente pediátrico es necesario adaptarse a su edad y nivel evolutivo. El lenguaje no verbal, paraverbal y los juegos pueden ser aspectos tan esenciales de la comunicación con el niño o niña como las palabras, ya que permiten comprender sus necesidades y pueden ayudarle a participar en la toma de decisiones.
El reconocimiento y respeto de la realidad de la relación del niño, niña o adolescente con sus padres es un factor que debe estar presente en la dinámica del proceso, es decir, la TDD sobre el tratamiento y cuidados del paciente debería ser consistente con la forma en la que se toman decisiones sobre otros aspectos de la vida del menor.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
8. Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Boletín Oficial del Estado, nº 274, (15-11-2002).
49. Junta de Andalucía [Internet]. [citado mayo 2022]. Los derechos de los niños y niñas. Disponible en: https://www.juntadeandalucia.es/organismos/igualdadpoliticassocialesyconciliacion/areas/infancia-familias/derechos-infancia.html
50. Ley 26/2015, de 28 de julio, de modificación del sistema de protección a la infancia y a la adolescencia. Boletín Oficial del Estado nº 180 (29 de julio de 2015).
51. Coyne I, O’Mathúna DP, Gibson F, Shields L, Leclercq E, Sheaf G. Interventions for promoting participation in shared decision-making for children with cancer. Cochrane Database Syst Rev. 2016;11(11):Cd008970. https://doi.org/10.1002/14651858.CD008970.pub3.
52. Federación Española de Padres Niños con cáncer. Cambio legislativo respecto al interés superior del menor: Opiniones de adolescentes y padres/tutores de niños con cáncer. 2017.
53. Escudero Carretero MJ, Simón Lorda P, Aguayo Maldonado J, Arcos Ocón L, Cía Ramos R, Fernández López A, et al. El final de la vida en la infancia y la adolescencia: Aspectos éticos y jurídicos en la atención sanitaria. Sevilla: Junta de Andalucía; 2011.
54. Hinds PS, Drew D, Oakes LL, Fouladi M, Spunt SL, Church C, et al. End-of-life care preferences of pediatric patients with cancer. J Clin Oncol. 2005;23(36):9146-54. https://doi.org/10.1200/jco.2005.10.538.
55. Inglin S, Hornung R, Bergstraesser E. Palliative care for children and adolescents in Switzerland: a needs analysis across three diagnostic groups. Eur J Pediatr. 2011;170(8):1031-8. https://doi.org/10.1007/s00431-011-1398-5.
56. Kars MC, Grypdonck MH, de Korte-Verhoef MC, Kamps WA, Meijer-van den Bergh EM, Verkerk MA, et al. Parental experience at the end-of-life in children with cancer: ‘preservation’ and ‘letting go’ in relation to loss. Support Care Cancer. 2011;19(1):27-35. https://doi.org/10.1007/s00520-009-0785-1.
57. Matsuoka M, Narama M. Parents’ thoughts and perceptions on hearing that their child has incurable cancer. J Palliat Med. 2012;15(3):340-6. https://doi.org/10.1089/jpm.2011.0410.
58. de Vries MC, Bresters D, Kaspers GJL, Houtlosser M, Wit JM, Engberts DP, et al. What Constitutes the Best Interest of a Child? Views of Parents, Children, and Physicians in a Pediatric Oncology Setting. AJOB Primary Research. 2013;4(2):1-10. https://doi.org/10.1080/21507716.2012.757254.
59. Weaver MS, Baker JN, Gattuso JS, Gibson DV, Sykes AD, Hinds PS. Adolescents’ preferences for treatment decisional involvement during their cancer. Cancer. 2015;121(24):4416-24. https://doi.org/10.1002/cncr.29663.
60. Kars MC, Grypdonck MH, de Bock LC, van Delden JJ. The parents’ ability to attend to the «voice of their child» with incurable cancer during the palliative phase. Health Psychol. 2015;34(4):446-52. https://doi.org/10.1037/hea0000166.
61. Ley 10/2011, de 24 de marzo, de derechos y garantías de la dignidad de la persona en el proceso de morir y de la muerte. Boletín Oficial de Aragón nº 70, (24 de marzo de 2011).
62. Ley 26/2018, de 21 de diciembre, de derechos y garantías de la infancia y la adolescencia de la Comunidad Valenciana. DOGV nº 8450, (24 de diciembre de 2018).
63. Espejo M, Miquel E, Esquerda M, Pifarré J. Valoración de la competencia del menor en relación con la toma de decisiones sanitarias: escala de la competencia de Lleida. Med Clin (Barc). 2011;136(1):26-30. https://doi.org/10.1016/j.medcli.2009.05.014.
64. Drane JF. The many faces of competency. Hasting Cent Rep. 1985;4:17-21.
Comunicación con el paciente y la familia
Actualizado a fecha: 30/06/2022
¿Qué aspectos de la comunicación se perciben como útiles al plantear a los pacientes y familiares la adecuación de las medidas terapéuticas a la situación clínica del niño, niña o adolescente en CPP?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
- Los profesionales deben esforzarse para que la comunicación con el paciente y la familia se desarrolle en un ambiente de máxima cercanía y confianza. El paciente y la familia deberían percibir la implicación y voluntad del equipo en el tratamiento y cuidado del paciente.
- En la medida de lo posible, identificar y asignar profesionales de referencia dentro del equipo sanitario para la comunicación con el paciente y su familia.
- Los clínicos deben investigar las preferencias de los pacientes y la familia sobre qué información quieren recibir y cómo (interlocutor/es, frecuencia, nivel de detalle y complejidad), preguntándoles y adaptando la comunicación a sus necesidades, a sus valores y a su cultura en cada momento.
- Las necesidades de información y las preferencias del paciente y la familia deben valorarse regularmente.
- Tratar de conocer los pensamientos y sentimientos del paciente y la familia, haciéndoles preguntas y escuchando respetuosamente sus respuestas. El equipo debe poner en valor y respetar el conocimiento único que los padres tienen de su propio hijo o hija.
- Mostrar compasión y empatía, expresando preocupación por el paciente y reconociendo el estrés emocional y las dificultades familiares que se producen.
- Las reuniones con el paciente en CPP y su familia deben planificarse, preparando los siguientes aspectos con antelación:
- Buscar un lugar cómodo, tranquilo, con privacidad, preferentemente sin barreras físicas entre los interlocutores y sin interrupciones, dedicando el tiempo necesario.
- Animar al paciente y la familia a preparar la reunión escribiendo con antelación las dudas, preocupaciones o ideas que deseen plantear durante la misma.
- Identificar, abordar y, si es posible, resolver cualquier discrepancia entre los profesionales sanitarios antes de la reunión. Si el consenso no es posible, decidir cómo presentar la diferencia de opiniones a la familia y al paciente, e informarles acerca de las acciones futuras dirigidas a resolver la falta de consenso.
- Cuando se informa al paciente en CPP y a la familia, los hechos deben presentarse de forma clara y honesta, utilizando un lenguaje fácilmente comprensible. Es aconsejable transmitir la información clave en frases cortas. A continuación, es importante permanecer en silencio, dando tiempo al paciente y a la familia para expresar emociones, y compartir sus pensamientos.
- Las emociones que pueden experimentar el paciente y la familia pueden dificultar la comprensión y retención de la información; por tanto, puede ser necesario repetir la información varias veces, preguntando si se ha comprendido. Se recomienda emplazar al paciente y la familia a un siguiente encuentro, y ofrecer disponibilidad para reiterar y reforzar los mensajes, y aclarar nuevas dudas.
- Antes de finalizar cada reunión, el paciente en CPP y la familia deben conocer el momento en el que es probable que reciban más información, y la próxima ocasión en la que pueden preguntar a los clínicos acerca de las dudas que les hayan surgido.
- La decisión de adecuar las medidas terapéuticas a la situación clínica del niño, niña o adolescente que ha entrado en una fase avanzada de la enfermedad debe ser clara para todos los involucrados en la toma de decisiones sobre el tratamiento del paciente. Se debe registrar el proceso en la historia clínica o plan de actuación.
- Tras consensuar la necesidad de adecuar las medidas terapéuticas, se debe informar al paciente en CPP y a la familia sobre el nuevo plan de tratamiento y cuidados, comunicando que los objetivos son conseguir el máximo confort y bienestar para el paciente, y disminuir el sufrimiento.
- Las organizaciones sanitarias deben proporcionar a los profesionales que trabajan con pacientes pediátricos que precisan de CPP una formación adecuada en habilidades para la comunicación.
- Las organizaciones sanitarias y los propios servicios asistenciales deben garantizar la continuidad de cuidados, durante 24 horas al día, los 365 días del año y la coordinación entre los distintos servicios y ámbitos asistenciales.
Justificación
El GEG ha tenido en cuenta la evidencia sobre los facilitadores y las barreras de la comunicación desde el momento del diagnóstico hasta el final de la vida porque entiende que la comunicación es un proceso continuo que se desarrolla a lo largo de toda la enfermedad.
Justificación detallada
Las recomendaciones se han formulado en base a la evidencia identificada y la experiencia clínica de los profesionales del GEG. La evidencia pone de manifiesto la necesidad de compasión, empatía, escucha activa y apoyo emocional de los pacientes y sus familias. Es importante tener en cuenta sus preferencias sobre la cantidad de información, frecuencia, interlocutores y momento de la comunicación. La información debe adaptarse a su capacidad de comprensión.
De la evidencia a la recomendación
¿Cuál es la evidencia identificada?
Se incluyeron estudios cuyo objetivo era explorar los aspectos facilitadores o barreras de la comunicación entre los pacientes, sus familiares y los profesionales cuando la salud del niño, niña o adolescente empeora cerca del final de la vida y continúa recibiendo tratamiento con intención curativa. También se incluyeron estudios con una perspectiva más amplia, que investigan la experiencia de los pacientes y sus familias en torno a diversos aspectos de la atención al final de la vida, entre los que destacase la comunicación.
Fueron identificados e incluidos un total de 14 estudios66-79. Diez estudios investigaron la comunicación desde la perspectiva de los padres66,69-77, 1 estudio incluyó a los pacientes y a sus padres78, 1 estudio entrevistó a la familia del paciente (padres y hermanos)68 y, finalmente, 2 estudios atendieron la perspectiva de los profesionales67,79.
Temas que emergieron del análisis de los estudios identificados:
1. Establecer una relación de confianza (6 estudios)
Un estudio realizado en EEUU entrevistó a 20 pacientes (9 – 21 años) con cáncer avanzado, y a sus padres, para identificar los aspectos que favorecen o dificultan la comunicación en CPP. Padres y pacientes manifestaron la necesidad de construir una relación con los clínicos. En este sentido, ambos consideraron importante la continuidad en la relación (tratar siempre con el mismo profesional/es) y la demostración de esfuerzo, voluntad y competencia por parte de los clínicos. La falta de continuidad en el seguimiento del paciente durante el proceso de su enfermedad es percibida de forma negativa. La disponibilidad de los clínicos y el apoyo emocional (consuelo, compasión, afecto, consideración, esperanza), también son valorados por padres y pacientes como aspectos relevantes. Padres y pacientes aprecian a los clínicos que invierten tiempo en conocer personalmente y desarrollar una amistad con los pacientes78.
Un estudio realizado en Francia, entrevistó a 133 familias para explorar la experiencia de los padres en la toma de decisiones al final de la vida, 3 años después de la muerte del hijo/a, en el ámbito de los cuidados intensivos perinatales. Para construir una relación de confianza, los padres señalan la importancia de tratar siempre con los mismos profesionales, la presencia de una atmósfera protectora y compasiva, y la calidad de la atención y los cuidados al bebé71.
Un estudio realizado en EEUU describe la experiencia de 14 padres que perdieron a su hijo o hija (>10 años) a causa de un cáncer, como mínimo un año antes del estudio. Los padres manifiestan la necesidad de tratar con los mismos profesionales de forma continuada. La dedicación, interés, cuidado, sensibilidad, empatía, consideración y cariño fueron muy valorados. Perciben que la confianza y la familiaridad entre clínicos y pacientes generan seguridad, el conocimiento de qué es lo que se puede esperar, y coincidencia en las expectativas69.
Un estudio realizado en EEUU en el que participan 56 padres cuyos hijos/as (0 – 18 años) fallecieron en la UCI 12 – 45 meses antes, investigó sobre las prioridades en la comunicación durante la atención al final de la vida. La mayoría de los padres prefiere una figura familiar o de referencia responsable de transmitir la información, para evitar la confusión y la consiguiente falta de confianza que pueden generar demasiados interlocutores. Manifiestan la necesidad de tener acceso inmediato al equipo sanitario, no sólo para obtener información del plan de cuidados sino también para adquirir seguridad y tranquilidad emocional. La percepción de prisa o impaciencia en los clínicos o, peor aún, renuencia a reunirse con ellos les desalienta profundamente. Los padres respaldan con fuerza las demostraciones genuinas de compasión y empatía77.
Un estudio realizado en EEUU entrevistó a 56 padres de niños y niñas que fallecieron en una UCI pediátrica 3 – 12 meses antes. El aspecto de la comunicación con los clínicos mencionado con más frecuencia es la disponibilidad y solicitud del profesional. Los padres comentan que su compresión aumenta cuando los clínicos se toman el tiempo de sentarse con ellos durante las conversaciones. Algunos padres percibieron rechazo a hablar sobre el cuidado de sus hijos e hijas a no ser que se les preguntara directamente75.
Un estudio realizado en el Reino Unido en el que participaron 54 madres y 3 padres que perdieron a su hijo o hija durante el periodo neonatal, explora la experiencia de los padres sobre los cuidados paliativos neonatales. Los padres anhelan comprensión (empatía) y agradecen un trato respetuoso y digno para ellos y para su bebé (sensibilidad)70.
2. Interacción durante el proceso de comunicación (9 estudios)
Un estudio realizado en EEUU en el que participan 51 padres de niños y niñas que fallecieron en una UCI pediátrica 3 – 12 meses antes, recopila información sobre buenas y malas prácticas de los profesionales en la comunicación con los padres. Según los padres, los clínicos deben comunicar con el estado afectivo apropiado (sentimiento, actitud) y tratar al paciente como a una persona, no como a otro caso clínico más. La información médica debe ser clara y comprensible. Consideran responsabilidad de los clínicos saber gestionar la esperanza (balance entre incertidumbre y pronóstico), sin crear falsas expectativas74.
Un estudio realizado en EEUU entrevistó a 56 padres de niños y niñas que fallecieron en una UCI pediátrica 3 – 12 meses antes. Según los padres, los clínicos deben emplear un tono compasivo, amable, y consolador, e informar con claridad, empleando términos coloquiales, y al ritmo adecuado a la capacidad de comprensión del paciente y la familia. Hacen referencia al impacto del lenguaje corporal, la falta de contacto visual genera desconfianza y el sentimiento de que se oculta información75.
Un estudio realizado en EEUU explora aspectos de la comunicación cuando la salud del paciente, en tratamiento con intención curativa, empeora cerca del final de la vida. Participan 12 padres cuyos hijos e hijas fallecieron por cáncer 1,5 – 14 años antes del estudio. El 45% de los padres demanda que las malas noticias se comuniquen de manera compasiva, seguidas de inmediato de un plan para el futuro. El 63% valora que el equipo sanitario muestre emociones como preocupación, frustración o tristeza66.
Un estudio realizado en Francia, entrevistó a 133 familias para explorar la experiencia de los padres en la toma de decisiones al final de la vida, 3 años después de la muerte del hijo o hija, en el ámbito de los cuidados intensivos perinatales. Perciben como aspectos facilitadores que los clínicos clarifiquen y repitan los datos médicos, sin crear falsas esperanzas ni con metáforas incomprensibles71.
Un estudio realizado en EEUU entrevistó a 20 pacientes (9 – 21 años) con cáncer avanzado, y a sus padres, para identificar los aspectos que favorecen o dificultan la comunicación en CPP. Como facilitadores del intercambio de información, padres y pacientes hacen referencia a la habilidad de los clínicos para escuchar y hablar de manera directa y comprensible, utilizando el tiempo que sea necesario. Expresan la necesidad de que los clínicos muestren interés por lo que piensan padres y pacientes, escuchándoles, aunque estén en desacuerdo. Los pacientes señalan la importancia de que los clínicos les crean (están “de su parte”)78.
Un estudio realizado en EEUU en el que participan 56 padres cuyos hijos o hijas (0 – 18 años) fallecieron en la UCI 12 – 45 meses antes, investigó sobre las prioridades en la comunicación durante la atención al final de la vida. Los padres apoyan una comunicación honesta, sin falsas esperanzas. Valoran el respeto por la integridad de la relación paterno-filial: ser escuchados, respetados, y no juzgados77.
Un estudio realizado en Canadá y EEUU entrevistó a 99 familiares (36 madres, 24 padres, 39 hermanos) de niños, niñas y adolescentes que fallecieron de cáncer en los 12 meses previos al estudio, para solicitar su opinión sobre cómo mejorar la atención al final de la vida. Los padres son conscientes de la dificultad que implica dar malas noticias, pero manifiestan la necesidad de ser escuchados y que se respete su perspectiva. Señalan que la información debe repetirse hasta tener la seguridad de que la familia la ha comprendido68.
Un estudio realizado en Canadá examina las opiniones de 29 profesionales del ámbito de los cuidados paliativos perinatales que manifestaron la importancia de encontrar un espacio que asegure la privacidad y el uso del tiempo necesario para la comunicación67.
Un estudio realizado en el Reino Unido investiga cómo perciben los pediatras la comunicación que tiene lugar en torno a la muerte de los pacientes, mediante un cuestionario de preguntas abiertas que respondieron 61 profesionales. Valoran el respeto mutuo (escuchar y ser escuchado) como un factor facilitador en las discusiones con los padres, mientras que la falta de tiempo y las interrupciones se perciben como barreras para una comunicación efectiva79.
3. Comunicación personalizada/ individualizada (9 estudios)
Un estudio realizado en EEUU describe la experiencia de 14 padres que perdieron a su hijo o hija (>10 años) a causa de un cáncer, como mínimo un año antes del estudio. Señalan la importancia de adaptar las discusiones sobre el final de la vida a las necesidades individuales de los interesados. Los padres creen que en ocasiones los clínicos hacen uso de técnicas aprendidas de memoria en las discusiones sobre el final de la vida69.
Un estudio realizado en Francia, entrevistó a 133 familias para explorar la experiencia de los padres en la toma de decisiones al final de la vida, 3 años después de la muerte del hijo/a, en el ámbito de los cuidados intensivos perinatales. Según los padres, los clínicos deberían incorporar la realidad de la familia en la comunicación71.
Un estudio realizado en EEUU en el que participaron 28 padres de niños y niñas que habían fallecido 6 meses – 4 años antes, y que recibieron CPP, investiga las preferencias de los padres sobre el momento de entablar la discusión sobre los cuidados paliativos y las opciones de cuidados al final de la vida. El 43% (n=12) prefiere que tenga lugar en fases muy tempranas (en el diagnóstico o al inicio del tratamiento), el 39% (n=11) prefiere que tenga lugar cuando fracasa el tratamiento curativo o se diagnostica una recurrencia de la enfermedad, y el 17% (n=5) expresó incertidumbre al respecto76.
Un estudio realizado en el Reino Unido analizó las experiencias durante la atención al final de la vida de 55 padres de niños, niñas y adolescentes (<17 años) que fallecieron 12 a 18 meses antes en un centro hospitalario de tercer nivel. Los padres plantearon la necesidad de una buena comunicación que les prepare frente a la posible muerte de su hijo o hija. Comentaron la resistencia que en ocasiones manifiestan los clínicos a tratar sobre la muerte hasta que es muy tarde72.
Un estudio realizado en Canadá y EEUU entrevistó a 99 familiares (36 madres, 24 padres, 39 hermanos) de niños, niñas y adolescentes que fallecieron de cáncer en los 12 meses previos al estudio, para solicitar su opinión sobre cómo mejorar la atención al final de la vida. Reclaman que los clínicos faciliten detalles por anticipado sobre lo que puede suceder en el curso de la enfermedad, incluida la posibilidad de que su hijo o hija pueda morir. En relación a los hermanos/as del paciente, deberían ser incluidos en las reuniones con el equipo médico, informándoles de manera adecuada a su nivel de desarrollo68.
Un estudio realizado en el Reino Unido en el que participaron 54 madres y 3 padres que perdieron a su hijo hija durante el periodo neonatal, explora la experiencia de los padres sobre los cuidados paliativos neonatales. Los padres desean saber qué pueden esperar y cómo manejar la posibilidad de muerte y los sentimientos que conlleva70.
Un estudio realizado en EEUU explora las experiencias de 36 padres de un origen cultural diferente (Méjico y China), que sufrieron la muerte de su hijo o hija (≤20 años) entre 6 meses y 5 años antes. Las diferencias culturales y el lenguaje pueden ser una barrera en la comunicación que frene a los padres inmigrantes a solicitar información, dando a los clínicos la falsa impresión de que han abordado de forma adecuada sus preocupaciones. Los padres apreciaron que los clínicos incorporasen en la comunicación los valores religiosos y culturales de las familias73.
Un estudio realizado en EEUU en el que participan 56 padres cuyos hijos e hijas (0 – 18 años) fallecieron en la UCI 12 – 45 meses antes, investigó sobre las prioridades en la comunicación durante la atención al final de la vida. Es frecuente que los padres reconozcan su fe como el centro de su esfuerzo en encontrar sentido a la situación77.
Un estudio realizado en el Reino Unido investiga cómo perciben los pediatras la comunicación que tiene lugar en torno a la muerte de los pacientes, mediante un cuestionario de preguntas abiertas que respondieron 61 profesionales. Los clínicos opinan que la comunicación tiende a “ir bien” cuando ha habido una buena planificación e introducción previas79.
Los temas y subtemas que emergieron del análisis de los estudios identificados para responder a esta pregunta se describen en detalle en el anexo II.
¿Cuál es la confianza en la evidencia?
La calidad de la evidencia fue evaluada como moderada, baja o muy baja. Las causas que motivaron el descenso de la calidad son compartidas por la mayoría de los estudios incluidos.
En general, la tasa de respuesta fue baja lo que significa que el riesgo de sesgo de autoselección es elevado. Es posible que las opiniones y necesidades en torno a la comunicación de aquellos que rehusaron participar fueran diferentes de las opiniones y necesidades de los participantes en los estudios.
Existe incertidumbre respecto a la triangulación y saturación de los datos en los estudios individuales. Los estudios no informan si llegaron a alcanzar la saturación de los datos y algunos no realizaron triangulación de los mismos. La triangulación es una técnica que consiste en utilizar 3 o más perspectivas o diferentes observadores, o varias fuentes de datos para reducir la incertidumbre de un solo método. La saturación se refiere al momento en que, después de la realización de un número de entrevistas, grupos de discusión, etc., el material cualitativo deja de aportar datos nuevos.
La naturaleza retrospectiva de los estudios, con una única excepción, introduce un riesgo elevado de sesgo de memoria. Los resultados de Hendricks-Ferguson et al.76 sobre cuándo prefieren los padres recibir la información de los cuidados al final de la vida deben ser interpretados con cautela, es preciso tener en cuenta que su perspectiva es muy diferente tras la muerte del hijo o hija.
Los investigadores no han examinado de forma crítica su propio rol y su subjetividad de análisis. Los estudios no informan sobre la relación entre investigadores, entrevistadores y participantes.
Los hallazgos de los estudios se consideran aplicables a nuestra pregunta en términos de población incluida, contexto y temas investigados.
Facilitadores y barreras
La evidencia incluida explora la comunicación desde una perspectiva más amplia que la formulada en la pregunta de investigación. Además de las percepciones y expectativas de la familia y los profesionales en torno a la comunicación cuando el objetivo global del cuidado cambia a “mantener el confort”, el GEG ha considerado oportuno explorar los facilitadores y barreras de la comunicación desde el momento del diagnóstico hasta el final de la vida.
Esta perspectiva tiene en cuenta que la comunicación es un proceso continuo que tiene lugar durante todo el curso de la enfermedad. Cuando el paciente entra en una fase de irreversibilidad y progresión, la comunicación entre los profesionales, el paciente y la familia habrá adquirido ya una dinámica que influirá en el momento de plantear la adaptación de los cuidados a la situación de final de vida del paciente.
Para una comunicación efectiva, la evidencia sugiere establecer una relación de confianza con un número limitado de profesionales. Deben poseer las habilidades y competencias necesarias para comunicar “malas noticias” (es decir, información capaz de alterar drásticamente la visión que tiene un paciente sobre su futuro80) y estar disponibles cuando es importante la discusión frecuente (por ejemplo, ante un deterioro grave del estado del paciente). Cuando el paciente y la familia se sientan más cómodos con un profesional en particular, sus preferencias deberían ser reconocidas y respetadas. El GEG entiende que en el transcurso de la enfermedad los profesionales de referencia para el paciente y la familia cambiarán en función del ámbito asistencial en el que el paciente es atendido. Por este motivo es primordial que todos los servicios, a nivel domiciliario, hospitalario o en centros sociosanitarios trabajen de forma coordinada para asegurar la continuidad asistencial.
La evidencia muestra que es importante que los profesionales sean sensibles a la situación de vulnerabilidad en la que se encuentran los pacientes y sus familias, y a la necesidad que tienen de compasión, empatía y apoyo emocional. Por otra parte, la claridad, la honestidad y la transparencia son esenciales, los padres desean ser informados de la incertidumbre clínica, evitando afirmaciones poco realistas y falsas esperanzas.
Los padres quieren la información completa proporcionada a un ritmo adecuado a su capacidad de comprensión. Para tomar decisiones de manera conjunta, ambas partes (padres y profesionales sanitarios) deben tener la misma información y, lo que es más importante, entenderla de la misma manera. El GEG indica, no obstante, que en determinados momentos la familia y el paciente pueden tener una actitud de “no querer saber” que dificulte la comunicación. Los profesionales deberían ser sensibles a esta situación, y reevaluar de forma periódica dicha actitud para adecuar sus actuaciones.
El GEG señala que los profesionales no deberían suponer cuáles son las necesidades de la familia y el paciente en relación a la comunicación, por el contrario, deberían preguntarles qué funciona mejor para ellos (cantidad de información, frecuencia, interlocutores, momento y lugar de la comunicación). Además, es importante tener en cuenta que las preferencias de la familia pueden variar según el momento y el estado del paciente. La información deberá proporcionarse tantas veces como sea preciso, ya sea porque el equipo lo juzgue necesario o, principalmente, porque el paciente o la familia lo demanden.
Es preciso tener en cuenta que los hermanos/as del niño/ niña o adolescente enfermo se pueden sentir excluidos si no son informados por el equipo sanitario de forma directa. Es preciso valorar la posibilidad de que esta información no sea dada únicamente con los padres presentes, sino también en privado81. Además, los adolescentes tienen la necesidad de que la comunicación sea acorde a su desarrollo madurativo, evitando el trato infantil, y el lenguaje o los razonamientos simples.
La evidencia sugiere que los profesionales sanitarios deben adaptar la comunicación a las necesidades individuales o situación particular de las familias, de acuerdo con sus creencias y valores culturales, espirituales o religiosos.
Otras consideraciones
La necesidad de comunicación con la familia puede surgir de forma repentina, por ejemplo, ante un deterioro brusco del estado de salud del paciente, o en el caso de muerte inminente. En este sentido, el GEG indica que es preciso que la información sobre el pronóstico, la toma de decisiones consensuada y el plan de tratamiento estén bien recogidos en la historia para que sea posible una continuidad de la atención.
Padres y pacientes necesitan recibir mensajes de apoyo y acompañamiento que les ayuden a prepararse frente a la muerte. Esto tiene implicaciones importantes al plantear a la familia la adecuación las medidas terapéuticas, información con un enorme impacto emocional que debe verse compensada a continuación con la información sobre los tratamientos paliativos, atención integral, medidas de confort y disponibilidad del equipo, que pueden ofrecerse al niño, niña o adolescente.
Cuando se informa al menor en CPP los profesionales deben tener en cuenta su edad y capacidad de comprensión y valorar el uso de actividades de juego, materiales escritos, apoyos visuales y soportes tecnológicos.
Aunque no es objeto de la pregunta, el GEG considera muy importante formar a los profesionales de todos los niveles asistenciales para que adquieran las habilidades necesarias para establecer una comunicación adecuada con el paciente en cuidados paliativos pediátricos y su familia82.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
65. Herreros B, Palacios G, Pacho E. Limitación del esfuerzo terapéutico. Rev Clin Esp. 2012;212(3):134-40. https://doi.org/10.1016/j.rce.2011.04.016.
66. Snaman JM, Torres C, Duffy B, Levine DR, Gibson DV, Baker JN. Parental Perspectives of Communication at the End of Life at a Pediatric Oncology Institution. J
Palliat Med. 2016;19(3):326-32. https://doi.org/10.1089/jpm.2015.0253.
67. Stenekes SJ, Ens CD, Harlos M, Chochinov HM, Mytopher K. A descriptive study evaluating perinatal healthcare providers’ perspectives of palliative programming in
3 Canadian institutions. J Perinat Neonatal Nurs. 2014;28(4):280-9; quiz E1-2. https://doi.org/10.1097/jpn.0000000000000020.
68. Steele AC, Kaal J, Thompson AL, Barrera M, Compas BE, Davies B, et al. Bereaved parents and siblings offer advice to health care providers and researchers. J Pediatr
Hematol Oncol. 2013;35(4):253-9. https://doi.org/10.1097/MPH.0b013e31828afe05.
69. Robert R, Zhukovsky DS, Mauricio R, Gilmore K, Morrison S, Palos GR. Bereaved parents’ perspectives on pediatric palliative care. J Soc Work End Life Palliat Care. 2012;8(4):316-38. https://doi.org/10.1080/15524256.2012.732023.
70. Branchett K, Stretton J. Neonatal palliative and end of life care: What parents want from professionals. Journal of Neonatal Nursing. 2012;18(2):40-4. https://doi.org/10.1016/j.jnn.2012.01.009.
71. Caeymaex L, Speranza M, Vasilescu C, Danan C, Bourrat MM, Garel M, et al. Living with a crucial decision: a qualitative study of parental narratives three years after the loss of their newborn in the NICU. PLoS One. 2011;6(12):e28633. https://doi.org/10.1371/journal.pone.0028633.
72. Midson R, Carter B. Addressing end of life care issues in a tertiary treatment centre: lessons learned from surveying parents’ experiences. J Child Health Care. 2010;14(1):52-66. https://doi.org/10.1177/1367493509347060.
73. Davies B, Contro N, Larson J, Widger K. Culturally-sensitive information-sharing in pediatric palliative care. Pediatrics. 2010;125(4):e859-65. https://doi.org/10.1542/peds.2009-0722.
74. Gordon C, Barton E, Meert KL, Eggly S, Pollacks M, Zimmerman J, et al. Accounting for medical communication: parents’ perceptions of communicative roles and
responsibilities in the pediatric intensive care unit. Communication & medicine. 2009;6(2):177-88.
75. Meert KL, Eggly S, Pollack M, Anand KJ, Zimmerman J, Carcillo J, et al. Parents’ perspectives on physician-parent communication near the time of a child’s death in
the pediatric intensive care unit. Pediatr Crit Care Med. 2008;9(1):2-7. https://doi.org/10.1097/01.Pcc.0000298644.13882.88.
76. Hendricks-Ferguson VL. Parental perspectives of initial end-of-life care communication. Int J Palliat Nurs. 2007;13(11):522-31. https://doi.org/10.12968/ijpn.2007.13.11.27587.
77. Meyer EC, Ritholz MD, Burns JP, Truog RD. Improving the quality of end-of-life care in the pediatric intensive care unit: parents’ priorities and recommendations. Pediatrics. 2006;117(3):649-57. https://doi.org/10.1542/peds.2005-0144.
78. Hsiao JL, Evan EE, Zeltzer LK. Parent and child perspectives on physician communication in pediatric palliative care. Palliat Support Care. 2007;5(4):355-65. https://doi.org/10.1017/s1478951507000557.
79. Baverstock A, Finlay F. What can we learn from the experiences of consultants around the time of a child’s death? Child Care Health Dev. 2008;34(6):732-9. https://doi.org/10.1111/j.1365-2214.2008.00875.x.
80. Buckman R. Communications and emotions. BMJ. 2002;325(7366):672. https://doi.org/10.1136/bmj.325.7366.672.
81. Costey S, Martín Ruiz N, Lorente R, Martínez de Zabarte Fernández JM, Marco S, Lanceta V, et al. La experiencia de enfermedad en los hermanos de niños en cuidados paliativos. Medicina Paliativa. 2020;27. https://doi.org/10.20986/medpal.2020.1143/2019.
82. Caballero Pérez V, Rigal Andrés M, Beltrán García S, Parra Plantagenet-Whyte F, Moliner Robredo MC, Gracia Torralba L, et al. Influencia de los recursos especializados en cuidados paliativos pediátricos en los pediatras de Atención Primaria. Pediatría Atención Primaria. 2018;20:133-42.
Lugar preferido para los cuidados al final de la vida
Actualizado a fecha: 30/06/2022
¿Qué preferencias tienen los niños, niñas y adolescentes en CPP y sus familiares o cuidadores respecto al lugar donde reciben los cuidados?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
- Se propone que el profesional aborde con el niño, niña o adolescente y la familia sus preferencias en cuanto al lugar de los cuidados y el fallecimiento, teniendo en cuenta sus valores culturales, espirituales y religiosos.
- Los cuidados deben proporcionarse en el lugar que prefieran el niño, niña o adolescente y su familia, siempre que sea adecuado a sus necesidades de atención y a la disponibilidad de servicios en su área.
- Siempre que sea posible, se debe garantizar una asistencia paliativa pediátrica en el propio hogar, las 24 horas del día, por ser el lugar de los cuidados que con más frecuencia prefieren el niño, niña o adolescente y su familia.
- Los pacientes y sus familias deben tener la posibilidad de cambiar de lugar de cuidado en todo momento, siendo necesaria una adecuada coordinación entre los diferentes niveles asistenciales que atienden al paciente. Esta opción se les debería comunicar desde un inicio.
- Las preferencias del lugar de los cuidados del paciente y su familia deben quedar registradas en la historia clínica y ser accesibles a los profesionales implicados en su asistencia.
Justificación
La evidencia es escasa y de baja calidad; no obstante, es relevante señalar que existe consistencia entre los estudios en cuanto a la preferencia del lugar de los cuidados. El paciente y su familia se sienten más cómodos y seguros en su propio hogar, dónde creen que van a poder mantener una vida lo más normal posible. Ante todo, el GEG entiende que es imperativo respetar los deseos del paciente pediátrico en cuidados paliativos y su familia, y así queda reflejado en las recomendaciones.
De la evidencia a la recomendación
¿Cuál es la evidencia identificada?
Se identificaron 3 estudios transversales83-85, un estudio de cohortes86 y un estudio cualitativo87, que investigan las preferencias del lugar de los cuidados85 y de la muerte83,84,86, mediante encuestas con preguntas cerradas83,85,86 y entrevistas semi-estructuradas84,85. El estudio de Kassam et al.85 utilizó tres escenarios hipotéticos que los participantes debían priorizar según sus preferencias. El estudio cualitativo aporta información sobre las preferencias y las motivaciones que les llevan a elegir el cuidado en casa o en el hospital87.
Resumen de la evidencia los estudios identificados:
- Preferencia lugar de los cuidados (2 estudios)
En un estudio realizado en Canadá, el 79,1% de los padres de niños, niñas o adolescentes que fallecieron por cáncer eligió el domicilio en primer lugar, entre tres escenarios de cuidados hipotéticos (domicilio, hospital y hospice)85.
Un estudio cualitativo, realizado en Francia, muestra que los padres prefieren que su hijo o hija pase el mayor tiempo posible en casa para que pueda estar en su entorno familiar. El cuidado en el hogar es para ellos una forma de ayudar a combatir la enfermedad. Cuando el estado del paciente es grave prefieren el hospital. Para algunos padres la atención en el domicilio representa el fin del tratamiento curativo y la proximidad de la muerte87.
- Preferencia lugar de la muerte (6 estudios)
En estudios realizados en el Reino Unido, Alemania, Canadá y EEUU, la mayoría de los padres de pacientes pediátricos con cáncer preferían la muerte en el hogar (60,8% a 88%)83-86.
En un estudio realizado en EEUU el 97% prefirió la muerte en casa cuando los niños, niñas o adolescentes eran atendidos en un programa de CPP domiciliario, la proporción se redujo al 72% entre los que no participaron en el programa de CPP. Un estudio realizado en Canadá observa que los pacientes en edad pediátrica que participan en programas de CPP tienen más probabilidad de morir en casa, de acuerdo con los deseos de la familia86.
Un estudio cualitativo, realizado en Francia87, muestra que la mayoría de los padres prefirieron la muerte en el hospital. Respecto a fallecer en casa, expresaron:
- Temor a arrepentirse (no saber cómo actuar)
- Mayor persistencia de la imagen del hijo o hija muerto.
- Necesidad de proteger a los hermanos y hermanas.
La elección del hogar respondió, en una paciente, a los deseos de morir rodeada por su familia y, en otro paciente y su familia, a su bagaje cultural. Uno de los temas que emergieron fue la representación de la calidad de los cuidados: creencia de que los mejores cuidados se reciben en el hospital donde, además, la disponibilidad de los profesionales es constante.
- Cambio en las preferencias con el tiempo (1 estudio)
En un estudio realizado en el Reino Unido, la proporción de niños, niñas o adolescentes con cáncer y sus familias que prefería la muerte en casa al inicio de los CPP aumentó durante el último mes de vida (de 60,8% a 80%). El porcentaje de indecisos disminuyó del 17,7% al 10,3% durante el último mes de vida83.
¿Cuál es la confianza en la evidencia?
La calidad de la evidencia fue juzgada como baja o muy baja. La metodología de la mayoría de los estudios es demasiado rígida (encuestas con preguntas cerradas), no se adapta al amplio rango de factores que motivan las preferencias de los pacientes y sus familias, ni a un estado en el que los síntomas pueden evolucionar con rapidez. El enfoque cualitativo es más idóneo para responder a la pregunta; sin embargo, la aplicabilidad del único estudio cualitativo incluido se ve comprometida por la edad de los pacientes (14 a 25 años) y porque la atención paliativa no es la específica de pediatría.
El riesgo de sesgo de selección es elevado. La tasa de respuesta de los participantes fue baja, entre el 26% y el 54% de las familias elegibles. Los valores y preferencias de las familias que escogieron participar pueden haber sido diferentes de aquellas que rehusaron a ser encuestadas.
Existe un alto riesgo de sesgo de memoria en la mayoría de los estudios. Las preferencias de los padres podrían haber sido diferentes si se les hubiera preguntado de forma prospectiva.
En relación a la aplicabilidad de la evidencia:
- Los estudios encontrados se centran en población con cáncer y no pueden generalizarse a todas las enfermedades que precisan cuidados paliativos. En este sentido, es mayor la relevancia de los temas expresados por el grupo focal que participó en la GPC del NICE, constituido por 14 jóvenes de 12 – 18 años de edad con distintas enfermedades como atrofia muscular espinal, cáncer, fibrosis quística y otras enfermedades raras y degenerativas amenazantes para la vida.
- Las preferencias culturales condicionan la elección del lugar de la muerte. Teniendo en cuenta el contexto de los hallazgos de los estudios, su aplicabilidad a nuestro medio es limitada.
Facilitadores y barreras
La evidencia sugiere que el domicilio es el lugar que con más frecuencia prefieren los niños, niñas o adolescentes en situación de final de vida y sus familias para recibir los cuidados. También sugiere una tendencia positiva a la asociación entre esta preferencia y los cuidados efectivos en domicilio cuando hay involucrado un equipo de CPP85,86. Gracias al soporte del equipo de CPP las familias se sienten capacitadas para cuidar al niño, niña o adolescente en casa. Según la Unidad de Atención Integral Paliativa Pediátrica del Hospital Niño Jesús de Madrid, desde su aparición y con su apoyo, la cantidad de niños que participan en el programa de CPP y que mueren en los hospitales es muy baja; lo hacen en su casa de una manera más confortable, familiar e íntima88. La experiencia del GEG apunta en la misma dirección, la atención continuada por unidades multidisciplinares de CPP en coordinación con atención primaria, con accesibilidad al equipo las 24 horas, favorece que llegado el momento los familiares y pacientes elijan el domicilio como el lugar para los cuidados hasta el final de la vida.
La decisión de cada paciente y su familia depende tanto de factores médicos, psicológicos, sociales y culturales, como de consideraciones de tipo práctico relacionadas con la disponibilidad de recursos y la capacitación de los cuidadores. La familia y el paciente deberían estar correctamente informados sobre los medios disponibles en su entorno, y las necesidades técnicas de la atención al paciente en CPP.
Equidad, aceptabilidad y factibilidad
Los cuidados y el fallecimiento en casa llevan implícito el apoyo continuado de los profesionales, preferentemente de un equipo de CPP en coordinación con atención primaria y especializada, que deben estar localizables las 24 horas al día, los 365 días del año, para poder atender las eventuales necesidades que se puedan presentar.
El análisis de la situación de la atención paliativa pediátrica en el SNS realizado en el documento “Cuidados Paliativos Pediátricos en el Sistema Nacional de Salud: Criterios de Atención”5, pone de manifiesto que solamente 5 comunidades autónomas cuentan con dispositivos específicos de atención en CPP. Posteriormente, algunas comunidades autónomas han actualizado o puesto en marcha recursos destinados a cubrir la atención paliativa pediátrica89. La provisión de servicios que faciliten al paciente y su familia la posibilidad de elegir el lugar de la atención y de la muerte es una decisión de política sanitaria a nivel de las Comunidades Autónomas, propia de otro contexto.
¿Cuál es la magnitud de los recursos requeridos (costes)?
Se realizaron búsquedas bibliográficas de evaluaciones económicas o estudios de costes en los últimos 10 años que abordaran el uso de recursos de los diferentes lugares de cuidados (domicilio y hospital). Se encontraron tres estudios90-92. Sin embargo, ninguno de ellos contenía una evaluación económica completa, ya que no comparan explícitamente una alternativa frente a la práctica habitual en términos de costes y resultados en salud. La información que se presenta, no obstante, resulta relevante para la estimación de parámetros (uso de recursos, necesidades de personal para la atención de los CPP en el domicilio, clasificación de diagnósticos para cuantificar uso de recursos o descripción de modelos organizativos de CPP) y la construcción de un modelo.
Se desarrolló, por tanto, un modelo analítico que simula las dos estrategias de abordaje de CPP (en el domicilio del paciente versus ingreso hospitalario) durante los últimos 30 días de vida. Los resultados indican que la opción de establecer los CPP en el domicilio del paciente durante los últimos 30 días de vida tiene un coste de 19.304 € menos que la atención mediante ingreso hospitalario, tomando la perspectiva del SNS. En el caso de ampliar la perspectiva e incluir, además, los costes asumidos por la familia en forma de cuidados informales, la diferencia entre ambas alternativas es de aproximadamente 16.500 €. En concreto, el coste por día de un paciente en CPP en el domicilio es de 1.084,16 € y en el hospital es de 1.902,46 €. Los resultados específicos se muestran en la tabla 4 y figura 3.
En el anexo III se incluye la metodología detallada y una descripción amplia de los resultados obtenidos con el modelo analítico.
Se ha elaborado una plantilla de cálculo que muestra el uso de recursos y el coste durante los últimos 30 días de vida de un niño, niña o adolescente en cuidados paliativos, proporcionados en el domicilio y/o en el hospital. Esta herramienta ofrece la posibilidad de modificar los parámetros relacionados con el uso de recursos y costes para ajustarlos a la práctica diaria o condiciones de los distintos servicios, ayudando a informar las decisiones de los profesionales usuarios de la presente GPC. Puede consultarse en el anexo IV.
Otras consideraciones
El lugar preferido de atención cerca del final de la vida puede no ser el lugar escogido para morir. Montel et al.87 citan el caso de un adolescente que era atendido en el domicilio y eligió ingresar en el hospital dos días antes de morir. Efectivamente, según la experiencia del GEG, el lugar de los cuidados no siempre coincide con el lugar dónde el paciente y la familia prefieren que suceda el fallecimiento, debido a que las circunstancias clínicas y emocionales son muy distintas. El GEG considera que cualquiera que sea la decisión sobre la ubicación principal de la atención, los niños, niñas o adolescentes y sus familias deberían tener la posibilidad de cambiar de una opción a otra, con garantías de una buena coordinación con los diferentes niveles asistenciales que atienden al paciente. Asimismo, debe tenerse en cuenta que el lugar de los cuidados y la muerte planeados en un principio pueden cambiar según la evolución clínica del paciente. Esta posibilidad ha de quedarles clara al paciente y su familia desde el principio, para mitigar su angustia en esos momentos. Cuando el paciente y la familia opten por la donación de órganos y tejidos (donación en asistolia) el lugar de fallecimiento será en cualquier caso el hospital.
El GEG considera que es de enorme importancia explicar al niño, niña o adolescente en cuidados paliativos, con información adecuada su edad y capacidad de comprensión, y a la familia, las posibles opciones respecto al lugar de los cuidados y de la muerte, y asistirles a la hora de tomar la decisión. Siempre que sea posible, el lugar de los cuidados y de la muerte debería ser aquel que hayan elegido el paciente y su familia. Es importante hacerles comprender, sin embargo, que es preciso tener en cuenta otros factores como son las necesidades clínicas del paciente o la disponibilidad de los servicios.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
5. Ministerio de Sanidad, Servicios Sociales e Igualdad. Cuidados paliativos pediátricos en el Sistema Nacional de Salud: Criterios de Atención. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2014.
83. Vickers J, Thompson A, Collins GS, Childs M, Hain R. Place and provision of palliative care for children with progressive cancer: a study by the Paediatric Oncology Nurses’ Forum/United Kingdom Children’s Cancer Study Group Palliative Care Working Group. J Clin Oncol. 2007;25(28):4472-6. https://doi.org/10.1200/jco.2007.12.0493.
84. Hechler T, Blankenburg M, Friedrichsdorf SJ, Garske D, Hübner B, Menke A, et al. Parents’ perspective on symptoms, quality of life, characteristics of death and end-of-life decisions for children dying from cancer. Klin Padiatr. 2008;220(3):166-74. https://doi.org/10.1055/s-2008-1065347.
85. Kassam A, Skiadaresis J, Alexander S, Wolfe J. Parent and clinician preferences for location of end-of-life care: home, hospital or freestanding hospice? Pediatr Blood Cancer. 2014;61(5):859-64. https://doi.org/10.1002/pbc.24872.
86. Friedrichsdorf SJ, Postier A, Dreyfus J, Osenga K, Sencer S, Wolfe J. Improved quality of life at end of life related to home-based palliative care in children with cancer. J Palliat Med. 2015;18(2):143-50. https://doi.org/10.1089/jpm.2014.0285.
87. Montel S, Laurence V, Copel L, Pacquement H, Flahault C. Place of death of adolescents and young adults with cancer: first study in a French population. Palliat Support Care. 2009;7(1):27-35. https://doi.org/10.1017/s1478951509000054.
88. Astray San Martín A. Encuesta sobre cuidados paliativos a pediatras de Atención Primaria en un área sanitaria de Madrid. Rev Pediatr Aten Primaria. 2010;XII(45):33-40.
89. Arias-Casais N, Garralda E, Pons JJ, Marston J, Chambers L, Downing J, et al. Mapping Pediatric Palliative Care Development in the WHO-European Region: Children Living in Low-to-Middle-Income Countries Are Less Likely to Access It. J Pain Symptom Manage. 2020;60(4):746-53. https://doi.org/10.1016/j.jpainsymman.2020.04.028.
90. Ananth P, Melvin P, Feudtner C, Wolfe J, Berry JG. Hospital Use in the Last Year of Life for Children With Life-Threatening Complex Chronic Conditions. Pediatrics. 2015;136(5):938-46. https://doi.org/10.1542/peds.2015-0260.
91. Noyes J, Edwards RT, Hastings RP, Hain R, Totsika V, Bennett V, et al. Evidence-based planning and costing palliative care services for children: novel multi-method epidemiological and economic exemplar. BMC Palliat Care. 2013;12(1):18. https://doi.org/10.1186/1472-684x-12-18.
92. Chong PH, De Castro Molina JA, Teo K, Tan WS. Paediatric palliative care improves patient outcomes and reduces healthcare costs: evaluation of a home-based program. BMC Palliat Care. 2018;17(1):11. https://doi.org/10.1186/s12904-017-0267-z.
Evaluación de los síntomas en cuidados paliativos pediátricos
Actualizado a fecha: 30/06/2022
¿Cómo podemos evaluar qué síntoma físico y/o emocional causa más malestar al paciente en CPP? ¿Cuáles son percibidos como los más angustiosos por el paciente y su familia o cuidadores?
Práctica recomendada basada en la experiencia clínica y el consenso del equipo elaborador. LEER MÁS
- La valoración de los síntomas tanto físicos como psicológicos del paciente en CPP debe ser multidisciplinar, individualizada, adaptada al niño, niña, o adolescente y su familia y continuada en el tiempo.
- El reconocimiento y manejo de los síntomas tanto físicos como psicológicos del paciente en CPP debería llevarse a cabo preferentemente por profesionales especializados en la atención paliativa pediátrica, especialmente en los pacientes en situación de últimos días de vida.
- Los profesionales deben conocer los síntomas físicos y psicológicos percibidos por el paciente en CPP y su familia. Se sugiere la búsqueda intencionada y continua de todos los síntomas, a través de preguntas dirigidas sobre lo que preocupa o molesta al paciente, además de la exploración física, para favorecer una valoración integral.
- La identificación de los síntomas que sufren los pacientes con dificultades de comunicación debería realizarla personal entrenado, mediante escalas de valoración adaptadas y teniendo en cuenta los cambios percibidos por el cuidador principal respecto a la situación basal del paciente.
- Los profesionales sanitarios deben comunicar con antelación al paciente en CPP y a la familia, los síntomas físicos y psicológicos que pueden aparecer al final de la vida, en particular los signos y síntomas relacionados con la agonía.
- Se debe instruir a los padres acerca del uso de medidas de confort efectivas para aliviar o atenuar el sufrimiento del niño, niña o adolescente en el final de la vida, como usar una esponja para humedecer la zona oral, posiciones anatómicas, mantas para dar calor, o que pueda tener cerca sus juguetes u objetos preferidos.
Justificación
El GEG ha decidido formular una serie de consideraciones prácticas generales porque no ha encontrado evidencia científica para responder directamente a la pregunta de investigación. También ha tenido en cuenta la evidencia científica procedente de estudios sobre cómo perciben los pacientes y sus familiares los síntomas al final de la vida.
De la evidencia a la recomendación
¿Cuál es la evidencia identificada?
No se encontraron estudios que investigaran la aplicación en la práctica clínica de estrategias validadas para precisar la carga de sufrimiento asociado a cada síntoma físico y psicológico del paciente en CPP. Aunque no responden de manera directa a la primera parte de la pregunta planteada, el GEG decidió considerar la inclusión de estudios sobre los síntomas percibidos por el paciente y su familia durante los últimos días de vida.
Se identificaron 10 estudios transversales25,28,84,93-99 que investigan los diferentes tipos de síntomas y el sufrimiento que generan desde la perspectiva del paciente o la familia, a través de encuestas con preguntas cerradas25,28,84,93-97,99, y un cuestionario semiestructurado98. Además, 3 estudios analizan la concordancia entre profesionales y padres respecto al número e intensidad de los síntomas94,95,98, 5 estudios investigan qué síntomas se trataron y cuál fue la respuesta al tratamiento, según los padres84,94-96,98, y 5 estudios informan sobre la repercusión de los síntomas físicos y psicológicos en la calidad de los últimos días de vida del paciente84,94-96,98. Ullrich et al.98 estudia un único síntoma, la astenia (fatiga), mientras que el objetivo de Rosenberg et al.28 es analizar la calidad de vida relacionada con la salud y su asociación con el malestar causado por los síntomas físicos y psicológicos.
Para dar respuesta a la segunda parte de la pregunta se incluye un estudio cualitativo76 que identifica, mediante entrevistas semiestructuradas, los síntomas que más preocupan a los padres al final de la vida del paciente en CPP.
Resumen de la evidencia de los estudios identificados:
1. Síntomas (frecuencia y grado de sufrimiento) (9 estudios)
En un estudio prospectivo realizado en EEUU en niños y niñas (n=25) con cáncer al final de la vida (resultados informados por el paciente), los síntomas informados con más frecuencia fueron dolor (61,6%), somnolencia (50%) y astenia (fatiga) (49,3%). El número de síntomas por encuesta fue de 5 (RIC, 2 – 10), de los cuales 3 (RIC, 1 – 9) causaban niveles altos de sufrimiento93.
En un estudio realizado en Alemania, disnea (61%), dolor (58%), náuseas/vómitos (34%) y agitación (34%) fueron los principales síntomas durante el último mes de vida, según los padres de niños y niñas (n=38) que fallecieron por una enfermedad limitante para la vida. El 82% de los síntomas informados fue catalogado como grave. El 82% de los padres informaron 2 o 3 síntomas. La combinación más frecuente fue dolor y disnea (25%)95.
En un estudio realizado en EEUU, astenia (fatiga) (96%), dolor (83%), disnea (82%) y falta de apetito (82%) fueron los síntomas durante el último mes de vida informados por padres de niños y niñas (n=103) que fallecieron por cáncer. El 89% experimentó un sufrimiento intenso, al menos por un síntoma; 51% por 3 o más síntomas. Al 57% del total de niños y niñas con astenia (fatiga), este síntoma les causó un gran sufrimiento (proporción más elevada) frente al 19% en el caso del estreñimiento y la diarrea (proporción más baja)94.
Un estudio realizado en Alemania con padres de niños y niñas (n=48) que fallecieron por cáncer, informa que los síntomas más frecuentes al final de la vida fueron dolor (83%) y astenia (fatiga) (91%). Los síntomas asociados a mayor sufrimiento, con más frecuencia, fueron dolor (65%) y nausea (63,6%)96.
En un estudio realizado en Holanda, los 5 síntomas físicos durante el final de la vida, informados con más frecuencia por padres de niños y niñas (n=32) que fallecieron por cáncer, fueron dolor (75%), falta de apetito (75%), astenia (fatiga) (72%), falta de movilidad (66%), y vómitos (53%). La media de síntomas físicos durante la fase paliativa fue de 6,3 (DE 2,7). Los síntomas psicológicos más frecuentes fueron tristeza (65%), dificultad para hablar sobre sus sentimientos (41%) y temor a la soledad (37%). La media de síntomas psicológicos fue de 3,2 (DE 2,2)97.
Según un estudio realizado en EEUU el 96% (132 de 137) de los niños y niñas que fallecieron por cáncer tuvieron astenia (fatiga) durante el último mes de vida, según sus padres. El 49% (68 de 138) experimentó un gran sufrimiento por astenia (fatiga). Anorexia, nausea/vómitos, y miedo se asociaron de forma independiente a astenia (fatiga) intensa98.
En un estudio realizado en Alemania, los padres de niños y niñas (n=48) que fallecieron por cáncer refieren que los síntomas más frecuentes al final de la vida fueron la astenia (fatiga) (n=40) y el dolor (n=35). Disnea (15/27) y ansiedad (10/22) fueron los síntomas que causaron mayor sufrimiento84.
En un estudio realizado en Australia, los síntomas al final de la vida informados con mayor frecuencia por padres de niños y niñas (n=96) que fallecieron por cáncer fueron dolor (87%), astenia (fatiga) (86%) y falta de apetito (82%). El porcentaje de niños y niñas que experimentaron un sufrimiento intenso por estos síntomas osciló entre el 46% (dolor) y el 7% (convulsiones). El 84% padeció un gran sufrimiento por ≥1 síntoma, y el 43% por ≥ 3 síntomas99.
En un estudio realizado en 164 niños y niñas con cáncer avanzado (cuestionario completado por el clínico en colaboración con el paciente y la familia), los síntomas más frecuentes al final de la vida fueron dolor (91,5%), debilidad (90,9%) y anorexia (67,7%). Dolor (64,4%) y debilidad (62,2%) también fueron los que con más frecuencia se asociaron con sufrimiento intenso25.
2. Concordancia entre profesionales y padres (síntomas y gravedad de los mismos) (3 estudios)
En un estudio realizado en Alemania, los padres de niños y niñas (n=38) que fallecieron por una enfermedad limitante para la vida, informan de una percepción acertada de los síntomas por los profesionales en el 95% de los casos. La concordancia profesional/padres respecto a la gravedad se produce sólo en el 65% de los casos (los profesionales subestiman la gravedad, según los padres)95.
En un estudio realizado en EEUU, fue superior la probabilidad de que los padres de niños y niñas (n=103) que murieron por cáncer informaran de astenia (fatiga) (48% vs 1%, p<0,001), falta de apetito (36% vs 1%, p<0,001), estreñimiento (34% vs 8%, p<0,001) y diarrea (22% vs. 9%, p=0,04), en comparación con los profesionales94.
En un estudio realizado en EEUU, sólo el 52% (62/119) de los casos de astenia (fatiga) referidos por los padres en una encuesta tras el fallecimiento del menor fueron registrados en la historia clínica. En el caso de astenia (fatiga) grave el 48% (30/63) de las historias clínicas registraba este síntoma98.
3. Tratamiento (síntomas que se trataron y respuesta al tratamiento) (6 estudios)
En un estudio realizado en Alemania, los padres de niños y niñas (n=38) que fallecieron por una enfermedad limitante para la vida, informan de buena respuesta al tratamiento del dolor (85%), convulsiones (83%), agitación (75%), y náuseas/vómitos (60%). El tratamiento de la disnea fue efectivo en el 40%95.
En un estudio realizado en EEUU, los padres de niños y niñas (n=103) que murieron por cáncer refieren que los síntomas tratados con más frecuencia fueron dolor (76%) y disnea (65%). El tratamiento tuvo éxito en el 27% y 16%, respectivamente. La astenia (fatiga) fue el síntoma tratado con menos frecuencia (16%), hubo respuesta en el 5%94.
Un estudio realizado en Alemania con padres de niños y niñas (n=48) que fallecieron por cáncer, informa de que el 80% (n=32) de los casos con dolor (n=40) fue tratado con éxito. Menos de la mitad de los casos con sufrimiento intenso por astenia (fatiga) (n=24) recibió tratamiento, sólo en 4 casos hubo respuesta. El 64,3% de los casos con ansiedad (n=28) no recibieron tratamiento96.
En un estudio realizado en EEUU, los padres de niños y niñas (n=141) que fallecieron por cáncer informan de que la astenia (fatiga) (leve, moderada o grave) se trató en el 13% (17 de 129), la astenia (fatiga) grave en el 18% (12 de 66) y que la respuesta al tratamiento fue favorable en el 25% (3 de 12)98.
En un estudio realizado en Alemania, según los padres de niños y niñas (n=48) que fallecieron por cáncer, el dolor (35 casos, 32 tratados, 30 con éxito), el estreñimiento (20 casos, 19 tratados, 17 con éxito) y las náuseas (20 casos, 10 tratados, 8 con éxito) tuvieron buena respuesta al tratamiento. Astenia (fatiga) (40 casos, 1 tratado, 0 con éxito), pérdida de apetito (35 casos, 14 tratados, 3 con éxito), disnea (27 casos, 20 tratados, 14 con éxito) y ansiedad (22 casos, 1 tratado, 1 con éxito) no se trataron o no hubo respuesta al tratamiento, según los padres84.
En un estudio realizado en 164 niños y niñas con cáncer avanzado (cuestionario completado por el clínico en colaboración con el paciente y la familia), presentaron porcentajes elevados de respuesta al tratamiento los siguientes síntomas: dolor (90%), náuseas (91%), vómitos (89%), y estreñimiento (78%). Debilidad (23%), falta de movilidad (13%), anorexia (28%) y pérdida de peso (20%) rara vez respondieron al tratamiento25.
4. Calidad de vida (5 estudios)
En un estudio realizado en EEUU, según los padres, el 53% de los niños y niñas (n=103) que fallecieron por cáncer tuvieron pocos o ningún momento de diversión, el 61% sentían tristeza moderada o intensa y el 63% no se encontraban en paz y tranquilidad la mayor parte del tiempo. El 21% informó sentirse asustados con frecuencia94.
Un estudio realizado en Alemania con padres de niños y niñas (n=48) que fallecieron por cáncer, estos percibieron en el 72,3% de los casos que su hijo se sentía feliz, tranquilo y de buen humor la mayor parte del tiempo. Casi dos tercios de los pacientes no tuvieron emociones negativas (ansiedad o depresión)96.
En un estudio realizado en EEUU, según los padres de niños y niñas (n=141) que fallecieron por cáncer, la astenia (fatiga) durante el último mes de vida, se asoció con menos probabilidad de ser feliz [RR 0,58 (IC95% 0,39 a 0,88), p=0,007] y de diversión [RR 0,61 (IC95% 0,43 a 0,87), p=0,006]98.
En un estudio prospectivo realizado en EEUU en niños y niñas (n=25) con cáncer al final de la vida (resultados percibidos por el paciente), los resultados del Pediatric Quality of Life Inventory 4.0, encuesta validada para medir la salud relacionada con la calidad de vida, mostraron que el 47% de las puntuaciones totales fueron ‘bajas’ (<40) o ‘medias’ (40–69,9). El 58% de las puntuaciones del área física fueron ‘bajas’ o ‘medias’. Once síntomas se asociaron con disminuciones significativas en las puntuaciones de los dominios físico, emocional, social y escuela. Casi todas las disminuciones fueron de magnitud superior a la diferencia mínima con relevancia clínica (estimador puntual), pero considerando los intervalos de confianza sólo están somnolencia en el área física y tristeza en el área emocional28.
Un estudio realizado en Alemania con padres de niños y niñas (n=48) que fallecieron por cáncer, estos percibieron que su hijo se sentía feliz (67%), tranquilo (72%) y de buen humor (89%) la mayor parte del tiempo. El 58% de los pacientes no tuvieron emociones negativas (ansiedad o depresión)84.
5. Síntomas que más preocupan a los padres durante la última semana de vida/ último día de vida (1 estudio)
En un estudio cualitativo realizado en EEUU, padres y madres de 19 niños y niñas que fallecieron por una enfermedad limitante para la vida, informaron de los siguientes síntomas (mayor a menor frecuencia)76:
- Durante la última semana de vida: pérdida de la función motora, cambios en el nivel de energía (astenia), dificultad respiratoria, molestias gastrointestinales o vesicales, o dolor no controlado con la medicación.
- Durante el último día de vida: cambios en la respiración, pérdida de la función motora, cambios en el nivel de energía (astenia), cambios en la frecuencia cardiaca y la temperatura.
¿Cuál es la confianza en la evidencia?
La calidad metodológica de los estudios se evaluó como muy baja. La mayoría presentaban un riesgo elevado de sesgo de selección y de memoria. La tasa de participación fue baja, entre el 35% y el 84%, y el tiempo medio transcurrido entre la realización de las encuestas y la muerte del paciente en edad pediátrica osciló entre los 3,1 años y los 4,8 años. Además, las opiniones expresadas por los padres pueden no reflejar exactamente las experiencias de los niños, niñas y adolescentes. Por otra parte, el GEG destaca que la aparición de dificultad para dormir no ha sido explorada en los estudios incluidos a pesar de ser un síntoma característico en estos pacientes.
La evidencia identificada no es directamente aplicable a pacientes con enfermedades no oncológicas. Los síntomas y su intensidad se relacionan con la enfermedad específica del paciente. Así, el estudio de Vollenbroich et al.95 muestra que cuando participan pacientes oncológicos y no oncológicos la disnea es, al menos, igual de frecuente que el dolor y más difícil de tratar.
Los avances en la atención paliativa generan incertidumbre sobre la aplicabilidad actual de los resultados de 8 de los estudios que fueron publicados hace 6 años o más.
Facilitadores y barreras
La evidencia sugiere que los pacientes pediátricos en atención paliativa sufren a causa de síntomas físicos y psicológicos, entre los que destacan el dolor, la astenia (fatiga), la disnea y la ansiedad. Más del 80% de los niños, niñas y adolescentes95,99 experimentan un sufrimiento intenso causado por 2 o más síntomas durante el último mes de vida.
Los estudios observan inconsistencia entre los padres y los profesionales sanitarios a la hora de percibir los síntomas y su gravedad durante la fase final de la vida del paciente en edad pediátrica. Según los padres la astenia (fatiga) es uno de los síntomas más frecuentes en pacientes con cáncer y que más se asocia con sufrimiento intenso. Sin embargo, los clínicos no reconocen la astenia (fatiga) casi nunca, como demuestran el infra-registro de los casos y las bajas tasas de tratamiento, incluso en los niños, niñas y adolescentes que experimentan un sufrimiento intenso por este síntoma. El GEG considera que esto tiene importantes implicaciones en la práctica porque sugiere que una parte del sufrimiento del paciente puede ser consecuencia de la falta de reconocimiento del problema por parte de los clínicos. La inconsistencia entre padres y profesionales aparece con síntomas como astenia (fatiga) o falta de apetito, y podría explicarse por una actitud que considera ciertos síntomas como esperables o inevitables. En opinión del GEG este proceder ignora la necesidad del paciente y la familia de que estos síntomas sean al menos reconocidos y explicados por los profesionales, y enfatiza la importancia del trabajo en equipo entre todas las partes involucradas en el cuidado del paciente al final de la vida.
Según el GEG, los pacientes con necesidad de un nivel 3 de atención paliativa precisan de un equipo de CPP para la atención integral del paciente y su familia, que identifique y resuelva otros problemas y necesidades que pudieran generar sufrimiento, respetando sus vínculos y valores. En su defecto, al menos debería asegurarse el acceso a la atención por un equipo multidisciplinar liderado y coordinado por el profesional más cercano al paciente y la familia.
Equidad, aceptabilidad y factibilidad
Otras consideraciones
El uso de cuestionarios o instrumentos validados puede ser una estrategia útil para estandarizar la evaluación de síntomas y monitorizar la respuesta a los cuidados de una forma objetiva. El Memorial Symptom Assessment Scale (MSAS)100,101 es el único instrumento multidimensional diseñado para evaluar múltiples síntomas que ha sido adaptado y validado en pacientes pediátricos con cáncer, pero no ha sido evaluado en el ámbito de los CPP. Atendiendo a los estudios analizados, la mayoría utiliza cuestionarios de valoración de síntomas no validados, diseñados ‘ad hoc’84,94-99. Esto pone de manifiesto la necesidad de diseñar y validar cuestionarios o instrumentos apropiados para uso clínico en la atención paliativa pediátrica que evalúen las diferentes dimensiones del sufrimiento (físico, psicológico, social y espiritual o existencial).
El equipo sanitario que atiende al paciente y su familia debe asegurarse de que se diagnostican y tratan tanto los problemas físicos como los psicológicos. La evidencia muestra que un elevado porcentaje de pacientes con ansiedad no reciben tratamiento96. El GEG cree necesario recordar que la atención de los profesionales debe centrarse también en los síntomas psicológicos.
El GEG considera importante destacar que la atención paliativa prestada por los profesionales debe estar centrada en el paciente y su familia, y debe ser integral, atendiendo a sus problemas y necesidades, tanto físicos y de desarrollo, como psicológicos, sociales y espirituales.
Tablas GRADE
Resumen de la evidencia
BIBLIOGRAFÍA
25 .Goldman A, Hewitt M, Collins GS, Childs M, Hain R. Symptoms in children/young people with progressive malignant disease: United Kingdom Children’s Cancer Study Group/Paediatric Oncology Nurses Forum survey. Pediatrics. 2006;117(6):e1179-86. https://doi.org/10.1542/peds.2005-0683.
28. Rosenberg AR, Orellana L, Ullrich C, Kang T, Geyer JR, Feudtner C, et al. Quality of Life in Children With Advanced Cancer: A Report From the PediQUEST Study. J Pain Symptom Manage. 2016;52(2):243-53. https://doi.org/10.1016/j.jpainsymman.2016.04.002.
76. Hendricks-Ferguson VL. Parental perspectives of initial end-of-life care communication. Int J Palliat Nurs. 2007;13(11):522-31. https://doi.org/10.12968/ijpn.2007.13.11.27587.
84. Hechler T, Blankenburg M, Friedrichsdorf SJ, Garske D, Hübner B, Menke A, et al. Parents’ perspective on symptoms, quality of life, characteristics of death and end-of-life decisions for children dying from cancer. Klin Padiatr. 2008;220(3):166-74. https://doi.org/10.1055/s-2008-1065347.
88. Astray San Martín A. Encuesta sobre cuidados paliativos a pediatras de Atención Primaria en un área sanitaria de Madrid. Rev Pediatr Aten Primaria. 2010;XII(45):33-40.
89. Arias-Casais N, Garralda E, Pons JJ, Marston J, Chambers L, Downing J, et al. Mapping Pediatric Palliative Care Development in the WHO-European Region: Children Living in Low-to-Middle-Income Countries Are Less Likely to Access It. J Pain Symptom Manage. 2020;60(4):746-53. https://doi.org/10.1016/j.jpainsymman.2020.04.028.
90. Ananth P, Melvin P, Feudtner C, Wolfe J, Berry JG. Hospital Use in the Last Year of Life for Children With Life-Threatening Complex Chronic Conditions. Pediatrics. 2015;136(5):938-46. https://doi.org/10.1542/peds.2015-0260.
91. Noyes J, Edwards RT, Hastings RP, Hain R, Totsika V, Bennett V, et al. Evidence-based planning and costing palliative care services for children: novel multi-method epidemiological and economic exemplar. BMC Palliat Care. 2013;12(1):18. https://doi.org/10.1186/1472-684x-12-18.
92. Chong PH, De Castro Molina JA, Teo K, Tan WS. Paediatric palliative care improves patient outcomes and reduces healthcare costs: evaluation of a home-based program. BMC Palliat Care. 2018;17(1):11. https://doi.org/10.1186/s12904-017-0267-z.
93. Wolfe J, Orellana L, Ullrich C, Cook EF, Kang TI, Rosenberg A, et al. Symptoms and Distress in Children With Advanced Cancer: Prospective Patient-Reported Outcomes From the PediQUEST Study. J Clin Oncol. 2015;33(17):1928-35. https://doi.org/10.1200/jco.2014.59.1222.
94. Wolfe J, Grier HE, Klar N, Levin SB, Ellenbogen JM, Salem-Schatz S, et al. Symptoms and suffering at the end of life in children with cancer. N Engl J Med. 2000;342(5):326-33. https://doi.org/10.1056/nejm200002033420506.
95. Vollenbroich R, Borasio GD, Duroux A, Grasser M, Brandstätter M, Führer M. Listening to parents: The role of symptom perception in pediatric palliative home care. Palliat Support Care. 2016;14(1):13-9. https://doi.org/10.1017/s1478951515000462.
96. von Lützau P, Otto M, Hechler T, Metzing S, Wolfe J, Zernikow B. Children dying from cancer: parents’ perspectives on symptoms, quality of life, characteristics of death, and end-of-life decisions. J Palliat Care. 2012;28(4):274-81.
97. Theunissen JM, Hoogerbrugge PM, van Achterberg T, Prins JB, Vernooij-Dassen MJ, van den Ende CH. Symptoms in the palliative phase of children with cancer. Pediatr Blood Cancer. 2007;49(2):160-5. https://doi.org/10.1002/pbc.21042.
98. Ullrich CK, Dussel V, Hilden JM, Sheaffer JW, Moore CL, Berde CB, et al. Fatigue in children with cancer at the end of life. J Pain Symptom Manage. 2010;40(4):483-94. https://doi.org/10.1016/j.jpainsymman.2010.02.020.
99. Heath JA, Clarke NE, Donath SM, McCarthy M, Anderson VA, Wolfe J. Symptoms and suffering at the end of life in children with cancer: an Australian perspective. Med J Aust. 2010;192(2):71-5. https://doi.org/10.5694/j.1326-5377.2010.tb03420.x.
100 .Collins JJ, Byrnes ME, Dunkel IJ, Lapin J, Nadel T, Thaler HT, et al. The measurement of symptoms in children with cancer. J Pain Symptom Manage. 2000;19(5):363-77. https://doi.org/10.1016/s0885-3924(00)00127-5.
101. Collins JJ, Devine TD, Dick GS, Johnson EA, Kilham HA, Pinkerton CR, et al. The measurement of symptoms in young children with cancer: the validation of the Memorial Symptom Assessment Scale in children aged 7-12. J Pain Symptom Manage. 2002;23(1):10-6. https://doi.org/10.1016/s0885-3924(01)00375-x.
Sedación paliativa en pediatría
La sedación, en tanto a disminución del nivel de consciencia, es un procedimiento utilizado frecuentemente en pediatría (procedimientos invasivos, ansiolisis, etc.)102,103. La sedación paliativa constituye una indicación particular en la que la única manera de evitar el sufrimiento del paciente es disminuyendo su nivel de consciencia. Conceptualmente, es necesario circunscribir su práctica a la de un procedimiento médico con sus indicaciones, objetivos y métodos104.
Cuando una enfermedad grave progresa es frecuente que aumente el número de síntomas25, especialmente en el final de vida, pudiendo asociar un grado importante de sufrimiento94,105. En la mayoría de pacientes, este sufrimiento se controla con tratamientos sintomáticos103 o bien desaparece progresivamente a medida que el paciente pierde de manera natural su consciencia por el cese de las funciones corporales106. En un pequeño número de casos los tratamientos no van a controlar el sufrimiento del paciente, siendo necesario emplear la sedación paliativa cuando exista al menos un síntoma refractario.
En la población pediátrica, los datos sobre sedación paliativa son escasos107. Los datos en población adulta parecen indicar una frecuencia aproximada de un 20%108, con cifras que oscilan entre un 2,5% y un 60%109,110. En adultos, algunos factores como la menor edad de los pacientes, la presencia de cáncer frente a otras patologías, fallecer en el hospital o creencias y actitudes de los profesionales se podrían asociar a una mayor probabilidad de recibir sedación paliativa109. En España, algunas comunicaciones médicas presentadas en congresos pediátricos parecen reflejar una variabilidad importante en su práctica111,112. Si bien muchos de los principios de tratamiento son comunes a adultos y pacientes en edad pediátrica107, el tipo de enfermedades90, el impacto emocional y social113 y el proceso de consentimiento informado8 presenta distinciones importantes114.
9.1 Definición
La sedación paliativa se define como “la disminución deliberada de la consciencia del paciente, una vez obtenido el oportuno consentimiento mediante la administración de los fármacos indicados y a las dosis proporcionadas, con el objetivo de evitar un sufrimiento insostenible causado por uno o más síntomas refractarios”108.
9.2 Objetivo de la sedación paliativa
El objetivo de la sedación paliativa es disminuir el sufrimiento del paciente cuando no existe otro medio posible. Se considera una herramienta de “último recurso” cuando no existen tratamientos sintomáticos que se puedan aplicar en un marco de tiempo razonable para el paciente y existe un grado de sufrimiento intenso103,115. Su práctica suele circunscribirse a la existencia de una enfermedad incurable avanzada108 o ante la situación de final de vida116.
9.3 Síntoma refractario
Es aquel que no puede controlarse adecuadamente con los medios disponibles por un equipo experto. Debe diferenciarse de un síntoma difícil, definido como aquel que precisa de una intervención terapéutica intensiva para su control, más allá de los medios habituales, no sólo farmacológicos, sino también intervencionistas y psicológicos117.
Una mayor experiencia y conocimientos en el control de síntomas puede convertir un síntoma “refractario” en “difícil”, por lo que se recomienda la valoración del síntoma por un equipo experto108,118 que busque posibles alternativas, delimite objetivos y establezca un plan de acción. Si localmente no se dispone de un equipo experto, podría realizarse una consulta telemática con un equipo de referencia116. En el caso de niños, niñas, adolescentes y adultos jóvenes, este equipo debe ser pediátrico119 e interdisciplinar10,110. En pediatría, los síntomas más frecuentemente descritos ante la aplicación de sedación paliativa son el dolor, la disnea, la ansiedad o las convulsiones114,120,121. Es importante recalcar que, en la mayoría de ocasiones, estos síntomas pueden controlarse con tratamientos adecuados, por lo que la aplicación de sedación paliativa debe considerarse una excepción.
9.4 Sedación paliativa en agonía
Se define como aquella que se utiliza en las últimas horas o días de vida para aliviar un sufrimiento intenso108,118. La sedación no se aplica porque el paciente esté muriendo, sino porque el proceso de morir le produce sufrimiento. Corresponde a una situación diferenciada del control de un síntoma fuera del periodo de agonía, ya que en agonía la condición clínica del paciente empeorará inexorablemente. Por ello, cuando se emplee sedación en agonía, se optará por que sea continua y tan profunda como sea necesario103.
9.5 Controversias
Las diferencias en las definiciones existentes106 pueden plantear dudas en el marco conceptual de la sedación paliativa122.
- La diferencia entre sedación paliativa, eutanasia y suicido médicamente asistido está señalada en el código deontológico108, así como por distintas guías nacionales118 e internacionales103,116. La distinción se establece en la intención, procedimiento y resultados. La sedación paliativa busca disminuir el sufrimiento del paciente con la mínima sedación posible y no su fallecimiento.
- Aunque existe un riesgo teórico de que la sedación paliativa adelante el momento de la muerte, esto no ha sido demostrado123,124 y éticamente quedaría aceptado dentro del principio del “doble efecto”106.
- En la práctica, existe el riesgo tanto de un abuso como de un empleo insuficiente de sedación paliativa, fundamentalmente por la falta de una definición unívoca de la refractariedad para cada síntoma, así como por la subjetividad inherente al concepto de sufrimiento103. La mayoría de guías recomiendan el abordaje de estos aspectos, caso a caso, por equipos expertos103,108.
- En pediatría la mayoría de síntomas en los que se ha descrito la sedación paliativa son físicos102, siendo los casos de sufrimiento psicológico o del denominado “sufrimiento existencial”125,126 infrecuentes, con escasa evidencia y consenso103,122. En estos casos, se recomienda el abordaje por parte de un equipo interdisciplinar experto que incluya profesionales de psicología clínica y referentes espirituales. La sedación intermitente para aliviar temporalmente el sufrimiento podría ser una medida útil103,121.
9.6 Aplicación de sedación paliativa
9.6.1 Consentimiento informado
Privar a un paciente de su consciencia interfiere con su funcionalidad y su capacidad de interacción127, características fundamentales de la persona en el periodo de final de vida. Cuando la necesidad de sedación paliativa sea previsible se recomienda abordarlo con el paciente y/o su familia antes de que se produzca una crisis de mal control sintomático103,116,127 en el contexto de los cuidados al final de la vida114. Cuando sea necesario aplicar una sedación paliativa de emergencia por un empeoramiento brusco116, el proceso de información debe realizarse como ante otras urgencias8,103.
A pesar de las dificultades existentes128 (edad, alteraciones cognitivas, barreras emocionales, etc.), los pacientes pediátricos deben incorporarse al proceso de consentimiento, adecuando la información y su participación a su capacidad117,129,130. Incluso cuando el paciente es completamente competente, conviene incluir a su familia131. Se debe imbricar la sedación paliativa y el resto de objetivos terapéuticos con los vínculos y valores que el paciente y su familia hayan expresado previamente9,116,132.
Si bien no es necesario un documento firmado de consentimiento escrito, se debe registrar en la historia clínica todos los puntos referentes al proceso de deliberación, acuerdos, motivos de indicación, fármacos, vías y dosis empleadas103,108.
9.6.2 Características de la sedación
Modalidades
Previo a la elección de un fármaco es necesario considerar las características que queremos aplicar:
- Temporalidad: continua vs intermitente. La aplicación de una sedación intermitente se plantea cuando se prevea una mejoría del paciente, cuando exista un componente importante de ansiedad o en los casos en los sea importante mantener momentos de consciencia103,110,123, siempre que se asegure el control sintomático106. Cuando se prevea que la disminución de la sedación pueda producir un empeoramiento, o en las sedaciones en agonía, se optará por una aplicación continua.
- Nivel de sedación: profunda vs superficial. En general, los expertos recomiendan utilizar el nivel más bajo posible para que el paciente se mantenga confortable103,123, titulando el nivel de sedación en función de sus necesidades. En algunos casos puede ser incluso posible mantener la comunicación verbal116. Es importante no sólo valorar el nivel de control sintomático y de sedación, sino también los deseos del paciente, si este es competente y capaz de expresarse130.
- Vías: la mayoría de fármacos van a requerir de una vía de administración continua, siendo las más empleadas la intravenosa y la subcutánea121. Para la inducción, como alternativa, pueden plantearse vías de administración rápida (transmucosa o intramuscular). Al ser la vía intramuscular una vía de absorción errática, su empleo debe limitarse a aquellos escenarios en los que no se pueda contar con otra vía.
- Ámbito: domicilio vs hospital. Debe plantearse en función de la disponibilidad de recursos locales y de las preferencias del paciente y su familia. Se debe garantizar un control adecuado del paciente valorando su complejidad global109 contando con la necesidad de dar apoyo a sus cuidadores 24 horas al día121.
Elección de fármacos
Los datos aplicables a la población pediátrica se basan en extrapolaciones de adultos, recomendaciones de expertos o series de casos. Sus características de aplicación se recogen en la tabla 5108,117.
Generalmente se administran a modo de perfusión continua con bolus de rescate. Al inicio, suele ser necesario emplear dosis de inducción para alcanzar niveles plasmáticos rápidamente110,116. La dosis de administración basal y de rescates se irán titulando en función de las necesidades del paciente116.
La mayoría de guías recomiendan como fármaco de primera elección las benzodiacepinas, especialmente el midazolam103,108,116-118. Tiene como principales ventajas una vida media corta, la posibilidad de abarcar todo el espectro de sedación (niveles superficiales a profundos), la posibilidad de aplicarse tanto por vía intravenosa como subcutánea y que presenta pocas interacciones e incompatibilidades con otros fármacos o con situaciones de fallo renal o hepático. Además, en caso de urgencia se pueden emplear las presentaciones bucales o nasales como inductores. Su eficacia en adultos se estima entre un 75-100%133, sin haber demostrado superioridad ningún otro fármaco. En pacientes que hayan recibido benzodiacepinas pueden ser necesarias dosis más altas por la presencia de tolerancia108.
El fenobarbital108 está espacialmente indicado cuando el síntoma a tratar son crisis epilépticas o irritabilidad de origen central. Presenta interacciones farmacocinéticas con varios fármacos. El propofol110 es farmacológicamente muy inestable, sólo se puede administrar por vía intravenosa y generalmente se utiliza en medio hospitalario por parte de personal experto108. También presenta interacciones importantes con otros fármacos. Se suele reservar para casos en los que se prevé una duración de sedación de horas o días.
Otros dos fármacos recogidos en la literatura de adultos son el haloperidol y la levomepromazina, que se utilizan especialmente ante cuadros de delirium118. Sin embargo, este cuadro es mucho menos frecuente en pediatría, donde podrían ser más útiles como adyuvantes de otro sedante, especialmente ante la presencia de ansiedad.
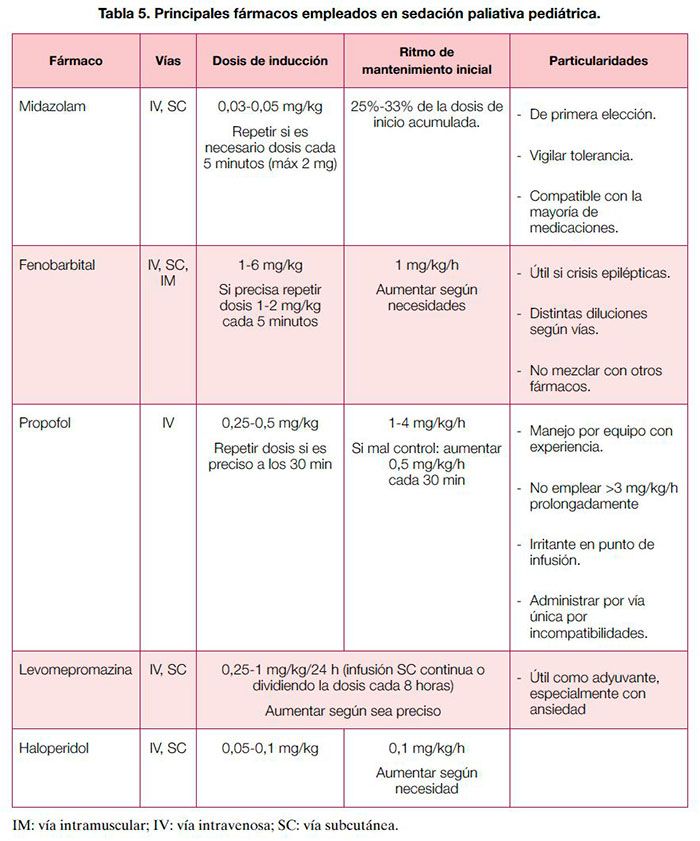
Monitorización y seguimiento
La aplicación de una sedación paliativa requiere de la monitorización del paciente para garantizar su confort121,131. Al inicio, las guías recomiendan una monitorización estrecha (cada 15-30 minutos) para ajustar la dosis de inducción y el ritmo de mantenimiento115. Mientras se mantenga la sedación, debe vigilarse el estado de confort del paciente, su estabilidad clínica, el nivel de sedación, la aparición de efectos adversos103, y la existencia de causas de sufrimiento116.
Cuando sea posible se aconseja utilizar escalas observacionales y medidas validadas115,134. Para controlar el nivel de sedación puede emplearse la escala de Ramsay108,118, mientras que para cada síntoma debe emplearse una escala específica110. El grado global de confort es un concepto subjetivo y por lo tanto difícil de convertir en una medición objetiva. En caso de que el paciente no pueda expresarse, debe incluirse la valoración de la familia102. Si bien la tasa de efectos secundarios es baja121, es necesario explicarlos y prever su aparición y tratamiento (ej. anticolinérgicos para broncorrea108).
El nivel de monitorización debe adecuarse a las circunstancias del paciente116:
- Ante una sedación planteada como reversible la monitorización de constantes vitales deberá ser más estrecha103.
- En el caso de encontrarse en situación de agonía, es prioritario monitorizar el confort del paciente y evitar mediciones que puedan resultar invasivas10,127.
En el momento de iniciar una sedación paliativa se deben re-evaluar el resto de terapias y tratamientos108,110. En general, el tratamiento sintomático (ej. opioides para dolor o disnea) debe mantenerse115, pues su suspensión puede empeorar el control sintomático. La sedación suele suponer la pérdida de la vía oral, por lo que toda medicación que se administrase por esa vía debe suspenderse o cambiarse a una vía alternativa. Debe evaluarse la necesidad de mantener la hidratación y la nutrición en función de las necesidades de confort del paciente y su situación clínica, especialmente en final de vida103,110,135.
Mientras el paciente permanezca sedado es fundamental atender las necesidades de información, psicológicas y de apoyo de la familia103,131. La duración de la aplicación de sedación paliativa es variable110,136, por lo que es necesario mantener informados a los familiares y al resto de profesionales que atienden al paciente, del estado de sedación, confort y de su evolución116,137.
Metodología
La metodología empleada en la elaboración de esta guía de práctica clínica (GPC) es la que se recoge en el documento Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico138.
A continuación, se describen las etapas que se han seguido en el proceso de elaboración:
- Constitución del grupo elaborador de la guía, integrado por un grupo multidisciplinar de 13 profesionales sanitarios del ámbito de la atención primaria y hospitalaria de diferentes especialidades como son pediatría (especialistas adscritos a unidades hospitalarias de cuidados paliativos pediátricos, oncología pediátrica, cuidados intensivos pediátricos) medicina intensiva, medicina familiar y comunitaria, medicina interna, psicología clínica, y enfermería y 3 especialistas en metodología y en economía de la salud pertenecientes al Instituto Aragonés de Ciencias de la Salud (IACS).
- Las preguntas clínicas sobre eficacia de las intervenciones se formularon en el formato PICO (Paciente/ Intervención/ Comparación /Outcome o resultado). Las preguntas cualitativas se formularon siguiendo el formato SPIDER (Muestra/ Fenómeno de interés/ Diseño/ Evaluación/ Tipo de investigación).
- La búsqueda bibliográfica de estudios originales en las preguntas sobre eficacia de las intervenciones se realizó en las siguientes fuentes y bases de datos: PubMed/MEDLINE, EMBASE (Elsevier.com), Cochrane Library, y Centre for Reviews and Dissemination (CRD) Databases. Las fuentes bibliográficas consultadas en la búsqueda de estudios originales sobre investigación cualitativa fueron las siguientes: PubMed/MEDLINE, EMBASE (Elsevier.com), Cochrane Library, PsycINFO, CINAHL y CUIDEN. Las fuentes de evidencia económica consultadas fueron las siguientes: PubMed/MEDLINE, EMBASE (Elsevier.com) y CRD (Centre for Reviews and Dissemination) que incluye, HTA (Health Technology Assessment), DARE (Database of Abstracts of Reviews of Effectiveness) y NHS EED (Economic Evaluation Database del National Health Service). Además, se realizó una búsqueda bibliográfica en bases de datos y otras fuentes especializadas (PubMed/MEDLINE, EMBASE, Trip Database, National Guideline Clearinghouse, Guidelines International Network -G-I-N, National Institute for Health–NICE and Care Excellence, Scottish Intercollegiate Guidelines Network–SIGN), con el objetivo de localizar otras GPC, nacionales o internacionales, de temática similar. Las búsquedas se ciñeron a los tipos de estudios más adecuados según las características de la pregunta y a los idiomas castellano e inglés. El periodo de búsqueda abarca desde el año 1996 hasta finales del año 2016 en dos preguntas (tratamiento farmacológico, y quimioterapia y radioterapia paliativas), y desde el año 2007 hasta el año 2017, a lo largo del periodo comprendido entre marzo y abril, en cuatro preguntas. El GEG decidió ampliar el periodo de búsqueda de las dos preguntas cuantitativas dado el escaso número de estudios publicados después de 2007 que cumplieron los criterios de inclusión. Finalmente, el periodo de búsqueda de una de las preguntas es el comprendido entre 2007 y abril de 2018. Adicionalmente, se definieron alertas automáticas de correo electrónico para nuevos artículos agregados a Pubmed/MEDLINE, EMBASE y Cochrane Library hasta la fecha de maquetación de la GPC en junio de 2022. Se llevó a cabo una búsqueda inversa en las referencias de los artículos identificados e incluidos en la guía. También se realizó búsqueda no sistemática de literatura gris en el motor de búsqueda Google.
- Inicialmente, el cribado de los estudios recuperados se efectuó por título y resumen. En un segundo cribado, se registraron los estudios descartados y se señalaron las causas de exclusión. Mediante las alertas automáticas de correo electrónico se identificaron un total de 18 estudios por título y resumen entre marzo de 2017 y junio de 2021. Tras la lectura a texto completo, 17 estudios se descartaron y un estudio se incluyó en la GPC.
- La evaluación del riesgo de sesgo de los estudios se realizó mediante la herramienta de lectura crítica de la Agencia de Evaluación de Tecnologías Sanitarias del País Vasco (OSTEBA)139. La valoración de los estudios de investigación cualitativa se llevó a cabo con la herramienta de lectura crítica CASPe (Critical Appraisal Skills Programme) para estudios cualitativos140.
- La evaluación de la calidad de los estudios y resumen de la evidencia se desarrolló según el método “Grading of Recommendations Assessment, Development and Evaluation” (GRADE).
- El programa GRADEPro141, desarrollado por grupo de trabajo GRADE, se utilizó para generar los perfiles de evidencia de las preguntas sobre eficacia de las intervenciones. Los perfiles de evidencia GRADE son tablas que constan de dos secciones: ofrecen información sobre la calidad de la evidencia para cada variable, así como un resumen de los resultados para cada una de las variables de interés.
- La confianza en los hallazgos de revisiones de estudios cualitativos se evaluó mediante la propuesta CerQUAL desarrollada por el grupo GRADE142. Las tablas de resumen GRADE-CerQUAL describen la calidad de la evidencia para cada uno de los hallazgos en filas sucesivas. Los hallazgos pueden tener su origen en un único estudio o haber sido identificados a partir de un número determinado de temas y subtemas presentes en diferentes estudios.
- La formulación de las recomendaciones se ha realizado siguiendo el marco de trabajo EtD (Evidence to Decision) propuesto por el grupo GRADE143. En el caso de la evidencia cualitativa, el grupo elaborador de la guía (GEG) ha tenido en cuenta la confianza (calidad) en la evidencia disponible, y aspectos como la equidad, aceptabilidad y factibilidad. Cuando la evidencia era de baja calidad, inconsistente o ausente, se formularon recomendaciones por consenso del GEG.
- La metodología empleada en el análisis del uso de recursos y costes se describe en los anexos I y III.
- Los colaboradores expertos han participado en la formulación de preguntas y en la revisión del primer borrador de la GPC. Propusieron un listado inicial de 43 preguntas que se agruparon en las siguientes áreas temáticas: control de síntomas (11 preguntas), comunicación con el paciente y su familia (14 preguntas), atención a la familia (4 preguntas), atención en la agonía (4 preguntas), sedación (5 preguntas), apoyo psicológico y espiritual (2 preguntas), duelo (1 pregunta), otros (2 preguntas). A continuación, los colaboradores expertos puntuaron cada pregunta del 1 al 7 en base a los siguientes criterios: impacto en la calidad de los cuidados, repercusiones éticas e implicaciones económicas. Se atribuyeron diferentes pesos para cada criterio en función del área temática. El listado priorizado se presentó al GEG que decidió excluir una de las preguntas priorizadas y formuló dos nuevas preguntas. Los revisores externos han participado en la revisión del segundo borrador de la GPC.
- Las sociedades científicas implicadas en el desarrollo de esta guía, representadas por miembros del GEG, colaboradores expertos y revisores externos, son la Asociación de Enfermería Comunitaria (AEC), la Asociación de Niños con Cáncer de Aragón (ASPANOA), la Asociación Española de Enfermería en Cuidados Paliativos (AECPAL), la Asociación Española de Lucha Contra el Cáncer (AECC), la Asociación Española de Pediatría (AEP), la Asociación Española de Psicología Clínica y Psicopatología (AEPCP), la Asociación Española de Trabajo Social y Salud (AETSyS), la Federación de Asociaciones de Enfermería Comunitaria y Atención Primaria (FAECAP), la Federación Española de Padres de Niños con Cáncer (FEPNC), la Sociedad Española de Cirugía Pediátrica (SECP), la Sociedad Española de Cuidados Paliativos (SECPAL), la Sociedad Española de Cuidados Paliativos Pediátricos (PedPal), la Sociedad Española de Enfermería Oncológica (SEEO), la Sociedad Española de Farmacéuticos de Atención Primaria (SEFAP), la Sociedad Española de Hematología y Oncología Pediátrica (SEHOP), la Sociedad Española de Hospitalización a Domicilio (SEHAD), la Sociedad Española de Medicina de Familia y Comunitaria (SemFyC), la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC), la Sociedad Española de Medicina Interna (SEMI), la Sociedad Española de Médicos de Atención Primaria (SEMERGEN), la Sociedad Española de Médicos Generales y de Familia (SEMG), y la Sociedad Española del Dolor (SED),
- La GPC fue sometida a un proceso de Exposición Pública, en el cuál el borrador de la GPC revisado por organizaciones del ámbito de la salud que no participaron en la revisión externa, registradas previamente e interesadas en hacer aportaciones al mismo. En el caso de esta GPC han participado 7 organizaciones cuyas aportaciones y comentarios están disponibles para su consulta en la web de GuíaSalud: https://www.guiasalud.es.
- En guiasalud.es está disponible el material donde se presenta de forma detallada la información con el proceso metodológico de la GPC (estrategias de búsquedas para cada pregunta clínica, tablas de síntesis de la evidencia, perfiles de evidencia GRADE, tablas de resumen GRADE-CerQUAL, y tablas EtD).
- Está prevista una actualización de la guía cada tres años, o en un plazo de tiempo inferior si aparece nueva evidencia científica que pueda modificar algunas de las recomendaciones ofrecidas en esta guía. Las actualizaciones se realizarán sobre la versión electrónica de la guía, disponible en la URL: https://www.guiasalud.es.
En la redacción de este documento se buscó utilizar un lenguaje inclusivo, evitando al mismo tiempo dificultar la lectura y la compresión del texto. En este sentido se optó por el uso de términos neutros cuando fue posible, y por el uso de la palabra familia en lugar de ‘familia, cuidadores y/o tutores’.
Material complementario
PREGUNTAS Y RECOMENDACIONES
INVESTIGACIÓN FUTURA
Líneas de investigación futura
DIFUSIÓN E IMPLEMENTACIÓN
Difusión e implementación de la GPC
ANEXOS
Anexo II. Temas y subtemas identificados en el análisis de la evidencia cualitativa.
Anexo V. Abreviaturas
EXPOSICIÓN PÚBLICA
Informe de la Exposición pública de la GPC
Autores
GRUPO DE TRABAJO DE LA GUÍA DE PRÁCTICA CLÍNICA
SOBRE CUIDADOS PALIATIVOS EN PEDIATRÍA
Paula Armero Pedreira. Médica Especialista en Pediatría. Hospital Universitario Puerta de Hierro.
Majadahonda.
María José Arroyo Marín. Médico Especialista en Pediatría. Hospital Universitario Reina Sofía.
Córdoba.
Belén Estébanez Montiel. Médica Especialista en Medicina Intensiva. Hospital Universitario
La Paz. Madrid.
Alba Gállego Royo. Médica Especialista en Medicina Familiar y Comunitaria. Centro de Salud
Andorra. Teruel.
Fernando Miguel Gamboa Antiñolo. Médico Especialista en Medicina Interna. Hospital
Universitario Virgen de Valme. Sevilla.
Patricia Gavín Benavent. Médica Especialista en Microbiología y Parasitología. Instituto Aragonés
de Ciencias de la Salud. Zaragoza.
Rosa Gil Aparicio. Médica Especialista en Pediatría. Hospital General Universitario de Alicante.
Alicante.
Isabel Gimeno Sánchez. Médica Especialista en Pediatría. Hospital Universitario 12 de Octubre.
Madrid.
María Soledad Isern de Val. Doctora en Bioquímica, Biología Molecular y Biomedicina. Instituto
Aragonés de Ciencias de la Salud. Zaragoza.
Alma Dolores Martínez de Salazar Arboleas. Psicóloga Especialista en Psicología Clínica.
Hospital Universitario Torrecárdenas. Almería.
Celia Muñoz Fernández. Economista de la salud. Instituto Aragonés de Ciencias de la Salud.
Zaragoza.
Ascensión Muñoz Mellado. Médico Especialista en Pediatría. Hospital Miguel Servet. Zaragoza.
Iñigo de Noriega Echevarría. Médico Especialista en Pediatría. Hospital Infantil Universitario Niño
de Jesús. Madrid.
Fátima Parra Plantagenet Whyte. Médica Especialista en Pediatría. Hospital Universitario Miguel
Servet. Zaragoza.
José Antonio Porras Cantarero. Médico Especialista en Pediatría. Servicio Atención Paliativa y
Paciente Crónico Complejo. Hospital Sant Joan de Déu. Barcelona.
Paula Santos Herraiz. Médica Especialista en Pediatría. Complejo Hospitalario Universitario de
Toledo. Toledo.
COORDINACIÓN METODOLÓGICA
Patricia Gavín Benavent. Médica Especialista en Microbiología y Parasitología. Instituto Aragonés
de Ciencias de la Salud. Zaragoza.
COLABORACIÓN
Documentalista
María Pilar Blas Díez.Instituto Aragonés de Ciencias de la Salud. Zaragoza.
Apoyo logístico y administrativo
María Esther García Pomar.Instituto Aragonés de Ciencias de la Salud. Zaragoza.
COLABORACIÓN EXPERTA
Agustina Barahona Clemente. Psicóloga Especialista en Psicooncología. Unidad de Oncología
Pediátrica. Hospital La FE. Valencia. Asociación Española de Lucha Contra el Cáncer (AECC)
María Rosario Baydal Cardona. Médica Especialista en Medicina Familiar y Comunitaria. Hospital
Universitario de Denia. Denia.
María Consuelo Company Sancho. Enfermera. Dirección General Salud Pública Servicio Canario
de Salud. Las Palmas de Gran Canaria.
Ángel Estella García. Médico Especialista en Medicina Intensiva. Servicio de Medicina Intensiva
Hospital Universitario de Jerez. Profesor de Medicina Universidad de Cádiz.
Gema Flox Benítez. Médica Especialista en Medicina Interna. Hospital Universitario Severo
Ochoa. Madrid.
María García de Paso Mora. Médica Especialista en Pediatría. Unidad de Cuidados Paliativos
Pediátricos. Hospital Universitario Son Espases. Palma de Mallorca.
Juan Manuel Gavala Arjona. Director de Enfermería. Especialista en Pediatría. Hospital
Universitario Son Espases. Palma
José Manuel Gómez García. Médico Especialista en Medicina Intensiva. Hospital General
Universitario Gregorio Marañón. Madrid.
Marta López Maestro. Graduada en Trabajo Social. Valencia.
Ricardo Martino Alba. Médico Especialista en Pediatría. Unidad de Atención Integral Paliativa
Pediátrica Hospital Infantil Universitario Niño Jesús. Madrid.
Carmen Menéndez Llaneza. Coordinadora Comisión de Sanidad. Federación Española de Padres
de Niños con Cáncer. Madrid.
Elvira Eva Moreno Campoy. Doctora y Farmacéutica de Atención Primaria. Directora
de la Estrategia para la Seguridad del Paciente del Sistema Sanitario Público de Andalucía. Consejería
de Salud y Familias de la Junta de Andalucía. Sevilla.
Alvaro Navarro Mingorance. Médico especialista en Pediatría. Unidad de Atención Integral
Paliativa Pediátrica. Hospital Infantil Universitario Niño Jesús. Madrid.
Sergio Navarro Villarubí. Médico Especialista en Pediatría. Servicio Atención Paliativa y Paciente
Crónico Complejo. Hospital Sant Joan de Déu. Barcelona.
Miguel Angel Nuñez Viejo. Médico Especialista en Medicina Interna. Unidad de Cuidados
Paliativos. Complejo Hospitalario Universitario de Ourense. Ourense.
Eduardo Quiroga Cantero. Médico Especialista en Pediatría. Hospital Infantil Virgen del Rocio.
Sevilla
Laura Rubio Ortega. Médico Especialista en Pediatría. Hospital General Universitario de Alicante.
Alicante
REVISIÓN EXTERNA
Jacinto Bátiz Cantera. Doctor en Medicina y Cirugía. Hospital San Juan de Dios de Santurtce.
Instituto de Sensibilización, Formación, Investigación e Innovación para cuidar mejor. Bizkaia.
Emilio Casariego Vales. Médico Especialista en Medicina Interna. Hospital Universitario Lucus
Augusti. Lugo.
Isabel Cuéllar Flores. Doctora en Psicología. Psicóloga Especialista en Psicología Clínica. Hospital Clínico
San Carlos. Madrid.
María Luisa de la Rica Escuín, Enfermera. Unidad de Investigación IIS-Aragón, Universidad de
Zaragoza. Zaragoza.
Javier González de Dios. Médico Especialista en Pediatría. Hospital General Universitario de
Alicante. Alicante.
María Cruz Martín Delgado. Médica Especialista en Medicina Intensiva. Hospital Universitario de
Torrejón. Madrid.
Manuel José Mejías Estévez. Médico Especialista en Medicina de Familia y Comunitaria. Servicio
Andaluz de Salud. Universidad Pablo de Olavide. .Sevilla.
Isabel Miguel Montoya. Doctora en Ciencias de la Enfermería. Docente de Enfermería de la Salud
Infantil y del Adolescente. Escuela Universitaria de Enfermería La Fe. Universidad de Valencia. Valencia.
Jordi Miró Martínez. Catedrático de Psicología de la Salud. Director de la Cátedra de Dolor Infantil
URV-FG. Universidad Rovira i Virgili. Tarragona
Rosa María Paredes Esteban. Médica Especialista en Pediatría. Hospital Universitario Reina
Sofía de Córdoba. Córdoba.
María José Peláez Cantero. Médica Especialista en Pediatría. Unidad de crónicos complejos y
cuidados paliativos pediátricos, Hospital Regional Universitario de Málaga. Málaga.
Jesús Sánchez Etxaniz. Médico Especialista en Pediatría. Hospitalización a Domicilio Pediátrica.
Hospital Universitario de Cruces. Barakaldo. Bilbao.
Eva Trillo Calvo. Médica Especialista en Medicina de Familia y Comunitaria. Centro de Salud
Campo de Belchite. Zaragoza.
SOCIEDADES COLABORADORAS
Asociación de Enfermería Comunitaria (AEC)
Asociación Española de Enfermería en Cuidados Paliativos (AECPAL)
Asociación Española de Bioética (AEBI)
Asociación Española de Lucha Contra el Cáncer (AECC)
Asociación Española de Pediatría (AEP)
Asociación Española de Psicología Clínica y Psicopatología (AEPCP)
Asociación Española de Trabajo Social y Salud (AETSyS)
Federación de Asociaciones de Enfermería Comunitaria y Atención Primaria (FAECAP)
Federación Española de Padres de Niños con Cáncer (FEPNC)
Sociedad Española de Cirugía Pediátrica (SECP)
Sociedad Española de Cuidados Paliativos (SECPAL)
Sociedad Española de Cuidados Paliativos Pediátricos (PedPal)
Sociedad Española de Enfermería Oncológica (SEEO)
Sociedad Española de Farmacéuticos de Atención Primaria (SEFAP)
Sociedad Española de Hematología y Oncología Pediátrica (SEHOP)
Sociedad Española de Hospitalización a Domicilio (SEHAD)
Sociedad Española de Medicina de Familia y Comunitaria (SemFyC)
Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICYUC)
Sociedad Española de Medicina Interna (SEMI)
Sociedad Española de Médicos de Atención Primaria (SEMERGEN)
Sociedad Española de Médicos Generales y de Familia (SEMG)
Sociedad Española del Dolor (SED)
Miembros de estas sociedades han participado en la autoría, colaboración experta y revisión externa de la GPC.
EXPOSICIÓN PÚBLICA
Esta GPC ha sido sometida a un proceso de Exposición Pública. El listado completo de los grupos de interés que han participado en el proceso de exposición pública está disponible en la siguiente URL: https://portal.guiasalud.es/wp-content/uploads/2022/09/gpc_618_cuidados_palitativos_pediatria_iacs_exposicion_publica.pdf
Declaración de interés: Todos los miembros del Grupo de Trabajo, así como las personas que han participado en la colaboración experta y en la revisión externa de esta guía, han realizado la declaración de posibles conflictos de interés. Este documento podrá ser consultado, bajo petición, a través del Instituto Aragonés de Ciencias de la Salud (IACS).
Bibliografía
- World Health Organization. Integrating palliative care and symptom relief into paediatrics: a WHO guide for health-care planners, implementers and managers [Internet] . Geneva: WHO; 2018 [citado mayo 2022]. Disponible en: https://apps.who.int/iris/handle/10665/274561
- A guide to the development of children’s palliative care services. Association for Children with Life-Threatening or Terminal Conditions and their Families. Bristol, UK: ACT-and The Royal College of Paediatrics and Child Health; 2003.
- Martino Alba R. ¿Qué debemos saber sobre los cuidados paliativos pediátricos en los niños? En: AEPap, ed. Curso de Actualización Pediatría . Madrid: Exlibris Ediciones; 2012. p. 285-92.
- Hoell JI, Warfsmann J, Gagnon G, Trocan L, Balzer S, Oommen PT, et al. Palliative care for children with a yet undiagnosed syndrome. Eur J Pediatr. 2017;176(10):1319-27. https://doi.org/10.1007/s00431-017-2991-z.
- Ministerio de Sanidad, Servicios Sociales e Igualdad. Cuidados paliativos pediátricos en el Sistema Nacional de Salud: Criterios de Atención. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2014.
- Connor SR, Downing J, Marston J. Estimating the Global Need for Palliative Care for Children: A Cross-sectional Analysis. J Pain Symptom Manage. 2017;53(2):171-7. https://doi.org/10.1016/j.jpainsymman.2016.08.020.
- Villegas J.A, Antuña M.J. Cuidados Paliativos Pediátricos. Bol Pediatr. 2012; 52:131-145.
- Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Boletín Oficial del Estado, nº 274, (15-11-2002).
- Ortiz San Román L, Martino Alba R. Enfoque paliativo en Pediatría. Pediatr Integral. 2016; XX (2): 131.e1–131.e7
- Craig F, Abu-Saad Huijer H, Benini F, Kuttner L, Wood C, Feraris PC, et al. [IMPaCCT: standards of paediatric palliative care]. Schmerz. 2008;22(4):401-8. https://doi.org/10.1007/s00482-008-0690-4.
- Martino Alba R. El proceso de morir en el niño y el adolescente. Pediatría Integral. 2007; XI(10):926-934.
- Sociedad Española de Cuidados Paliativos. Directorio de Recursos de Cuidados Paliativos en España: Directorio SECPAL 2015 [Internet]. Madrid: SECPAL; 2016 [citado mayo 2022]. Monografías SECPAL, n. 8. Disponible en: http://www.secpal.com/Documentos/Blog/monografia8_directorio.pdf.
- Morán Roldán L, García-Mauriño Alcázar C. Situación de los cuidados paliativos pediátricos en el ámbito de Atención Primaria. Rev Pediatr Aten Primaria. 2021;23:261-72.
- García de Paso M. Analgesia y sedación en Cuidados Paliativos Pediátricos. Bol pediatr. 2013; 53: 68-73.
- World Health Organization. WHO Guidelines on the Pharmacological Treatment of Persisting Pain in Children with Medical Illnesses. Geneva: WHO; 2012.
- Navarro S, Martino RJ. Cuidados Paliativos Pediátricos: Epidemiología, organización. Fallecimiento en el hospital. Sedación. Actualizaciones Sociedad Española de Pediatría Hospitalaria (SEPHO). 2016.
- Hunt A, Goldman A, Devine T, Phillips M. Transdermal fentanyl for pain relief in a paediatric palliative care population. Palliat Med. 2001;15(5):405-12. https://doi.org/10.1191/026921601680419456.
- Finkel JC, Finley A, Greco C, Weisman SJ, Zeltzer L. Transdermal fentanyl in the management of children with chronic severe pain: results from an international study. Cancer. 2005;104(12):2847-57. https://doi.org/10.1002/cncr.21497.
- Finkel JC, Pestieau SR, Quezado ZM. Ketamine as an adjuvant for treatment of cancer pain in children and adolescents. J Pain. 2007;8(6):515-21. https://doi.org/10.1016/j.jpain.2007.02.429.
- Ruggiero A, Barone G, Liotti L, Chiaretti A, Lazzareschi I, Riccardi R. Safety and efficacy of fentanyl administered by patient controlled analgesia in children with cancer pain. Support Care Cancer. 2007;15(5):569-73. https://doi.org/10.1007/s00520-006-0193-8.
- Davies D, DeVlaming D, Haines C. Methadone analgesia for children with advanced cancer. Pediatr Blood Cancer. 2008;51(3):393-7. https://doi.org/10.1002/pbc.21584.
- Vondracek P, Oslejskova H, Kepak T, Mazanek P, Sterba J, Rysava M, et al. Efficacy of pregabalin in neuropathic pain in paediatric oncological patients. Eur J Paediatr Neurol. 2009;13(4):332-6. https://doi.org/10.1016/j.ejpn.2008.06.011.
- Ruggiero A, Coccia P, Arena R, Maurizi P, Battista A, Ridola V, et al. Efficacy and safety of transdermal buprenorphine in the management of children with cancer-related pain. Pediatr Blood Cancer. 2013;60(3):433-7. https://doi.org/10.1002/pbc.24332.
- Madden K, Mills S, Dibaj S, Williams JL, Liu D, Bruera E. Methadone as the Initial Long-Acting Opioid in Children with Advanced Cancer. J Palliat Med. 2018;21(9):1317-21. https://doi.org/10.1089/jpm.2017.0712.
- Goldman A, Hewitt M, Collins GS, Childs M, Hain R. Symptoms in children/young people with progressive malignant disease: United Kingdom Children’s Cancer Study Group/Paediatric Oncology Nurses Forum survey. Pediatrics. 2006;117(6):e1179-86. https://doi.org/10.1542/peds.2005-0683.
- Beecham E, Candy B, Howard R, McCulloch R, Laddie J, Rees H, et al. Pharmacological interventions for pain in children and adolescents with life-limiting conditions. Cochrane Database Syst Rev. 2015;2015(3):Cd010750. https://doi.org/10.1002/14651858.CD010750.pub2.
- Womer J, Zhong W, Kraemer FW, Maxwell LG, Ely EA, Faerber JA, et al. Variation of opioid use in pediatric inpatients across hospitals in the U.S. J Pain Symptom Manage. 2014;48(5):903-14. https://doi.org/10.1016/j.jpainsymman.2013.12.241.
- Rosenberg AR, Orellana L, Ullrich C, Kang T, Geyer JR, Feudtner C, et al. Quality of Life in Children With Advanced Cancer: A Report From the PediQUEST Study. J Pain Symptom Manage. 2016;52(2):243-53. https://doi.org/10.1016/j.jpainsymman.2016.04.002.
- Reglamento (CE) nº 1901/2006 del Parlamento Europeo y del Consejo, de 12 de diciembre de 2006, sobre medicamentos para uso pediátrico. Diario Oficial de la Unión Europea, nº 378 (27 de diciembre de 2006).
- McCulloch,R, Berde C. Difficult pain. Adjuvants or co-analgesics. En: Oxford Textbook of Palliative Medicine 3. Hain R, Goldman A, ed. 2021, p. 188-201.
- Stachelek GC, Terezakis SA, Ermoian R. Palliative radiation oncology in pediatric patients. Ann Palliat Med. 2019;8(3):285-92. https://doi.org/10.21037/apm.2019.05.01.
- Murphy JD, Nelson LM, Chang DT, Mell LK, Le QT. Patterns of care in palliative radiotherapy: a population-based study. J Oncol Pract. 2013;9(5):e220-7. https://doi.org/10.1200/jop.2012.000835.
- Rao AD, Chen Q, Ermoian RP, Alcorn SR, Figueiredo MLS, Chen MJ, et al. Practice patterns of palliative radiation therapy in pediatric oncology patients in an international pediatric research consortium. Pediatr Blood Cancer. 2017;64(11). https://doi.org/10.1002/pbc.26589.
- Rao AD, Figueiredo MLS, Yegya-Raman N, Sehgal S, Chen Q, Alcorn SR, et al. Clinical practice and outcomes of palliative radiation therapy in pediatric oncology patients: An international comparison of experiences from two distinct countries and health care systems. Radiother Oncol. 2019;140:1-5. https://doi.org/10.1016/j.radonc.2019.05.017.
- Chen EL, Yoo CH, Gutkin PM, Merriott DJ, Avedian RS, Steffner RJ, et al. Outcomes for pediatric patients with osteosarcoma treated with palliative radiotherapy. Pediatr Blood Cancer. 2020;67(1):e27967. https://doi.org/10.1002/pbc.27967.
- Mak KS, Lee SW, Balboni TA, Marcus KJ. Clinical outcomes and toxicity following palliative radiotherapy for childhood cancers. Pediatr Blood Cancer. 2018;65(1). https://doi.org/10.1002/pbc.26764.
- Lazarev S, Kushner BH, Wolden SL. Short Hypofractionated Radiation Therapy in Palliation of Pediatric Malignancies: Outcomes and Toxicities. Int J Radiat Oncol Biol Phys. 2018;102(5):1457-64. https://doi.org/10.1016/j.ijrobp.2018.07.2012.
- Varma S, Friedman DL, Stavas MJ. The role of radiation therapy in palliative care of children with advanced cancer: Clinical outcomes and patterns of care. Pediatr Blood Cancer. 2017;64(5). https://doi.org/10.1002/pbc.26359.
- Rahn DA, Mundt AJ, Murphy JD, Schiff D, Adams J, Murphy KT. Clinical outcomes of palliative radiation therapy for children. Pract Radiat Oncol. 2015;5(3):183-7. https://doi.org/10.1016/j.prro.2014.08.015.
- Caussa L, Hijal T, Michon J, Helfre S. Role of palliative radiotherapy in the management of metastatic pediatric neuroblastoma: a retrospective single-institution study. Int J Radiat Oncol Biol Phys. 2011;79(1):214-9. https://doi.org/10.1016/j.ijrobp.2009.10.031.
- Pramanik R, Agarwala S, Gupta YK, Thulkar S, Vishnubhatla S, Batra A, et al. Metronomic Chemotherapy vs Best Supportive Care in Progressive Pediatric Solid Malignant Tumors: A Randomized Clinical Trial. JAMA Oncol. 2017;3(9):1222-7. https://doi.org/10.1001/jamaoncol.2017.0324.
- Porkholm M, Toiviainen-Salo S, Seuri R, Lönnqvist T, Vepsäläinen K, Saarinen-Pihkala UM, et al. Metronomic therapy can increase quality of life during paediatric palliative cancer care, but careful patient selection is essential. Acta Paediatr. 2016;105(8):946-51. https://doi.org/10.1111/apa.13338.
- Cazzaniga ME, Biganzoli L, Cortesi L, De Placido S, Donadio M, Fabi A, Ferro A, Generali D, Lorusso V, Milani A, Montagna E, Munzone E, Orlando L, Pizzuti L, Simoncini E, Zamagni C, Pappagallo GL; Metronomic Chemotherapy in Advanced Breast Cancer Study Group. Treating advanced breast cancer with metronomic chemotherapy: what is known, what is new and what is the future? Onco Targets Ther. 2019 Apr 23;12:2989-2997.
- Karnofsky DA, Burchenal JH. The clinical evaluation of chemotherapeutics in cancer. En: MacLeod CM, ed. Evaluation of Chemotherapeutic Agents. Columbia University Press: New York, 1949, pp 191–205.
- Lansky SB, List MA, Lansky LL, Ritter-Sterr C, Miller DR. The measurement of performance in childhood cancer patients. Cancer. 1987 Oct 1;60(7):1651-6.
- Sociedad Española de Hematología y Oncología Pediátricas. Centros informantes del RETI-SEHOP [Internet]. [citado mayo 2022]. Disponible en: https://www.uv.es/rnti/pdfs/Listado%20CI.pdf
- Lee BKY, Apkon D, Wolfe J, Marcus KJ. Palliative Radiation Therapy for Pediatric Patients: Parental Perceptions. International Journal of Radiation Oncology, Biology, Physics. 2017;99(2):S86. https://doi.org/10.1016/j.ijrobp.2017.06.208.
- Tomlinson D, Bartels U, Gammon J, Hinds PS, Volpe J, Bouffet E, et al. Chemotherapy versus supportive care alone in pediatric palliative care for cancer: comparing the preferences of parents and health care professionals. CMAJ. 2011;183(17):E1252-8. https://doi.org/10.1503/cmaj.110392.
- Junta de Andalucía [Internet]. [citado mayo 2022]. Los derechos de los niños y niñas. Disponible en: https://www.juntadeandalucia.es/organismos/igualdadpoliticassocialesyconciliacion/areas/infancia-familias/derechos-infancia.html
- Ley 26/2015, de 28 de julio, de modificación del sistema de protección a la infancia y a la adolescencia. Boletín Oficial del Estado nº 180 (29 de julio de 2015).
- Coyne I, O’Mathúna DP, Gibson F, Shields L, Leclercq E, Sheaf G. Interventions for promoting participation in shared decision-making for children with cancer. Cochrane Database Syst Rev. 2016;11(11):Cd008970. https://doi.org/10.1002/14651858.CD008970.pub3.
- Federación Española de Padres Niños con cáncer. Cambio legislativo respecto al interés superior del menor: Opiniones de adolescentes y padres/tutores de niños con cáncer. 2017.
- Escudero Carretero MJ, Simón Lorda P, Aguayo Maldonado J, Arcos Ocón L, Cía Ramos R, Fernández López A, et al. El final de la vida en la infancia y la adolescencia: Aspectos éticos y jurídicos en la atención sanitaria. Sevilla: Junta de Andalucía; 2011.
- Hinds PS, Drew D, Oakes LL, Fouladi M, Spunt SL, Church C, et al. End-of-life care preferences of pediatric patients with cancer. J Clin Oncol. 2005;23(36):9146-54. https://doi.org/10.1200/jco.2005.10.538.
- Inglin S, Hornung R, Bergstraesser E. Palliative care for children and adolescents in Switzerland: a needs analysis across three diagnostic groups. Eur J Pediatr. 2011;170(8):1031-8. https://doi.org/10.1007/s00431-011-1398-5.
- Kars MC, Grypdonck MH, de Korte-Verhoef MC, Kamps WA, Meijer-van den Bergh EM, Verkerk MA, et al. Parental experience at the end-of-life in children with cancer: ‘preservation’ and ‘letting go’ in relation to loss. Support Care Cancer. 2011;19(1):27-35. https://doi.org/10.1007/s00520-009-0785-1.
- Matsuoka M, Narama M. Parents’ thoughts and perceptions on hearing that their child has incurable cancer. J Palliat Med. 2012;15(3):340-6. https://doi.org/10.1089/jpm.2011.0410.
- de Vries MC, Bresters D, Kaspers GJL, Houtlosser M, Wit JM, Engberts DP, et al. What Constitutes the Best Interest of a Child? Views of Parents, Children, and Physicians in a Pediatric Oncology Setting. AJOB Primary Research. 2013;4(2):1-10. https://doi.org/10.1080/21507716.2012.757254.
- Weaver MS, Baker JN, Gattuso JS, Gibson DV, Sykes AD, Hinds PS. Adolescents’ preferences for treatment decisional involvement during their cancer. Cancer. 2015;121(24):4416-24. https://doi.org/10.1002/cncr.29663.
- Kars MC, Grypdonck MH, de Bock LC, van Delden JJ. The parents’ ability to attend to the «voice of their child» with incurable cancer during the palliative phase. Health Psychol. 2015;34(4):446-52. https://doi.org/10.1037/hea0000166.
- Ley 10/2011, de 24 de marzo, de derechos y garantías de la dignidad de la persona en el proceso de morir y de la muerte. Boletín Oficial de Aragón nº 70, (24 de marzo de 2011).
- Ley 26/2018, de 21 de diciembre, de derechos y garantías de la infancia y la adolescencia de la Comunidad Valenciana. DOGV nº 8450, (24 de diciembre de 2018).
- Espejo M, Miquel E, Esquerda M, Pifarré J. Valoración de la competencia del menor en relacio´n con la toma de decisiones sanitarias: escala de la competencia de Lleida. Med Clin (Barc). 2011;136(1):26-30. https://doi.org/10.1016/j.medcli.2009.05.014.
- Drane JF. The many faces of competency. Hasting Cent Rep. 1985;4:17—21.
- Herreros B, Palacios G, Pacho E. Limitación del esfuerzo terapéutico. Rev Clin Esp. 2012;212(3):134-40. https://doi.org/10.1016/j.rce.2011.04.016.
- Snaman JM, Torres C, Duffy B, Levine DR, Gibson DV, Baker JN. Parental Perspectives of Communication at the End of Life at a Pediatric Oncology Institution. J Palliat Med. 2016;19(3):326-32. https://doi.org/10.1089/jpm.2015.0253.
- Stenekes SJ, Ens CD, Harlos M, Chochinov HM, Mytopher K. A descriptive study evaluating perinatal healthcare providers’ perspectives of palliative programming in 3 Canadian institutions. J Perinat Neonatal Nurs. 2014;28(4):280-9; quiz E1-2. https://doi.org/10.1097/jpn.0000000000000020.
- Steele AC, Kaal J, Thompson AL, Barrera M, Compas BE, Davies B, et al. Bereaved parents and siblings offer advice to health care providers and researchers. J Pediatr Hematol Oncol. 2013;35(4):253-9. https://doi.org/10.1097/MPH.0b013e31828afe05.
- Robert R, Zhukovsky DS, Mauricio R, Gilmore K, Morrison S, Palos GR. Bereaved parents’ perspectives on pediatric palliative care. J Soc Work End Life Palliat Care. 2012;8(4):316-38. https://doi.org/10.1080/15524256.2012.732023.
- Branchett K, Stretton J. Neonatal palliative and end of life care: What parents want from professionals. Journal of Neonatal Nursing. 2012;18(2):40-4. https://doi.org/https://doi.org/10.1016/j.jnn.2012.01.009.
- Caeymaex L, Speranza M, Vasilescu C, Danan C, Bourrat MM, Garel M, et al. Living with a crucial decision: a qualitative study of parental narratives three years after the loss of their newborn in the NICU. PLoS One. 2011;6(12):e28633. https://doi.org/10.1371/journal.pone.0028633.
- Midson R, Carter B. Addressing end of life care issues in a tertiary treatment centre: lessons learned from surveying parents’ experiences. J Child Health Care. 2010;14(1):52-66. https://doi.org/10.1177/1367493509347060.
- Davies B, Contro N, Larson J, Widger K. Culturally-sensitive information-sharing in pediatric palliative care. Pediatrics. 2010;125(4):e859-65. https://doi.org/10.1542/peds.2009-0722.
- Gordon C, Barton E, Meert KL, Eggly S, Pollacks M, Zimmerman J, et al. Accounting for medical communication: parents’ perceptions of communicative roles and responsibilities in the pediatric intensive care unit. Communication & medicine. 2009;6(2):177-88.
- Meert KL, Eggly S, Pollack M, Anand KJ, Zimmerman J, Carcillo J, et al. Parents’ perspectives on physician-parent communication near the time of a child’s death in the pediatric intensive care unit. Pediatr Crit Care Med. 2008;9(1):2-7. https://doi.org/10.1097/01.Pcc.0000298644.13882.88.
- Hendricks-Ferguson VL. Parental perspectives of initial end-of-life care communication. Int J Palliat Nurs. 2007;13(11):522-31. https://doi.org/10.12968/ijpn.2007.13.11.27587.
- Meyer EC, Ritholz MD, Burns JP, Truog RD. Improving the quality of end-of-life care in the pediatric intensive care unit: parents’ priorities and recommendations. Pediatrics. 2006;117(3):649-57. https://doi.org/10.1542/peds.2005-0144.
- Hsiao JL, Evan EE, Zeltzer LK. Parent and child perspectives on physician communication in pediatric palliative care. Palliat Support Care. 2007;5(4):355-65. https://doi.org/10.1017/s1478951507000557.
- Baverstock A, Finlay F. What can we learn from the experiences of consultants around the time of a child’s death? Child Care Health Dev. 2008;34(6):732-9. https://doi.org/10.1111/j.1365-2214.2008.00875.x.
- Buckman R. Communications and emotions. BMJ. 2002;325(7366):672. https://doi.org/10.1136/bmj.325.7366.672.
- Costey S, Martín Ruiz N, Lorente R, Martínez de Zabarte Fernández JM, Marco S, Lanceta V, et al. La experiencia de enfermedad en los hermanos de niños en cuidados paliativos. Medicina Paliativa. 2020;27. https://doi.org/10.20986/medpal.2020.1143/2019.
- Caballero Pérez V, Rigal Andrés M, Beltrán García S, Parra Plantagenet-Whyte F, Moliner Robredo MC, Gracia Torralba L, et al. Influencia de los recursos especializados en cuidados paliativos pediátricos en los pediatras de Atención Primaria. Pediatría Atención Primaria. 2018;20:133-42.
- Vickers J, Thompson A, Collins GS, Childs M, Hain R. Place and provision of palliative care for children with progressive cancer: a study by the Paediatric Oncology Nurses’ Forum/United Kingdom Children’s Cancer Study Group Palliative Care Working Group. J Clin Oncol. 2007;25(28):4472-6. https://doi.org/10.1200/jco.2007.12.0493.
- Hechler T, Blankenburg M, Friedrichsdorf SJ, Garske D, Hübner B, Menke A, et al. Parents’ perspective on symptoms, quality of life, characteristics of death and end-of-life decisions for children dying from cancer. Klin Padiatr. 2008;220(3):166-74. https://doi.org/10.1055/s-2008-1065347.
- Kassam A, Skiadaresis J, Alexander S, Wolfe J. Parent and clinician preferences for location of end-of-life care: home, hospital or freestanding hospice? Pediatr Blood Cancer. 2014;61(5):859-64. https://doi.org/10.1002/pbc.24872.
- Friedrichsdorf SJ, Postier A, Dreyfus J, Osenga K, Sencer S, Wolfe J. Improved quality of life at end of life related to home-based palliative care in children with cancer. J Palliat Med. 2015;18(2):143-50. https://doi.org/10.1089/jpm.2014.0285.
- Montel S, Laurence V, Copel L, Pacquement H, Flahault C. Place of death of adolescents and young adults with cancer: first study in a French population. Palliat Support Care. 2009;7(1):27-35. https://doi.org/10.1017/s1478951509000054.
- Astray San Martín A. Encuesta sobre cuidados paliativos a pediatras de Atención Primaria en un área sanitaria de Madrid. Rev Pediatr Aten Primaria. 2010;XII(45):33-40.
- Arias-Casais N, Garralda E, Pons JJ, Marston J, Chambers L, Downing J, et al. Mapping Pediatric Palliative Care Development in the WHO-European Region: Children Living in Low-to-Middle-Income Countries Are Less Likely to Access It. J Pain Symptom Manage. 2020;60(4):746-53. https://doi.org/10.1016/j.jpainsymman.2020.04.028.
- Ananth P, Melvin P, Feudtner C, Wolfe J, Berry JG. Hospital Use in the Last Year of Life for Children With Life-Threatening Complex Chronic Conditions. Pediatrics. 2015;136(5):938-46. https://doi.org/10.1542/peds.2015-0260.
- Noyes J, Edwards RT, Hastings RP, Hain R, Totsika V, Bennett V, et al. Evidence-based planning and costing palliative care services for children: novel multi-method epidemiological and economic exemplar. BMC Palliat Care. 2013;12(1):18. https://doi.org/10.1186/1472-684x-12-18.
- Chong PH, De Castro Molina JA, Teo K, Tan WS. Paediatric palliative care improves patient outcomes and reduces healthcare costs: evaluation of a home-based program. BMC Palliat Care. 2018;17(1):11. https://doi.org/10.1186/s12904-017-0267-z.
- Wolfe J, Orellana L, Ullrich C, Cook EF, Kang TI, Rosenberg A, et al. Symptoms and Distress in Children With Advanced Cancer: Prospective Patient-Reported Outcomes From the PediQUEST Study. J Clin Oncol. 2015;33(17):1928-35. https://doi.org/10.1200/jco.2014.59.1222.
- Wolfe J, Grier HE, Klar N, Levin SB, Ellenbogen JM, Salem-Schatz S, et al. Symptoms and suffering at the end of life in children with cancer. N Engl J Med. 2000;342(5):326-33. https://doi.org/10.1056/nejm200002033420506.
- Vollenbroich R, Borasio GD, Duroux A, Grasser M, Brandstätter M, Führer M. Listening to parents: The role of symptom perception in pediatric palliative home care. Palliat Support Care. 2016;14(1):13-9. https://doi.org/10.1017/s1478951515000462.
- von Lützau P, Otto M, Hechler T, Metzing S, Wolfe J, Zernikow B. Children dying from cancer: parents’ perspectives on symptoms, quality of life, characteristics of death, and end-of-life decisions. J Palliat Care. 2012;28(4):274-81.
- Theunissen JM, Hoogerbrugge PM, van Achterberg T, Prins JB, Vernooij-Dassen MJ, van den Ende CH. Symptoms in the palliative phase of children with cancer. Pediatr Blood Cancer. 2007;49(2):160-5. https://doi.org/10.1002/pbc.21042.
- Ullrich CK, Dussel V, Hilden JM, Sheaffer JW, Moore CL, Berde CB, et al. Fatigue in children with cancer at the end of life. J Pain Symptom Manage. 2010;40(4):483-94. https://doi.org/10.1016/j.jpainsymman.2010.02.020.
- Heath JA, Clarke NE, Donath SM, McCarthy M, Anderson VA, Wolfe J. Symptoms and suffering at the end of life in children with cancer: an Australian perspective. Med J Aust. 2010;192(2):71-5. https://doi.org/10.5694/j.1326-5377.2010.tb03420.x.
- Collins JJ, Byrnes ME, Dunkel IJ, Lapin J, Nadel T, Thaler HT, et al. The measurement of symptoms in children with cancer. J Pain Symptom Manage. 2000;19(5):363-77. https://doi.org/10.1016/s0885-3924(00)00127-5.
- Collins JJ, Devine TD, Dick GS, Johnson EA, Kilham HA, Pinkerton CR, et al. The measurement of symptoms in young children with cancer: the validation of the Memorial Symptom Assessment Scale in children aged 7-12. J Pain Symptom Manage. 2002;23(1):10-6. https://doi.org/10.1016/s0885-3924(01)00375-x.
- Kiman R, Wuiloud AC, Requena ML. End of life care sedation for children. Curr Opin Support Palliat Care. 2011;5(3):285-90. https://doi.org/10.1097/SPC.0b013e3283492aba.
- Cherny NI, Radbruch L. European Association for Palliative Care (EAPC) recommended framework for the use of sedation in palliative care. Palliat Med. 2009;23(7):581-93. https://doi.org/10.1177/0269216309107024.
- Henderson CM, FitzGerald M, Hoehn KS, Weidner N. Pediatrician Ambiguity in Understanding Palliative Sedation at the End of Life. Am J Hosp Palliat Care. 2017;34(1):5-19. https://doi.org/10.1177/1049909115609294.
- Drake R, Frost J, Collins JJ. The symptoms of dying children. J Pain Symptom Manage. 2003;26(1):594-603. https://doi.org/10.1016/s0885-3924(03)00202-1.
- Gurschick L, Mayer DK, Hanson LC. Palliative Sedation: An Analysis of International Guidelines and Position Statements. Am J Hosp Palliat Care. 2015;32(6):660-71. https://doi.org/10.1177/1049909114533002.
- Jordan M, Keefer PM, Lee YA, Meade K, Snaman JM, Wolfe J, et al. Top Ten Tips Palliative Care Clinicians Should Know About Caring for Children. J Palliat Med. 2018;21(12):1783-9. https://doi.org/10.1089/jpm.2018.0482.
- Organización Médico Colegial Española; Sociedad Española de Cuidados Paliativos. Guía de Sedación Paliativa. CGCOM 2021.
- van Deijck RH, Hasselaar JG, Verhagen SC, Vissers KC, Koopmans RT. Determinants of the administration of continuous palliative sedation: a systematic review. J Palliat Med. 2013;16(12):1624-32. https://doi.org/10.1089/jpm.2013.0173.
- Anghelescu DL, Hamilton H, Faughnan LG, Johnson LM, Baker JN. Pediatric palliative sedation therapy with propofol: recommendations based on experience in children with terminal cancer. J Palliat Med. 2012;15(10):1082-90. https://doi.org/10.1089/jpm.2011.0500.
- de Noriega Echevarría Í, García Salido A, Herrero Velasco B, Navarro Mingorance Á, Rigal Andrés M, Martino Alba R. Sedación paliativa en pacientes con cáncer: frecuencia de su práctica y diferencias entre grupos de tumores en cuidados paliativos pediátricos [Internet]. En: Libro de ponencias y comunicaciones: III Congreso nacional Sociedad Española de Cuidados Paliativos Pediátricos. Logroño: Universidad Internacional de La Rioja; 2019 [citado mayo 2022]. p. 58-60. Disponible en: https://www.pedpal.es/site/wp-content/uploads/2019/03/Libro-de-ponencias-y-comunicaciones-III-Congreso-PedPal.pdf.
- Salinas Sanz JA. Atención al final de la vida en las Unidades de Oncología Infantil en España [Internet]. En: Libro de ponencias y comunicaciones: III Congreso nacional Sociedad Española de Cuidados Paliativos Pediátricos. Logroño: Universidad Internacional de La Rioja; 2019 [citado mayo 2022]. p. 123. Disponible en: https://www.pedpal.es/site/wp-content/uploads/2019/03/Libro-de-ponencias-y-comunicaciones-III-Congreso-PedPal.pdf.
- Szymczak JE, Schall T, Hill DL, Walter JK, Parikh S, DiDomenico C, et al. Pediatric Oncology Providers’ Perceptions of a Palliative Care Service: The Influence of Emotional Esteem and Emotional Labor. J Pain Symptom Manage. 2018;55(5):1260-8. https://doi.org/10.1016/j.jpainsymman.2018.01.019.
- Postovsky S, Moaed B, Krivoy E, Ofir R, Ben Arush MW. Practice of palliative sedation in children with brain tumors and sarcomas at the end of life. Pediatr Hematol Oncol. 2007;24(6):409-15. https://doi.org/10.1080/08880010701451079.
- Schildmann EK, Schildmann J, Kiesewetter I. Medication and monitoring in palliative sedation therapy: a systematic review and quality assessment of published guidelines. J Pain Symptom Manage. 2015;49(4):734-46. https://doi.org/10.1016/j.jpainsymman.2014.08.013.
- Cherny NI. ESMO Clinical Practice Guidelines for the management of refractory symptoms at the end of life and the use of palliative sedation. Ann Oncol. 2014;25 Suppl 3:iii143-52. https://doi.org/10.1093/annonc/mdu238.
- Naipul A, Ullrich C. Palliative sedation. En: Wolfe J, Hinds PS, Sourkes BM, ed. Textbook of interdisciplinary pediatric palliative care. Philadelphia: Elsevier/Saunders; 2011. pp 204-214.
- Grupo de Trabajo de la Guía de Práctica Clínica sobre Cuidados Paliativos. Guía de Práctica Clínica sobre Cuidados Paliativos. Madrid: Plan Nacional para el SNS del MSC. Agencia de Evaluación de Tecnologías Sanitarias del País Vasco; 2008. Guías de Práctica Clínica en el SNS: OSTEBA Nº 2006/08.
- Lanken PN, Terry PB, Delisser HM, Fahy BF, Hansen-Flaschen J, Heffner JE, et al. An official American Thoracic Society clinical policy statement: palliative care for patients with respiratory diseases and critical illnesses. Am J Respir Crit Care Med. 2008;177(8):912-27. https://doi.org/10.1164/rccm.200605-587ST.
- de Noriega Echevarría Í, Rigal M, Navarro A, Puertas V, Pérez MÁ, Martino R. Palliative Sedation in a Regional Paeditric Unit: Frequency of Practice and Characteristics of Patients and Sedation. En: EAPC Abstracts: 16th World Congress of the European Association for Palliative Care. [Berlín]: EAPC; 2019. p. 96.
- Korzeniewska-Eksterowicz A, Przysło Ł, Fendler W, Stolarska M, Młynarski W. Palliative sedation at home for terminally ill children with cancer. J Pain Symptom Manage. 2014;48(5):968-74. https://doi.org/10.1016/j.jpainsymman.2014.01.012.
- Bruce A, Boston P. Relieving existential suffering through palliative sedation: discussion of an uneasy practice. J Adv Nurs. 2011;67(12):2732-40. https://doi.org/10.1111/j.1365-2648.2011.05711.x.
- Olsen ML, Swetz KM, Mueller PS. Ethical decision making with end-of-life care: palliative sedation and withholding or withdrawing life-sustaining treatments. Mayo Clin Proc. 2010;85(10):949-54. https://doi.org/10.4065/mcp.2010.0201.
- Whitehead PB. Palliative pharmacologic sedation for terminally ill adults. Clin J Oncol Nurs. 2015;19(3):373-4. https://doi.org/10.1188/15.Cjon.373-374.
- Ciancio AL, Mirza RM, Ciancio AA, Klinger CA. The Use of Palliative Sedation to Treat Existential Suffering: A Scoping Review on Practices, Ethical Considerations, and Guidelines. J Palliat Care. 2020;35(1):13-20. https://doi.org/10.1177/0825859719827585.
- Voeuk A, Nekolaichuk C, Fainsinger R, Huot A. Continuous Palliative Sedation for Existential Distress? A Survey of Canadian Palliative Care Physicians’ Views. J Palliat Care. 2017;32(1):26-33. https://doi.org/10.1177/0825859717711301.
- Mack JW, Weeks JC, Wright AA, Block SD, Prigerson HG. End-of-life discussions, goal attainment, and distress at the end of life: predictors and outcomes of receipt of care consistent with preferences. J Clin Oncol. 2010;28(7):1203-8. https://doi.org/10.1200/jco.2009.25.4672.
- Schüklenk U, van Delden JJ, Downie J, McLean SA, Upshur R, Weinstock D. End-of-life decision-making in Canada: the report by the Royal Society of Canada expert panel on end-of-life decision-making. Bioethics. 2011;25 (Suppl 1):1-73. https://doi.org/10.1111/j.1467-8519.2011.01939.x.
- Rigal M, del Rincón Fernández C, Martino Alba R. Vivir (y morir) a mi manera. La atención a adolescentes en cuidados paliativos. Revista Adolescer. III(3):32-51.
- Pellegrino ED. Decisions to withdraw life-sustaining treatment: a moral algorithm. Jama. 2000;283(8):1065-7. https://doi.org/10.1001/jama.283.8.1065.
- Bobb B. A Review of Palliative Sedation. Nurs Clin North Am. 2016;51(3):449-57. https://doi.org/10.1016/j.cnur.2016.05.008.
- Johnson LM, Frader J, Wolfe J, Baker JN, Anghelescu DL, Lantos JD. Palliative Sedation With Propofol for an Adolescent With a DNR Order. Pediatrics. 2017;140(2). https://doi.org/10.1542/peds.2017-0487.
- Cowan JD, Walsh D. Terminal sedation in palliative medicine–definition and review of the literature. Support Care Cancer. 2001;9(6):403-7. https://doi.org/10.1007/s005200100235.
- Brinkkemper T, van Norel AM, Szadek KM, Loer SA, Zuurmond WW, Perez RS. The use of observational scales to monitor symptom control and depth of sedation in patients requiring palliative sedation: a systematic review. Palliat Med. 2013;27(1):54-67. https://doi.org/10.1177/0269216311425421.
- National Institute for Health and Care Excellence. End of Life Care for Infants, Children and Young People with Life-Limiting Conditions: Planning and Management. London: National Institute for Health and Care Excellence; 2016.
- de Noriega I, Rigal Andrés M, Martino Alba R. Análisis descriptivo de la sedación paliativa en una Unidad de Cuidados Paliativos Pediátricos. An Pediatr (Engl Ed). 2021 Feb 18:S1695-4033(21)00009-6. https://doi.org/10.1016/j.anpedi.2021.01.005.
- Bruinsma SM, Rietjens JA, Seymour JE, Anquinet L, van der Heide A. The experiences of relatives with the practice of palliative sedation: a systematic review. J Pain Symptom Manage. 2012;44(3):431-45. https://doi.org/10.1016/j.jpainsymman.2011.09.006.
- Grupo de trabajo para la actualización del Manual de Elaboración de GPC. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; Zaragoza: Instituto Aragonés de Ciencias de la Salud (IACS); 2016 [Febrero 2018]. Disponible en: [https://portal.guiasalud.es/wp-content/uploads/2019/01/manual_gpc_completo.pdf].
- López de Argumedo M, Reviriego E, Gutiérrez A, Bayón JC. Actualización del Sistema de Trabajo Compartido para Revisiones Sistemáticas de la Evidencia Científica y Lectura Crítica (Plataforma FLC 3.0). Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Evaluación de Tecnologías Sanitarias del País Vasco; 2017. Informes de Evaluación de Tecnologías Sanitarias: OSTEBA.
- Cano Arana, A., González Gil, T., Cabello López, J.B. por CASPe. Plantilla para ayudarte a entender un estudio cualitativo. En: CASPe. Guías CASPe de Lectura Crítica de la Literatura Médica. Alicante: CASPe; 2010. Cuaderno III. p.3-8.
- GRADEpro GDT: GRADEpro Guideline Development Tool [Software]. McMaster University and Evidence Prime, 2022. Disponible en: gradepro.org
- Lewin S, Booth A, Glenton C, Munthe-Kaas H, Rashidian A, Wainwright M, et al. Applying GRADE-CERQual to qualitative evidence synthesis findings: introduction to the series. Implement Sci. 2018;13(Suppl 1):2. https://doi.org/10.1186/s13012-017-0688-3.
- Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016;353:i2016. https://doi.org/10.1136/bmj.i2016.
- Grupo de trabajo sobre implementación de GPC. Implementación de Guías de Práctica Clínica en el Sistema Nacional de Salud. Manual Metodológico. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Instituto Aragonés de Ciencias de la Salud-I+CS; 2009. Guías de Práctica Clínica en el SNS: I+CS Nº 2007/02-02.
- Gazelle G, Fine PG. Methadone for pain: No. 75. J Palliat Med. 2004;7(2):303-4. https://doi.org/10.1089/109662104773709431.
- Singh Jassal S, ed. The Association of Paediatric Palliative Medicine Master Formulary [Internet]. Association of Paediatric Palliative Medicine; 2020 [citado mayo 2022]. Disponible en: https://www.appm.org.uk/_webedit/uploaded-files/All%20Files/Event%20Resources/2020%20APPM%20Master%20Formulary%202020%20protected.pdf.
- Hoefman RJ, van Exel J, Brouwer W. How to include informal care in economic evaluations. Pharmacoeconomics. 2013;31(12):1105-19. https://doi.org/10.1007/s40273-013-0104-z.
- Indice de Precios de Consumo. Base 2016 [Internet]. Madrid: Instituto Nacional de Estadística; 2018 [citado junio 2019]. Disponible en: http://www.ine.es/dynt3/inebase/index.htm?padre=3464.
- Retribuciones correspondientes al año 2016 del personal del Servicio Aragonés de Salud al que resulta de aplicación el sistema retributivo establecido en la Ley 55/2003, del Estatuto Marco del Personal Estatutario de los Servicios de Salud. Zaragoza: Servicio Aragonés de Salud; 2016.
- Resolución de 30 de julio de 2012, de la Dirección Gerencia del Servicio Aragonés de Salud, sobre revisión de las tarifas a aplicar por la prestación de servicios sanitarios a terceros obligados al pago o a usuarios sin derecho a asistencia sanitaria en la Comunidad Autónoma de Aragón. Boletín Oficial de Aragón, nº 156.
- Orden 731/2013, de 6 de septiembre, del Consejero de Sanidad, por la que se fijan los precios públicos por la prestación de los servicios y actividades de naturaleza sanitaria de la Red de Centros de la Comunidad de Madrid. Boletín Oficial de la Comunidad de Madrid, nº 215.
- Lazzarin P, Schiavon B, Brugnaro L, Benini F. Parents spend an average of nine hours a day providing palliative care for children at home and need to maintain an average of five life-saving devices. Acta Paediatr. 2018;107(2):289-93. https://doi.org/10.1111/apa.14098.
- Encuestas de Estructura Salarial (EES). Ganancia por hora normal de trabajo. [Internet]. Madrid: Instituto Nacional de Estadística; 2017 [citado mayo 2022]. Disponible en: https://www.ine.es/dynt3/inebase/es/index.htm?padre=4565&capsel=4606.
- Serra-Prat M, Gallo P, Picaza JM. Home palliative care as a cost-saving alternative: evidence from Catalonia. Palliat Med. 2001;15(4):271-8. https://doi.org/10.1191/026921601678320250.
- Conjunto Mínimo Básico de Datos. Hospitalización (CMBD-H) [Internet]. Madrid: Ministerio de Sanidad, Consumo y Bienestar Social; 2015 [citado mayo 2022]. Disponible en: http://pestadistico.inteligenciadegestion.msssi.es/publicoSNS/Comun/ArbolNodos.aspx.
- Feudtner C, Feinstein JA, Zhong W, Hall M, Dai D. Pediatric complex chronic conditions classification system version 2: updated for ICD-10 and complex medical technology dependence and transplantation. BMC Pediatr. 2014;14:199. https://doi.org/10.1186/1471-2431-14-199.