11.1. Catarata
- ¿Cuándo debe operarse la catarata asociada? ¿Hay alguna maniobra específica que deba recomendarse?
Los pacientes con RP son una población con un elevado riesgo de desarrollar cataratas. En concreto es muy frecuente el desarrollo de cataratas subcapsulares posteriores.466
Las cataratas subcapsulares posteriores en la población general son relativamente raras y se estima que afectan al 2,1% de las personas mayores de 50 años. Sin embargo, en la RP aproximadamente la mitad de los pacientes desarrollan este tipo de cataratas a los 40 años y el 80% a los 60. La coexistencia de este tipo de cataratas con una restricción concéntrica del CV inherente a esta enfermedad hace que la pérdida de visión en estos pacientes, debido al desenfoque causado por la opacidad, sea muy acusado.212
Las cataratas son un hallazgo común en las formas sindrómicas de RP como el USH y en algunas otras distrofias retinianas como las vitreorretinopatias congénitas. Al ser estas enfermedades menos habituales, existen menos datos en la literatura.
En relación a esta pregunta clínica, no se han identificado estudios de alta calidad metodológica que evalúen las diferentes técnicas quirúrgicas para la catarata asociada a las DHR.
Parte de los estudios identificados abordan técnicas quirúrgicas para la catarata, que han ido cayendo en desuso, por lo que no se detallan los resultados de estos estudios.467-472 Estas técnicas son la cirugía extracapsular con467-469 o sin lente intraocular468,472 y la cirugía intracapsular con470 o sin lente intraocular.471,472
Para responder a esta pregunta, por tanto, se han tenido en cuenta los estudios en los que se emplea facoemulsificación con lente intraocular466,470,473-475 y con anillo de tensión capsular466. Todos los estudios identificados son observacionales,466,470,473-475 en su mayoría análisis retrospectivos466,470,474,475 y todos ellos en la RP (n=250 pacientes y 349 ojos intervenidos).
La AV media mejoró tras la operación en general en los pacientes con DHR. 466,470,473-475
En un primer estudio en el que se realizó facoemulsificación con implante de lente intraocular los autores observaron que la AV media preoperatoria fue de 20/340 y mejoró de forma significativa a 20/129 tras la intervención (P<0,0001). El 87,5% de los pacientes mejoraron tras la operación, el 10% se mantuvieron estables y el 2,5% empeoraron.472 En un segundo estudio 19 ojos (67,9%) mejoraron la AV y nueve (32,1%) no obtuvieron mejoría en su AV, aunque dos de ellos refirieron una mejoría subjetiva en su calidad de visión474. En un último estudio, se realizó facoemulsificación con implante de lente intraocular con y sin anillo endocapsular466. En este estudio obtuvieron resultados positivos aunque un poco más modestos. La AV mejoró en el 52% de los casos, permaneció estable en el 37% y empeoró en el 12%. La media de la mejor AV corregida preoperatoria en todo el grupo fue de 1,45 ± 0,85 (IC95%: 1,21-1,69) e incrementó a 1,32 ± 0,95 (IC95%: 1,06-1,58; P=0,02). La media preoperatoria y la postoperatoria en el grupo sin anillo mejoró de 1,16 ± 0,8 (IC95%: 0,83- 1,48) a 0,98 ± 0,88 (IC95%: 0,62-1,33; P=0,02) y en el grupo con anillo de 1,74 ± 0,81 (IC95%: 1,42-2,07) a 1,66 ± a 0,90 (IC95%: 1,3-2,03; P=0,31), respectivamente.466
baja/muy
baja
En relación al uso de facoemulsificación con implante de lente, en un primer estudio un paciente sufrió un edema macular postquirúrgico (4,8%) y otro una rotura de la cápsula posterior intraoperatoria (4,8%).474 Mientras que en otro estudio, el 82,5% de los ojos desarrollaron algún grado de opacificación de la cápsula posterior y el 52,5% precisaron capsulotomía con láser YAG una media de 10,8 meses tras la cirugía. El 18,8% de los ojos mostraron facodonesis o pseudofacodonesis.475
Bayyoud et al.466 observaron que pacientes operados mediante facoemulsificación con lente intraocular a los que se les implantó un anillo de tensión capsular mostraron una menor tendencia a la aparición de opacificación de la cápsula posterior (13/26 casos en pacientes operados mediante facoemulsificación sin anillo y 10/26 en pacientes a los que también se les implantó un anillo de tensión capsular). Asimismo, cuando a la facoemulsificación se asoció el uso de anillos de tensión capsular disminuyó la incidencia del síndrome de contracción capsular (2 casos en pacientes operados mediante facoemulsificación y ninguno en pacientes a los que también se les implantó un anillo de tensión capsular), sin embargo, las diferencias no fueron estadísticamente significativas para ninguna complicación.
A la semana de la intervención, Hayashi et al. no apreciaron diferencias en el área de la capsulorrexis entre ambos grupos (pacientes con RP operados de cataratas vs. pacientes sin RP pareado por edad), sin embargo, al mes el área era significativamente menor en el grupo de pacientes con RP. También hubo diferencias significativas en el grado de descentramiento y el grado de inclinación a uno, seis y 12 meses tras la intervención. Catorce ojos en el grupo de pacientes con RP (29,8%) precisaron una capsulotomía anterior con láser YAG y ninguno en el grupo control.473
baja/muy
baja
Resumen de la evidencia
| Calidad muy baja |
La cirugía de cataratas en personas con RP proporciona mejoría visual en la mayoría de los pacientes que mantienen buena función macular.466,470,473-475 |
| Calidad muy baja |
Algunas complicaciones tras la cirugía de cataratas, como la opacificación de la cápsula posterior, la contracción de la cápsula anterior o tendencia al descentrado de la lente intraocular o a la pseudofacodonesis, son más frecuentes en las personas con RP que en la población general.466,473,475 |
| Calidad muy baja |
La implantación de un anillo de tensión capsular en pacientes operados mediante facoemulsificación con lente intraocular podría disminuir el riesgo de aparición de opacificación de la cápsula posterior y síndrome de contracción capsular. |
| No existen datos suficientes referentes a la cirugía de cataratas en otras enfermedades hereditarias de la retina. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: La evidencia deriva de diversos estudios observacionales retrospectivos y un estudio de casos y controles en pacientes con DHR de baja o muy baja calidad, lo que influyó en la fuerza de la recomendación.
- Balance entre beneficios y riesgos: La cirugía de cataratas en personas con RP parece que mejora la AV de pacientes con RP que mantienen buena función macular. 466,470,472,474,475 Estos resultados son similares a los hallados en pacientes sin DHR, la MAVC mejora tras la cirugía frente aquellos que no son intervenidos (diferencia de medias=-0,15; IC95%: -0,28 a -0,02; P<0,05).476-478
Según la American Academy of Ophthalmology Cataract and Anterior Segment Panel la cirugía de cataratas es uno de los tratamientos más exitosos en la historia de la medicina. Sin la cirugía, los pacientes con cataratas experimentarían una disminución constante de la función visual y de la función física. En población general, con la cirugía, los pacientes se recuperan rápidamente con una excelente visión y la capacidad de reanudar las actividades normales de la vida diaria.478
Así, en la guía de la American Academy of Ophthalmology Cataract and Anterior Segment Panel se recomienda la cirugía de cataratas debido a la eficacia demostrada en la mejora de la calidad de vida. Por el momento, no se han encontrado datos en pacientes con DHR. Sin embargo, en pacientes sin DHR, los resultados en calidad de vida son mejores tras la cirugía, frente aquellos que no son intervenidos (diferencia de medias=1,60; IC95%: 0,61-2,59; P<0,05).476,477 Otros datos relacionados, es que los pacientes intervenidos muestran mejores niveles de bienestar emocional, movilidad, independencia, lectura y acceso a la información (P<0,05) que aquellos que no reciben la intervención.477
Con todo, esta organización insta a que la decisión de realizar la cirugía de catarata se base en la consideración de factores tales como la AV, la deficiencia visual y el potencial de beneficios funcionales.478
Sin embargo, se debe tener en cuenta que también presentan mayor riesgo de complicaciones tras la cirugía de cataratas, dado que la incidencia de opacificación capsular y de contracción capsular anterior es alta, aunque la incidencia del edema de mácula secundario es pequeña.470 - Valores y preferencias de los pacientes: Entre los estudios que exploran la efectividad y seguridad de la cirugía de cataratas, Bastek et al.472 informaron que el 83% de los pacientes indicó de que se someterían a la cirugía de nuevo y Reccia et al.467 indicaron que todos sus pacientes expresaron su satisfacción con el resultado de la intervención. En el estudio cualitativo con pacientes con DHR en el contexto español, algunos pacientes informaron de que la intervención disminuyó mucho o totalmente a su visión, mientras que otros percibieron que mejoró mucho. Esta variabilidad en la percepción de los pacientes se observó también en relación a la sensibilidad a la luz. Por otro lado, los pacientes informaron de que tanto los riesgos como los beneficios que perciben de la intervención son importantes. Y por tanto, recibir información sobre los riesgos hubiera podido cambiar su decisión respecto a cuándo operarse.
- Costes y uso de recursos: No se han identificado estudios que valoren los costes asociados.
El grupo de trabajo propuso la inclusión de las siguientes recomendaciones.
Recomendaciones
| Condicional | Se sugiere realizar cirugía de cataratas en personas con RP que mantienen algo de función macular. |
| √ | Se sugiere realizar cirugía de cataratas en personas con otras DHR en las que la catarata esté produciendo un deterioro adicional de la actividad visual |
| Condicional | En pacientes con RP, se sugiere valorar la necesidad de realizar maniobras como colocar un anillo de soporte capsular para minimizar el riesgo de contracción de la cápsula anterior y la tasa de opacificación de la cápsula posterior. |
- ¿Cómo puede prevenirse el desprendimiento de retina en las distrofias vitreorretinianas?
Las degeneraciones vitreorretinianas que tienen un riesgo aumentado de presentar DR son la XLRS, la vitreorretinopatía exudativa familiar y el complejo Wagner-Stickler.479
No se han encontrado estudios en los que se ensayen estrategias terapéuticas específicas para disminuir el riesgo de DR en los pacientes con XLRS.
No se han identificado estudios de alta calidad metodológica que evalúen las diferentes técnicas terapéuticas específicas para disminuir el riesgo de DR en los pacientes con vitreorretinopatía exudativa familiar. Sin embargo, en esta enfermedad se han publicado algunos estudios no controlados y retrospectivos que analizan los efectos de la ablación mediante fotocoagulación con láser de las áreas de isquemia, presuntamente causantes de la neovascularización y DR exudativo y/o traccional.480,481
Mientras que en el trabajo de Pendergast et al., de quince ojos tratados con ablación mediante fotocoagulación con láser de las áreas de isquemia en vitreorretinopatía exudativa familiar, ocho ojos no requirieron ningún tratamiento adicional y siete ojos progresaron a un DR que requirió cirugía vítreo-retiniana.480 En el estudio de Shukla et al., 20 ojos fueron tratados con fotocoagulación láser o criopexia, un paciente tuvo un agujero macular y neovascularización que requirió fotocoagulación láser. A lo largo del seguimiento (media: 16,4 meses), cuatro pacientes se perdieron durante el seguimiento y los demás se mantuvieron estables.481
Calidad
muy baja
Para el síndrome de Stickler se identificó una revisión sistemática que evalúa la eficacia y seguridad de las intervenciones profilácticas en la retina para reducir el riesgo de DR y la consecuente pérdida de visión en adultos y niños con este síndrome.482 Se pudieron incluir únicamente dos estudios ambos de cohortes retrospectivos con grupo control en población diagnosticada de síndrome de Stickler tipo 1.
Ang et al.483 evaluaron la eficacia profiláctica de la crioterapia 360° en la retina posterior a la ora serrata (n=204) y Leiba et al.484 valoraron el tratamiento con láser circunferencial 360° para los ojos con lesiones extensas contiguas de la retina, en los que las lesiones estaban presentes en al menos tres cuadrantes de la retina, y el tratamiento focal con láser para los ojos con pequeñas lesiones localizadas de degeneración en empalizada o roturas aisladas (n=22). Los participantes en los grupos control de ambos estudios o no se sometían a tratamiento profiláctico alguno o lo hacían a intervenciones profilácticas diferentes a la crioterapia. Ambos estudios realizaron la profilaxis en personas sin DR previo en cualquiera de los ojos o, en el ojo adelfo, en aquellas personas con un DR previo en un ojo.
La misma revisión de Carroll et al.482 identificó dos estudios más (informados en tres publicaciones en francés) pero los consideran como evidencia de apoyo por su baja calidad y poca relevancia485–487. Estos estudios pequeños, también de cohortes con grupo control, evaluaron intervenciones quirúrgicas profilácticas en población designada como síndrome WagnerStickler pero en la que todos o algunos de los participantes tenían características sistémicas que podían ser consistentes con el síndrome de Stickler, e informaron resultados poco fiables.
Los dos estudios principales, Ang et al.483 y Leiba et al.484, encontraron una menor tasa de DR en los grupos que recibieron profilaxis (bilateral y unilateral combinada) que en los grupos controles (P<0,0025). Ninguno de los dos estudios informaron de ningún evento adverso mayor o a largo plazo o complicaciones asociadas con las intervenciones.483,484
Sin embargo, tal y como destacan los autores de la revisión, estos estudios presentan alto riesgo de sesgos, no solo por la debilidad inherente del diseño de los estudios sino por la no comparabilidad entre el grupo de intervención y el control en sus características basales, lo que resta robustez a las recomendaciones que se podrían extraer de sus conclusiones.482
Calidad
baja
En los otros dos estudios, Monin et al., comparan el tratamiento con láser con el cerclaje escleral y otros tipos de intervenciones (incluyendo la crioterapia) como profilaxis en el ojo contrario (n=22 participantes) y concluyen que sólo el cerclaje resulta de utilidad para disminuir el riesgo de DR en pacientes con diagnóstico clínico de síndrome de Stickler.485,486 Por su parte, Fritsch et al. compararon el tratamiento con láser focal o crioterapia con dos intervenciones de cerclaje escleral, informando que no se produjeron DR en ninguno de los grupos en el seguimiento de un máximo de ocho años.487
Calidad
muy baja
Resumen de la evidencia
| No se dispone de estudios que hayan ensayado estrategias terapéuticas específicas para disminuir el riesgo de DR en los pacientes con XLRS. | |
| Calidad muy baja |
Los pocos datos sugieren que la fotocoagulación con láser de las áreas de isquemia, presuntamente causantes de la neovascularización y el DR exudativo y/o traccional, puede ser beneficiosa en los DR de los pacientes con vitreorretinopatía exudativa familiar.480,481 Sin embargo, este tratamiento clínicamente establecido no está avalado por ningún ensayo clínico en este tipo de pacientes. |
| Calidad muy baja |
El cerclaje escleral parece disminuir el riesgo de DR en pacientes con diagnóstico clínico de síndrome de Stickler.482,485-487 |
| Calidad baja |
En la reducción del riesgo de DR en el síndrome de Stickler, tanto la crioterapia 360° en la retina posterior a la ora serrata como la fotocoagulación con láser circular muestran cierta eficacia, sin efectos secundarios importantes a largo plazo o complicaciones.482-484 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: Por un lado, no se han identificado estudios de alta calidad metodológica en pacientes con DHR vitreorretinianas. Los estudios incluidos son estudios observacionales de baja o muy baja calidad y una revisión sistemática en la que se incluyeron estudios de baja calidad, lo que influyó en la fuerza de la recomendación
- Balance entre beneficios y riesgos: Los DR no mejoran sin tratamiento. En pacientes con DHR, la fotocoagulación con láser parece que podría llegar a ser beneficiosa en pacientes con vitreorretinopatía exudativa familiar para la prevención de los DR.
En el Síndrome de Stickler, la crioterapia 360° en la retina posterior a la ora serrata y la fotocoagulación con láser circular parece que pueden ser beneficiosas, sin presentar efectos secundarios importantes a largo plazo o complicaciones. Finalmente, el cerclaje escleral también parece disminuir el riesgo de DR en pacientes con síndrome de Stickler.
En población normal, una revisión sistemática de alta calidad intentó evaluar la eficacia y seguridad de las técnicas utilizadas para el tratamiento de los desgarros de retina y la degeneración reticular asintomáticos para la prevención del DR. Sin embargo, no se pudieron establecer conclusiones sobre la efectividad de las intervenciones quirúrgicas para prevenir el DR puesto que no se han identificado estudios de calidad en las sucesivas búsquedas488. Por lo que las recomendaciones en población normal están basadas hasta el momento en consensos de expertos y no pueden apoyar los datos en pacientes con DHR en evidencias indirectas. - Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
El grupo elaborador formuló tres recomendaciones basadas en la evidencia que complementó con una recomendación de buenas prácticas considerando las opciones que podrían ayudar al manejo del DR en las DHR vitreorretinianas.
Recomendaciones
| √ | En pacientes con vitreorretinopatía exudativa familiar, se sugiere fotocoagulación con láser de la retina avascular. |
| Condicional | Se sugiere realizar fotocoagulación con láser circular en los pacientes diagnosticados de síndrome de Stickler. |
| Condicional | En los pacientes diagnosticados de Síndrome de Stickler, también se puede considerar cerclaje profiláctico o crioterapia 360°. |
- ¿Cómo debe tratarse un desprendimiento de retina en las personas con DHR?
Como ya se ha comentado en la respuesta a la pregunta 23, las degeneraciones vitreorretinianas que tienen un riesgo aumentado de presentar DR son la XLRS, la vitreorretinopatía exudativa familiar y el complejo Wagner-Stickler.479 No obstante, al igual que ocurre en la población general, pueden presentarse DR en pacientes con otro tipo de DHR.
Únicamente se identificaron algunas publicaciones de casos clínicos aislados o pequeñas series de casos sobre el tratamiento del DR en pacientes con DHR, en concreto, vitreorretinopatía exudativa familiar.480,489-492
Los pocos resultados obtenidos del tratamiento de los DR, en general quirúrgico, en pacientes con vitreorretinopatía exudativa familiar apuntan a una posible buena respuesta al tratamiento en estos pacientes.480,489-492 Sin embargo, casi el 50% de los pacientes tratados con láser requirió de cirugía adicional posterior para volver a aplicar la retina.480
Calidad
muy baja
Resumen de la evidencia
| La evidencia disponible sobre el tratamiento del DR en pacientes con DHR es principalmente indirecta y traspuesta del tratamiento convencional de los desprendimientos de retina en la población general, al no haberse encontrado estudios de alta calidad realizados con estos pacientes. | |
| Muy baja | El tratamiento quirúrgico de los DR parece que puede tener una buena respuesta en pacientes con vitreorretinopatía exudativa familiar.480,489-492 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: Por un lado, no se han identificado estudios de alta calidad metodológica en pacientes con DHR y, por otro, la mayor parte de la evidencia empleada para dar respuesta a esta pregunta clínica es indirecta al tratarse de estudios realizados en población general, lo que ha influido en el tipo de recomendaciones.
- Balance entre beneficios y riesgos: El DR no mejora sin tratamiento. Por otro lado, sin un tratamiento rápido, DR puede conducir a la pérdida permanente de la visión. Además, la mayor parte de los desprendimientos de retina se pueden curar, la mayoría en una sola operación, pero algunos requieren varias intervenciones. Los resultados dependen de cada técnica escogida, del tipo de desprendimiento, del tiempo de evolución y de los factores de riesgo. En general parece que el tratamiento quirúrgico de los DR en pacientes con vitreorretinopatía exudativa familiar puede ser una buena respuesta al tratamiento.
Al igual que en la población general, la elección de la técnica quirúrgica en pacientes con DHR estará basada en las características del paciente y del propio DR así como de la experiencia del cirujano con las distintas técnicas quirúrgicas. Se debe tener en cuenta si el paciente es fáquico, afáquico o pseudofáquico y si se trata de un DR complejo o no complejo, dependiendo de la presencia de signos de vitreorretinopatía proliferativa mayor o menor de grado B493.
Las dos técnicas quirúrgicas más frecuentemente utilizadas son la cirugía escleral y la vitrectomía vía pars plana.494
En este último caso, la tendencia en los últimos años es utilizar, si la complejidad del caso lo permite, técnicas de microincisión con instrumental de 23 y 25 gauges frente a los 20 gauges, que era el calibre más utilizado en años anteriores.495-498 Los datos sobre la técnica de microincisión con instrumental de 25 gauges apuntan a que es una técnica que no presenta complicaciones, con un alto porcentaje de éxito de reinserción con una sola cirugía (92,9%- 95,45)496,498 y del 100% en las reintervenciones,496,498 acompañado de un aumento de la AV en el 86% de ojos.496 Datos similares se han observado en la técnica de microincisión con instrumental de 23 gauges, con una tasa de éxito anatómico primario del 91,7%, mejoras en la AV y pocas o ninguna complicación.495
La pneumorretinopexia se reserva para casos seleccionados en pacientes fáquicos, sin opacidad de medios, con roturas localizadas en las ocho horas superiores y sin presencia de vitreorretinopatía proliferativa.499 Y es que comparado con los ojos fáquicos sometidos a pneumorretinopexia, los afáquicos experimentan mayores tasas de vitreorretinopatía proliferativa (P=0,05) y peor AV final (P=0,01).
Evidencia indirecta de mejor calidad metodológica, proveniente de estudios realizados sobre el tratamiento del DR en población general, muestran que la cirugía escleral se considera la técnica de referencia en el DR primario en pacientes fáquicos, aunque los estudios publicados hacen referencia a la población general.500,501
La cirugía escleral mejora la mejor AV corregida frente a la vitrectomía vía pars plana (P=0,0005) en pacientes fáquicos.501 En estos mismos pacientes la progresión de cataratas fue mayor en el grupo de vitrectomía vía pars plana (P=0,00005).501 Además, la mayor parte de estos pacientes no requieren intervención a muy largo plazo.500
Otros estudios que muestran la superioridad de las técnicas de vitrectomía vía pars plana sobre la cirugía escleral en el tratamiento del DR primario no complejo en pacientes pseudofáquicos.502-504 Probablemente debido a las dificultades en la visualización de las roturas retinianas en pacientes pseudofáquicos muchos cirujanos están utilizando la vitrectomía vía pars plana, combinada o no con la cirugía escleral, en la reparación quirúrgica de DR en pacientes pseudofáquicos.504
Pero además, los estudios muestran cómo las técnicas de vitrectomía vía pars plana y los métodos combinados (vitrectomía vía pars plana y cirugía escleral) dan lugar a mayores tasas de reinserción iniciales (OR=18,13; IC95%: 1,07-2,68 y OR=3,54; IC95%: 1,57-7,97, respectivamente) en comparación con la cirugía escleral. Asimismo, la probabilidad de mejoría visual fue mayor después de las técnicas de vitrectomía vía pars plana (OR=2,34; IC95%: 1,58-3,46) o con los métodos combinados (OR=11,52; IC95%: 4,42-30,04) en comparación con la cirugía escleral.502 Además, la media de tiempo operatorio fue menor en las técnicas de vitrectomía vía pars plana (P=0,0001).503
En los casos de DR complejo, es decir, pacientes con vitreorretinopatía proliferativa de grado C o superior, la técnica de elección es la vitrectomía vía pars plana, asociando un procedimiento escleral circunferencial y la utilización de un agente taponador de larga duración (perfluoropropano frente a los gases oftálmicos de menor duración como el hexafluoruro de azufre), dada su superioridad en términos de AV (P=0,05) y la mejor reaplicación macular (P=0,05) que se obtiene con esta aproximación quirúrgica.505 Estos casos suponen menos del 5% del total de DR en la población general,506 no existiendo datos concretos en los pacientes con DHR.
En la población general, la vitrectomía vía pars plana asociada o no a un procedimiento circunferencial es la técnica de elección en los casos de DR secundarios a un desgarro gigante.507 - Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
El grupo elaborador formuló las siguientes recomendaciones de buenas prácticas considerando las opciones que podrían ayudar al manejo del DR en las DHR.
Recomendaciones
| √ | Se sugiere realizar cirugía escleral en el desprendimiento de retina primario en pacientes fáquicos. |
| √ | Se sugiere realizar vitrectomía vía pars plana en el tratamiento del desprendimiento de retina primario no complejo en pacientes pseudofáquicos. |
| √ | Se sugiere realizar vitrectomía vía pars plana asociando un procedimiento escleral circunferencial y la utilización de un agente taponador de larga duración en el tratamiento del desprendimiento de retina complejo, es decir pacientes con vitreorretinopatía proliferativa de grado C o superior, o también aquellos pacientes con retinosquisis o con hemorragia vítrea asociada. Considerarlo también en pacientes en edad pediátrica por su mayor riesgo de desarrollar vitreorretinopatía proliferativa. |
- ¿Cómo se debe tratar el edema macular asociado a una DHR?
11.3.1. Tratamiento farmacológico
11.3.1.1. Inhibidores de la anhidrasa carbónica
Retinosis pigmentaria
Acetazolamida
A partir de los prometedores resultados obtenidos en el estudio de Cox y colaboradores en 1988, en el que cuatro de seis pacientes con RP y edema macular crónico tratados con acetazolamida mejoraron,508 se llevaron a cabo una serie de estudios sobre la acetazolamida como posible terapia para esta complicación de la RP.
Se identificaron una serie de tres ECA,509-511 dos de ellos tienen diseño cruzado con la misma dosis de fármaco (500 mg/día) controlados por placebo, uno con periodo de lavado,509 el otro sin éste,510 y ambos con tamaños de muestra muy pequeños. En un tercer ECA, se asignó a los pacientes a recibir dosis inferiores de acetazolamida (125 ó 250 mg) durante un periodo de tiempo más largo (4-12 meses).511 Adicionalmente, se identificaron seis estudios observacionales que evaluaron el efecto terapéutico de la acetazolamida en el edema macular de pacientes con RP,508,512-514 USH,515 XLRS515 y distrofia macular cistoidea dominante.516
Agudeza visual
Se observó una gran variabilidad entre los estudios. Entre el 30% y el 83% de los pacientes incluidos mejoraron la AV medida a través de la escala ETDRS, así como en la sensación subjetiva durante el tratamiento con acetazolamida.509,510 Estas mejoras se mantuvieron con una dosis mínima eficaz en el tratamiento a largo plazo (125-250 mg).511
Calidad
baja
De manera similar, en los estudios observacionales, salvo en uno en el que no se observó respuesta,512 parte de la muestra de pacientes con RP (entre un 50 y un 67%) mostraron una clara respuesta al tratamiento, acompañada de ganancias en la AV508,513,514 y mejoras en la visión subjetiva.508,513 Una vez obtenidas las mejoras, se mantuvieron incluso con dosis mínimas de mantenimiento (125 mg).513 Sin embargo, en pacientes con distrofia macular cistoidea dominante, la AV tan solo mejoró ligeramente en aquellos pacientes con una AV más deteriorada (0,1), frente a aquellos con un deterioro en la AV menor (0,4) que no mostraron ningún cambio a lo largo de tratamiento. La mejora observada en parte de la muestra, además, podría ser atribuible a las fluctuaciones intraindividuales y la ausencia de respuesta al tratamiento podría estar justificada, dado que la distrofia macular cistoidea dominante se trata de una enfermedad vascular primaria.516
Calidad
muy baja
Edema macular-grosor macular
Entre el 43% y el 50% de los pacientes con RP y edema macular tratados con 500 mg de acetazolamida mostraron una mejoría angiográfica del edema macular.509,510 Parece que los casos con mayor engrosamiento de la mácula mostraron una mejoría marcada en al menos un ojo tras el tratamiento con acetazolamida (se produjo una reducción >31% en el grosor en OCT), frente a los casos con menor engrosamiento que obtuvieron una respuesta mínima o inexistente al tratamiento.511
Calidad
baja
Los resultados en los estudios observacionales incluidos fueron heterogéneos. Mientras que algunos estudios muestran tasas de respuestas elevadas,508,512,514 otros obtuvieron una respuesta nula al tratamiento.513,514 El uso prolongado se asoció a una tasa de recurrencia del edema elevada (en torno 50% de los pacientes).512 Tras la aparición de recurrencias en el edema macular, se observó que se puede volver a obtener una respuesta favorable tras interrumpir el tratamiento durante un periodo entre uno y seis meses.515
muy baja
Seguridad
El efecto adverso más frecuente durante el tratamiento con acetazolamida fue parestesia en manos y pies, que se presentó entre el 67-89% de los casos,509,510 seguida de pérdida/alteración del gusto (22-25%)509,510, mareo (22%),509 náuseas (8-22%),509,510 fatiga (8-22%),509,510 depresión (16%)510 y anorexia (8%).510
Calidad
baja
Metazolamida
Se identificaron dos ECA informados en tres publicaciones que trataban del efecto de la metazolamida en el edema macular de pacientes con RP.517-519
Fishman et al. (n=17) evaluaron la eficacia de la metazolamida (2×50 mg/día) para mejorar el edema macular y la AV, tanto objetiva como subjetiva, en personas afectadas de RP.517,518 En una etapa posterior del estudio, los pacientes que mejoraron continuaron el tratamiento con la mitad de la dosis (2x25mg/día) durante tres semanas más para estudiar si, a esta dosis más baja, los efectos beneficiosos se conservaban. A aquellos participantes que mostraron una mejoría de la AV y/o el edema macular se les incluyó en un periodo adicional más extenso de tres meses de tratamiento (2×50 ó 2×25 mg/día, según la dosis que se tolerara), con el objetivo de observar si se mantenía o aumentaba la mejora.
Shahidi et al. evaluaron el efecto terapéutico de la metazolamida (sin informar la dosis) en seis pacientes afectos de RP con edema macular.519
Hay que tener en cuenta que en España no está comercializados medicamentos con este principio activo.
Agudeza visual
La AV mejoró de forma moderada (ganancia de 10-15 letras) en al menos un ojo en el 17,6% de los pacientes, mientras que en el resto solo se observaron mejorías leves (17,6% ganaron entre cinco y 10 letras en al menos un ojo), estabilización (el 53% ganó o perdió menos de cinco letras) o incluso empeoramiento (perdieron más de cinco letras en al menos un ojo el 11,8%).517
En cuanto a la función visual auto-percibida, aproximadamente la mitad de los pacientes indicaron que mejoraban tanto con metazolamida como con placebo, mientras que solamente un paciente (6%) expresó mejoría (leve) con metazolamida, pero no con placebo, mientras que otro decía haber mejorado con placebo pero no con metazolamida.517
El uso de la mitad de la dosis de metazolamida (25 mg x 2 al día) no aportó ventaja alguna. El tratamiento continuado con metazolamida (50 mg x 2 al día) tras la obtención de mejoras no condujo a ningún efecto beneficioso adicional sobre la AV.518
Calidad
moderada
Edema macular-grosor macular
Aproximadamente el 53% de los pacientes con metazolamida mostraron mejoría angiográfica del edema macular en comparación al examen basal, frente a ningún paciente en el periodo placebo. Además, parece que los pacientes que mostraban mayor grado de difusión en la angiografía eran los que tenían mayor grosor macular.519
De los pacientes que obtuvieron mejoras angiográficas tras el tratamiento con metazolamida, el 20-50% no obtuvieron una mejora de la AV.517,519 Es posible que la medida del grosor foveal medido con retinal thickness analyzer correlacione mejor con la AV (r=0,81).519
En cualquier caso, la prolongación del tratamiento durante tres semanas no se asoció a mejoría.517 En la misma línea, la extensión del tratamiento durante tres meses no condujo a ningún efecto beneficioso adicional sobre la AV y, en algún caso, se observó una recidiva parcial en cuanto a la extensión del edema macular.518
Seguridad
Entre los efectos adversos observados durante el tratamiento con metazolamida se encuentran las parestesias (71%), la debilidad (47%) y la alteración del gusto (29%).517
Calidad
baja
Dorzolamida
Se incluyeron seis estudios que evaluaban el efecto de un inhibidor de anhidrasa carbónica formulado para ser administrado por vía tópica, la dorzolamida (un medicamento utilizado como solución oftálmica para el tratamiento del glaucoma y de la hipertensión ocular), en pacientes con RP con edema macular cistoide.
Uno de los estudios es un ECA cruzado en tres fases con un tamaño muestral muy pequeño (n=6) en el que se aplicaba dorzolamida (al 2% tres veces al día) o placebo. En la segunda fase del ensayo, tras un nuevo periodo de lavado de cuatro semanas, todos los participantes recibieron dorzolamida al 2% cinco veces al día. En la tercera y última fase, tras un nuevo periodo de lavado de cuatro semanas, recibieron acetazolamida oral (500 mg/día) durante dos semanas.520
Los otros cinco son estudios observacionales sin grupo control con tamaños de muestra también muy pequeños. En el primero, informado en dos publicaciones,521,522 se incluyeron 16 ojos de 10 pacientes con RP y edema macular cistoide secundario que fueron tratados con dorzolamida tópica al 1% tres veces al día durante seis meses. En el segundo,523 27 ojos de 15 participantes afectos de RP con edema macular cistoide fueron tratados con dorzolamida tópica al 2% tres veces al día durante cuatro semanas tras las cuales, sólo aquellos pacientes que mejoraron por más de un 11% el grosor macular central por OCT continuaron el tratamiento durante 4-8 semanas más.523 Un tercer estudio, en el que se evaluó el efecto del tratamiento prolongado con dorzolamida en una serie de ocho casos constituida por pacientes que ya habían participado en el estudio anterior,523 con un periodo de tratamiento que varió entre siete siete y 15 meses.524 En el cuarto estudio, de diseño retrospectivo, se observaron 64 ojos de 32 pacientes afectos de RP (26 pacientes; 81,2%) y USH1 (3 pacientes; 9,4%) y USH2 (3 pacientes; 9,4%) con quistes maculares a los que se les trató con dorzolamida al 2% tres veces al día en los dos ojos.525 Por último, en el quinto estudio, se presentó a tres pacientes con RP a los que se siguió durante seis meses. En dos de ellos se usó acetazolamida oral en primera instancia pero se tuvo que reemplazar por la aparición de efectos adversos (cólico renal, parestesias, astenia), por dorzolamida al 2% tres veces al día. El tercer paciente presentaba una historia de cálculos renales por lo que emplearon dorzolamida desde el inicio.526
Agudeza visual
No se obtuvieron mejoras de la AV con el tratamiento de dorzolamida tópica en ningún paciente, en comparación con los valores basales y con el periodo de placebo.520
Calidad
baja
Los estudios observacionales van en la misma línea, no se observaron prácticamente mejoras en la AV tras el tratamiento con dorzolamida al 1- 2%.526 En el mejor de los casos, se observó una mejora (>5 letras) en el 20% de los ojos expuestos al tratamiento.521,523 El tratamiento prolongado obtuvo resultados heterogéneos, mientras que, en algunos casos no se obtuvo ninguna mejora,522 en otros más del 37% de los casos mostraron una mejoría clínicamente significativa (≥7 letras), que se mantuvo durante 7-15 meses de seguimiento.524,525
Calidad
muy baja
Edema macular-grosor macular
Un alto porcentaje de pacientes tratados con dorzolamida (más del 80%) mostró una mejora en el OCT en al menos un ojo.521,523 Tras el tratamiento a largo plazo (> 6 meses), el engrosamiento macular central medido con OCT mostró una mejoría (casi total resolución del edema macular cistoide o una reducción de al menos el 20%) en el 77,8-100% de los pacientes.522,526 Sin embargo, tras cuatro semanas de tratamiento, en torno al 30% de los pacientes que habían respondido inicialmente al tratamiento mostraron un empeoramiento (aumento del espesor retiniano) es decir, una recaída.523,525
Calidad
muy baja
Campo visual – Sensibilidad al contraste
El 87,5% de los pacientes tratados con dorzolamida al 1% tres veces al día durante seis meses presentó una mejoría de la sensibilidad macular superior a un dB en los 12 puntos centrales, con una media de mejora de 1,6±2,8 dB (P<0,05). En particular, esta mejoría se vio especialmente marcada (2,9±3,0 dB) en los pacientes en los que el tratamiento había resuelto su edema macular (50%).521
Calidad
muy baja
Dado que, en general, la dorzolamida consiguió mejorías anatómicas pero no funcionales, no parece lógico tratar el edema macular cistoide en todos los pacientes con RP sino sólo aquellos con más posibilidades de mejorar (sin recaídas posteriores), que parecen ser los pacientes más jóvenes (16-33 años).527 Es posible que tratar la enfermedad en estadios precoces mejore la eficacia en términos de AV. El tratamiento con dorzolamida en días alternos podría disminuir la incidencia de recurrencias y, por tanto, ser más eficaz en pacientes mayores.528
Calidad
muy baja
Efectos adversos
Los efectos adversos más frecuentes derivados del tratamiento con dorzolamida fueron escozor ocular con la instilación (100%),523 visión borrosa (60%),520 sequedad ocular (60%),520 sabor amargo (60%),520 lagrimeo (40%),520 cefalea (20%),520 sed (20%),520, gusto metálico(20%),523, cansancio (0-7%),520,523 y dolor de cabeza (20%).520 Sin embargo, no se constataron efectos secundarios graves.521
Calidad
muy baja
La instilación del colirio, cerrar los ojos y presionar con la yema de los dedos el canto interno, ocluyendo así los puntos lagrimales durante unos minutos reduce significativamente la absorción sistémica de los colirios y los posibles efectos secundarios generales.529,530
Calidad
muy baja
Otras distrofias hereditarias
Para la XLRS se identificaron varios estudios que evaluaron la efectividad de los inhibidores de anhidrasa carbónica tanto oral531 como tópica.49,515,532-534
Dos de los artículos corresponden a la publicación de casos aislados. El primero, un niño de ocho años con quistes maculares asociados a XLRS tratado con acetazolamida oral 62,5 mg tres veces al día durante dos meses para subirla luego a 250 mg/día durante nueve meses. Con ello se normalizó tanto la anatomía macular como la AV. Tras discontinuar el tratamiento (2,5 meses) el niño hizo una recaída del cuadro que consiguió revertirse de nuevo al reinstaurar el tratamiento con acetazolamida.531 En el segundo caso, se informa de un paciente que tras haber respondido (mejorando su OCT > 17,1%) al uso de dorzolamida tópica al 2% tres veces al día durante dos años y cuatro meses sufrió una recaída. Se interrumpió el tratamiento durante tres meses reinstaurándose más tarde, consiguiéndose de nuevo una respuesta favorable.515
Apushkin et al.532 trataron con dorzolamida tópica al 2% a ocho pacientes con XLRS y quistes foveales. Siete pacientes tuvieron una reducción notable del grosor macular central (>17%) en al menos un ojo (11 ojos de 16) tras un mes de tratamiento. De los siete pacientes en los que mejoró el OCT, cinco mejoraron también su AV (≥7 letras en al menos un ojo).
Walia et al. en 200949 analizaron de manera retrospectiva 13 ojos de siete pacientes afectos de XLRS tratados con dorzolamida tópica. Se obtuvo una reducción del grosor macular central en 85,7% de los pacientes (3 del primer grupo, los dos del segundo y el paciente del tercero). Los autores concluyen que la respuesta a la dorzolamida de los quistes maculares en pacientes con XLRS es independiente del mecanismo responsable de la disfunción de la proteína retinosquisina.
Calidad
muy baja
Khandhadia et al. en 2011534 analizan retrospectivamente a cuatro pacientes (7 ojos) afectos de XLRS que habían sido tratados con dorzolamida tópica con un seguimiento medio de 21,7±7,7 meses. Encontraron una mejoría significativa del grosor macular central pero no de la AV que continuó empeorando de forma significativa (logMAR: 0,38±0,25 a 0,31±0,24; P<0,05). La información genotípica no predijo la respuesta al tratamiento, ya que no había asociación aparente entre el tipo de mutación y la respuesta a la dorzolamida tópica.
Genead et al. en 2012533 valoraron la eficacia del mismo tratamiento (dorzolamida 2% tópica tres veces al día) en dos pacientes con coroideremia y edema macular quístico observando una notable reducción en el grosor macular central (>11%) en el OCT de dominio espectral tras dos meses de tratamiento, que fue aún mayor tras cinco meses de tratamiento. Ambos pacientes mejoraron al menos cinco letras su AV (ETDRS) en al menos un ojo (3 ojos) mientras que no apreciaron mejorías en la sensibilidad al contraste ni en la microperimetría.
Calidad
muy baja
11.3.1.2. Corticoides
Corticoides orales
Se identificó un estudio piloto con 10 pacientes con RP y edema macular cistoide a los que trataron con el glucocorticoide sintético de tercera generación deflazacort (30 mg/día).535
Agudeza visual
El tratamiento con deflazacort durante un año mejoró la visión de cerca (línea base: 32±12cp; seguimiento: 8±2cp, P<0,01) y la AV lejana, aunque ésta de forma menos pronunciada (0,6±1,8 a 0,7±2,4; P<0,05).535
Calidad
muy baja
Edema macular-grosor macular
Se observó una mejoría angiográfica del edema con menor difusión macular. Este hallazgo fue particularmente evidente tras cuatro meses del inicio de la terapia. Posteriormente se produjo una ligera recaída del edema macular que persistió a lo largo de todo el periodo de seguimiento.535
En el OCT, el grosor macular central pasó de 380±89 micras a 268±50 micras a los 12 meses.535
Calidad
muy baja
Campo visual – Sensibilidad al contraste
El CV central (10º) mostró una mejoría significativa tanto de la sensibilidad media, el defecto medio, como de la fluctuación corta (P<0,01), especialmente tras cuatro meses del inicio de la terapia.535
Calidad
muy baja
Seguridad
No se registró ningún efecto secundario ocular o sistémico al tratamiento.535
Calidad
muy baja
Triamcinolona intravítrea
Se identificaron tres estudios observacionales. El primer estudio incluyó a cinco pacientes (n=5 ojos) con edema macular cistoide (confirmado por AFG y OCT) secundario a RP resistente al tratamiento con 250 mg acetazolamida oral dos veces al día durante un mes y a los que se les inyectó 4 mg (0,1 ml) de triamcinolona.536 El segundo estudio examinó el efecto de la inyección intravítrea en 20 ojos de 20 pacientes con edema macular cistoide secundario a la RP en comparación con un grupo control con el mismo número de ojos y pacientes con la misma afección, que rechazaron el tratamiento.537 Finalmente, un último estudio analizó retrospectivamente una muestra de 18 pacientes con edema macular difuso crónico secundario a distintas patologías (7 diabetes, cuatro Síndrome de Irvine-Gass, cinco oclusiones venosas y dos RP) tratados con triamcinolona intravítrea.538
Agudeza visual
La AV mejoró en el 40-60% los pacientes tratados con triamcinolona intravítrea536,538, sin embargo, esas mejorías no se mantuvieron a medio plazo (3-6 meses).536,537
Calidad
muy baja
Edema macular-grosor macular
El grosor macular central se redujo de forma significativa (se produjo un cambio en torno al 54-58%),536,538 sin embargo, este efecto desapareció a los 12 meses.536
Seguridad
Dado que los estudios sobre el uso de la triamcinolona intravítrea en distrofias retinianas son tan limitados, los datos de seguridad de que se disponen son prácticamente inexistentes. Las complicaciones descritas con el uso de la triamcinolona intravítrea (glaucoma, cataratas, DR y endoftalmitis) y los problemas legales que pueden derivarse de su uso hacen que, en la actualidad, se use de forma muy restrictiva.539-547
Calidad
muy baja
Implante de dexametasona intravítrea
Se identificó una serie de tres pacientes (4 ojos) afectos de RP con edema macular cistoide refractario a los tratamientos habituales (inhibidores de la anhidrasa carbónica, antiinflamatorios no esteroideos tópicos, triamcinolona subtenoniana) que fueron tratados con implante intravítreo de 0,7 mg de dexametasona, con un seguimiento posterior de seis meses.548
Agudeza visual
La AV basal mejoró ligeramente de 20/160 a 20/100 al mes y a 20/125, tanto al tercer, como al sexto mes.548
Calidad
muy baja
Edema macular-grosor macular
Se constató una reducción del grosor macular central en todos los casos, que tras tres meses recidivó en dos de los tres pacientes. En concreto, el grosor macular central medio disminuyó de 443±185 micras en línea base, a 234±68 micras al mes, 332±177 micras a los tres meses y 305±124 micras a los seis meses, lo que supone en este caso una reducción notable.548
Calidad
muy baja
11.3.1.3. Fármacos antiangiogénicos
Bevacizumab
Se identificaron dos estudios para el tratamiento con bevacizumab en personas con RP y edema macular cistoideo, uno inicial con tan solo dos pacientes y uno posterior con siete pacientes (13 ojos).549,550
Agudeza visual
Aunque en el estudio inicial no se observó mejoría en ninguno de los dos pacientes,550 el estudio posterior asoció el tratamiento a una mejoría de la AV que osciló en unos rangos de 5/400–20/100 pre-tratamiento y 20/200–20/63 post-tratamiento.549
Calidad
muy baja
Edema macular-grosor macular
En el estudio inicial, el tratamiento con bevacizumab no asoció una mejoría anatómica29, sin embargo, en el estudio posterior, tras un número medio de inyecciones de 3,3 (rango 1-8), con un periodo medio de reinyección de ochos semanas, se consiguió una disminución del grosor macular central de 370,15 micras (basal) a 142,53 micras, lo que supone una mejoría notable.549
Seguridad
No se observaron efectos secundarios sistémicos ni oculares atribuibles al fármaco.549
Calidad
muy baja
Ranibizumab
Se identificó un estudio observacional que evaluó los efectos de una inyección intravítrea de ranibizumab en 30 ojos de 30 personas afectas de RP con edema macular cistoide resistente al tratamiento con acetazolamida, que fueron divididos en dos grupos de características similares: el de tratamiento, a los que se les inyectó 0,5 mg de ranibizumab intravítreo, y el control.551
Agudeza visual
La AV mejoró a los seis meses tras la inyección (nueve de los 15 ojos mostraron una mejoría mientras que los otros seis permanecieron estables, línea base: 0,72 ± 0,22, seguimiento 0,69 ± 18), pero sin diferencias significativas con el grupo control (línea base: 0,70 ± 0,20, seguimiento 0,72 ± 0,25).551
Calidad
muy baja
Edema macular-grosor macular
Trece de los 15 ojos (86,6%) tratados mostraron una resolución significativa del edema macular sin recaída o complicación a los seis meses de la inyección, frente a ninguno en el grupo control. El espesor macular central, evaluado mediante OCT, disminuyó a partir del primer mes (línea base: 478 ± 88 µm, seguimiento: 272 ± 65 µm) y se mantuvo hasta los seis meses en el grupo ranibizumab, con diferencias significativas con el grupo control (P<0,001 en los tres exámenes), donde no se modificó el espesor macular (línea base: 480 ± 92 µm, seguimiento: 469 ± 75 µm).551
Calidad
muy baja
Seguridad
No se aporta información de los posibles eventos adversos asociados al tratamiento.551
Calidad
muy baja
11.3.1.4. Laserterapia
Se identificó un estudio en la era previa a la OCT en el que 16 pacientes con RP y edema macular demostrable por angiofluoresceingrafía fueron sometidos a fotocoagulación macular en rejilla en el ojo con peor AV.552
Agudeza visual
Seis de los 16 ojos tratados (37,5%) ganaron al menos cinco letras de visión del ETDRS, mientras que no lo hizo ninguno de los no tratados.552 Siete de los ojos no tratados (43,75%) perdieron al menos cinco letras de visión mientras que no lo hizo ninguno de los tratados.552
Percepción del color
En cinco de los seis ojos que mejoraron la AV, también mejoró la percepción del color.552
Calidad
muy baja
Edema macular-grosor macular
En 13 de los 16 ojos (82,25%) disminuyó la difusión en la AFG.552
Calidad
muy baja
Seguridad
No informaron efectos secundarios atribuibles al tratamiento, salvo las molestias transitorias habituales en el láser.552 No obstante hay que tener en cuenta que este estudio es de 1987, cuando aún no se habían desarrollado otras terapias alternativas como los antiangiogénicos o los implantes de dexametasona, y teniendo en cuenta que el láser deja siempre lesiones irreversibles en el área macular con tendencia a aumentar de tamaño a lo largo del tiempo, este tratamiento quizás no deba considerarse totalmente exento de complicaciones.
Calidad
muy baja
11.3.2. Tratamiento quirúrgico
En relación con el tratamiento quirúrgico del edema macular, se identificó una serie de 12 ojos con RP y edema macular refractario al tratamiento médico que provocaba una disminución de la AV, a los que se les realizó una vitrectomía vía pars plana con hialoidectomía y disección de la membrana limitante interna tras tinción con verde de indocianina y taponamiento posterior con gas.553
Agudeza visual
La AV preoperatoria tuvo un rango entre 20/60 y 20/400 (media de 20/115). Tras la cirugía, mejoró a 20/45 (mejorando de media 15 letras) (P<0,05).553
Calidad
muy baja
Edema macular-grosor macular
El grosor macular central fue de 477 micras. Tras la cirugía, el OCT disminuyó a 260 micras de media (el 83,3% de los ojos disminuyó al menos un 40%). Además, en nueve de los 12 pacientes (75%) se constató una mejoría angiográfica del edema.553
Calidad
muy baja
Seguridad
No se observaron complicaciones postoperatorias importantes.553
Calidad
muy baja
Resumen de la evidencia
| Inhibidores de la anhidrasa carbónica | |
|
Acetazolamida
|
|
| Calidad baja |
En el tratamiento del edema macular asociado a RP, la acetazolamida (500 mg/día) presenta resultados funcionales positivos pero modestos (mejora la AV).509,510 Estas mejorías se mantienen con una dosis mínima eficaz (125-250 mg/día) a largo plazo.511 |
| Calidad baja |
El tratamiento del edema macular asociado a RP con acetazolamida (500 mg/día) es eficaz anatómicamente (reduce el grosor macular central (OCT) y disminuye la difusión angiográfica del edema).509,510 Estas mejorías se mantienen con una dosis mínima eficaz (125-250 mg/día) a largo plazo.511 |
| Calidad baja |
Parece que los casos con mayor engrosamiento de la mácula son los que muestran una mejor respuesta en OCT al tratamiento con acetazolamida.511 |
| Calidad muy baja |
Tras la aparición de recurrencias en el edema macular, se puede volver a obtener una respuesta favorable al tratamiento, tras interrumpirlo durante un periodo entre uno y seis meses.515 |
| Calidad muy baja |
Los pacientes con distrofia macular cistoidea dominante no parecen mostrar respuesta al tratamiento con acetazolamida.516 |
| Calidad baja |
Durante el tratamiento del edema macular asociado a RP con acetazolamida pueden aparecer los siguientes efectos secundarios: parestesia en manos y pies,509,510 pérdida/alteración del gusto,509,510 mareo,509 náuseas,509,510 fatiga,509,510 depresión510 y anorexia.510 |
| La acetazolamida por vía oral a una dosis de 500 mg/día puede ser útil en el tratamiento del edema macular cistoide asociado a la RP, sin embargo, aún no se dispone de evidencia suficiente para determinar su efectividad y hay indicios de que se pueda producir rebote al suspender el tratamiento por lo que puede ser necesario mantenerlo a largo plazo. Sin embargo, los efectos secundarios son comunes, limitando el período durante el cual el paciente tolera el medicamento. | |
|
Metazolamida
|
|
| Calidad moderada |
Muy pocos pacientes con RP presentan mejoras funcionales con metazolamida (2×50 mg/día) y en la mayor parte de los casos, estas mejoras son muy modestas.517 |
| Calidad moderada |
La mitad de los pacientes con RP tratados con metazolamida presentan una mejoría angiográfica del edema macular. Los pacientes que muestran mayor grado de difusión en la angiografía son aquellos que presentan mayor grosor macular.519 |
| Calidad moderada |
El tratamiento con metazolamida prolongado no presenta ningún efecto beneficioso adicional (anatómico ni funcional).518 |
|
Dorzolamida
|
|
| Calidad baja |
Con el uso de la dorzolamida tópica (1-2% instilada 3-5 veces al día) en pacientes con RP con edema macular cistoide se obtienen escasas o inexistentes mejoras en la AV.520 |
| Calidad muy baja |
Un alto porcentaje de los pacientes con RP con edema macular cistoide tratados con dorzolamida tópica presenta una mejoría del edema macular en OCT,521,523 así como de la sensibilidad y defecto del CV,521 especialmente en el tratamiento a medio /largo plazo (seis meses).522,526 |
| Calidad muy baja |
Casi un tercio de los pacientes con RP con edema macular cistoide que responden al tratamiento presenta una recaída a corto plazo.523,525 |
| Calidad muy baja |
Durante el tratamiento del edema macular asociado a RP con dorzolamida tópica pueden aparecer los siguientes efectos secundarios: escozor ocular con la instilación,523 visión borrosa,520 sequedad ocular,520 sabor amargo,520 lagrimeo,520 cefalea,520 sed,520 gusto metálico,523 cansancio520,523 y dolor de cabeza.520 |
| Calidad muy baja |
No parece lógico tratar el edema macular cistoide en todos los pacientes con RP sino sólo aquellos con más posibilidades de mejorar (sin recaídas posteriores), que parecen ser los pacientes más jóvenes.527 |
| Calidad muy baja |
Tras la instilación del colirio, cerrar los ojos y presionar con la yema de los dedos el canto interno, ocluyendo así los puntos lagrimales durante unos minutos reduce significativamente la absorción sistémica de los colirios y los posibles efectos secundarios generales.529,530 El tratamiento con dorzolamida en días alternos podría disminuir la incidencia de recurrencias y, por tanto, ser más eficaz en pacientes mayores.528 |
| Calidad muy baja |
En pacientes con edema macular en pacientes con XLRS el uso de la dorzolamida tópica podría reducir el grosor macular central en un porcentaje significativo de casos con resultados menos predecibles en cuanto a la AV.49,532,534 |
| La acetazolamida parece ser más eficaz que la dorzolamida en el manejo del EM asociado a RP. | |
| Corticoides | |
|
Corticoides orales: deflazacort
|
|
| Calidad muy baja |
El tratamiento con deflazacort (30 mg/día) durante un año mejora la AV de forma modesta y se asocia a una mejoría del edema macular en OCT, así como de la sensibilidad y defecto del CV tras cuatro meses del inicio de la terapia.535 |
|
Triamcinolona intravítrea
|
|
| Calidad muy baja |
El tratamiento con triamcinolona intravítrea parece ser eficaz mejorando la visión en el 40-60% de los pacientes inicialmente, pero su efecto no se mantiene más allá de 3-6 meses24-26 y hay un riesgo incrementado de cataratas, glaucoma y endoftalmitis.536-538,554 |
|
Implante de dexametasona intravítrea
|
|
| Calidad muy baja |
Pacientes afectos de RP con edema macular cistoide refractario a los tratamientos habituales con un implante intravítreo de dexametasona presentan una ligera mejoría funcional y una reducción a del grosor macular, que recidiva tras 3-6 meses en un alto porcentaje de los pacientes por lo que sería necesario retratar cada 3-6 meses.548 |
| Fármacos antiangiogénicos | |
|
Bevacizumab
|
|
| Calidad muy baja |
Los resultados funcionales y anatómicos derivados del tratamiento del edema macular en pacientes con RP son por el momento heterogéneos549,550 aunque parece que puede tener algún efecto beneficioso en pacientes refractarios a otros tratamientos.549 |
|
Ranibizumab
|
|
| Calidad muy baja |
El tratamiento con ranibizumab muestra resultados anatómicos positivos que no se correlacionan con un grado similar de mejoría funcional ya que ésta es muy modesta.551 |
| Laserterapia | |
| Calidad muy baja |
La mayor parte de los de los pacientes con RP y edema macular sometidos a fotocoagulación macular en rejilla muestran una disminución del edema, mientras que aproximadamente un tercio presentan mejoras modestas en la AV y la percepción del color.552 Sin embargo, el perfil de seguridad del láser no es bueno, pues deja lesiones permanentes en el área macular de estos pacientes |
| Tratamiento quirúrgico | |
| Calidad muy baja |
La vitrectomía vía pars plana con hialoidectomía y disección de la membrana limitante interna tras tinción con verde de indocianina y taponamiento posterior con gas puede mejorar la AV, el grosor de la mácula y la angiografía. |
| Otros tratamientos ensayados como son el deflazacort, la dexametasona, bevacizumab ranibizumab, la laserterapia han mostrado algún efecto beneficioso en alguna medida de resultado, sin embargo, las pruebas científicas de efectividad y seguridad son muy limitadas y el tamaño muestral de los estudios demasiado reducido como para hacer recomendaciones terapéuticas concluyentes. | |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia:
Acetazolamida: La evidencia deriva de cinco series de casos y tres pequeños ECA con pequeño tamaño muestral con ciertos riesgos de sesgo e inconsistencia entre los resultados. La calidad de la evidencia global fue considerada baja.
Metazolamida: La evidencia deriva de dos pequeños ECA de diseño cruzado controlados por placebo (n=17 y n=6) que evaluaron la eficacia de la metazolamida para mejorar el edema macular en personas afectadas de RP. La calidad de la evidencia global fue considerada moderada.
Dorzolamida: Se incluyeron seis estudios, un ECA cruzado en tres fases con un tamaño de muestra muy pequeño (n=6) y cinco estudios observacionales sin grupo control con tamaños de muestra también muy pequeños, que evaluaban el efecto de la forma tópica de la dorzolamida en pacientes con RP con edema macular cistoide. En relación a otras distrofias, la evidencia deriva de un caso de XLRS tratado con dorzolamida tras una recaída, un estudio prospectivo con ocho pacientes con XLRS, dos estudios retrospectivos con siete y cuatro pacientes afectos de XLRS y un último estudio con dos pacientes con coroideremia. La calidad de la evidencia global fue considerada muy baja.
Triamcinolona intravítrea: En relación al tratamiento con triamcinolona intravítrea del edema macular en pacientes con DHR se identificaron tres estudios observacionales, dos prospectivos con cinco y 20 pacientes; y uno retrospectivo, en el que solo se incluyeron dos pacientes con RP. La calidad de la evidencia global fue considerada muy baja.
Implante de dexametasona intravítrea: La evidencia deriva de una serie de casos de tres pacientes afectos de RP con edema macular cistoide refractario a los tratamientos habituales. La calidad de la evidencia global fue considerada muy baja.
Tratamiento quirúrgico: se identificó una serie de casos de 12 ojos con RP y edema macular refractario al tratamiento médico. La calidad de la evidencia global fue considerada muy baja. - Balance entre beneficios y riesgos:
Acetazolamida: El grupo de elaboración consideró que puede existir un beneficio neto asociado a la intervención. En pacientes con RP, la AV y el grosor de la mácula mejora en un porcentaje importante de pacientes e incluso las mejorías se mantienen con dosis mínimas a largo plazo; mientras que pacientes con distrofia macular cistoidea dominante no muestran ningún cambio a lo largo de tratamiento. El tratamiento con acetazolamida se asocia con la aparición de eventos adversos no graves entre los que se encuentran: parestesia en manos y pies, pérdida/alteración del gusto, mareo, náuseas, fatiga, depresión y anorexia. Antes de administrar este tratamiento es necesario considerar el balance beneficio-riesgo para cada paciente, en función de su susceptibilidad a los efectos adversos.
Metazolamida: El grupo de elaboración consideró que puede que no exista un beneficio neto asociado a la intervención y, sin embargo, no está exenta de eventos adversos, por lo que la recomendación es en contra. Muy pocos pacientes presentan mejoras funcionales con metazolamida. El tratamiento con metazolamida se asocia con escozor ocular con la instilación, visión borrosa, sequedad ocular, sabor amargo, lagrimeo, cefalea, sed, gusto metálico, cansancio y dolor de cabeza.
Dorzolamida: Con el uso de la dorzolamida tópica se obtienen escasas mejoras en la AV; sin embargo, un alto porcentaje de los pacientes tratados con dorzolamida tópica presenta una mejoría del edema macular (aunque casi un tercio de los pacientes que responden al tratamiento presenta una recaída a corto plazo). En esta situación, por un lado, parece lógico tratar el edema macular cistoide a los pacientes con RP con más posibilidades de mejorar, que parecen ser los pacientes más jóvenes y los pacientes con edema macular con XLRS. Con todo, no se debe olvidar que el tratamiento con dorzolamida tópica se asocia a ciertos eventos adversos, aunque no graves, como son: escozor ocular con la instilación, visión borrosa, sequedad ocular, sabor amargo, lagrimeo, cefalea, sed, gusto metálico, cansancio y dolor de cabeza. El grupo de elaboración consideró que puede existir un beneficio asociado a la intervención en el edema macular en pacientes con XLRS, en pacientes con coroideremia y en pacientes jóvenes.
Triamcinolona intravítrea: Aunque el tratamiento parece ser eficaz en un porcentaje importante de pacientes, su efecto no se mantiene y tiene riesgos asociados como las cataratas, el glaucoma y la endoftalmitis, tal y como se han observado en pacientes diabéticos.554 El grupo de elaboración consideró que dados los riesgos, se debía emitir una recomendación en contra.
Implante de dexametasona intravítrea: Pacientes con RP con edema macular cistoide refractario a los tratamientos habituales con un implante intravítreo de dexametasona presentan una ligera mejoría funcional y una reducción a del grosor macular. Sin embargo, existe una alta probabilidad de recidiva. El grupo de elaboración consideró que debe evaluarse paciente por paciente el posible beneficio asociado a la intervención en el edema macular en pacientes refractarios a los tratamientos habituales.
Tratamiento quirúrgico: Los escasos datos apuntan a que la vitrectomía vía pars plana con hialoidectomía y disección de la membrana limitante interna tras tinción con verde de indocianina y taponamiento posterior con gas puede mejorar la visión anatómica y funcional, sin complicaciones postoperatorias - Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
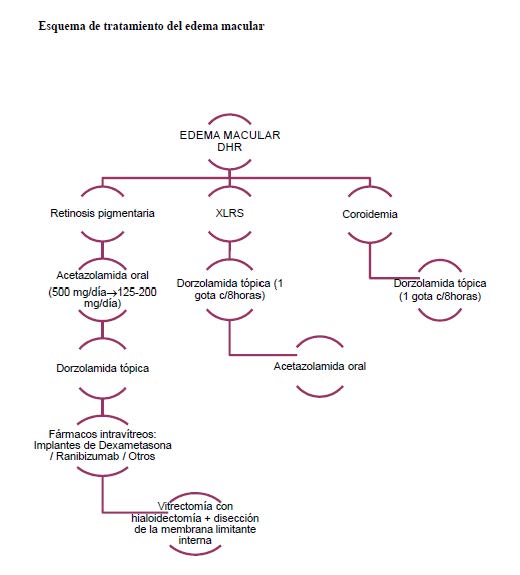
El grupo elaborador formuló las siguientes recomendaciones considerando las opciones que podrían ayudar al a la elección del tratamiento para el edema macular en las DHR. Asimismo, proporciona un esquema de tratamiento del edema macular en las DHR.
Recomendaciones
| Condicional | Se sugiere el tratamiento con acetazolamida oral (500 mg/día) para el edema macular asociado a RP, salvo contraindicación (pacientes con historia de cálculos renales o afectos de insuficiencia renal o hepática grave, primer trimestre del embarazo, etc.). |
| √ | Se sugiere controlar la eficacia del tratamiento con acetazolamida oral para el edema macular asociado a RP al menos con la toma de AV, FO y OCT. |
| Condicional | Como tratamiento de mantenimiento a largo plazo, se sugiere utilizar una dosis mínima de acetazolamida oral (125-250 mg/día) para el edema macular asociado a RP, con el fin de minimizar los efectos secundarios asociados. |
| Condicional | En caso de recaída del edema macular durante el curso del tratamiento con acetazolamida oral para el edema macular asociado a RP, se sugiere interrumpirlo durante un periodo entre uno y seis meses y reinstaurarlo posteriormente. |
| Condicional | Se sugiere no usar metazolamida en el tratamiento del edema macular en pacientes con RP. En caso de usarlo, hacerlo con dosis de 2 x 50 mg/día solo durante cuatro semanas. |
| Condicional | En casos de edema macular en pacientes con retinosquisis ligada a X se sugiere el uso de dorzolamida tópica como tratamiento de primera línea. |
| Condicional | En casos de edema macular en pacientes con retinosquisis ligada a X se sugiere el uso de acetazolamida oral como alternativa a la dorzolamida tópica. |
| Condicional | En casos de edema macular en pacientes con coroideremia se sugiere el uso de dorzolamida tópica. |
| √ | Se sugiere instruir al paciente para que se presione el canto interno ocluyendo los puntos lagrimales durante unos minutos tras la instilación ya que esta maniobra reduce significativamente su absorción sistémica y los posibles efectos adversos generales. |
| Condicional | Se sugiere controlar la eficacia del tratamiento con dorzolamida tópica en casos de edema macular en pacientes con coroideremia a través de tomografía de coherencia óptica macular o AV mejor corregida. |
| Condicional | Se sugiere no emplear acetazolamida oral en los pacientes con distrofia macular cistoidea dominante. |
| √ | En casos en los que no sea efectiva la acetazolamida o que no sea bien tolerada por el paciente o que ésta no pueda ser usada por estar contraindicada, se sugiere el uso de la dorzolamida tópica (1-2% instilada tres veces al día) para el tratamiento del edema macular secundario a RP, especialmente en pacientes jóvenes. |
| √ | Se sugiere que en pacientes mayores en los que se decida usar dorzolamida se pruebe inicialmente en días alternos. |
| √ | Se sugiere valorar sustituir por dorzolamida tópica el tratamiento de pacientes en los que aun siendo efectiva la acetazolamida, ésta origine efectos secundarios. |
| Condicional | En pacientes afectos de RP con edema macular refractario a acetazolamida oral y dorzolamida tópica, se sugiere valorar el uso de inyecciones intravitreas de ranibizumab. |
| Condicional | Se sugiere valorar el uso de implantes de dexametasona en el edema macular resistente a la acetazolamida oral o la dorzolamida tópica en pacientes con RP, valorando siempre el riesgo a presentar una catarata secundaria ante la inyección repetida así como a subidas de la presión intraocular. |
| Condicional | Tan solo se sugiere valorar el uso de corticoides, valorando posibles efectos secundarios, o antiangiogénicos en pacientes refractarios en los que ninguna otra opción terapéutica sea viable ya que sus resultados son poco predecibles. |
| Condicional | En pacientes refractarios a todos estos tratamientos se sugiere valorar el abordaje quirúrgico (vitrectomía con disección de la membrana limitante interna). |
| Condicional | En pacientes afectos de RP con edema macular, se sugiere no ofrecer triamcinolona intravítrea dada la alta tasa de efectos secundarios. |
- ¿Cómo se deben tratar las membranas neovasculares asociadas a una DHR?, ¿hay que hacer alguna consideración especial en la edad pediátrica?
La neovascularización subretiniana (NVSR) macular es una complicación rara de las DHR. Aunque la incidencia exacta de la NVSR en las DHR no se ha establecido, se ha descrito un aumento del riesgo relativo para algunas de ellas, como en la distrofia viteliforme macular o enfermedad de Best y en las distrofias en patrón.555,556 Esta complicación es aún más infrecuente en edad pediátrica existiendo hasta la fecha muy pocos trabajos sobre el tratamiento en este grupo de pacientes.
No se dispone de estudios de calidad que evalúen la eficacia de posibles tratamientos para la NVSR en las DHR. Únicamente se han identificado diversas series de casos y casos clínicos aislados mayoritariamente en la enfermedad de Best, sobre la que se encontraron seis estudios de casos aislados557-562 y cuatro series pediátricas.555,563-565 También se identificaron series de casos y casos aislados en la siguientes DHR: distrofia macular de Sorsby,556,566 enfermedad de Stargardt,567,568 RP,569 la coroideremia,570 distrofia macular viteliforme del adulto,571-574 distrofia en panal de Doyne,575 distrofia en patrón576 y distrofia en alas de mariposa.577
Terapia fotodinámica con verteporfin
muy baja
Para el bevacizumab se han informado buenos resultados tanto en casos clínicos aislados559,562,565 como en series de casos en edad pediátrica.564 Para el ranibizumab existe menos bibliografía, tan solo casos clínicos aislados558,561 y una serie de cuatro ojos en pacientes pediátricos presentada en congreso, con inactivación de la membrana neovascular en todos los casos con entre una a tres inyecciones.563
Sobre el aflibercept, uno de los fármacos anti-VEGF nuevos, no existen hasta la fecha estudios disponibles para la NVSR asociada a DHR.
Un detalle importante es que tampoco se han reportado problemas de seguridad diferentes de los descritos en la población general.
muy baja
Terapia fotodinámica con verteporfin
muy baja
Para el ranibizumab intravítreo, se han informado casos clínicos aislados con buenos resultados tras el uso de ranibizumab en la NVSR asociada a enfermedad de Stargardt,567 distrofia en patrón en alas de mariposa,577 distrofia viteliforme del adulto,572 distrofia macular de Sorsby,556 etc. También se han publicado dos series retrospectivas de casos usando ranibizumab para tratar la neovascularización secundaria a distrofia foveomacular viteliforme del adulto, Gallego-Pinazo et al. con seis casos573 y Mimoun et al. con 24 casos.574
Los estudios comparativos más extensos realizados hasta la fecha no encontraron diferencias significativas en términos de seguridad sistémica entre los diferentes anti-VEGF22, aunque algún estudio ha encontrado un mayor nivel sistémico del fármaco y de inhibición de la actividad del VEGF circulante con bevacizumab respecto a ranibizumab23, por lo que, especialmente en pacientes en edad pediátrica podría implicar un mayor riesgo teórico de efectos adversos.
muy baja
Resumen de la evidencia
| En relación a la terapia fotodinámica, no existen estudios comparativos con placebo por lo que la evidencia se sustenta en casos clínicos aislados y series de casos clínicos. | |
| En relación a las inyecciones de fármacos anti-VEGF, no existen estudios comparativos con placebo por lo que la evidencia se sustenta en casos clínicos aislados y series de casos clínicos. Los resultados obtenidos parecen ser mucho mejores a la evolución natural de la patología. | |
| No existen estudios disponibles sobre el aflibercept en la NVSR asociada a DHR. | |
| Calidad muy baja |
La poca evidencia disponible apunta a que la terapia fotodinámica con verteporfin da buenos resultados en la enfermedad de Best.555,557,560 |
| Calidad muy baja |
El uso de bevacizumab se ha asociado a buenos resultados en la enfermedad de Best.559,562,564,565 |
| Calidad muy baja |
Existe poca evidencia disponible sobre la eficacia del bevacizumab, pero los datos apuntan a la obtención de buenos resultados en el tratamiento de la NVSR asociada a las DHR.569-571,575576 |
| Calidad muy baja |
Existen pocos datos relacionados con la eficacia del ranibizumab intravítreo, pero estos apuntan a la obtención de buenos resultados en el tratamiento de la NVSR asociada a las DHR.556,558,561,567,572-574,577 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: La evidencia deriva de diversos casos aislados, series de casos y revisiones de casos de muy baja calidad. En líneas generales, la calidad de los estudios primarios seleccionados fue muy baja y la calidad de la evidencia global también fue considerada muy baja.
- Balance entre beneficios y riesgos: La NVSR es una complicación poco frecuente de enfermedad.578 Aun así, la NVSR puede ser una secuela devastadora y causar una rápida pérdida de la visión.579
Terapia fotodinámica con verteporfin:
En pacientes con la enfermedad de Best se han informado buenos resultados tras el uso de terapia fotodinámica. El efecto de esta terapia para las membranas neovasculares en pacientes con degeneración macular relacionada con la edad se exploró en una revisión sistemática. El riesgo relativo de perder tres o más líneas de AV comparando la intervención con el grupo control fue de 0,77 (IC95%: 0,69-0,87) y de perder seis o más líneas fue de 0,62 (IC95%: 0,50-0,76), con resultados similares a los 12 y a los 24 meses. Por otro lado, observaron que el resultado adverso más grave, fue la pérdida de AV dentro de los siete días a partir del tratamiento, lo que ocurrió en 1 de cada 50 pacientes.580 - Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta. que aparecen.
- Viabilidad: Tanto la FDA como la EMA han aprobado el uso de ranibizumab en la forma «húmeda» de la degeneración macular relacionada con la edad, el edema macular causada por una oclusión venosa retiniana, el edema macular diabético y la neovascularización coroidea causada por la miopía patológica, pero no en la NVSR asociada a DHR.
Asimismo, se ha aprobado el uso de bevacizumab para tratar a adultos con diferentes tipos de cáncer, pero no en pacientes con DHR con NVSR asociada.
Es poco factible por tanto poner el uso generalizado del ranibizumab o el bevacizumab en nuestro entorno, dado que no está aprobado su uso en esta indicación por parte de la FDA y la EMA. En este contexto, solo se puede acceder al tratamiento de estos fármacos dentro del contexto de investigación.
El grupo elaborador formuló las siguientes recomendaciones considerando las opciones que podrían ayudar al manejo de la NVSR asociada a las DHR.
Recomendaciones
| Condicional | En pacientes con membranas neovasculares asociadas a DHR se sugiere el uso de antiangiogénicos intravítreos, incluidos pacientes en edad pediátrica. |
| √ | En pacientes con membranas neovasculares asociadas a DHR resistentes a los antiangiogénicos intravítreos, se sugiere una terapia combinada (terapia fotodinámica + antiangiogénicos). |
Bibliografía 11. Manejo de las complicaciones asociadas
22. Bonnet C, El-Amraoui A. Usher syndrome (sensorineural deafness and retinitis pigmentosa): pathogenesis, molecular diagnosis and therapeutic approaches. Curr Opin Neurol 2012; 25: 42–49.
23. Renner AB, Kellner U, Cropp E, et al. Choroideremia: variability of clinical and electrophysiological characteristics and first report of a negative electroretinogram. Ophthalmology 2006; 113: 2066.e1–10.
29. Mura M, Sereda C, Jablonski M, et al. Clinical and functional finding in choroideremia due to complete deletion of the CHM gene. Arch Ophtalmol 2007; 125: 1109–1113.
49. Walia S, Fishman G a, Molday RS, et al. Relation of response to treatment with dorzolamide in X-linked retinoschisis to the mechanism of functional loss in retinoschisin. Am J Ophthalmol 2009; 147: 111–115.e1.
212. Hanein S, Perrault I, Gerber S, et al. Leber congenital amaurosis: Comprehensive survey of the genetic heterogeneity, refinement of the clinical definition, and genotypephenotype correlations as a strategy for molecular diagnosis. Hum Mutat 2004; 23: 306– 317.
466. Bayyoud T, Bartz-Schmidt KU, Yoeruek E. Long-term clinical results after cataract surgery with and without capsular tension ring in patients with retinitis pigmentosa: a retrospective study. BMJ Open 2013; 3: 1–6.
467. Reccia R, Scala A, Bosone G. Posterior chamber intraocular lens implantation in patients with retinitis pigmentosa. Doc Ophthalmol 1989; 72: 115–118.
468. Newsome D, Stark W, Maumenee I. Cataract extraction and intraocular lens implantation in patients with retinitis pigmentosa or Usher’s syndrome. Arch Ophtalmol 1986; 104: 852–854.
469. Kogure S, Iijima H. Preoperative evaluation by laser interferometry in cataractous eyes with retinitis pigmentosa. Jpn J Ophthalmol 1993; 37: 282–286.
470. Jackson H, Garway-Heath D, Rosen P, et al. Outcome of cataract surgery in patients with retinitis pigmentosa. Br J Ophthalmol 2001; 85: 936–938.
471. Fagerholm P, Philipson T. Cataract in retinitis pigmentosa An analysis of cataract surgery results and pathological lens changes. Acta Ophthalmol 1985; 63: 50–58.
472. Bastek J, Heckenlively J, Straatsma B. Cataract surgery in retinitis pigmentosa patients. Ophthalmology 1982; 89: 880–884.
473. Hayashi K, Hayashi H, Matsuo K, et al. Anterior capsule contraction and intraocular lens dislocation after implant surgery in eyes with retinitis pigmentosa. Ophthalmology 1998; 105: 1239–1243.
474. Figueroa-Wong LW, Suárez-tatá M, Peniche-moreno S, et al. Resultados visuales en pacientes con retinosis pigmentaria , operados de catarata con facoemulsificación e implante de lente intraocular. Rev Mex Oftalmol 2003; 77: 41–43.
475. Dikopf MS, Chow CC, Mieler WF, et al. Cataract extraction outcomes and the prevalence of zonular insufficiency in retinitis pigmentosa. Am J Ophthalmol 2013; 156: 82–88.
476. Casparis H, Lindsley K, Kuo IC, et al. Surgery for cataracts in people with age-related macular degeneration. Cochrane Database Syst Rev 2013; 6: CD006757.
477. Hooper CY, Lamoureux EL, Lim L, et al. Cataract surgery in high-risk age-related macular degeneration: a randomized controlled trial. Clin Experiment Ophthalmol 2009; 37: 570–576.
478. American Academy of OPhthalmology Cataract and Anterior Segment Panel. Preferred Practice Pattern Guideline. Cataract in the adult eye. San Francisco, CA, 2011.
479. Peralta J, Pastora N. Degeneraciones vitrorretinianas hereditarias. In: Oftalmología SE de (ed) Patología y Cirugía de la mácula. 2010.
480. Pendergast SD, Trese MT. Familial exudative vitreoretinopathy: Results of surgical management. Ophthalmology 1998; 105: 1015–1023.
481. Shukla D, Singh J, Sudheer G, et al. Familial exudative vitreoretinopathy (fevr). Clinical profile and management. J Ophthalmol 2003; 51: 323–328.
482. Carroll C, Papaioannou D, Rees A, et al. The clinical effectiveness and safety of prophylactic retinal interventions to reduce the risk of retinal detachment and subsequent vision loss in adults and children with Stickler syndrome: a systematic review. 2011. Epub ahead of print 2011. DOI: 10.3310/hta15160.
483. Ang A, Poulson A V., Goodburn SF, et al. Retinal Detachment and Prophylaxis in Type 1 Stickler Syndrome. Ophthalmology 2008; 115: 164–168.
484. Leiba H, Oliver M, Pollack A. Prophylactic laser photocoagulation in Stickler syndrome. Eye (Lond) 1996; 10: 701–708.
485. Monin C, Van Efferterre G, Andre-Sereys P, et al. [Prevention of retinal detachment in Wagner–Stickler disease. Comparative study of different methods. Apropos of 22 cases.]. J Fr Ophtalmol 1994; 17: 167–74.
486. Monin C, Allagui M, Larricart P, et al. [Prevention of non-traumatic retinal detachment by surgical cerclage. J Fr Ophtalmol 1993; 16: 247–53.
487. Fritsch D, Vallat M, Lagoutte F, et al. [Prevention of retinal detachment in WagnerStickler syndrome]. Bull Soc Ophtalmol Fr 1989; 89: 657–64.
488. Wilkinson C. Interventions for asymptomatic retinal breaks and lattice degeneration for preventing retinal detachment. Cochrane Database Syst Rev 2014; CD003170.
489. Ikeda T, Fujikado T, Tano Y. Combined tractional rhegmatogenous retinal detachment in familial exudative vitreoretinopathy associated with posterior retinal holes: Surgical therapy. Retina 1998; 18: 566–568.
490. Ikeda T, Fujikado T, Tano Y, et al. Vitrectomy for rhegmatogenous or tractional retinal detachment with familial exudative vitreoretinopathy. Ophthalmology 1999; 106: 1081– 5.
491. Bergen R, Glassman R. Familial exudative vitreoretinopathy. Ann Ophthalmol 1983; 15: 275–276.
492. Sobrin L, Berrocal AM, Murray TG. Retinal detachment 7 years after prophylactic schisis cavity excision in juvenile X-linked retinoschisis. Ophthalmic surgery, lasers & imaging 2003; 34: 401–402.
493. Aylward G. Optimal procedures for retinal detachment. In: Retinak textbook. 2006, pp. 2095–2105.
494. Schwartz SG, Flynn HW. Primary retinal detachment: scleral buckle or pars plana vitrectomy? Curr Opin Ophthalmol 2006; 17: 245–50.
495. Tsang Cw, Cheung BTO, Lam RF, Tsang Cw, Cheung BTO LR (2005). Primary 23- Gauge Vitrectomy for Rhegmatogenous. Retina 2008; 28: 1075–1081.
496. Acar N, Kapran Z, Altan T, et al. Primary 25-gauge sutureless vitrectomy with oblique sclerotomies in pseudophakic retinal detachment. Retina 2008; 28: 1068–1074.
497. Von Fricken M a, Kunjukunju N, Weber C, et al. 25-Gauge sutureless vitrectomy versus 20-gauge vitrectomy for the repair of primary rhegmatogenous retinal detachment. Retina 2009; 29: 444–50.
498. Miller DM, Riemann CD, Foster RE, et al. Primary repair of retinal detachment with 25- gauge pars plana vitrectomy. Retina 2008; 28: 931–936.
499. Han DP, Mohsin NC, Guse CE, et al. Comparison of pneumatic retinopexy and scleral buckling in the management of primary rhegmatogenous retinal detachment. Am J Ophthalmol 1998; 126: 658–668.
500. Schwartz SG, Kuhl DP, McPherson AR, et al. Twenty-year follow-up for scleral buckling. Arch Ophthalmol 2002; 120: 325–329.
501. Heimann H, Bartz-Schmidt KU, Bornfeld N, et al. Scleral Buckling versus Primary Vitrectomy in Rhegmatogenous Retinal Detachment. Ophthalmology 2007; 114: 2142– 2154.e4.
502. Arya A V, Emerson JW, Engelbert M, et al. Surgical management of pseudophakic retinal detachments: a meta-analysis. Ophthalmology 2006; 113: 1724–33.
503. Brazitikos PD, Androudi S, Christen WG, et al. Primary pars plana vitrectomy versus scleral buckle surgery for the treatment of pseudophakic retinal detachment: a randomized clinical trial. Retina 2005; 25: 957–64.
504. Lois N, Wong D. Pseudophakic retinal detachment. Surv Ophthalmol 2003; 48: 467– 487.
505. Abrams G, Azen S, McCuen B 2nd, et al. Vitrectomy with silicone oil or sulfur hexafluoride gas in eyes with severe proliferative vitreoretinopathy: results of a randomized clinical trial. Silicone Study Report 1. Arch Ophthalmol 1992; 110: 770–9
506. Tseng W, Cortez RT, Ramirez G, et al. Prevalence and risk factors for proliferative vitreoretinopathy in eyes with rhegmatogenous retinal detachment but no previous vitreoretinal surgery. Am J Ophthalmol 2004; 137: 1105–1115.
507. Jain N, Kozak J, Niziol L, et al. Vitrectomy Alone in the Management of Giant Retinal Tears. Ophthalmic Surgery, Lasers Imaging Retin 2014; 45: 421–427.
508. Cox SN, Hay E, Bird A. Treatment of Chronic Macular Edema With Acetazolamide. Arch Ophtalmol 1988; 106: 1190–5.
509. Moldow B, Sander B, Lund-andersen H. The effect of acetazolamide on passive and active transport of fluorescein across the blood-retina barrier in retinitis pigmentosa complicated by macular oedema. Graefe’s Arch Clin Exp Ophthalmol 1998; 236: 881–9.
510. Fishman G, Gilbert L. Acetazolamide for treatment of chronic macular edema in retinitis pigmentosa. Arch Ophtalmol 1989; 107: 1445–52.
511. Chung H, Hwang J, Kim J, et al. Optical coherence tomography in the diagnosis and monitoring of cystoid macular edema in patients with retinitis pigmentosa. Retina 2006; 26: 922–7.
512. Apushkin M, Fishman G, Grover S, et al. Rebound of cystoid macular edema with continued use of acetazolamide in patients with retinitis pigmentosa. Retina 2007; 27: 1112–1118.
513. Orzalesi N, Pierrottet C, Porta A, et al. Long-term treatment of retinitis pigmentosa with acetazolamide A pilot study. Graefe’s Arch Clin Exp Ophthalmol 1993; 231: 254–256.
514. Apushkin M a, Fishman G a, Janowicz MJ. Monitoring cystoid macular edema by optical coherence tomography in patients with retinitis pigmentosa. Ophthalmology 2004; 111: 1899–904.
515. Thobani A, Fishman G. The use of carbonic anhydrase inhibitors in the retreatment of cystic macular lesions in retinitis pigmentosa and X-linked retinoschisis. Retina 2011; 31: 312–15.
516. Pinckers A, Cruysberg J. Acetazolamide in dominant cystoid macular dystrophy. Ophthalmic Paediatr 1993; 14: 95–9.
517. Fishman G a., Gilbert LD, Anderson RJ, et al. Effect of Methazolamide on Chronic Macular Edema in Patients with Retinitis Pigmentosa. Ophthalmology 1994; 101: 687– 693.
518. Gilbert LD, Fishman GGA, Glenn AM, et al. Rebound of macular edema with continued use of methazolamide in patients with retinitis pigmentosa. Arch Ophtalmol 1993; 111: 1640–6.
519. Shahidi M, Fishman G, Ogura Y, et al. Foveal thickening in retinitis pigmentosa patients with cystoid macular edema. Retina 1994; 14: 243–7.
520. Grover S, Fishman G, Fiscella R, et al. Efficacy of dorzolamide hydrochloride in the management of chronic cystoid macular edema in patients with retinitis pigmentosa. Retina 1997; 17: 222–31.
521. Ikeda Y, Hisatomi T, Yoshida N, et al. The clinical efficacy of a topical dorzolamide in the management of cystoid macular edema in patients with retinitis pigmentosa. Graefes Arch Clin Exp Ophthalmol 2012; 250: 809–14.
522. Ikeda Y, Yoshida N, Notomi S, et al. Therapeutic effect of prolonged treatment with topical dorzolamide for cystoid macular oedema in patients with retinitis pigmentosa. Br J Ophthalmol 2013; 97: 1187–91.
523. Grover S, Apushkin M a, Fishman G a, et al. Topical dorzolamide for the treatment of cystoid macular edema in patients with retinitis pigmentosa. Am J Ophthalmol 2006; 141: 707.
524. Fishman G a, Apushkin M a. Continued use of dorzolamide for the treatment of cystoid macular oedema in patients with retinitis pigmentosa. Br J Ophthalmol 2007; 91: 743–5.
525. Genead M, Fishman G. Efficacy of sustained topical dorzolamide therapy for cystic macular lesions in patients with retinitis pigmentosa and usher syndrome. Arch Ophthalmol 2010; 128: 1146–1150.
526. Pacella E, Arrico L, Santamaria V, et al. Chlorhydrate Versus Acetazolamide in the Management of Chronic Macular Edema in Patients with Retinitis Pigmentosa: Description of Three Case Reports. Opthalmology eye Dis 2014; 6: 21–26.
527. Guiffre G. Topical dorzolamide for the treatment of cystoid macular edema in patients with retinitis pigmentosa. Am J Ophthalmol 2006; 142: 707.
528. Grover S. Topical Dorzolamide for the treatment of Cystoid Macular Edema in patients with retinitis pigmentosa Reply. Am J Ophthalmol 2005; 142: 707–8.
529. Passo M, Palmer E, Van Buskirk E. Plasma timolol in glaucoma patients. Ophthalmology 1984; 91: 1361–3.
530. García Sánchez J, Honrubia López F, García Feijóo J, et al. Diagnóstico y tratamiento del glaucoma del ángulo abierto. LXXXIX Ponen la Soc Española Oftalmol 2013; 10: 283–306.
531. Ghajarnia M, Gorin M. Acetazolamide in the treatment of X-linked retinoschisis maculopathy. Arch Ophthalmol 2007; 125: 571–573.
532. Apushkin MA, Fishman GA. Use of Dorzolamide for patients with x-linked retinoschisis. Retina 2006; 26: 741–745.
533. Genead M, Mcanany J, Fishman G. Topical dorzolamide for treatment of cystoid macular edema in patients with choroideremia. Retina 2012; 32: 826–33.
534. Khandhadia S, Trump D, Menon G, et al. X-linked retinoschisis maculopathy treated with topical dorzolamide, and relationship to genotype. Eye 2011; 25: 922–8.
535. Giusti C, Forte R, Vingolo E. Deflazacort treatment of cystoid macular edema in patients affected by Retinitis Pigmentosa: a pilot study. Eur Rev Med Pharmacol Sci 2002; 6: 1– 8.
536. Ozdemir H, Karacorlu M, Karacorlu K. Intravitreal triamcinolone acetonide for treatment of cystoid macular oedema in patients with retinitis pigmentosa. Acta Ophthalmol … 2005; 83: 248–51.
537. Scorolli L, Morar M, Meduri A, et al. Treatment of Cystoid Macular Edema in Retinitis Pigmentosa With Intravitreal Triamcinolone. Arch Ophtalmol 2007; 125: 759–64.
538. Wang C, Hu J, Bernstein P, et al. Intravitreal injection of triamcinolone acetonide for macular due to retinitis pigmentosa and other retinal diseases. Adv Exp Med Biol 2006; 572: 309–314.
539. Gokce G, Sobaci G, Durukan A, et al. Intravitreal triamcinolone acetonide compared with bevacizumab for the treatment of patients with macular edema secondary to central retinal vein occlusion. Postgr Med 2013; 125: 51–8.
540. Bressler NM, Edwards AR, Beck RW, et al. Exploratory analysis of of diabetic retinopathy progression through 3 years in a randomized clinical trial comparing intravitreal triamcinolone with focal/grid photocoagulation. Arch Ophthalmol 2009; 127: 1566–71.
541. Conti SM, Kertes PJ. The use of intravitreal corticosteroids, evidence-based and otherwise. Curr Opin Ophthalmol 2006; 17: 235–244.
542. Luthra S, Alberto R, Luigi S, et al. Bilateral optic neuropathy and intraretinal deposits after pars plana vitrectomy. Indian J Ophthalmol 2013; 63: 72–4.
543. Group DRR. A randomized trial comparing intravitreal triamcinolone acetonide and focal/grid photocoagulation for diabetic macular edema. Ophthalmology 2008; 115: 1447–1450.
544. Gómez-Ulla F, Abraldes MJ, Basauri E, et al. Guías de práctica clínica de la SERV: manejo de las oclusiones venosas de la retina. Arch Soc Esp Oftalmol 2010; 85: 294– 309.
545. Mirshahi A, Shenazandi H, Lashay A, et al. Intravitreal triamcinolone as an adjunct to standard laser therapy in coexisting high-risk proliferative diabetic retinopathy and clinically significant macular edema. Retina 2010; 30: 254–259.
546. Ramezani A, Esfandiari H, Entezari M, et al. Three intravitreal bevacizumab versus two intravitreal triamcinolone injections in recent onset central retinal vein occlusion. Acta ophthalmol 2014; 92: e530–e539.
547. Pareja Ríos a, López Galvez M. Manejo de las complicaciones oculares de la diabetes. Retinopatía Diabética y Edema Macular. 2015.
548. Srour M, Querques G, Leveziel N, et al. Intravitreal dexamethasone implant (Ozurdex) for macular edema secondary to retinitis pigmentosa. Graefes Arch Clin Exp Ophthalmol 2013; 251: 1501–6.
549. Yuzbasioglu E, Artunay O, Rasier R, et al. Intravitreal bevacizumab (Avastin) injection in retinitis pigmentosa. Curr Eye Res 2009; 34: 231–7.
550. Melo GB, Farah ME, Aggio FB. Intravitreal injection of bevacizumab for cystoid macular edema in retinitis pigmentosa. Acta Ophthalmol Scand 2007; 85: 461–3.
551. Artunay O, Yuzbasioglu E, Rasier R, et al. Intravitreal ranibizumab in the treatment of cystoid macular edema associated with retinitis pigmentosa. J Ocul Pharmacol Ther 2009; 25: 545–50.
552. Heckenlively J, Newsome D, Blacharski P. Grid photocoagulation for macular edema in patients with retinitis pigmentosa. Am J Ophthalmol 1987; 103: 161–6.
553. García-Arumí J, Martinez V, Sararols L, et al. Vitreoretinal surgery for cystoid macular edema associated with retinitis pigmentosa. Ophthalmology 2003; 110: 1164–9.
554. Batioğlu F, Ozmert E, Parmak N, et al. Two-year results of intravitreal triamcinolone acetonide injection for the treatment of diabetic macular edema. 27.
555. Sodi A, Murro V, Caporossi O, et al. Long-Term Results of Photodynamic Therapy for Choroidal Neovascularization in Pediatric Patients with Best Vitelliform Macular Dystrophy. 2015; 26: 168–74.
556. Kapoor KG, Bakri SJ. Intravitreal anti-vascular endothelial growth factor therapy for choroidal neovascularization due to Sorsby macular dystrophy. J Ocul Pharmacol Ther 2013; 29: 444–447.
557. Andrade RE, Farah ME, Costa R. Photodynamic Therapy With Verteporfin for Subfoveal Choroidal Neovascularization in Best Disease. Am J Ophthalmol 2003; 136: 1179–1181.
558. Batioglu F, Ozmert E, Suren E, et al. Intravitreal Ranibizumab for the Treatment of Choroidal Neovascularization in Best’s Vitelliform Macular Dystrophy. J Med Cases 2012; 3: 250–253.
559. Cennamo G, Cesarano I, Vecchio EC, et al. Functional and Anatomic Changes in Bilateral Choroidal Neovascularization Associated with Vitelliform Macular Dystrophy After Intravitreal Bevacizumab. J Ocul Pharmacol Ther 2012; 28: 643–6.
560. Frennesson CI, Wadelius C, Nilsson SEG. Best vitelliform macular dystrophy in a Swedish family: genetic analysis and a seven-year follow-up of photodynamic treatment of a young boy with choroidal neovascularization. Acta Ophthalmol 2014; 92: 238–242.
561. Querques G, Bocco MCA, Soubrane G, et al. Intravitreal ranibizumab (Lucentis) for choroidal neovascularization associated with vitelliform macukar dystrophy. Acta Ophthalmol 2008; 246: 694–5.
562. Velazquez-Villoria D, Badia CM, Quera JR, et al. Bevacizumab intravítreo en neovascularización coroidea asociada a enfermedad de Best. Arch Soc Esp Oftalmol 2015; 89: 405–407.
563. Campos Arcos M, Díaz Cascajosa J. Ranibizumab intravítreo como tratamiento de membrana neovascular coroidea asociada a la distrofia macular viteliforme o enfermedad de Best. In: 44 Congrés de la Societat Catalana d’Oftalmologia. 2003.
564. Sisk R a, Berrocal AM, Albini T a, et al. Bevacizumab for the treatment of pediatric retinal and choroidal diseases. Ophthalmic Surg Lasers Imaging 2010; 41: 582–592.
565. Celea C, Pop M, Avidis-Zamfiroiu N, et al. Evolution of Choroidal Neovascular Membrane in Best Disease after Single Intravitreal Bevacizumab. Case Report. MAEDICA- a Journa Clin Med 2015; 10: 61–64.
566. Peiretti E, Klancnik JJ, Spaide R, et al. Choroidal neovascularization in sorsby fundus dystrophy treated with photodynamic therapy and intravitreal triamcinolone acetonide. Retina 2005; 25: 377–9.
567. Querques G, Bocco MCA, Soubrane G, et al. Intravitreal ranibizumab (Lucentis) for choroidal neovascularization associated with Stargardt’s disease. Graefes Arch Clin Exp Ophthalmol 2008; 246: 319–21.
568. Kim HH, Carvounis PE, Bc H, et al. Photodynamic therapy for bilateral subfoveal choroidal neovascularization complicating stargardt macular dystrophy. Retin Cases Br Reports 2008; 2: 6–8.
569. Malik A, Sood S, Narang S. Successful treatment of choroidal neovascular membrane in retinitis pigmentosa with intravitreal bevacizumab. Int Ophthalmol 2010; 30: 425–428.
570. Palejwala N V, Lauer AK, Weleber RG. Choroideremia associated with choroidal neovascularization treated with intravitreal bevacizumab. Clin Ophthalmol 2014; 8: 1675–9.
571. Tiosano L, Jaouni T, Averbukh E, et al. Bevacizumab treatment for choroidal neovascularization associated with adult-onset foveomacular vitelliform dystrophy. Eur J Ophthalmol 2014; 24: 890–6.
572. Prieto-Calvo E, Torrón-Fernández Blanco C, Egea-Estopiñán C, et al. Ranibizumab intravítreo en neovascularización coroidea secundaria a distrofia foveomacular viteliforme del adulto. Arch Soc Esp Oftalmol 2012; 87: 149–152.
573. Gallego-Pinazo R, Dolz-Marco R, Pardo-López D, et al. Primary intravitreal ranibizumab for adult-onset foveomacular vitelliform dystrophy. Graefe’s Arch Clin Exp Ophthalmol 2011; 249: 455–458.
574. Mimoun G, Caillaux V, Querques G, et al. Ranibizumab for choroidal neovascularization associated with adult-onset foveomacular vitelliform dystrophy: oneyear results. Retina 2013; 33: 513–521.
575. Sohn E, Patel P, MacLaren R, et al. Responsiveness of Choroidal Neovascular Membranes in Patients With R345W Mutation in Fibulin 3 (Doyne Honeycomb Retinal Dystrophy) to Anti–Vascular Endothelial Growth Factor Therapy. Arch Ophthalmol 2011; 129: 1626–8.
576. Parodi MB, Iacono P, Cascavilla M, et al. Intravitreal bevacizumab for subfoveal choroidal neovascularization associated with pattern dystrophy. Investig Ophthalmol Vis Sci 2010; 51: 4358–4361.
577. Empeslidis T, Vardarinos a, Deane J, et al. Intravitreal ranibizumab in the treatment of butterfly-shaped pattern dystrophy associated with choroidal neovascularization: a case report. Case Rep Ophthalmol 2012; 3: 77–82.
578. Miller S, Bresnick G, Chandra S. Choroidal neovascular membrane in Best’s vitelliform macular dystrophy. Am J Ophthalmol 1976; 82: 252–5.
579. Moss H, Epley KD, Tripathy K, et al. Best Disease. Best Disease http://eyewiki.aao.org/Best_Disease (2014, accessed 22 February 2016).
580. Wormald R, Evans J, Smeeth L, et al. Photodynamic therapy for neovascular age-related macular degeneration. Cochrane Database Syst Rev 2007; CD002030.






