7.1. Terapias farmacológicas
- ¿Cuál es la eficacia y seguridad de los tratamientos farmacológicos disponibles para las DHR?
Los agentes farmacológicos pueden compensar un defecto bioquímico y podrían ser una buena elección en los casos en los que se conocen algunos aspectos de la fisiopatología de la DHR. La eventual toxicidad del fármaco puede conocerse y muchas veces modularse.
QLT 091001
Esta terapia podría ser útil en las RP causadas por un defecto primario en la biosíntesis del cromóforo que produciría una alteración del ciclo visual. Ejemplos de esta terapia son los recientes ensayos clínicos con el retinoide sintético QLT 091001, en pacientes con ACL causada por mutaciones en los genes LRAT y RPE65. Este tipo de tratamientos pueden suministrarse por vía general, oral habitualmente, precisando una terapia corta al quedar almacenado en el tejido graso.276
Tartrato de brimonidina
Se identificó un ensayo clínico aleatorizado (ECA) que evaluaba la eficacia de la aplicación tópica de tartrato de brimonidina, un agonista alpha-2 adrenoreceptor, sobre la neuroprotección de la retina en pacientes con distrofias retinianas debidas a RP o a distrofia de conos-bastones. Se aleatorizaron los ojos de 26 pacientes, uno de ellos al grupo experimental (tartrato de brimonidina al 0,2% dos veces al día) y el contralateral al grupo control (lágrimas artificiales dos veces al día).277
Campo visual
La pérdida de CV desde el momento basal hasta el final del seguimiento en los ojos tratados con la aplicación tópica de tartrato de brimonidina no fue significativa (P=0,11), mientras que los ojos no tratados presentaron una pérdida estadísticamente significativa (P=0,02). La curva de supervivencia en los ojos que perdía al menos el 25% del CV muestra un mayor tiempo hasta producirse dicho evento en los ojos tratados con brimonidina, pero sin diferencias significativas con los ojos controles (P=0,39).
Agudeza visual
La pérdida de AV en pacientes con DHR desde el momento basal hasta el final del seguimiento fue estadísticamente significativa, tanto en el grupo brimonidina tópica (P=0,02), como en el control (P=0,01). Al igual que ocurría en el examen basal, no hubo diferencia entre los grupos al final del seguimiento (P=0,60 y P=0,84, respectivamente).
Seguridad
El 11,5% de los pacientes presentaron alergias oculares a la brimonidina tópica que obligaron a su retirada del estudio.
Otras medidas
No se obtuvieron diferencias significativas entre grupos en la sensibilidad al contraste, en las anomalías en la visión de colores y en la presión intraocular.
Calidad
moderada
Taurina/diltiazem/vitamina E
Se identificó un ensayo clínico no aleatorizado (ECnoA) doble ciego controlado con placebo (n=62) en el que se evaluó el tratamiento combinado de taurina (1g/día), con bloqueador de canales de calcio, diltiazem (30 mg/día) y vitamina E (400 mg/día), administrados diariamente de forma oral, sobre la progresión de la pérdida de CV en la RP.278
Campo visual
A los tres años de seguimiento, el CV (central y periférico) del 69% de los pacientes del grupo control empeoró frente a un 18% del grupo de intervención. Sin embargo, solo el 19% de los pacientes del grupo control mostraron mejoría del CV frente al 53% del grupo intervención.
Los resultados obtenidos en el grupo de pacientes a los que se les prolongó el tratamiento hasta los seis años apuntan a que el beneficio observado a los tres años se mantiene en el tiempo.
Calidad
baja
Raubasina
Se identificó un estudio que exploraba los efectos del alcaloide indólico raubasina en pacientes con RP típica, tras algunos resultados favorables en diversos trastornos vasculares del ojo.279 El tratamiento se inició con tres inyecciones diarias de 10 mg cada una durante cuatro semanas, que continuó de forma oral con 40 mg cuatro veces al día durante tres meses.
Campo visual
El 35,7% de los pacientes tratados con raubasina mejoró (la mejoría del CV fue de más de un 50% y estable en el tiempo ≥6 meses), el 50% se mantuvo estable y el 14,3% empeoró levemente.
Calidad
muy baja
Ácido valproico
Se identificaron tres estudios, dos revisiones retrospectivas de cohortes de pacientes con RP (n=31, n=13)280,281 y un estudio de casos y controles (casos=15, controles=15)282 que exploraron el efecto del tratamiento oral con ácido valproico con una dosis que varió de 500 a 750 mg/día.
Campo visual
El posible efecto del ácido valproico sobre el CV de pacientes con RP, informado en los estudios incluidos, muestra una amplia variabilidad. Mientras que un estudio informa de un 70% de la muestra que mejoraron su CV280, con un incremento general del área de CV del 11% (P<0,02), en otro estudio el 80% de la muestra tuvo una disminución del CV (el 26,5% en ambos ojos) y tan solo el 20% mejoró.281
Agudeza visual
Al igual que con el CV, los resultados del ácido valproico en la AV en pacientes con RP han sido heterogéneos. Por un lado, mientras que en un estudio se observó que un 93% de los pacientes tratados tuvieron una mejoría de la mejor AV corregida (MAVC=1,8 al inicio; MAVC=1,3 al año de seguimiento; P<0,001).282 E incluso, cuando se asumió que no había pérdida de AV sin tratamiento, se observó un incremento de la AV significativo (P<0,02)280. Por otro, hay un estudio en el que se obtuvo un resultado en AV más modesto. Se obtuvo un incremento de la AV en tan solo un 9,8% de los pacientes, el 51,2% se mantuvo sin cambios y el 31% de los pacientes empeoró.281
Seguridad
Se observaron pocas o ninguna alteración de la función hepática,280,281 con algunas alteraciones en los análisis clínicos de sangre en pocos casos (elevación de los niveles de alanina aminotransferasa sérica elevada [6,5%], aspartato aminotransferasa [6,5%] y amoníaco [3,2%]).281
El resto de los efectos secundarios más comunes fueron leves y bien tolerados, incluyendo: letargo o astenia (10%),280,281 irritación gástrica (6,5-13%),280,281 aumento de peso (6,5%),281 erupción cutánea (6,5%),281 hiperagudeza (6,5%),281 malestar general (3,2%)281 y hematomas (3,2%).281
Calidad
muy baja
Unoprostona isopropilo tópico
Se identificaron dos estudios que evaluaban el efecto terapéutico de la unoprostona isopropilo tópico (0,12% dos veces al día), medicación utilizada como hipotensor ocular, en pacientes con RP, uno de ellos un estudio controlado por sujetos libres de la enfermedad y en el que a los casos se les asignaba al azar un ojo a la condición de tratamiento (n casos=17, n controles=23)283 con medidas pre-tratamiento y al año; y el otro un estudio prospectivo no comparativo (n=30)284 con medidas pre-tratamiento y a los seis meses.
Campo visual
El uso terapéutico de la unoprostona isopropilo tópico parece que puede mejorar la sensibilidad macular en 2º y 10º en pacientes con RP (de 12,3±4,8 dB a14,7±5,5 dB en 2º; P=0,001; de 9,1±5,4 dB a11,0±6,2 dB en 10º; P=0,001), aun así pacientes con <6dB al inicio del estudio no mostraron mejora en la sensibilidad macular.284
Agudeza visual
Existe cierta heterogeneidad en relación al efecto de la unoprostona en la AV de pacientes con RP. Mientras que en el estudio de Akiyama et al.283 no se observaron cambios en la MAVC tras el tratamiento con unoprostona (0,12% dos veces al día), en la cohorte prospectiva de Tawada et al.284 se redujo de manera significativa tras seis meses (-0,026±0,097 pre, 0,026±0,109 tras seis meses; P=0,001).
Seguridad
No se observó efectos secundarios en ningún paciente.283
Calidad
muy baja
Penicilamina
Se identificaron dos series de siete y cuatro casos, lideradas por el mismo autor, Gahlot en 1977285 y 1981,286 en las que los pacientes seguían un esquema terapéutico similar que se componía de una dieta baja en cobre (1mg/día), sulfuro de potasio en cada comida (40 mg), 250 mg de penicilamida dos horas antes de cada comida y tres horas después de la cena (empezando por dos cápsulas al días e incrementando la dosis a 6-8 cápsulas diarias) y piroxidina (20-25 mg/día).
Campo visual
Más de un 40% de los pacientes parece que presenta una mejora en el CV, sin embargo, este dato no fue analizado estadísticamente.286
Agudeza visual
Aunque no se aportaron datos con agregación estadística, sino gráfica, parece que la AV mejora en los pacientes expuestos a este esquema terapéutico.286
Audición
Parece que la falta de audición mejora en casi todos los pacientes con RP y sordera neurosensorial (85%286-100%285) que son tratados con penicilamida.
Seguridad
No se informó de eventos adversos en los estudios incluidos.285,286
Calidad
muy baja
Acetazolamida
Se identificó un estudio publicado en 1993, sobre el efecto terapéutico de la acetazolamida en pacientes con RP sin evidencia de edema macular.287 En el estudio se reclutó por un lado a 13 pacientes con RP (cuatro aisladas, dos USH2, cinco AR y dos AD) de un estudio previo con medidas pre- y post-tratamiento con acetazolamida (250 mg dos veces al día) durante ocho semanas y 10 pacientes adicionales (cuatro aisladas, cinco AR y una AD) para un estudio cruzado con la misma pauta terapéutica controlada con placebo, con ocho semanas en cada condición experimental.
Para más información sobre el efecto de la acetazolamida en pacientes con RP y edema macular ver pregunta 25.
Campo visual
Aunque tres pacientes mostraron cambios significativos en el área del CV y en los umbrales adaptados a la oscuridad (adaptómetro de Goldmann-Weekers modificado), ninguno de los pacientes en el estudio cruzado mostró un aumento significativo en el área del CV.287
Agudeza visual
Ningún paciente en el estudio preliminar mostró cambios significativos en la AV.287
Adaptación a la oscuridad
Siete de los 13 pacientes (54%) del estudio previo y 3 pacientes del estudio cruzado (30%) informaron de una mejora subjetiva de la función visual, específicamente de noche y en habitaciones con poca luz. E incluso dos de ellos, localizaron esa mejora en el CV inferior. Cinco pacientes (38%) no experimentaron ningún cambio.287
Seguridad
Los 13 pacientes del estudio previo y 8 del cruzado se quejaron de entumecimiento y hormigueo en manos y pies (80-100%). Otros síntomas como la de pérdida del gusto, la fatiga, la confusión mental y cálculos renales también se asociaron al tratamiento con acetazolamida, pero con una menor frecuencia.287
Calidad
muy baja
Encad
En relación a la efectividad del Encad, preparado creado en la ex Unión Soviética (mezcla de ribonucleótidos como resultado de la hidrólisis fermentativa de la levadura), solo se identificó un estudio. Investigadores rusos observaron el efecto de 150-200 mg/día de Encad durante aproximadamente 10 días (en al menos un curso anual). La muestra se seleccionó entre 2200 pacientes tratados con Encad y finalmente estuvo compuesta por 467 pacientes con seguimientos que iban desde los 4 hasta 14 años.288
Los datos apuntan a que el tratamiento con Encad favoreció una estabilización de la enfermedad en el 60% de los pacientes. Sin embargo este estudio es muy antiguo, de 1990 y ningún estudio posterior ha confirmado la eficacia de este tratamiento por lo que se necesitarían más estudios para probar su eficacia.
baja
Nivaldipina oral
Se identificaron dos pequeños ECA, publicados en 2011 (n=37, de los cuales terminaron el seguimiento 33)289 y 2013 (n=41)290, liderados por el mismo autor. En ambos se evaluaba el efecto a largo plazo de nivaldipina sobre la progresión del defecto central del CV en la RP. Los pacientes fueron asignados al azar a tratamiento con nivaldipina (4 mg/día durante ≥30 meses; n=19) o al grupo control en el que los pacientes recibían 300 mg de nicotinato de tocoferol (n=5), 15 mg/día de helenien (familia de los carotenoides, n=5) o no recibieron tratamiento (n=4).
Campo visual
El tratamiento a largo plazo con nivaldipina parece tener un efecto protector sobre la progresión del defecto en el CV central en pacientes con RP con una pendiente de pérdida en el defecto medio significativamente inferior en el grupo tratado que el control (P-valores< 0,05).289,290
Calidad
baja
Gangliósido
Otro tratamiento que se ha probado en pacientes con DHR son los gangliósidos. Se identificó un ECA doble ciego (n=32) en el que se administró en una inyección intramuscular 40 mg diarios de gangliósidos o 2 ml de placebo.291
Campo visual y ERG
La administración de gangliósidos en comparación con placebo no influyó en la progresión de la RP evaluada por a través del CV y el ERG.
Calidad
baja
Resumen de la evidencia
| Son muy pocos los estudios de calidad disponibles que informan sobre la eficacia y seguridad de los tratamientos farmacológicos frente a las DHR. | |
| En la actualidad no existe ningún tratamiento farmacológico recomendado para mejorar o estabilizar la progresión de la RP ni ninguna otra DHR. | |
| Calidad baja/ muy baja |
El deflazacort, el ácido valproico, la raubasina, la unoprostona isopropilo, el encad y el tartrato de brimonidina han mostrado algún efecto beneficioso en alguna medida de resultado. Sin embargo, las pruebas científicas de efectividad y seguridad son muy limitadas por lo que se necesitan más estudios para poder recomendar o desaconsejar el uso de alguno de esos tratamientos. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: La evidencia estuvo compuesta por: un ECA de calidad moderada sobre la eficacia y seguridad del tartrato de brimonidina; un ECnoA de calidad baja con placebo doble ciego (n=62) en el que se combinaba taurina, diltiazem y vitamina E; una serie de casos de calidad muy baja que exploraba los efectos del alcaloide indólico raubasina en pacientes con RP típica; tres estudios, dos revisiones retrospectivas de cohortes de pacientes con RP (n=31 y n=13) y un estudio de casos y controles (casos=15, controles=15) de calidad muy baja que exploraron el efecto del tratamiento oral con ácido valproico; dos estudios, un estudio de casos y controles y una cohorte, ambos de calidad muy baja, que evaluaban el efecto terapéutico de la unoprostona isopropilo tópico en pacientes con RP; dos series de casos, compuestas por siete y cuatro pacientes cada una, de calidad muy baja, en las que los pacientes seguían un esquema terapéutico que se componía de una dieta baja en cobre, sulfuro de potasio en cada comida, penicilamida y piroxidina; una serie de casos de calidad muy baja sobre la acetazolamida publicada en 1993 (n=13 pacientes con RP); un estudio de cohorte de calidad baja con seguimiento hasta los 14 años de pacientes que tomaban Encad; dos pequeños ECA sobre la nivaldipina, (n=37 y n=41) de baja calidad y un ECA doble ciego de calidad baja (n=32) en el que se administró inyecciones intramusculares de gangliósidos. En líneas generales, la calidad de los estudios primarios seleccionados fue baja o muy baja y la calidad de la evidencia global también fue considerada baja.
- Balance entre beneficios y riesgos: El grupo de elaboración consideró que aunque puede existir un potencial beneficio neto asociado a los tratamientos con deflazacort, ácido valproico, raubasina, unoprostona isopropilo, encad y tartrato de brimonidina, las pruebas científicas de efectividad y seguridad son muy limitadas. Por tanto, por el momento el balance beneficio riesgo se considera incierto en estas intervenciones.
- Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
El grupo de elaboración propuso la inclusión de la siguiente recomendación.
Recomendación
| Condicional | No se sugiere la utilización de los siguientes tratamientos farmacológicos para los pacientes con DHR: deflazacort, ácido valproico, raubasina, unoprostona isopropilo, encad y/o tartrato de brimonidina, |
La neuroprotección es independiente de la etiología de la RP o de cualquier enfermedad retiniana neurodegenerativa. Se pretende conseguir un ambiente protector que prolongue la supervivencia de los fotorreceptores. Tanto la administración de factores neurotróficos (CNTF, bFGF, BDNF, NGF, cardiotrofina-1 o FGF) como de factores antiapoptóticos o de factores de viabilidad derivados de los conos (RdCVF) podrían actuar de esta manera. Este tipo de factores suelen administrarse localmente requiriendo generalmente implantes intravítreos mediante la llamada Terapia de Células Encapsuladas.
Se localizaron un ECA,292 con una publicación asociada sobre el seguimiento longitudinal a parte de la muestra que participó en el ECA,293 y una serie de casos.294 Los estudios identificados evaluaron la efectividad la implantación de dispositivos con neurotróficos. En el ECA, Birch et al. pusieron a prueba la terapia que comprende un dispositivo intravítreo con células manipuladas para sobreexpresar CNTF (CNFT3 en pacientes con RP en etapas avanzadas, n=65, y CNFT4 en pacientes con RP en estadios precoces, n=68) en un ensayo clínico en el que se asignó al azar a los pacientes a recibir dosis altas o bajas en un ojo, mientras que en el otro se le realizaba una cirugía simulada.292 De este ECA se realizó un seguimiento durante 30-35 meses a tres pacientes, dos pacientes con RP y uno con USH2.293 El estudio de casos (n=8) posterior evaluó el efecto del implante de factor neurotrófico ciliar (CNTF) en el grosor macular medio en ojos con RP.294
Agudeza visual
Los resultados hasta el momento indican que el dispositivo fue bien tolerado, aunque no se obtuvieron efectos beneficiosos en la AV o la sensibilidad del visual campo.292,293
Calidad
moderada
Otras medidas
Aun así, se observó un aumento significativo en el volumen macular en la mayoría de los ojos tratados292-294 y la separación entre conos aumentó (P<0,002) y la densidad de conos disminuyó (P=0,002) en los ojos no tratados, pero no en los ojos tratados con CNTF.293
Calidad
muy baja
Resumen de la evidencia
| Son muy pocos los estudios de calidad disponibles para informar sobre la eficacia y seguridad de la neuroprotección frente a las DHR. | |
| Calidad muy baja | La implantación de dispositivos con neurotróficos muestra una efectividad muy limitada, si bien podría tener un efecto positivo sobre volumen macular y en el mantenimiento del mosaico de conos.292-294 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: La evidencia deriva de un ECA y una serie de casos (n=8) que evaluaron la efectividad la implantación de dispositivos con neurotróficos. La calidad de la evidencia global fue considerada muy baja.
- Balance entre beneficios y riesgos: La evidencia existente sobre la neuroprotección en pacientes con DHR muestra una efectividad muy limitada, por lo que el grupo de elaboración consideró el balance beneficio riesgo incierto en esta intervención.
- Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
El grupo de elaboración propuso la inclusión de la siguiente recomendación.
Recomendaciones
| Con la evidencia disponible actual, no es posible emitir una recomendación ni a favor ni en contra de la neuroprotección en pacientes con DHR. |
7.3. Implantes retinianos electrónicos
- ¿Cuál es la eficacia y seguridad de los implantes retinianos electrónicos en el tratamiento de las DHR?
En muchas de las enfermedades hereditarias que conducen a la baja visión, la célula diana es el fotorreceptor, sin embargo, las neuronas secundarias pueden mantenerse relativamente bien preservadas. En esta situación se puede plantear reemplazar la función de los fotorreceptores a través de una prótesis electrónica que estimularía esas neuronas secundarias e induciría una imagen visual.295 Sin embargo, antes de plantear colocar un implante de visión artificial hay que revisar la retina para comprobar que hay retina interna residual y capa de fibras nerviosas en análisis estructural con OCT, además de obtener el umbral capaz de producir fosfenos, con el fin de predecir si el implante de una prótesis retiniana puede tener éxito.296
Muchos grupos tienen diferentes versiones de los implantes, incluyendo implantes corticales o a nivel del nervio óptico, así como implantes retinianos, estos últimos con localización epirretiniana, subretiniana o supracoroidea.297
Se identificaron tres ECnoA298-300 de muestras muy pequeñas y una cohorte301 que probaron estos dispositivos en pacientes con RP.
Chow et al. 2004298 estudiaron el efecto de un microchip artificial de silicona implantado quirúrgicamente en el espacio subretiniano temporal superior en el tratamiento de la pérdida de visión en pacientes con RP. La muestra la constituyeron seis pacientes con una edad media de 63 años. El ojo derecho de cada paciente fue el intervenido mientras que el ojo izquierdo, que no recibió ninguna intervención, se usó como control. Se realizaron visitas de seguimiento cada mes completando un periodo total de seguimiento que varió de seis a 18 meses. La medida de resultado principal fue el cambio subjetivo de la función visual, respondiendo preguntas sobre brillo, contraste, color, formas, movimiento, resolución y tamaño del CV, usando el ojo control como referencia. A este estudio piloto, se le sumó cuatro pacientes en un estudio posterior vinculado.302
Yanai et al. 2007 realizaron un implante epirretiniano de una prótesis de retina en tres sujetos con RP y disminución severa de la AV (uno con ceguera y dos con solo percepción de luz). La prótesis tenía un grupo de electrodos de platino y estaba controlada de manera inalámbrica por un ordenador o por una cámara de video colocada sobre la cabeza del paciente. La prótesis se implantó en el ojo peor de cada sujeto, según los resultados de los exámenes oftalmológicos preoperatorios. La función visual se evaluó mediante una serie de pruebas visuales descritas con detalle por los autores, realizadas con estímulo por ordenador o con estimulación basada en la información visual recibida a través de una videocámara. Cada paciente fue analizado en un momento diferente tras el implante, a los siete, 15 y 18 meses. El porcentaje de respuestas correctas en cada tarea fue comparado con lo esperado por el azar para determinar la significación estadística.299
Más recientemente, Klauke et al. evaluaron en dos centros en Alemania la eficacia y seguridad del dispositivo epirretiniano EPIRET3 durante un tiempo limitado de implantación en una muestra de tan solo seis pacientes con ceguera y RP. Este dispositivo con control remoto sin cables se implantó en un solo ojo de cada paciente que fueron sometidos a tres sesiones de estimulación eléctrica de una hora de duración a lo largo de un periodo de cuatro semanas, tras las cuales se extrajo. Los pacientes fueron examinados a los seis meses después de la retirada del dispositivo.300
Por último, Dorn et al. en 2013 evaluaron la capacidad de 28 pacientes ciegos con RP de distintos centros del mundo, implantados con dispositivo epirretiniano para detectar la dirección de objetos en movimiento.301 Este sistema consistía en una matriz de 60 electrodos controlados independientemente implantados en el espacio epirretiniano, una bobina inductiva para transmitir datos de forma inalámbrica, una unidad de procesamiento de vídeo externa, y una cámara de video en miniatura montada en un par de gafas.
Agudeza visual
Todos los pacientes con un microchip artificial de silicona implantado quirúrgicamente en el espacio subretiniano o epirretiniano mostraron algún grado de mejoría postoperatoria en la percepción de su visión298,300,301 y la mayoría de los pacientes con un implante epirretinano (83%) en su función visual (P<0,01) (la función visual fue evaluada mediante una serie de pruebas visuales realizadas con estímulos por ordenador o con estimulación basada en la información visual recibida a través de una videocámara).299
En pacientes con un implante subretiniano, el 50% de los pacientes mejoró la AV. Las mejoras observadas no aparecen inmediatamente, sino entre una semana y dos meses después de la intervención. Los autores no realizan análisis estadístico.298
Campo visual
En Chow et al.,298 el 33% (2/6) de los pacientes con un microchip artificial de silicona implantado quirúrgicamente en el espacio subretiniano, mejoró el área de CV. Al igual que en el caso de la AV, las mejoras observadas no aparecen inmediatamente y no se realizaron análisis estadístico.
Calidad
baja
Dirección del movimiento
El estudio de Dorn et al.301 muestra cómo el 54% de los pacientes ciegos con RP con un implante epirretiniano mejoran su capacidad para detectar objetos en movimiento.
Calidad
muy baja
Eventos adversos
No se observaron eventos adversos importantes del microchip artificial de silicona tales como infección, inflamación prolongada o malestar, hemorragia intraocular o retiniana, neovascularización, rechazo o desplazamiento del implante o extrusión retiniana.298,302
En el estudio de Chow et al., en el 50% de los pacientes (3/6) se produjo una elevación de la presión intraocular postoperatoria a más de 25 mmHg, por lo general, hacia el final de la primera semana tras el implante, que se relacionó con los corticoides tópicos postoperatorios. El 83% (5/6) informó de picor en el ojo intervenido, resuelto en seis semanas al reabsorberse las suturas. Por último, un paciente (17%) notó aniseiconia entre el ojo intervenido y el ojo control cuando usaba gafas.298
Aunque en el estudio de Yanai et al. no se informó de eventos adversos, sí se observaron otras complicaciones tales como una reintervención a los 11 meses post-implante debido a desplazamiento de la placa de electrodos retinianos tras caída con traumatismo craneoencefálico.299
Finalmente Klauke et al. indicaron que en general la implantación fue exitosa, provocando únicamente moderada inflamación postoperatoria temporal, un caso de hipopión estéril que se resolvió eficazmente con esteroides y antibióticos y un caso de rotura retiniana durante la eliminación del dispositivo que requirió cirugía con taponamiento con aceite de silicona.300
Calidad
baja
Vaidya et al.303 realizaron una evaluación de coste efectividad de la prótesis de retina Argus II frente a los cuidados tradicionales en pacientes con RP ciegos. Se siguió una cohorte hipotética de 1000 pacientes con RP de países de la eurozona durante un horizonte temporal de 25 años. El ratio costeefectividad incremental fue de 14.603€/año de vida ajustado por calidad (AVAC). A los 10 y 20 años fue de 31.890€/AVAC y 49.769€/AVAC, respectivamente.
coste
efectividad
Resumen de la evidencia
| Son muy pocos los estudios de calidad disponibles para informar sobre la eficacia y seguridad de los implantes retinianos electrónicos en las DHR. | |
| Los implantes retinianos es una línea de investigación prometedora pero que se encuentra en las primeras fases de su desarrollo. | |
| Calidad baja | Distintas prótesis electrónicas retinianas probadas en un número muy pequeño de pacientes con RP han obtenido resultados positivos, sin embargo, la investigación en este campo está en un estadio aún muy inicial.298-301 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: Prótesis de visión artificial: Se identificaron tres ECnoA de muestras muy pequeñas y una cohorte, todas de calidad baja. La calidad de la evidencia global fue considerada baja por lo que la fuerza de la recomendación fue condicional.
- Balance entre beneficios y riesgos: Distintos tipos de dispositivos se han probado en un número muy pequeño de pacientes con RP con resultados positivos, dado que todos los pacientes mostraron algún grado de mejoría postoperatoria en la percepción de su visión y la mayoría en su función visual. Además, en general, no se observaron eventos adversos importantes. El grupo de elaboración consideró que, en el balance beneficio riesgo, los efectos deseados pueden superar a los indeseados por lo que emitió una recomendación a favor.
- Valores y preferencias de los pacientes: No se identificaron estudios publicados sobre valores y preferencias de las personas con DHR en cuanto a esta pregunta. En el estudio cualitativo realizado en el contexto español, se observó variabilidad sobre las preferencias de los pacientes en cuanto a las prótesis de visión artificial, mientras unos manifestaron su deseo por acceder a este tipo de intervención, otros se mostraron cautelosos y prefieren esperar a una mayor evolución de la tecnología.
- Costes y uso de recursos: Se identificó una evaluación económica realizada en Alemania sobre dispositivos de visión artificial en pacientes ciegos con RP. El ratio coste-efectividad incremental fue de 53.165€ por AVAC ganado, por lo que tienen el potencial de ser una opción de tratamiento coste-efectiva en pacientes con RP en Alemania; sin embargo, no sería una alternativa en España dado el umbral en el SNS se encuentra aproximadamente en los 21.000€ – 24.000€304. Sin embargo, en el ámbito de las enfermedades raras no hay consenso sobre la disposición del SNS a pagar este tratamiento305.
El grupo de trabajo propuso la inclusión de la siguiente recomendación.
Recomendaciones
| Condicional | Se sugiere la colocación, en el contexto estricto de investigación, de prótesis de visión artificial en aquellos pacientes con amaurosis debido a una DHR, tras un proceso de toma de decisiones compartidas en el que el profesional explore las preocupaciones y expectativas del paciente candidato a la colocación de la prótesis e informe de los posibles riesgos y beneficios de la intervención. |
7.4. Trasplantes retinianos
- ¿Cuál es la eficacia y seguridad de los trasplantes retinianos en el tratamiento de las DHR?
Varios tejidos son susceptibles de ser trasplantados en la retina enferma con objetivos terapéuticos:
- Retina fetal: consiste en el trasplante de neurorretina fetal en el espacio subretiniano. Entre las principales limitaciones de esta técnica se encuentran algunas de carácter físico ya que existen problemas de espacio y desorganización de la retina huésped. Resultaría quizá más eficaz el trasplante de la capa de fotorreceptores inmaduros exclusivamente.
- Células pluripotentes: las células pluripotentes con posibilidades terapéuticas en la retina son las células embrionarias y las células progenitoras neuronales. Existen limitaciones éticas a la hora de trabajar con células embrionarias humanas así como limitaciones técnicas a la hora de dirigir la diferenciación de las células progenitoras adultas hacia fotorreceptores.
- Células pluripotentes inducidas: son un tipo de células maduras procedentes de tejidos diferenciados que existen en tejidos adultos y que, artificialmente, se desprograman para conseguir células pluripotentes y se reprograman posteriormente para intentar convertirlas en células retinianas. Aunque esta técnica evita los problemas éticos del uso de células madre embrionarias, la reprogramación de las mismas puede originar problemas como la activación de ciertos oncogenes debida a la inestabilidad epigenética de las células pluripotentes inducidas comparadas con las células madre embrionarias. Independientemente de su capacidad terapéutica real, esta tecnología es muy interesante en cuanto a la generación de modelos in vivo e in vitro para el estudio de la fisiopatología de la enfermedad.
- Trasplante de EPR: el EPR constituye una unidad funcional con la capa de los fotorreceptores para la fototransducción. Así mismo, desempeña un papel importante en el mantenimiento de la estructura y la polaridad de la retina. Estas características han impulsado a algunos investigadores a buscar una mejoría de la visión mediante el trasplante de EPR. La hipotética combinación de la terapia génica junto al trasplante de EPR constituye también una estrategia terapéutica prometedora para algunos tipos de RP.
Se identificaron varias series de casos en las que se explora la viabilidad, efectividad y seguridad de los trasplantes de neurorretina fetal,306-309 de fotorreceptores,310 de células madre pluripotentes inducidas311,312 y de células madre del EPR.313-315
7.4.1. Retina fetal
En el estudio de Das et al. de 1999, a una serie de 14 pacientes adultos menores de 50 años con RP avanzada se les inyectó, en el espacio subretiniano, células neurorretinianas fetales humanas (edad gestacional de 14 a 18 semanas) en uno de los ojos, con el objetivo de determinar la seguridad a largo plazo del implante. El ojo contralateral se usó como control. El periodo de seguimiento tras la intervención varió de 12 a 40 meses entre los pacientes.306
En ese mismo año, Radtke et al.307 publicaron una serie de dos casos con RP en la que se analizó la eficacia y seguridad del trasplante de dos hojas intactas de retina fetal de 15 y 17 semanas de gestación en el espacio subretiniano en un ojo de cada paciente.
Un año más tarde, en 2000 Humayun et al.308 realizaron un estudio piloto con ocho pacientes con RP y un paciente con degeneración macular asociada a la edad avanzada, todos con AV de percepción de luz, a los que se les realizó un trasplante de neurorretina fetal en el espacio subretiniano con la finalidad de conocer su efectividad y seguridad. El estudio incluyó evaluaciones pre- y post-operatorias compuestas por pruebas de la función visual, exámenes detallados del FO, fotografía del FO, AFG, perimetría macular y ERG.
En 2002, el grupo liderado por Radtke309 publica una serie de cinco pacientes con RP, que tan solo habían tenido percepción de luz, en la que evaluaron la seguridad del trasplante en el espacio subretiniano de hojas de retina neural fetal junto con su EPR. En este caso, los pacientes fueron seguidos durante seis meses y no se dieron medicamentos inmunosupresores.
Agudeza visual
El trasplante de neurorretina fetal en el espacio subretiniano mejora poco o nada la AV de los pacientes con RP.
En ocho de los 14 ojos intervenidos en el estudio de Das et al. no se observaron cambios en la AV, medida como la capacidad de la persona para percibir luz y contar dedos a diferentes distancias. De los seis pacientes restantes, uno rechazó el tratamiento para el desprendimiento de retina (DR) con el que se complicó y la AV empeoró, pasando de percibir movimiento de manos antes del trasplante a la percepción de luz; y los otros cinco pacientes obtuvieron una mejoría. De los cinco pacientes que mejoraron, la AV de tres pacientes cambió de percepción de luz a la del movimiento de la mano al año de seguimiento, otro cambió de percepción de luz a una visión de 20/200 ocho meses después de la operación y, por último, un paciente cambió de contar dedos de 15 cm a 50 cm seis meses después de la operación.306
Sin embargo, los cinco pacientes de las serie de casos de Radtke et al. no mostraron ningún cambio en la agudeza de Snellen.309
ERG y campo visual
El trasplante de neurorretina fetal muestra un efecto nulo o limitado en pacientes con RP tanto en el CV como en el ERG.
Radtke et al. en 1999 mostraron cómo tras cinco y seis meses los dos pacientes reclutados informaron de una mejora subjetiva, una nueva sensación en el CV, que permaneció tras 8 y 10 meses de la intervención. Sin embargo, en tan solo uno de los dos pacientes se detectó una respuesta transitoria en el ERG-mf, que no se mantuvo en el seguimiento a los seis y a los nueve meses y medio.307
En la misma línea, los pacientes de la serie de casos de Radtke et al. publicada en 2002 no mostraron ningún cambio en el ERG-mf309 y los pacientes de Humayun et al. tampoco experimentaron ningún cambio en el ERG o en la perimetría macular.308
Sensibilidad a la luz
En el estudio de Humayun et al., tres de los ocho pacientes con RP demostraron una posible sensibilidad mejorada a la luz durante los primeros meses de seguimiento. Sin embargo, la mejora visual desapareció entre los 3 y los 13 meses de seguimiento.308
Seguridad
En general, en ninguna de las series se observó evidencia de rechazo.306,307,309
Además, no se produjeron acontecimientos adversos tales como infecciones,306,308 inflamaciones o edemas,306,308,309 sangrado abundante,308 vasculitis retiniana,308 desintegración de tejido309 o cicatrización.309
Tan solo en la serie de casos de Das et al. se produjo un DR en el ojo operado de un paciente. En su caso, y dado que rechazó tratamiento para el DR, la AV empeoró, pasando de percibir movimiento de manos antes del trasplante a percepción de luz, como se ha explicado previamente.306
Calidad
muy baja
7.4.2. Células pluripotentes
Se identificó un estudio en el que Berger et al. 2003 evaluaron la eficacia terapéutica del trasplante de fotorreceptores procedentes de donantes adultos muertos a pacientes afectos de RP en un estadio avanzado. Los resultados obtenidos no fueron positivos. Ocho pacientes (rango de edad: 31-59 años) fueron examinados antes de la operación y al mes, 3, 6 y 12 meses tras la operación con medidas de AV y función de la retina. En este estudio, se produjo una pérdida de seguimiento tras el examen a los 3 meses después de la intervención.310
Agudeza visual
Con el trasplante de fotorreceptores no se obtuvieron cambios estadísticamente significativos de la MAVC (medida con la escala Bailey-Lovie) ni en el ojo operado ni en el ojo contralateral no operado en ninguna de las evaluaciones post-trasplante.
Sensibilidad al contraste
La velocidad de lectura media y la sensibilidad al contraste en el ojo operado tampoco cambiaron a lo largo del estudio, sin embargo, en el ojo no operado se obtuvo una mejoría significativa de la velocidad de lectura media en el examen a los 12 meses (P<0,01) y de la sensibilidad al contraste a los seis meses (P<0,05), si bien solo tres de siete ojos no operados fueron examinados a los 6 meses y los valores volvieron a los niveles pre-operación en el examen a los 12 meses.
Campo visual
Tampoco se obtuvo una diferencia significativa entre el ojo operado y el no operado en los valores pre-operación y post-operación de otras medidas de la función visual como son el umbral de adaptación a la oscuridad, la amplitud y latencia del ERG y el CV.
Seguridad
El único evento adverso observado durante el periodo de seguimiento fue una diplopía monocular y una catarata visualmente significativa en un paciente lo que provocó una disminución de la AV y una constricción del CV. Tras la extracción de la catarata, la agudeza y el CV volvieron a sus niveles preoperatorios, si bien, el paciente se siguió quejando de la diplopía.
Calidad
muy baja
7.4.3. Células pluripotentes inducidas
Se localizó un estudio publicado en 2011, en el que Siqueira et al.312 evaluaron a corto plazo (10 meses) la seguridad de una única inyección intravítrea de células mononucleares procedentes de médula ósea en una serie de casos con tres pacientes con RP y dos pacientes con distrofia de conos y bastones. Las evaluaciones incluyeron MAVC y ERG, examen del CV de Goldmann, AFG y verde de indocianina, y OCT.
A principios de 2015 por Park et al.311 evaluaron una serie de casos en la que se implantaron células pluripotentes inducidas, para conocer la seguridad y la viabilidad de las células autólogas intravítreas CD34+ en enfermedades isquémicas y degenerativas de la retina. Tras la inyección intravítrea se evaluó con microperimetría/perimetría, AFG, ERG y OCT durante los 6 meses de seguimiento.
Agudeza visual
La MAVC no mostró empeoramiento después de 6 meses.311
Campo visual
Tras el mismo periodo tampoco empeoró la evaluación del EGR de campo amplio.311
Seguridad
La terapia fue bien tolerada sin inflamación o hiperproliferación intraocular asociadas con la inyección311,312
Calidad
muy baja
7.4.4. Trasplante de EPR
Radtke et al. 313 publicaron en 2008 un estudio clínico fase II en el que se analizó la eficacia y seguridad del implante de capas de células progenitoras neurales retinianas con su EPR en pacientes con RP o degeneración macular asociada a la edad con una AV de 20/200 o peor mediante el test de visión Early Treatment Diabetic Retinopathy Study de (ETDRS). De un total de 10 pacientes incluidos en el ensayo, 6 presentaban diagnóstico de RP. Se intervino el ojo con peor visión de cada paciente y, aunque los autores manifiestan que no hubo grupo control, los resultados se comparan con los ojos no intervenidos. Todos completaron al menos un año de seguimiento (al menos siete exámenes post-intervención) y tres consintieron en participar en exámenes de seguimiento anuales posteriores opcionales hasta los dos, tres y seis años en los distintos casos.311
Schwartz et al. publicaron resultados de dos estudios prospectivos en fase I/II para evaluar la seguridad y tolerabilidad del trasplante de células madre embrionarias humanas derivadas a EPR en nueve pacientes con distrofia macular de Stargardt (edad > 18 años) y nueve con la degeneración macular asociada a la edad (edad > 55 años). Estos datos fueron publicados en 2015,314 si bien en 2012 se publicaron datos de dos de estos pacientes.315 Las evaluaciones incluyeron AV, AFG, OCT y pruebas de CV. Los pacientes completaron un seguimiento medio de 22 meses.
Agudeza visual
En general, la AV mejoró en más del 70%313-315 de los pacientes que recibieron un transplante de EPR que se mantuvo durante el seguimiento.
En el subgrupo de pacientes con RP (n=6), la AV del ojo con implante celular aumentó en tres pacientes, en uno de los cuales se observó un mismo grado de mejoría en ambos ojos, en uno se mantuvo igual mientras que en dos empeoró. En cuanto a los ojos no intervenidos, dos mejoraron, tres se mantuvieron igual y uno empeoró.313
En el subgrupo de pacientes con Stargardt, de los ocho pacientes con una evaluación a los seis meses la AV mejoró en tres ojos (cambio ≥15 letras), se mantuvo estable en cuatro ojos (cambio ≤10 letras) y empeoró en un ojo (cambio >10 letras). De los siete pacientes con seguimiento a los 12 meses, la AV mejoró en tres, se mantuvo estable en tres y empeoró en uno.314,315
ERG
No se observaron cambios en las medidas de ERG-mf. Tampoco mediante microperimetría se observaron cambios en la sensibilidad a la luz con la excepción de un paciente con RP que aumentó un 22,7% entre el examen a tres años post-implante (1,6 dB) y el examen a cinco años post-implante (2,7 dB). Este mismo paciente logró mantener una mejoría de la AV durante más de cinco años tras el implante, de 20/800 basal a 20/200 a los cinco años y 20/320 a los seis años, mientras que el ojo no intervenido pasó de 20/400 basal a movimiento de manos.313
Seguridad
No hubo evidencia de rechazo, o graves problemas oculares o sistémicas de seguridad relacionados con el tejido trasplantado.313
En ocho de 10 ojos intervenidos se informó de que las células trasplantadas perdieron su pigmentación en el intervalo de tres a seis meses post-implante.313 El resto de eventos adversos se asociaron con la cirugía vitreorretiniana o con la inmunosupresión.314
Calidad
muy baja
Resumen de la evidencia
| Son muy pocos los estudios de calidad disponibles para informar sobre la eficacia y seguridad de los trasplantes retinianos en las DHR. | |
|
Calidad
muy baja |
Los trasplantes de células retinianas son técnicamente posibles, pero su efectividad aún no está sustentada por pruebas científicas suficientes.306-315 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: La evidencia deriva de pequeñas series de casos sobre el trasplante de células neurorretinianas fetales humanas, sobre la eficacia terapéutica del trasplante de fotorreceptores y sobre células pluripotentes inducidas. Sobre el implante de capas de células progenitoras neurales retinianas se identificó un estudio clínico fase II y una serie de casos. La calidad de la evidencia global fue considerada muy baja.
- Balance entre beneficios y riesgos: la evidencia existente sobre los implantes retinianos en pacientes con DHR muestra una efectividad muy limitada, por lo que el grupo de elaboración consideró el balance beneficio-riesgo incierto en esta intervención.
- Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
El grupo de elaboración propuso la inclusión de la siguiente recomendación.
Recomendaciones
| Con la evidencia disponible actual, no es posible emitir una recomendación ni a favor ni en contra de la trasplantes de células retinianas en pacientes con DHR, salvo en el contexto estricto de investigación (ensayo clínico), tras un proceso de toma de decisiones compartidas en el que el profesional explore las preocupaciones y expectativas del paciente candidato a la terapia e informe de los posibles riesgos y beneficios de la intervención. |
7.5. Terapia génica
- ¿Cuál es la eficacia y seguridad de la terapia génica en el tratamiento de las DHR?
En los últimos años se han iniciado múltiples ensayos clínicos utilizando terapia génica en distintas DHR, entre ellas, ACL, coroideremia, RP, retinosquisis LX, acromatopsia, enfermedad de Stargardt y USH.
Basados en la eficacia y la seguridad de la terapia génica en modelos animales de ACL (roedores,316caninos317), en 2007, en el Children’s Hospital de Filadelfia se realizaron las primeras inyecciones subretinianas en humanos del virus AAV2.hRPE65v2 a adultos jóvenes (19-26 años de edad), a los que se les inyectó el vector en el ojo con peor función visual (NCT00481546). Se obtuvieron diferentes grados de mejora de la función visual en las áreas tratadas sin problemas con la inyección respecto a la seguridad (sin presencia de toxicidad sistémica) y sin efectos dependientes de la edad.318 Se realizaron inyecciones en el ojo contralateral en un total de tres pacientes de la cohorte anterior, sin problemas de seguridad. En este estudio fue la primera vez en la que se realizó terapia génica en ambos ojos. Todos los pacientes inyectados mejoraron su sensibilidad retiniana, AV y CV.319
muy baja
En otro ECnA, ocho adultos y cuatro niños recibieron una inyección subretiniana del vector rAAV2-CB-hRPE65 en el ojo con peor función visual y se les realizó un seguimiento de dos años. Todos los pacientes toleraron las inyecciones subretinianas y no se presentaron efectos adversos relacionados con el tratamiento, pero sí con el procedimiento quirúrgico (hemorragia subconjuntival en ocho pacientes e hiperemia ocular en cinco pacientes). En el ojo tratado, la MAVC aumentó en cinco pacientes y disminuyó en uno. El examen de 30º del CV mejoró en seis pacientes, del CV total en cinco pacientes y en la prueba cinética mejoró en tres pacientes, mientras que dos mostraron peores resultados en esta medida tras el tratamiento. En total, nueve pacientes mejoraron su función visual en al menos una medida.320
muy baja
En un tercer estudio con pacientes con ACL, se administró a tres adultos jóvenes inyecciones subretiniana del virus rAAV 2/2.hRPE65p.hRPE65. No se observaron cambios clínicamente significativos en la AV o el CV. No se detectaron cambios en el ERG. Un paciente tuvo una mejoría significativa en la función visual y en una prueba subjetiva de la movilidad visual.321 En una ampliación de este estudio, 12 pacientes completaron tres años de seguimiento (cuatro con una dosis más baja del vector, y ocho con una dosis más alta). Las mejoras en la sensibilidad retiniana fueron evidentes en seis participantes, alcanzando su mejor nivel entre los seis y los 12 meses tras el tratamiento y luego declinando. Tres participantes tuvieron inflamación intraocular y dos tuvieron un deterioro clínicamente significativo de la AV.322 En el momento actual, y dado que los resultados no se mantienen a largo plazo, se están estudiando otros vectores virales para mejorar la respuesta y la permanencia de esta.
muy baja
En la actualidad se encuentran en diferentes etapas de desarrollo otros ensayos clínicos en los que se está vehiculizando el gen RPE65 con un adenovirus de serotipo 2 (AAV2) en pacientes con ACL.
En pacientes con coroideremia, actualmente hay registrado seis ensayos en Fase I o Fase I/II. Todos los estudios se llevan a cabo vehiculizando el gen CHM que codifica la proteína Rab-escort 1 (REP 1), con un AAV2, a través de una inyección subretiniana.
En el ensayo clínico multicéntrico dirigido por el Dr. Robert MacLaren (NCT01461213), seis pacientes (edad 35-63 años) con coroideremia recibieron una inyección subfoveal. Tras la administración del vector, los dos pacientes con la coroideremia más avanzada tuvieron una mejora sustancial en la AV. Los otros cuatro pacientes que tenían AV casi normal al inicio del estudio recibieron el vector sin efectos perjudiciales significativos. Los ojos tratados mejoraron su sensibilidad retiniana, a pesar de la separación de la mácula, seis meses después de la cirugía.323
muy baja
Basado en la eficacia y seguridad de la terapia génica en modelos de rata,324 se llevó a cabo un estudio en fase I donde se evaluaba la eficacia y seguridad de la inyección subretiniana de rAAV2-VMD2-hMERTK en pacientes con RP debida a mutaciones en el gen MERTK. En este ECnA, seis pacientes recibieron una inyección subretiniana de rAAV2-VMD2-hMERTK en el ojo de peor visión. Tras dos años de seguimiento, no se observaron complicaciones que pudieran ser atribuibles con certeza a la administración del vector. Tres pacientes mostraron una mejoría en la AV del ojo tratado que desapareció en dos de ellos al cabo de dos años.325
muy baja
Basados en la eficacia y la seguridad de la terapia génica en modelos animales (ratones)326,327 actualmente se están llevando a cabo dos ensayos en Fase I/II registrados en ClinicalTrial.gov donde se evalúa la tolerabilidad y seguridad de rAAV-hRS1(NCT02317887) y la seguridad y eficacia de rAAV2tYF-CB-hRS1 (NCT02416622) en pacientes con XLRS.
Basados en la eficacia y la seguridad de la terapia génica en modelos animales (ratones328 y macacos329) actualmente se están llevando a cabo dos ensayos en Fase I/II registrados en ClinicalTrial.gov donde se evalúa la eficacia y seguridad de una única inyección subretiniana de rAAV.hCNGA3 (NCT02610582) y rAAV2tYF-PR1.7-hCGB3 (NCT02599922) en pacientes con acromatopsia ligado a CNGA3.
Basados en la eficacia y seguridad de la terapia génica en modelos animales (macacos y conejos)330 y ratones331,332 actualmente se están llevando a cabo dos ensayos clínicos en Fase I/IIa registrados en ClinicalTrial.gov en pacientes con enfermedad de Stargardt. Uno evalúa la eficacia y tolerabilidad de una inyección subretiniana de SAR422459 (vector lentiviral basado en el virus de la anemia infecciosa equina) (NCT01367444),mientras que, el otro evalúa la seguridad a largo plazo, la tolerabilidad y la actividad biológica de esta molécula (NCT01736592).
Basados en la eficacia y la seguridad de la terapia génica en modelos animales (macacos)333 se están llevando a cabo dos ensayos en Fase I/II registrados en ClinicalTrial.gov donde se evalúa la seguridad y tolerabilidad de inyecciones subretinianas con dosis ascendentes de UshStat en pacientes con USH tipo 1B (NCT01505062) y esos mismos objetivos a largo plazo (NCT02065011).
Resumen de la evidencia
| Son muy pocos los estudios de calidad disponibles para informar sobre la eficacia y seguridad de los tratamientos frente a las DHR. | |
| La terapia génica en pacientes afectos de retinosquisis XL, RP por mutaciones en MERKT, ACL, coroideremia, enfermedad de Stargardt, Acromatopsia y Síndrome Usher son líneas de investigación clínica (ensayos clínicos) que se encuentran en las primeras fases de su desarrollo. | |
| Calidad muy baja | La terapia génica en la ACL se realiza vehiculizando el gen RPE65 con un adenovirus, aunque existen diferencias según la localización de la administración y el volumen inyectado, el tratamiento postquirúrgico, etc. Aunque en investigaciones iniciales no se presentaron problemas con la seguridad y la eficacia de esta terapia y se asociaron con mejoras en distintas medidas de la función visual (sensibilidad retiniana, AV y CV así como en las áreas de respuesta cerebrales que corresponden a las áreas de inyección retiniana),318-321 otros estudios con seguimientos a más largo plazo muestran que la terapia génica mejoró la sensibilidad de la retina aunque tan solo modesta y temporalmente.322 |
| Calidad muy baja | La terapia génica en la coroideremia se encuentra en un en un estado inicial, sin embargo, se ha asociado a mejoras en la AV en pacientes con coroideremia avanzada, mejoras en la sensibilidad retiniana y sin efectos perjudiciales significativos.323 |
| Calidad muy baja | Los ensayos clínicos mediante terapia génica en la RP debida a mutaciones en el gen MERTK se encuentran en una fase inicial, sin embargo, se ha asociado a mejoras en la AV en pacientes con RP por déficit de MERTK aunque este efecto parece reversible.325 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Balance entre beneficios y riesgos: Aunque la investigación de la vehiculización del gen RPE65 con un adenovirus en pacientes con ACL está en etapas iniciales de investigación, no ha mostrado problemas respecto a la seguridad y se ha asociado con mejoras en la sensibilidad retiniana, AV y CV, así como mejoras en las áreas de respuesta cerebrales corresponden a las áreas de inyección retiniana. El grupo de elaboración consideró que puede existir un beneficio neto asociado a la intervención.
- Costes y uso de recursos: No se identificaron estudios que hayan analizado los costes y usos de recursos o sobre valores y preferencias de los pacientes en relación a esta pregunta.
El grupo de elaboración propuso la inclusión de las siguientes recomendaciones.
Recomendaciones
| Condicional | Se sugiere ofrecer la terapia génica, únicamente en el contexto estricto de investigación (ensayos clínicos), a aquellos pacientes afectos de Amaurosis Congénita de Leber debida a mutaciones en RP65 que aún no hayan perdido completamente su visión, teniendo en cuenta los requerimientos éticos y legales del ensayos clínico en cuestión y tras un proceso de toma de decisiones compartidas, en el que el profesional explore las preocupaciones y expectativas del paciente candidato a la terapia e informe de los posibles riesgos y beneficios de la intervención. |
| Condicional | Se sugiere ofrecer la terapia génica, únicamente en el contexto estricto de investigación (ensayos clínicos), a aquellos pacientes afectos de coroideremia en fases avanzadas debida a mutaciones en el gen CHM que aún no hayan perdido completamente su visión, teniendo en cuenta los requerimientos éticos y legales del ensayos clínico en cuestión y tras un proceso de toma de decisiones compartidas en el que el profesional explore las preocupaciones y expectativas del paciente candidato a la terapia e informe de los posibles riesgos y beneficios de la intervención. |
| Condicional | Se sugiere ofrecer la terapia génica, únicamente en el contexto estricto de investigación (ensayos clínicos), a aquellos pacientes afectos de RP en fases avanzadas debida a mutaciones en el gen MERTK que aún no hayan perdido completamente su visión, teniendo en cuenta los requerimientos éticos y legales del ensayos clínico en cuestión y tras un proceso de toma de decisiones compartidas en el que el profesional explore las preocupaciones y expectativas del paciente candidato a la terapia e informe de los posibles riesgos y beneficios de la intervención. |
7.6. Suplementos nutricionales
- ¿Cuál es la efectividad y seguridad de los suplementos dietéticos para las personas con DHR?
7.6.1. Vitaminas
7.6.1.1. Vitamina A
Retinosis pigmentaria
La deficiencia de vitamina A dificulta la síntesis de rodopsina ya que esta es un derivado de la primera, y por lo tanto, puede ocasionar ceguera nocturna y un cuadro clínico similar a la RP. Por esta razón, se ha propuesto desde hace muchos años el tratamiento con vitamina A de los pacientes con RP para retrasar los efectos degenerativos de la enfermedad.
Una revisión sistemática de la Colaboración Cochrane analizó la efectividad y seguridad de la vitamina A y del ácido docosahexaenoico (DHA) en la prevención de la progresión de la RP.334 Esta revisión incluyó dos ECA del mismo autor para la vitamina A: Berson et al. 1993 (n=601)335 y 2004 (n=208).336
Berson et al. 1993335 comparó pacientes a los que se les administró vitamina A con otros que recibieron placebo. Este estudio también evaluó los efectos de la vitamina E pero los grupos correspondientes y sus resultados no fueron contemplados por la presente RS. En 2004, Berson et al.336 compararon la administración de vitamina A más DHA con la de vitamina A más placebo, publicando con posterioridad un interesante análisis de subgrupos.337
La heterogeneidad clínica en el tipo de participantes, las intervenciones y los grupos de comparación, así como en los instrumentos de medida, hizo que no fuera posible realizar un análisis cuantitativo conjunto de los resultados de los estudios individuales.
Campo visual
En el estudio de 1993,335 no se obtuvo diferencia estadísticamente significativa en el porcentaje de disminución del CV residual usando perimetría cinética de Goldmann entre el grupo suplementado con vitamina A (5,6%) y el grupo control (5,9%).334
En el estudio de 2004 Berson et al.336 no hallaron diferencias significativas en la tasa media anual de disminución de la sensibilidad perimétrica estática entre el grupo suplementado con vitamina A más DHA (36,95 ± 3,36 dB/año) y el grupo que recibió vitamina A más placebo (37,68 ± 3,36 dB/año, P=0,88). Sin embargo, al examinar solamente el subgrupo de pacientes (n=208) que no utilizaban vitamina A antes del comienzo del ensayo,337 los autores encontraron diferencias significativas en la disminución del declive de la sensibilidad del CV central y total a favor del grupo que recibió DHA además de la suplementación con 15.000 unidades internacionales (UI) de vitamina A, frente al grupo suplementado con igual cantidad de vitamina A más placebo. Esta diferencia solo se mantuvo durante los dos primeros años de este estudio de cuatro años de seguimiento.334
Agudeza visual
En el estudio de 1993 Berson et al. informaron de una disminución de 1,1 letras por año medida en todos los estudios por medio del test ETDRS en el grupo suplementado con vitamina A y de 0,9 letras por año en el grupo control, sin que esto supusiera una diferencia significativa entre los grupos.335
Así mismo, en el estudio de Berson et al. 2004336 tampoco se obtuvieron diferencias en el número de letras perdidas por año en el test ETDRS entre el grupo que recibió vitamina A más DHA y el que solo recibió vitamina A (0,7 letras en ambos casos).
Calidad
alta
Amplitud respuesta ERG
Berson et al. 1993 informaron de un efecto de la vitamina A en la diferencia de las amplitudes de respuestas de conos en el ERG en unidades logarítmicas estadísticamente significativa (P=0,01).335 Un análisis de subgrupo en el que solo se incluyeron participantes que al inicio presentaban una diferencia de las amplitudes de respuestas de conos en unidades logarítmicas igual o superior a 68 μV, dio como resultado una diferencia estadísticamente significativa en el ratio anual de pérdida de amplitud respuesta de conos entre los participantes suplementados con 15000 UI de vitamina A frente a aquellos que no recibían esta cantidad (8,3% de disminución anual frente a 10%, P=0,01). Así mismo, se informaron resultados estadísticamente significativos cuando se incluyeron en el análisis todos los pacientes aleatorizados: 6,1% de disminución anual en el grupo suplementado con vitamina A frente a 7,1% de disminución anual en el grupo control que no recibía esta vitamina (P=0,01). Los autores de la revisión Cochrane aclaran que estos resultados del análisis de subgrupos no han sido reproducidos en otros ECA.334
Berson et al. 2004336 no encontraron diferencias significativas en el ratio medio de disminución de la amplitud ERG 30 Hz por año de seguimiento entre pacientes suplementados con vitamina A más DHA y pacientes suplementados solamente con vitamina A (P=0,64).334
Calidad
alta
Seguridad
En ninguno de los dos ECA incluidos en la revisión se observaron eventos adversos o toxicidad relacionados con la vitamina A. Sin embargo, los efectos adversos a largo plazo aún son desconocidos.334
En modelos animales con mutaciones en gen ABCA4 la suplementación con vitamina A produce un incremento de lipofucsina en las células del EPR por una mala metabolización de los residuos de los fotorreceptores que, debido a estas mutaciones, producen metabolitos que el EPR no es capaz de eliminar. En este sentido, Radu et al.,338 demostraron un incremento de A2E y A2PE-H2 en ratones con mutación en ABCA4 tras dos meses de suplementos con vitamina A. En esta misma línea, un estudio reciente en un modelo de enfermedad de Stargardt (enfermedad debida a mutaciones en el citado gen ABCA4) en animales, mostró mejoría clínica y reducción del acúmulo de lipofucsina mediante el empleo de C20-D3-vitamin A que es un inhibidor de la dimerización de la vitamina A,339 pues, como ya se ha dicho, se sabe que esta enfermedad empeora con la suplementación de vitamina A.
Calidad
alta
Por todo ello aconsejan que los pacientes con DHR deberían ser estudiados genéticamente para descartar mutaciones en ABCA4 antes de que se les prescriban suplementos con Vitamina A.
Abetalipoproteinemia (síndrome Bassen-Kornzweig) e hipobetalipoproteinemia
Estos dos problemas genéticos provocan dificultades severas en la absorción de las vitaminas liposolubles (A, E y K) debido a la deficiente formación de lipoproteínas de baja y muy baja densidad y bajos niveles de colesterol y triglicéridos.
Se identificó un estudio de una serie de casos que había evaluado la eficacia a largo plazo de una combinación de vitamina A+E (15000 UI/día y 100 mg/kg/día, respectivamente) en la prevención de la degeneración de la retina en pacientes con abetalipoproteinemia (n=10) e hipobetalipoproteinemia homocigótica (n=3). Los pacientes fueron seguidos durante una media de 11,7 años a partir del comienzo del tratamiento, el cual empezó inmediatamente después del diagnóstico.340
Amplitud respuesta ERG
Once de los 13 pacientes tuvieron resultados por debajo de los valores normales en la amplitud en la respuesta mixta cono/bastón.340
Calidad
muy baja
Campo visual
Los siete pacientes para los que estuvo disponible la prueba perimétrica sufrieron restricciones leves del CV. No se tuvo datos para los tres restantes.340
Calidad
muy baja
Fondo de ojo
Todos los pacientes presentaron cambios pigmentarios fundoscópicos inusuales.340
Calidad
muy baja
Seguridad
Ninguno de los pacientes sufrió efectos adversos relacionados con la toxicidad de la vitamina A, lo que era esperable debido a los niveles relativamente bajos de la vitamina en sangre. No se mencionan eventos adversos relacionados con la vitamina E, siendo los niveles encontrados en sangre bajos (0,03-0,35 mg/100 ml), mientras que, a nivel tisular, los niveles fueron normales.340
Calidad
muy baja
7.6.1.2. Vitamina E
Retinosis pigmentaria
Berson et al. 1993, basándose en indicios previos de la acción protectora de las vitaminas A y E sobre la función y estructura de los fotorreceptores de la retina, llevaron a cabo un ECA que comparó el efecto de varias combinaciones de ambas vitaminas en la progresión de la RP. Los pacientes (n=601, rango edad: 18-49 años) fueron aleatorizados a recibir: 1) tratamiento con vitamina A (15.000 UI/día) (n=146), 2) tratamiento con vitamina E (400 UI/día) (n=155), 3) ambos tratamientos (n=151) o, por último, como grupo control, 4) tratamiento con dosis mínimas de ambas vitaminas (75 UI/día de vitamina A más 3 UI/día de vitamina E) (n=149). La variable de resultado principal fue la amplitud de respuesta de los conos en el ERG, con visitas anuales durante un periodo de seguimiento medio de 5,2 años.335
Campo visual
No se obtuvo efecto significativo de la vitamina A ni de la vitamina E, ni efecto de interacción en el porcentaje de descenso anual del área de CV.335
Calidad
alta
Agudeza visual
En la evaluación de la disminución de la AV por año, mediante optotipos ETDRS a una distancia de 3,2 m, no se observaron diferencias significativas en la comparación del grupo suplementado con vitamina E y el grupo control.335
Calidad
alta
Amplitud de respuesta ERG
Contrariamente a lo ocurrido con la suplementación de vitamina A, Berson et al. 1993335 no encontraron un efecto significativo de la vitamina E en la tasa de disminución de la amplitud de respuesta de los conos en el ERG a 30 Hz (grupo vitamina E: 7,9% vs. grupo control: 7,1%). Cuando se compararon los resultados combinados de los que recibieron vitamina A (grupos A y A+E) con los resultados combinados de los que no la recibieron (grupo E y grupo control), se obtuvo que la tasa de descenso anual durante los cuatro años fue significativamente más lenta para los grupos combinados de vitamina A (P=0,01). Además, aquellos que no recibieron vitamina E mantuvieron su amplitud inicial mejor que los que la recibieron (P=0,03).
Un análisis de subgrupo posterior de la cohorte con mayor amplitud de respuesta del ERG al inicio dio como resultado que el grupo tratado con vitamina E sufrió una disminución más acusada que los grupos que no recibieron vitamina E (P=0,04). Por todo ello se concluyó que la vitamina E parecía mostrar un efecto perjudicial.
Calidad
alta
Seguridad
La toxicidad de la vitamina E fue evaluada por medio de un cuestionario administrado en cada visita de seguimiento, además de mediante medidas séricas de la función hepática. No se observaron reacciones adversas al uso de la vitamina E suplementada.335
Calidad
alta
7.6.1.3. Vitamina B6
Atrofia girata
La atrofia girata es causada por la actividad deficiente de la ornitina aminotransferasa, de la que la vitamina B6 es cofactor.
La evidencia disponible acerca del efecto de la vitamina B6 sobre los trastornos asociados a la atrofia girata es muy escasa, con estudios de casos antiguos y de muy pocos pacientes.341,342 Estos estudios indicaron un efecto positivo de la suplementación con B6 en la bajada del nivel sérico de ornitina y una mejora en los parámetros asociados al ERG.
muy baja
Resumen de la evidencia
| Vitamina A en RP | |
| Calidad alta | La vitamina A no parece tener un efecto significativo en la disminución anual del CV ni en la tasa media anual de disminución de sensibilidad de campo. Tampoco parece tener un efecto beneficioso con significación estadística sobre la AV medida en disminución de letras ETDRS/año.335,336 |
| Calidad alta | La vitamina A podría proporcionar un efecto protector limitado en la tasa anual de disminución de la amplitud de respuesta del ERG 30 Hz en comparación con placebo, especialmente en los pacientes con mejores valores de amplitud de respuesta al inicio.343 |
| Calidad alta | No se han observado eventos adversos o toxicidad relacionados con la suplementación con 15000 UI/día de vitamina A en estudios realizados a medio plazo. Sin embargo se deben vigilar los posibles efectos adversos a largo plazo de la suplementación con esta vitamina liposoluble.334 |
| Se han observado incrementos de A2E y A2PE-H2 en ratones con mutación en ABCA4 tras dos meses de suplementos con vitamina A.338 | |
| Vitaminas A+E en la abetalipoproteinemia (síndrome Bassen-Kornzweig) e hipobetalipoproteinemia | |
| Calidad muy baja | La suplementación con una combinación de vitamina A y E durante un periodo largo no parece tener efectos beneficiosos de consideración sobre el CV, FO o amplitud de respuesta en el ERG. Tampoco parece haber toxicidad en la dosis estudiadas (15000 UI/día de vitamina A y 100 mg/kg/día de vitamina E).340 |
| Vitamina E en RP | |
| Calidad alta | La vitamina E no parece tener un efecto protector sobre la disminución anual del CV ni en la tasa media anual de disminución de sensibilidad de campo. Tampoco sobre la AV.335 |
| Calidad alta | La suplementación con vitamina E parece tener un efecto negativo sobre la amplitud de respuesta del ERG.335 |
| Calidad alta | No se observaron eventos adversos asociados al consumo de vitamina E en las condiciones experimentales indicadas (400 UI/día durante 4-6 años).335 |
| Vitamina B6 en atrofia girata | |
| Calidad muy baja | Puede existir un efecto positivo de la suplementación con B6 en la bajada del nivel sérico de ornitina y sobre los parámetros asociados al ERG.341,342 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: Para la vitamina A se consideró una revisión sistemática de la Colaboración Cochrane en la RP que incluye dos ECA de buena calidad por lo que, la calidad de la evidencia se considera alta. Para la vitamina E se identificó un ECA sin importante riesgo de sesgos, por lo que la calidad de la evidencia global también fue considerada alta. Para la vitamina B6 en atrofia girata se identificó tan solo dos pequeños estudios de caso antiguos de muy baja calidad.
- Balance entre beneficios y riesgos: La Vitamina A en dosis altas parece que podría ser recomendada para ralentizar la progresión de la RP. Sin embargo, la evidencia considerada para hacer esta afirmación ha sido posteriormente matizada por algunos autores, debido a que existe riesgo en interpretar como positivos los resultados de los estudios de 1993 y 2004 de Berson et al. por estar basados en análisis secundarios de los datos obtenidos344. Además, por un lado, se han observado incrementos de A2E y A2PE-H2 en ratones con mutación en ABCD4 tras dos meses de suplementos con vitamina A338. Por lo que el grupo de elaboración consideró que el balance beneficio riesgo es negativo en pacientes con RP con una mutación en ABCD4 genéticamente o sospecha de ésta. Por otro lado, la vitamina A tiene riesgo potencial de efectos indeseables producidos por el exceso de vitamina A, retinoides, y carotenoides345,346. La intoxicación aguda por hipervitaminosis A aparece después de la ingesta de 150 a 1.200 mg (500.000-4.000.000 UI) de vitamina A a lo largo de dos días para los adultos, tras una dosis única de 45 mg aproximadamente (150.000 UI) para niños en edad escolar, o después de la ingesta de alrededor de 22 mg (75.000 UI) para niños más pequeños347. Como resultado, se puede producir incluso la muerte348. Por su parte, la intoxicación crónica en el contexto de la ingesta a largo plazo de esta vitamina (que va desde varias semanas a más de tres años) se producirá con la ingestión de más de 25.000 UI/día durante más de seis años o de más de 100.000 UI/día (>30 mg/día) durante más de seis meses, aunque existe una elevada variabilidad interindividual349. Así, se han descrito numerosos casos de intoxicación aguda por vitamina A que incluyen la aparición de signos y síntomas como: náuseas, vómitos, diarrea, falta de apetito, fatiga, fiebre, dolor de cabeza por edema cerebral o elevación de la fontanela en lactantes como resultado de una mayor presión intracraneal, por citar unos pocos.350,351 Además aparecen en la lista algunas disfunciones nerviosas, como por ejemplo confusión, irritabilidad, ansiedad, depresión e ideación suicida.345 Por último, una intoxicación por vitamina aguda puede dar lugar a visión borrosa y disminución de la coordinación muscular.352 Pero los efectos indeseables se observan con mucha mayor frecuencia después de la ingesta de vitamina A de forma crónica. Los adultos que han tomado dosis elevadas de vitamina A clínicamente pueden presentar alteraciones en la piel (cambio de color, picor, eritema, descamación, rash cutáneo e incluso ulceración), caída del cabello, visión doble o borrosa, nistagmus, papiledema por pseudotumor cerebral, hematuria por disfunción renal, hepatoesplenomegalia, anemia aplásica, fatiga crónica, insomnio, parestesias, convulsiones y en ocasiones comportamiento psicótico además de alteraciones óseas o de las articulaciones.347 Entre los riesgos asociados a la ingesta también se encuentran el retraso del crecimiento y el cierre temprano de la epífisis en niños con hipervitaminosis A,353 la disminución de la densidad ósea (osteoporosis) y la aparición de fracturas óseas con mayor frecuencia y a edades más tempranas en adultos que tomaban dietas ricas en vitamina A,349 la toxicidad hepática, especialmente en pacientes con enfermedades hepáticas previas como la hepatitis vírica o los pacientes que toman medicamentos que se eliminan por vía hepática de forma crónica,354 el aumento de cáncer fundamentalmente de pulmón y, principalmente, en fumadores355 Así tendríamos que tener especial cuidado en pacientes diagnosticados además de una RP, de trastornos neuronales, como podría suceder en algunas formas de RP sindrómicas.356
El control efectivo de los niveles plasmáticos de retinol es dificultoso y poco fiable.357 En general se admite que una concentración en sangre de vitamina A >1,0 mg/l (3,5 mmol/l) es indicativa de posible toxicidad358 y habría que discontinuar la ingesta de estos suplementos si se alcanzasen estos niveles. Sin embargo, en la práctica clínica, la toxicidad por Vitamina A es realmente rara, y no se monitorizan los niveles en sangre de retinol de forma estandarizada. A pesar de todo, la Autoridad Europea de Seguridad Alimentaria ha establecido niveles máximos de ingesta tolerables para los precursores de vitamina A (retinol):359
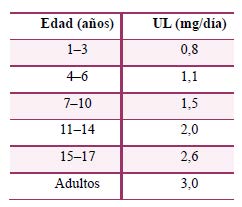
No se tiene constancia de que la vitamina A obtenida desde los β-caroteno aumente el riesgo de defectos de nacimiento. Sin embargo, sí se tiene constancia de que algunos derivados sintéticos del retinol (p. ej. etretinato, isotretinoina o tretinoina) causan serios defectos de nacimiento y no deberían ingerirse durante el embarazo o si existe la posibilidad de un embarazo. Por ello, las mujeres embarazadas o en edad fértil que puedan quedarse embarazadas deberían evitar suplementos multivitamínicos o prenatales que contengan más de 1,5 mg/día (5.000 UI) de vitamina A.
Por su parte el Consejo de Alimentación y Nutrición estadounidense (FNB) del Instituto de Medicina ha establecido niveles de ingesta máximos tolerables (UL) para los precursores de la vitamina A (retinol):360
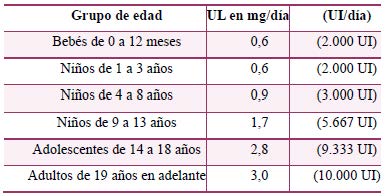
La vitamina E no parece tener un efecto protector ni en la AV, ni en el CV, sin embargo, parece que sí presenta un efecto negativo sobre la amplitud de respuesta del ERG. El grupo de elaboración consideró que puede existir un perjuicio asociado a la intervención. - Valores y preferencias de los pacientes: No se identificaron estudios publicados sobre valores y preferencias de las personas con DHR en cuanto a esta pregunta. En el estudio cualitativo realizado en el contexto español, la mayoría de los pacientes informó de haber tomado complejos vitamínicos en algún momento de su vida. Sin embargo, solo una minoría mantiene su ingestión en el tiempo. Los motivos por los que informan su cese son el cansancio, el coste asociado a los suplementos o nuevas informaciones sobre la seguridad del suplemento. Otro factor que los pacientes informaron que influyó en la toma de los suplementos fue la recepción de información contradictoria entre sus médicos (variabilidad en las recomendaciones).
- Costes y uso de recursos. No se identificaron estudios que valoren los costes asociados a la suplementación con vitaminas de las personas con DHR.
El grupo de elaboración propuso la inclusión de las siguientes recomendaciones.
Recomendaciones
| Condicional | Se sugiere evaluar a los pacientes que decidan tomar Vitamina A de forma continuada, a través de una evaluación profunda guiada por la clínica y, secundariamente, marcadores indirectos de toxicidad en órganos diana:
|
| Condicional | Se sugiere no monitorizar los niveles de Vitamina A mediante la cuantificación en suero de los niveles de vitamina A dada su baja fiabilidad. |
| Fuerte | En pacientes con DHR con mutación del gen ABCA4 o sospecha de ésta (fundamentalmente en enfermedad de Stargardt, Fundus flavimaculatus o CORD), se recomienda evitar los suplementos con Vitamina A. |
| Fuerte | En mujeres embarazadas o mujeres fértiles que puedan quedarse embarazadas, se recomienda no prescribir suplementos con Vitamina A. |
| Condicional | Se sugiere no prescribir suplementos con vitamina A en los siguientes pacientes:
|
| Fuerte | No se recomienda la suplementación con vitamina E en pacientes con RP ni en ninguna otra DHR. |
7.6.2. Otros suplementos
7.6.2.1. Ácido docosahexaenoico (DHA)
Los omega-3 son ácidos grasos poliinsaturados esenciales que se encuentran en una alta concentración en el cerebro y los ojos, donde se acumulan durante la vida fetal tardía y la neonatal temprana. En concreto, en la retina existen niveles muy altos de DHA donde se cree que desempeña un papel fundamental en la señalización y proliferación celular a través de la acción de la fosfatidilserina.
Retinosis pigmentaria
Hoffman et al. 2004 investigaron la hipótesis de que niveles bajos de DHA en sangre pueden influir en la función retiniana de las personas afectadas por XLRP. Para ello compararon el DHA 400 mg/día con placebo en pacientes varones con XLRP.361
Un ECA fase II posterior de los mismos autores trata de determinar si una dosis alta de DHA puede retrasar la progresión de la XLRP, usando como variable principal la respuesta de los conos en el ERG.362 Los participantes, todos hombres (n=78), fueron asignados a un grupo suplementado con una dosis de DHA entre 600 y 3600 mg/día o a un grupo control que recibió un placebo. Todos los participantes recibieron un complejo vitamínico que cubría la cantidad diaria recomendada de vitamina A, C, D, E, B6 y B12. La duración del estudio fue de cuatro años. El análisis de los grupos al inicio del estudio mostró que no eran totalmente comparables sino que había pequeñas diferencias, como que el grupo intervención era ligeramente de mayor edad y presentaba un mayor nivel de DHA en sangre.
Campo visual
Hoffman et al. 2004 informaron que no existieron diferencias significativas entre los grupos en el descenso de la sensibilidad campimétrica media a los cuatro años (grupo DHA: 2,4 dB ± 3,66; grupo placebo: 1,4 dB ± 1,32; P=0,29).361
Agudeza visual
En el estudio de Hoffman et al. 2004, la diferencia media de la AV tras cuatro años de seguimiento fue de 0,05 unidades logMAR (IC95%: −0,04 a 0,14), equivalente a 2,5 letras, en los participantes tratados con DHA, y de 0,06 unidades logMAR (IC95%: −0,02 a 0,14) en los participantes que recibieron placebo, lo que supuso una diferencia de menos de una letra de variación entre los dos grupos [Diferencia media: −0,01 unidades logMAR (IC95%: −0,14 a 0,12)], no significativa.361
Calidad alta
Amplitud de respuesta ERG
Hoffman et al. 2004 informan que la diferencia del cambio medio de la amplitud de respuesta de conos del ERG entre el grupo suplementado con DHA y el grupo placebo, aunque menos acusada en el primero, no fue estadísticamente significativa (P=0,20). Estos resultados pueden estar limitados dado que el estudio fue diseñado para detectar cambios anticipados de 0,085 unidades log/año, y la disminución de la amplitud de los conos del ERG fue de solamente 0,066. Un análisis de subgrupos de este estudio mostró un efecto estadísticamente significativo del DHA en la amplitud de respuesta del ERG de bastones en menores de 12 años (P=0,04). Estos resultados se invirtieron en mayores de 12 años, donde el efecto estadísticamente significativo del DHA ocurrió en la amplitud de conos del ERG pero no en bastones (P=0,038).361
Hoffman et al. 2014 no encontraron efecto del tratamiento con DHA sobre la pérdida de función mediada por conos (P=0,30), aun cuando la pérdida de función en ambos grupos fue notablemente menor que en el estudio previo,361 especialmente en el grupo placebo. Así mismo, tampoco se encontraron diferencias entre los participantes que recibieron placebo y aquellos que recibieron DHA para la tasa anual de disminución de amplitud de bastones del ERG (P=0,27) y la tasa anual de disminución de amplitud ERG máxima (P=0,65).362
Calidad
moderada/
alta
Seguridad
No hubo efectos adversos de la suplementación con ácidos grasos omega-3 (DHA) en el estudio de Hoffman et al. de 2004.361
En Hoffman et al. 2014, de los 78 participantes inscritos, 27 sufrieron 42 eventos posiblemente relacionados con el tratamiento (22 en el grupo DHA y 20 en el grupo placebo). Hubo un caso de sensibilidad al DHA en un paciente con antecedentes familiares de enfermedad de Crohn. Ninguno de los eventos necesitó hospitalización por lo que se pueden clasificar como no severos.362
Calidad
moderada/
alta
Distrofia macular viteliforme de Best
Se identificó un ECA que investiga la relación entre la suplementación con DHA y la degeneración macular en individuos con distrofia macular viteliforme de Best. Se asignó de forma aleatoria a miembros de tres familias no relacionadas (n=8) a un grupo suplementado con 20 mg/kg/día de DHA durante dos meses o al grupo placebo, para después intercambiar el tratamiento entre los grupos durante otros dos meses, y volver a intercambiarlo esta vez por cuatro meses más. Todos los participantes eran hombres, de edades entre 23 y 64 años, en diferentes estados de progresión de la enfermedad. La hipótesis detrás de este diseño era que estudios previos en animales y humanos indicaban que la deficiencia de DHA puede ser totalmente recuperada en dos meses de suplementación, y también mermada en el mismo periodo de tiempo. Además, los autores optaron por añadir cuatro meses más de tratamiento para aumentar las posibilidades de detectar mejoras visuales debidas al DHA.363
La variable de resultado primaria fue el efecto del DHA en la amplitud y tiempos de respuesta del ERG-mf. Asimismo, se midió la percepción subjetiva de la propia visión (cuestionario VF-14), la AV (ETDRS) y la media y patrón de desviación estándar del CV (Humphrey) en el mejor ojo. Además se midieron los niveles de DHA en sangre.
Campo visual
En el estudio no se encontraron diferencias significativas en el CV entre los periodos de suplementación y los de no suplementación en los grupos, ni tampoco al comparar entre grupos.363
Calidad
moderada
Agudeza visual
No se encontraron diferencias significativas en la AV entre los periodos de suplementación y los de no suplementación en los grupos, ni al comparar entre grupos, excepto para la correlación entre el nivel plasmático de DHA y la AV en el ojo izquierdo durante el tratamiento con placebo.363
Calidad
moderada
Amplitud de respuesta ERG
La amplitud central y periférica del ERG-mf no cambió significativamente en ninguno de los dos grupos durante el estudio. Sí hubo una correlación positiva entre el nivel plasmático de DHA y la amplitud del ERG-mf central en el grupo placebo; los niveles plasmáticos de DHA de los ocho participantes aumentaron durante los periodos de suplementación comparados con los periodos de no suplementación.363
Calidad
moderada
Función visual subjetiva
No hubo diferencias significativas en la puntuación de los cuestionarios VF-14 de función visual autopercibida tanto para el análisis cruzado como para el análisis de correlación.363
Calidad
moderada
Seguridad
No se informaron efectos adversos en este estudio.363
Calidad
moderada
7.6.2.2. Luteína
Retinosis pigmentaria
Se encontraron cuatro estudios cuyo objetivo era evaluar el efecto de la luteína sobre la RP.
Bahrami et al. en 2006 aleatorizaron a pacientes con RP y un CV menor de 30 grados (n=45) a tratamiento con luteína (10 mg/día las primeras 12 semanas y 30 mg/día las siguientes) o placebo durante 24 semanas. A continuación, sin periodo de lavado, se cruzaron las intervenciones entre los grupos. Desde cuatro semanas antes del inicio de la suplementación luteína/placebo, a todos los participantes del ensayo se les ofreció suplementación de multivitaminas. No se observaron diferencias significativas entre los grupos con respecto a las características basales excepto en la edad y en la sensibilidad al contraste con nivel de iluminación bajo (ambas variables fueron menores en el grupo que fue tratado inicialmente con placebo). Los pacientes fueron evaluados cada seis semanas y la variable principal fue el cambio en la AV mediante el test ETDRS.364 Los resultados de esta variable y otras secundarias recogidos en el laboratorio se publicaron en 2003 en un abstract en IOVS.365 En el artículo de Bahrami se aportan los resultados obtenidos en una serie de medidas de resultado secundarias evaluadas semanalmente por el propio paciente mediante el ordenador personal: cambio en la AV, cambio en la sensibilidad al contraste y cambio en el radio del CV central. Un total de 11 participantes se perdieron durante el seguimiento.
Otro ECA posterior sobre los efectos de la luteína fue realizado por Berson et al. en 2010, con una muestra mayor (n=240) y un periodo de tratamiento también más largo (4 años). En este ensayo multicéntrico bien diseñado y ejecutado, los pacientes fueron asignados al azar a dos grupos: el experimental, que recibió luteína (12 mg/día), y el control con placebo, que recibió una tableta diaria de almidón de maíz. Los participantes de ambos grupos recibieron suplemento de vitamina A (15.000 UI/día) en forma de palmitato de retinol y se les aconsejó por carta consumir 1-2 servicios por semana de pescado azul (rico en DHA). Se realizaron evaluaciones anuales, aunque 15 participantes (6,25%) no completaron el seguimiento de cuatro años. La medida de resultado primaria fue el cambio de la sensibilidad del CV central expresada como tasa de disminución anual de la puntuación total en el analizador de campos de Humphrey (estrategia 30-2). Los resultados secundarios fueron las tasas de disminución en: las puntuaciones totales en el programa 60-4 (CV medio-periférico) y en los programas combinados 30-2 y 60-4, en la amplitud de la respuesta a 30 Hz en el ERG y en la AV medida con el test ETDRS.366
Dagnelie et al. en 2000 examinaron el impacto de la suplementación de luteína sola o en combinación con DHA y unas multivitaminas en la RP y en otras degeneraciones de la retina relacionadas. Un grupo de pacientes (n=10) recibió únicamente luteína (40 mg/día durante nueve semanas y, a continuación, 20 mg/día hasta completar los seis meses de tratamiento) y un segundo grupo (n=10) recibió luteína (mismas dosis e intervalos de administración que el otro grupo) más DHA (500 mg/día), un complejo de vitamina B (no se informa la dosis) y enzimas digestivas (600 mg/día). Diez de los participantes en este estudio que estaban tomando previamente vitamina A y/o β-caroteno, continuaron con esos suplementos a lo largo de todo el estudio. De los 16 pacientes incluidos finalmente en el análisis, 13 estaban afectados específicamente por RP. Las evaluaciones durante el seguimiento las realizaron los propios pacientes desde sus casas (vía internet y correo electrónico) semanalmente durante 14 semanas y, posteriormente, cada dos semanas hasta los seis meses (26 semanas). Las medidas de resultado fueron el cambio en la AV, el cambio en el área de CV central y los cambios subjetivos en la visión mediante cuestionario cuestionario auto-cumplimentado.367
Por último, en un estudio preliminar prospectivo de 2001, Alemán et al. analizaron la hipótesis de que, en caso de afectación retiniana, la función retiniana puede ser estabilizada mediante suplementación del carotenoide luteína. De un total de 58 participantes, un subgrupo (n=31, de los cuales RP=21; USH2=2; RP no sindrómica=8) fueron suplementados con 20 mg diarios de luteína. Trece de los 58 participantes tomaban un suplemento de vitamina A (15.000 UI/día) antes del comienzo y siguieron tomándolo a lo largo del mismo. Las medidas de resultados incluyeron análisis de carotenoides en sangre, AV según test ETDRS, densidad del pigmento macular y sensibilidad absoluta de la fóvea.368
Agudeza visual
Bahrami et al. informaron que, en condiciones normales de iluminación (100%), la AV mejoró con la luteína pero este efecto no fue significativo. Tampoco fueron significativos los cambios en la sensibilidad al con iluminación normal, con baja iluminación (4%) ni con muy baja iluminación (0,1%).364
Berson 2010, no encontró diferencias significativas entre los grupos en la AV (P=0,80).366
Dagniele et al. 2000 observaron un aumento de la AV media (P=0,05) entre las semanas 0 y 26. Las mejoras comenzaron a las 2-4 semanas después de que empezara el tratamiento de suplementación. La mejoría fue mayor en los pacientes del grupo solo luteína frente al grupo luteína+DHA+vitamina B+enzimas digestivas (P=0,05). La ganancia de AV se correlacionó fuertemente con el color del ojo: los pacientes con ojos azules tuvieron una mejoría de la AV significativamente mayor que los pacientes con ojos oscuros (P=0,05), especialmente en condiciones de alta iluminación, con mejoras tres a cuatro veces mayores a partir de las cuatro semanas de tratamiento (P=0,01).369
El estudio de Alemán et al. 2001 encontró de media una mejora de una letra (logMAR, 0,02 ± 0,07; P=0,11). Los resultados no están diferenciados por tipo de sujeto, por lo que se entiende que corresponden a 31 participantes suplementados (RP=21, USH2=2, sujetos sanos=8).368
Calidad
moderada/baja
Campo visual
Bahrami et al. 2006 indicaron que la media del área de CV en el periodo luteína fue significativamente mayor que en el periodo placebo (P=0,038). Asumiendo seis semanas de retraso en el inicio del efecto de la luteína, este efecto sería aún mayor (P=0,001). Sin embargo, el CV se deterioró a lo largo del estudio con un cambio de -0,2% semanal (P<0,001).364
En el estudio de Berson et al. 2010, no se observaron diferencias significativas entre los grupos en la sensibilidad del CV central (P=0,66) ni tampoco en la tasa de descenso combinado de la sensibilidad del CV central y medio-periférico (P=0,24). Sin embargo, sí se obtuvo un efecto significativo del tratamiento con luteína en la sensibilidad del campo medio-periférico (P=0,05). La disminución media en la tasa de pérdida de sensibilidad del campo medio-periférico fue más lenta entre los que presentaban la concentración de luteína en suero más alta o entre los de mayor aumento en la densidad óptica del pigmento macular (P=0,01 y P=0,006, respectivamente). Aquellos con el mayor incremento en la densidad óptica del pigmento macular también mostraron la disminución más lenta en la sensibilidad combinada del CV central y medio-periférico (P=0,005).366
Dagniele et al. 2000 observaron un aumento del área de campo (P=0,05) entre las semanas 0 y 26. Las mejoras comenzaron a las 2-4 semanas después de que empezara el tratamiento de suplementación. Los pacientes que no recibían suplementos anteriormente (vitamina A y/o β- caroteno) no mostraron cambios en el área de CV central, obteniéndose una diferencia significativa frente a los que sí los recibían (P=0,05).
Calidad
moderada/
baja
Amplitud de respuesta ERG
Berson et al. en 2010 no encontraron diferencias significativas entre el grupo suplementado con luteína y el grupo placebo (P=0,59).366
Calidad
moderada
Función visual subjetiva
Los 16 pacientes estudiados en el estudio de Dagniele et al. 2000 informaron en la semana nueve y al final del estudio, mediante cuestionarios con puntuación 0-10 que no se referencian en el estudio, mejoras de más de un punto en los siguientes ítems: resplandor luz solar, adaptación luz/oscuridad, percepción color, AV central, resplandor fuentes luz artificial, visión nocturna, luces intermitentes espontáneas y percepción profundidad.369
Calidad
baja
Densidad del pigmento macular
La densidad en cuatro puntos de la retina (0,17º; 0,5º; 1º; y 2º) al inicio y tras seis meses de suplementación con luteína, en 21 pacientes que presentaban degeneración macular (sin dejar claro si incluía los dos pacientes afectados por USH2) aumentó en 0,07 en 0,17º (P=0,02), y de forma estadísticamente significativa: 0,07 en 0,5°(P=0,001), 0,08 en 1° (P=0,0004) y 0,04 en 2° (P=0,01). El aumento no fue significativo en ninguno de los cuatro puntos en los ocho individuos sin degeneración igualmente suplementados. No se reportan resultados comparativos de participantes con degeneración y participantes normales.368
Calidad
baja
Sensibilidad absoluta de la fóvea
Alemán et al. 2001, informaron de un ligero cambio en este parámetro después del periodo de suplementación con luteína al compararlo con los valores iniciales (r=0,95). La sensibilidad absoluta foveal media aumentó en 0,30 ± 1,85 dB (P=0,33) de un valor inicial de 28,41 dB. Los resultados no están diferenciados por tipo de sujeto, por lo que se entiende que corresponden a 31 participantes suplementados (RP=21, USH2=2, sujetos sanos=8).368
Calidad
baja
Seguridad
No se presentaron eventos adversos de severidad asociados al consumo de suplementos de luteína.364,366,369
Calidad
moderada/
baja
Enfermedad de Stargardt
Se identificó un estudio en el que se reclutó a pacientes con enfermedad de Stargardt o CORD, la mayoría tenían mutaciones del gen ABCA4 (n=17). Todos los participantes presentaban afectación retiniana, aunque mantenía un grado relativamente bueno de función foveal. A estos, se sumaron datos de pacientes sanos provenientes de un estudio previo (n=29), pero solamente un subgrupo de algunos pacientes (n=11) y controles sanos (n=8) participaron en un subestudio no controlado sobre la efectividad de seis meses de suplementación con luteína (20 mg/día) en el pigmento macular y la función y estructura de la retina central. La variable resultado densidad óptica del pigmento macular fue medida usando fotometría intermitente heterocromática, mientras que para la función de la visión foveal se usó el perímetro automatizado Humphrey (Zeiss, Dublin, CA). Se realizó una única visita de seguimiento al final del estudio, en la que se tomaron datos de los niveles séricos de carotenoides, densidad óptica del pigmento macular y sensibilidad de la fóvea adaptada a oscuridad total.370
Densidad del pigmento macular
Las diferencias absoluta inter-visitas (dos visitas al inicio y una a los seis meses) entre los pacientes (aquejados en su mayoría de distrofias asociadas al gen ABCA4) y los pacientes sin mutaciones del gen (pero también con problemas de degeneración de la retina), no fueron significativamente diferentes.
Dieciséis ojos de 10 pacientes se usaron para medir la respuesta de la densidad óptica del pigmento macular tras la luteína. La densidad óptica del pigmento macular foveal aumentó con la suplementación: en 0,2º, de 0,17 ± 0,09 a 0,28 ± 0,14 (t-test, P<0,001); en 0,5º, de 0,11 ± 0,06 a 0,18 ± 0,10 (P<0,001). La magnitud de estos cambios fue mayor entre los pacientes que entre los sujetos normales: en 0,2º, 0,12 ± 0,12 vs. 0,07 ± 0,06 (P=0,28); en 0,5º, 0,06 ± 0,07 vs. 0,01 ± 0,04 (P=0,02).370
Calidad
baja
Niveles séricos de luteína
Sin diferenciar entre individuos con enfermedades asociadas al gen ABCA4 y los sujetos normales, la variación en los niveles séricos de luteína tras la suplementación y al inicio fue significativamente mayor (0,74 ± 0,44 vs. −0,01 ± 0,03 μmol/L; P<0,001). La diferencia en el nivel de luteína en sangre al final del tratamiento, no fue significativamente diferente entre los 11 pacientes y los ocho sujetos normales.370
Calidad
baja
Sensibilidad absoluta de la fóvea
Este parámetro utilizado para medir la función visual central, cambió ligeramente tras el periodo de suplementación, desde el valor medio al inicio 26,2 ± 6,3 dB a 26,0 ± 6,7 dB. Los resultados pre- y post-suplementación estuvieron altamente correlacionados (r=0,94, P<0,001).370
Calidad
baja
Seguridad
El estudio no contiene información sobre eventos adversos o toxicidad de la intervención.370 Sin embargo, al ser la luteína un derivado de la vitamina A, y al estar contraindicada el uso de esta en esta enfermedad, existen dudas de si esta suplementación pudiera resultar perjudicial en esta enfermedad y en cualquiera con mutaciones en ABCA4 en general.
Calidad
baja
7.6.1.3. β-caroteno
Retinosis pigmentaria
Se ha identificado un único ECA de diseño cruzado, que estudia la relación entre la suplementación oral de 9-cis β-caroteno y la función visual en adultos no fumadores con RP.371 Durante 90 días recibieron cuatro cápsulas diarias de 300 mg cada una de polvo del alga rica en 9-cis β-caroteno Dunaliella bardawil conteniendo 20 mg aproximadamente de β-caroteno (n=16) o placebo (n=18). Terminaron la fase I del estudio 13 y 16 pacientes respectivamente, y tras un periodo de lavado de 90 días los grupos cruzaron las intervenciones sin que hubiera nuevas pérdidas de seguimiento. El estudio tuvo cuatro momentos de evaluación clínica: al inicio e inmediatamente después de los periodos de 90 días (tras el primer tratamiento, tras el periodo de lavado y tras el segundo tratamiento). El resultado de salud principal fue la respuesta ERG tanto en condiciones de adaptación a la oscuridad como a la luz, según el protocolo de la International Society for Clinical Electrophysiology of Vision. Otros resultados de salud secundarios fueron: respuesta de conos en ERG fotópico (función objetiva de los conos), respuesta escotópica del CV con estímulos cromáticos (función subjetiva de conos o bastones), respuesta adaptada a la luz del área de CV (función subjetiva de conos y bastones), y MAVC medida con el test ETDRS.
Durante el análisis de los resultados, los autores concluyen que 90 días no es un periodo suficiente de tiempo para eliminar los efectos de la Dunaliella. Algunos resultados se presentan separados en ojo izquierdo y ojo derecho; además se presentaron los resultados medios, pero no todos los pacientes experimentaron el efecto del β-caroteno.
Niveles séricos de β-caroteno
El tratamiento con Dunaliella provocó un aumento significativo en los valores plasmáticos medios de todos los trans-β-caroteno, tanto en el grupo que fue tratado primero con Dunaliella (P=0,03), como en el que fue primero tratado con placebo (P=0,01).371
Calidad
alta
Amplitud máxima del ERG
La media aritmética de la diferencia en la amplitud máxima en adaptación a la oscuridad del ERG (función objetiva de los conos-bastones en oscuridad), en el grupo tratado con Dunaliella sufrió un aumento significativo con respecto a los valores iniciales (+8,9μV, P=0,01 y +7,8μV, P=0,004 en ojos derechos e izquierdos, respectivamente); mientras que para el grupo placebo hubo un decremento en ambos ojos, pero sólo significativo en el ojo derecho (-7,9µV, P=0,03 y -3,9µV, P=0,15 en ojos derechos e izquierdos, respectivamente). La diferencia entre ambos grupos para el ojo derecho fue estadísticamente significativa (P=0,001), al igual que para el ojo izquierdo (P=0,02).
En ambos ojos en conjunto, la mejora del grupo Dunaliella fue de +8,4 ± 2,8 (P=0,004), mientras que el empeoramiento en el grupo placebo fue de -5,9 (P=0,04), resultando en una diferencia estadísticamente significativa entre ambos grupos (P=0,001). En términos de porcentaje de cambio los valores fueron +39,8% (P=0,002) y −15,9% (P=0,20) respectivamente, diferencia entre los grupos significativa P=0,002).
Todos estos resultados de la variable principal del estudio responden a la diferencia de valores entre el inicio del estudio y el final del periodo de lavado.
El cambio en función de los conos, medido objetivamente por amplitud de la onda b con Estímulo único, fue mejorado por el tratamiento con Dunaliella. Al comparar con el grupo placebo, la diferencia fue significativa: el cambio medio desde el inicio hasta el final del tratamiento fue +17,8% (+3,4 µV) para 9-cis β-caroteno frente a −3,0% (−0,7 µV) para placebo (P=0,01), (P=0,06 para los valores absolutos de respuesta).371
Calidad
alta
Campo Visual
El tratamiento con Dunaliella mejoró el área de CV adaptada a oscuridad. El test de Goldman adaptado a la oscuridad mostró un aumento significativo de la visión nocturna tras el tratamiento con el extracto de alga (+8,6 cm2; P=0,03 con respecto al inicio) y un aumento no significativo tras el tratamiento placebo (+3,8 cm2; P=0,30 con respecto al inicio). La diferencia entre grupos no fue significativa (P=0,40).
La mejora con respecto al inicio del área del CV adaptada a luz, que evalúa visión diurna y nocturna, no fue significativa en el grupo tratado con Dunaliella (+7,8; P=0,09).371
Calidad
alta
Agudeza visual
La MAVC no sufrió una mejora significativa tras el tratamiento con Dunaliella (+0,4 letras; P=0,70) o placebo (+0,15 letras; P=0,90). Tampoco se encontró diferencia tras el tratamiento con Dunaliella en comparación con placebo (P=0,90).371
Calidad
alta
Seguridad
No se encontraron efectos adversos del 9-cis β-caroteno en los tres años siguientes en los que se continuó con la suplementación tras finalizar este estudio.371 Sin embargo, un meta-análisis ha señalado un significativo aumento del cáncer de pulmón en individuos fumadores así como en trabajadores expuestos a amianto, a los que se administró suplementos con dosis de β- caroteno por encima de 20 mg/día, por lo que habría que tener especial cuidado en administrar esta suplementación en estos dos subgrupos de pacientes.372
Calidad
alta
Fundus albipunctatus
Fundus albipunctatus es una distrofia de la retina causada por mutaciones en el gen que codifica la 11-cis-retinol deshidrogenasa, cuya falta de actividad retrasa la recuperación de los conos de la estimulación lumínica provocando ceguera nocturna, aunque se han encontrado mutaciones en otros dos genes asociadas también a la enfermedad: retinaldehyde binding protein 1 (RLBP1) y RPE-specific protein (RPE65). Todos estos genes participan en el metabolismo y trasporte del retinol, por lo que parece plausible que estos pacientes pudieran mejorar con suplementos vitamínicos a base de proretinoides.
Se ha identificado un estudio antes-después realizado por Rotenstreich et al. en el año 2010, en el que pacientes con Fundus albipunctatus de entre 18 y 48 años de edad (n=7) fueron suplementados durante 90 días con 60 mg/día de β-caroteno. Las medidas de resultado estudiadas fueron el cambio en el CV con campímetro Humphrey y, en el ERG en ambos ojos: 1) La función de los conos por estímulo lumínico discreto (un solo destello de 2,44 cd/m2/seg después de 10 minutos de exposición a luz de fondo de 29,63 cd/m2); 2) La función de los conos por estímulo lumínico repetitivo (flicker a 30 Hz de cd/m2/seg); 3) Visión de los bastones adaptada a la oscuridad (respuesta aislada de los bastones para un solo estímulo de 0,023 cd/m2/seg tras 30 minutos de adaptación a la oscuridad); 4) Recuperación de la visión de bastones adaptada a la oscuridad (respuesta aislada de los bastones después de 120 minutos de adaptación a la oscuridad); 5) Función de los bastones y conos (respuesta máxima escotópica a un estímulo único de 2,44 cd/m2/seg tras 30 minutos de adaptación a la oscuridad); 6) Recuperación de la visión de bastones y conos adaptada a la oscuridad (respuesta a un solo estímulo de 2,44 cd/m2/seg después de 120 minutos de adaptación a la oscuridad).373 Se midieron los resultados de ambos ojos.
Agudeza Visual
Todos los ojos, antes y después del tratamiento, tuvieron una MAVC de 20/20, con la excepción del ojo izquierdo de una paciente aquejada de ambliopía, cuya puntuación en el test de Humphrey fue 20/200.373
Calidad
baja
Campo Visual
Las mejoras en la desviación media del CV al término del tratamiento excluyendo el ojo ambliope anteriormente descrito en el cual no se pudo medir, variaron desde -4,77 ± 2,0 hasta -3,28 ± 2,28 (P=0,009; t test).373
Calidad
baja
Amplitud del ERG
Hubo cambios significativos antes y después del tratamiento en las medidas de recuperación de la visión de bastones adaptada a la oscuridad por medio de la respuesta aislada tras 120 min de adaptación a la oscuridad con estímulo único (cambio medio ± DE=132 ± 108%, P<0,001).373
Las cuatro medidas restantes de resultados asociados al ERG no cambiaron de manera significativa.
Calidad
baja
Seguridad
No se produjo ningún evento adverso relacionado con toxicidad del 9-cis β-caroteno durante este estudio.373 Pero como fue referido anteriormente, un estudio con meta-análisis realizado por Druesne-Pecollo et al. señaló un significativo aumento del cáncer de pulmón en individuos fumadores así como en trabajadores expuestos a amianto, a los que se administró suplementos con dosis de β-caroteno por encima de 20 mg/día.372
Calidad
baja
7.6.1.4. Lisina
Atrofia girata
Nivel sérico de ornitina
Peltola et al. señalan que un régimen de suplementación de 10 g de lisina oral durante siete días mejoró la concentración sérica de ornitina en un 34%, sin producir problemas de tolerancia.374
Calidad
muy baja
7.6.1.5. Creatina
Atrofia girata
Campo visual
Sipila et al. suplementaron a siete pacientes con 1,5g/día de creatina durante un año, informando que no hubo disminución del CV de los pacientes en ese periodo.375
Calidad
muy baja
| DHA en RP | |
| Calidad alta | El DHA no parece ofrecer un efecto beneficioso sobre el CV y la AV, ni tampoco en la función visual autopercibida por el paciente.361 |
| Calidad moderada | No existe un efecto protector del DHA en la amplitud de respuesta de conos o bastones en el ERG, al compararlo con placebo.361,362 |
| Calidad moderada | No se han observaron eventos adversos severos asociados a la suplementación con DHA,361,362 aunque pacientes aquejados o con antecedentes familiares de enfermedad de Crohn podrían mostrar una sensibilidad especial al DHA.362 |
| DHA en Distrofia macular viteliforme de Best | |
| Calidad moderada | La suplementación con DHA (20 mg/kg/día) no presenta un efecto significativamente diferente al placebo sobre el CV, AV, amplitud central y periférica del ERG-mf o la función visual autopercibida por el paciente.376 |
| Calidad moderada |
El DHA suplementado en la dosis indicada no parece presentar problemas de seguridad.376 |
| Luteína en RP | |
| Calidad moderada-baja | La escasa evidencia indica un efecto beneficioso de la luteína sobre la AV, aunque es estadísticamente significativo solo en los estudios de menor calidad metodológica.364,366,368,369 |
| Calidad moderada- baja |
La evidencia indica un efecto beneficioso o protector significativamente relevante de la luteína en algunos parámetros asociados al CV, como son media del área de CV, sensibilidad del campo medio-periférico.364,366,368,369 |
| Calidad moderada | La suplementación con luteína no presentó diferencias significativas en la comparación con el grupo placebo en la tasa anual de disminución de la amplitud del ERG.366 |
| Calidad baja | La suplementación con luteína parece producir una mejora estadísticamente significativa de la densidad del pigmento macular, no así de la sensibilidad absoluta de la fóvea.368 |
| Calidad moderada-baja | No se observaron eventos adversos de severidad asociados al consumo de suplementos de luteína.364,366,369 |
| Luteína en la Enfermedad de Stargardt | |
| Calidad muy baja | El efecto de la suplementación diaria con luteína no fue estadísticamente significativo en los parámetros densidad del pigmento macular, nivel sérico de luteína, y sensibilidad absoluta de la fóvea.370 |
| β-caroteno en RP | |
| Calidad alta | La suplementación diaria con 20 mg de β-caroteno parece mejorar el área de CV, en condiciones de adaptación a oscuridad, sin embargo, la evidencia no parece indicar un efecto significativo sobre la AV.377 |
| Calidad alta | La evidencia parece indicar un efecto significativamente positivo de la suplementación diaria de β-caroteno sobre diversos parámetros asociados al ERG: amplitud máxima en adaptación a la oscuridad, porcentaje de cambio de la amplitud, variación de la función de los conos.373 |
| Calidad alta | La evidencia señala la ausencia de efectos adversos asociados a la suplementación con β-caroteno en dosis altas a corto plazo. Sin embargo, la suplementación en dosis superiores a 20 mg/día a largo plazo aumenta significativamente el riesgo de cáncer de pulmón en fumadores y en población que ha estado expuesta al amianto.371 |
| β-caroteno en Fundus albipunctatus | |
| Calidad moderada | Un único estudio disponible obtuvo un efecto positivo estadísticamente significativo de la suplementación diaria con una alta dosis de β-caroteno (60 mg) sobre la desviación media del CV y la recuperación de la función de los bastones en condiciones de adaptación a oscuridad, tras 90 días.373 |
| Calidad moderada | La evidencia parece indicar la ausencia de evento adversos o toxicidad del β-caroteno en dosis altas a corto plazo. Sin embargo, la suplementación en dosis superiores a 20 mg/día a largo plazo, aumenta significativamente el riesgo de cáncer de pulmón en fumadores y población que ha estado expuesta al amianto.371 |
| Lisina en atrofia girata | |
| Calidad muy baja | La suplementación con 10 g diarios de lisina podría mejorar el nivel sérico de ornitina.374 |
| Creatina en atrofia girata | |
| Calidad muy baja | La suplementación con 1,5g diarios de creatina podría tener un efecto protector sobre la disminución del CV.375 |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y la dirección de las recomendaciones formuladas han sido los siguientes:
- Calidad global de la evidencia: Para el DHA se identificaron varios ECA de calidad alta o moderada. Aun así la evidencia se considera escasa, por lo que la calidad de la evidencia global también fue considerada moderada.
Para la luteína en RP se consideraron dos ECA y un estudio preliminar prospectivo. La calidad global de la evidencia fue considerada moderada-baja. En relación a suplementación con luteína en otras DHR, tan solo se identificó un estudio en el que se reclutó a pacientes con enfermedad de Stargardt o CORD (n=17) de baja calidad.
Para el β-caroteno se identificó un único estudio de alta calidad para la RP y un estudio con un diseño antes-después en pacientes con fundus albipunctatus de calidad moderada/baja. La calidad de la evidencia global fue considerada alta/moderada.
Para la lisina y la creatina se identificaron sendas serie de casos por lo que la calidad de la evidencia global fue considerada muy baja. - Balance entre beneficios y riesgos: La evidencia disponible indica que el DHA no ofrece un efecto beneficioso ni protector en pacientes con RP y distrofia macular viteliforme de Best aunque por el momento parece seguro; por lo que el grupo de elaboración consideró el balance beneficio riesgo incierto en esta intervención y no emite ninguna recomendación. La evidencia disponible parece indicar un efecto beneficioso o protector sin eventos adversos de severidad asociados al consumo de suplementos de luteína en la RP. El grupo de elaboración consideró que, en el balance beneficio riesgo, los efectos deseados pueden superar a los indeseados por lo que emitió una recomendación condicional a favor. En la Enfermedad de Stargardt no se observaron beneficios.
La evidencia indica un efecto positivo de la suplementación diaria con una alta dosis de β-caroteno (60 mg) sobre el CV y la adaptación a oscuridad en pacientes con fundus albipunctatus y de dosis moderadas (20 mg) sobre el área de CV, especialmente en condiciones de adaptación a oscuridad en pacientes con RP, por lo que el grupo de elaboración consideró el balance beneficio riesgo favorable para esta intervención. Sin embargo, la suplementación en dosis superiores a 20 mg/día a largo plazo aumenta significativamente el riesgo de cáncer de pulmón en fumadores y población que ha estado expuesta al amianto, por lo que el grupo de elaboración consideró el balance beneficio riesgo desfavorable para esta intervención en esos grupos de riesgo y formula una recomendación en contra.
Para la lisina y la creatina, la evidencia es tan escasa que, no se pudo plantear un balance beneficio riesgo. - Valores y preferencias de los pacientes: En el estudio cualitativo con pacientes con DHR en el contexto español, la mayoría de los pacientes informó de haber tomado suplementos en algún momento de su vida. Sin embargo, solo una minoría mantiene su ingesta en el tiempo. Los motivos por los que informan su cese son el cansancio, el coste asociado a los suplementos o nuevas informaciones sobre la seguridad del suplemento. Otro factor que los pacientes informaron que influyó en la toma de los suplementos fue la recepción de información contradictoria entre sus médicos (variabilidad en las recomendaciones).
- Costes y uso de recursos: No se identificaron estudios que valoren los costes asociados a estas intervenciones.
El grupo de elaboración decidió no incluir recomendaciones para el DHA, lisina y creatina y propuso la inclusión de las siguientes recomendaciones para la luteína y el β-caroteno.
Recomendaciones
| Condicional | Se sugiere la suplementación con luteína a pacientes con RP. Se sugiere informar al paciente sobre el perfil de efectividad y seguridad del suplemento con el fin de resolver sus dudas y de aumentar su adherencia. |
| Fuerte | En pacientes fumadores, se recomienda evitar suplementos que contengan β-caroteno. |
| Fuerte | En pacientes que han estado expuestos al amianto, se recomienda evitar suplementos que contengan β-caroteno. |
| Condicional | Se sugiere el uso de dosis altas de β-caroteno (60 mg) en pacientes con fundus albipunctatus para mejorar la visión nocturna a corto plazo. |
| Condicional | Se sugiere el uso de dosis moderadas de β-caroteno (20 mg) en pacientes con RP. Se sugiere informar al paciente sobre el perfil de efectividad y seguridad del suplemento con el fin de resolver sus dudas y de aumentar su adherencia. |
Bibliografía 7. Abordaje terapéutico general
276. Margaron P, Castaner L, Narfström K. Evaluation of Intravitreal -Retinoid Replacement Therapy in a Canine Model of Leber's Congenital Amaurosis. ARVO http://www.qltinc.com/development/products/documents/ARVO2009Poster.pdf (2009).
277. Merin S, Obolensky A, Farber MD, et al. A pilot study of topical treatment with an alpha2-agonist in patients with retinal dystrophies. J Ocul Pharmacol Ther 2008; 24: 80– 86.
278. Pasantes-Morales H, Quiroz H, Quesada O. Treatment with taurine, diltiazem, and vitamin E retards the progressive visual field reduction in retinitis pigmentosa: A 3-year follow-up study. Metab Brain Dis 2002; 17: 183–197.
280. Clemson CM, Tzekov R, Krebs M, et al. Therapeutic potential of valproic acid for retinitis pigmentosa. Br J Ophthalmol 2011; 95: 89–93.
281. Bhalla S, Joshi D, Bhullar S, et al. Long-term follow-up for efficacy and safety of treatment of retinitis pigmentosa with valproic acid. Br J Ophthalmol 2013; 97: 895–9.
282. Kumar A, Midha N, Gogia V, et al. Efficacy of Oral Valproic Acid in Patients with Retinitis Pigmentosa. J Ocul Pharmacol Ther 2014; 30: 580–586.
283. Akiyama M, Ikeda Y, Yoshida N, et al. Therapeutic efficacy of topical unoprostone isopropyl in retinitis pigmentosa. Acta Ophthalmol 2014; 92: e229–e234.
284. Tawada A, Sugawara T, Ogata K, et al. Improvement of central retinal sensitivity six months after topical isopropyl unoprostone in patients with retinitis pigmentosa. Indian J Ophthalmol 2013; 61: 95–9.
285. Gahlot DK, Sood VP, Khosla PK. Effect of penicillamine on the sensori-neural deafness of retinitis pigmentosa. J Laryngol Otol 1977; 91: 1107–1111.
286. Gahlot DK. Penicillamine-A new therapy of retinitis pigmentosa. Indian J Ophthalmol 1981; 29: 355–358.
287. Greenstein VC, Holopigian K, Siderides E, et al. The effects of acetazolamide on visual function in retinitis pigmentosa. Investig Ophthalmol Vis Sci 1993; 34: 269–273.
288. Katznelson LA, Khoroshilova-Maslova IP, Eliseyeva RF. A new method of treatment of retinitis pigmentosa/pigmentary abiotrophy. Ann Ophthalmol 1990; 22: 167–172.
289. Nakazawa M, Ohguro H, Takeuchi K, et al. Effect of nilvadipine on central visual field in retinitis pigmentosa: A 30-month clinical trial. Ophthalmologica 2011; 225: 120–126.
290. Nakazawa M, Suzuki Y, Ito T, et al. Long-Term Effects of Nilvadipine against Progression of the Central Visual Field Defect in Retinitis Pigmentosa : An Extended Study. Hindawi Publ Corp 2013; 2013: ID 585729.
291. Newsome D, Dorsey F, May J, et al. Glanglioside administration in retinitis pigmentosa. J Ocul Pharmacol 1987; 3: 323–332.
292. Birch D, Weleber R, Duncan J, et al. Randomized trial of ciliary neurotrophic factor deliveresd by encapsulated cell intraocular implants for retinitis pigmentosa. Am J Ophthalmol 2013; 156: 283–292.
293. Talcott KE, Ratnam K, Sundquist SM, et al. Longitudinal study of cone photoreceptors during retinal degeneration and in response to ciliary neurotrophic factor treatment. Invest Ophthalmol Vis Sci 2011; 52: 2219–26.
294. Pilli S, Zawadzki RJ, Telander DG. The dose-dependent macular thickness changes assessed by FD-OCT in patients with retinitis pigmentosa treated with ciliary neurotrophic factor. Retina 2014; 34: 1384–1390.
295. Palanker D, Vankov A, Huie P, et al. Design of a high-resolution optoelectronic retinal prosthesis. J Neural Eng 2005; 2: S105–20.
296. Huang Q, Chowdhury V, Coroneo MT. Evaluation of patient suitability for a retinal prosthesis using structural and functional tests of inner retinal integrity. J Neural Eng 2009; 6: 35010.
297. Fernandes R a B, Diniz B, Ribeiro R, et al. Artificial vision through neuronal stimulation. Neurosci Lett 2012; 519: 122–128.
298. Chow AY, Chow VY, Packo KH, et al. The artificial silicon retina microchip for the treatment of vision loss from retinitis pigmentosa. Arch Ophthalmol 2004; 122: 460–469.
299. Yanai D, Weiland JD, Mahadevappa M, et al. Visual Performance Using a Retinal Prosthesis in Three Subjects With Retinitis Pigmentosa. Am J Ophthalmol; 143. Epub ahead of print 2007. DOI: 10.1016/j.ajo.2007.01.027.
300. Klauke S, Goertz M, Rein S, et al. Stimulation with a wireless intraocular epiretinal implant elicits visual percepts in blind humans. Investig Ophthalmol Vis Sci 2011; 52: 449–455.
301. Dorn J, Ahuja A, Caspi A, et al. The detection of motion by blinf subjects with the epiretinal 60-electrode (argus II) retinal prothesis. JAMA Ophthalmol 2013; 131: 183– 189.
302. Chow AY, Bittner AK, Pardue MT. The artificial silicon retina in retinitis pigmentosa patients (an American Ophthalmological Association thesis). Trans Am Ophthalmol Soc 2010; 108: 120–154.
303. Vaidya A, Borgonovi E, Taylor RS, et al. The cost-effectiveness of the Argus II retinal prosthesis in Retinitis Pigmentosa patients. BMC Ophthalmol 2014; 14: 49.
304. Vallejo-Torres L, García-Lorenzo B, Castilla I, et al. Valor Monetario de un Año de Vida Ajustado por Calidad: Estimación empírica del coste de oportunidad en el Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Evaluación del Servicio Canario de la Salud, 2015.
305. M.F. D, D.a. W, P. K, et al. Assessing the economic challenges posed by orphan drugs. Int J Technol Assess Health Care 2007; 23: 36–42.
306. Das T, Cerro M, Jalali S, et al. Das T. Exp Neurol. 1999.pdf. 1999; 68: 58–68.
307. Radtke ND, Aramant RB, Seiler M, et al. Preliminary report: Indications of improved visual function after retinal sheet transplantation in retinitis pigmentosa patients. Am J Ophthalmol 1999; 128: 384–387.
308. Humayun MS, De Juan E. J, Del Cerro M, et al. Human neural retinal transplantation. Investig Ophthalmol Vis Sci 2000; 41: 3100–3106.
309. Radtke ND, Seiler MJ, Aramant RB, et al. Transplantation of intact sheets of fetal neural retina with its retinal pigment epithelium in retinitis pigmentosa patients. Am J Ophthalmol 2002; 133: 544–550.
310. Berger AS, Tezel TH, Del Priore L V., et al. Photoreceptor transplantation in retinitis pigmentosa: Short-term follow-up. Ophthalmology 2003; 110: 383–391.
311. Park SS, Bauer G, Abedi M, et al. Intravitreal Autologous Bone Marrow CD34+ Cell Therapy for Ischemic and Degenerative Retinal Disorders: Preliminary Phase 1 Clinical Trial Findings. Invest Ophthalmol Vis Sci 2014; 56: 81–89.
312. Siqueira RC, Messias A, Voltarelli JC, et al. Intravitreal Injection of Autologous Bone Marrow–Derived Mononuclear Cells for Hereditary Retinal Dystrophy. Retina 2011; 31: 1207–1214.
313. Radtke ND, Aramant RB, Petry HM, et al. Vision Improvement in Retinal Degeneration Patients by Implantation of Retina Together with Retinal Pigment Epithelium. Am J Ophthalmol; 146. Epub ahead of print 2008. DOI: 10.1016/j.ajo.2008.04.009.
314. Schwartz SD, Regillo CD, Lam BL, et al. Human embryonic stem cell-derived retinal pigment epithelium in patients with age-related macular degeneration and Stargardt's macular dystrophy: Follow-up of two open-label phase 1/2 studies. Lancet 2015; 385: 509–516.
315. Schwartz SD, Hubschman J, Heilwell G, et al. Embryonic stem cell trials for macular degeneration: a preliminary report. Lancet 2012; 379: 713–720.
316. Van Hooser JP, Aleman TS, He YG, et al. Rapid restoration of visual pigment and function with oral retinoid in a mouse model of childhood blindness. Proc Natl Acad Sci U S A 2000; 97: 8623–8628.
317. Acland G, Aguirre G, Ray J, et al. Gene therapy restores vision in a canine model of childhood blindness. Nat Genet 2001; 28: 92–5.
318. Jacobson SG, Cideciyan A V, Ratnakaram R, et al. Gene Therapy for Leber Congenital Amaurosis caused by RPE65 mutations: Safety and Efficacy in Fifteen Children and Adults Followed up to Three Years. Arch Ophthalmol 2012; 130: 9–24.
319. Bennett J, Ashtari M, Wellman J, et al. AAV2 gene therapy readministration in three adults with congenital blindness. Sci Transl Med 2012; 8: 120.
320. Weleber RG, Pennesi ME, Wilson DJ, et al. Results at 2 Years after Gene Therapy for RPE65-Deficient Leber Congenital Amaurosis and Severe Early-Childhood-Onset Retinal Dystrophy. Ophthalmology 2015; 123: 1606–1620.
321. Bainbridge JWB, Smith AJ, Barker SS, et al. Effect of gene therapy on visual function in Leber's congenital amaurosis. N Engl J Med 2008; 358: 2231–39.
322. Bainbridge J, Mehat M, Sundaram V, et al. Long-term effect of gene therapy on Leber's congenital amaurosis. N Engl J Med 2015; 372: 1887–97.
323. MacLaren RE, Groppe M, Barnard AR, et al. Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. Lancet 2014; 383: 1129– 37.
324. LaVail M, Yasumura D, Matthes M, et al. Gene Therapy for MERTK-Associated Retinal Degenerations. Adv Exp Med Biol 2016; 854: 487–493.
325. Ghazi N, Abboud E, Nowilaty S, et al. Treatment of retinitis pigmentosa due to MERTK mutations by ocular subretinal injection of adeno-associated virus gene vector: results of a phase I trial. H. Hum Genet 2016; 135: 327–343.
326. Ye G, Budzynski E, Sonnentag P, et al. Safety and Biodistribution Evaluation of rAAV2tYF-CB-hRS1, a Recombinant Adeno-Associated Virus Vector Expressing Retinoschisin, in RS1-Deficient Mice. Hum Gene Ther Clin Dev; 26.
327. Bush RA, Yong Z, Peter C, et al. Preclinical Dose-Escalation Study of Intravitreal AAVRS1 Gene Therapy in a Mouse Model of X-linked Retinoschisis: Dose-Dependent Expression and Improved Retinal Structure and Function. Hum Gene Ther 2016; 27: 376–389.
328. Ye G, Budzynski E, Sonnentag P, et al. Safety and Biodistribution Evaluation in CNGB3-deficient Mice of rAAV2tYF-PR1.7-hCNGB3, a Recombinant AAV Vector for Treatment of Achromatopsia. Hum Gene Ther Clin Dev; 7.
329. Ye G, Budzynski E, Sonnentag P, et al. Safety and Biodistribution Evaluation in Cynomolgus Macaques of rAAV2tYF-PR1.7-hCNGB3, a Recombinant AAV Vector for Treatment of Achromatopsia. Hum Gene Ther Clin Dev; 8.
330. Binley K, Widdowson P, Loader J, et al. Transduction of photoreceptors with equine infectious anemia virus lentiviral vectors: Safety and biodistribution of stargen for stargardt disease. Investig Ophthalmol Vis Sci 2013; 54: 4061–4071.
331. Han Z, Conley S, Naash M. Gene therapy for Stargardt disease associated with ABCA4 gene. Adv Exp Med Biol 2014; 801: 719–724.
332. Trapani I, Toriello E, De Simone S, et al. Improved dual AAV vectors with reduced expression of truncated proteins are safe and effective in the retina of a mouse model of Stargardt disease. Hum Mol Genet 2015; 24: 6811–6825.
333. Zallocchi M, Binley K, Lad Y, et al. EIAV-based retinal gene therapy in the shaker1 mouse model for usher syndrome type 1B: Development of UshStat. PLoS One; 9. Epub ahead of print 2014. DOI: 10.1371/journal.pone.0094272.
334. Rayapudi S, Schwartz S, Wang X, et al. Vitamin A and fish oils for retinitis pigmentosa. Cochrane Database Syst Rev 2013; 12: CD008428.
335. Berson E, Rosner B, Sandberg M, et al. A randomized trial of vitamin A and vitamin E supplementation for retinitis pigmentosa. Arch Ophthalmol 1993; 111: 761–72.
336. Berson EL, Rosner B, Sandberg MA, et al. Clinical trial of docosahexaenoic acid in patients with retinitis pigmentosa receiving vitamin A treatment. Arch Ophthalmol 2004; 122: 1306–14.
337. Berson EL, Rosner B, Sandberg MA, et al. Further Evaluation of Docosahexaenoic Acid in Patients With Retinitis Pigmentosa Receiving Vitamin A Treatment. Arch Ophthalmol 2004; 122: 1306–14.
338. Radu R a, Yuan Q, Hu J, et al. Accelerated accumulation of lipofuscin pigments in the RPE of a mouse model for ABCA4-mediated retinal dystrophies following vitamin a supplementation. Invest Ophthalmol Vis Sci 2008; 49: 3821–3829.
339. Charbel Issa P, Barnard AR, Herrmann P, et al. Rescue of the Stargardt phenotype in Abca4 knockout mice through inhibition of vitamin A dimerization. Proc Natl Acad Sci 2015; 112: 8415–20.
340. Chowers I, Banin E, Merin S, et al. Long-term assessment of combined vitamin A and E treatment for the prevention of retinal degeneration in abetalipoproteinaemia and hypobetalipo-proteinaemia patients. Eye 2001; 15: 525–30.
341. Kennaway NG, Weleber RG, Buist NR. Gyrate atrophy of the choroid and retina with hyperornithinemia: biochemical and histologic studies and response to vitamin B6. Am J Hum Genet 1980; 32: 529–541.
342. Weleber RG, Kennaway NG. Clinical Trial of Vitamin B6 for Gyrate Atrophy of the Choroid and Retina. Ophthalmology 1981; 88: 316–24.
344. Massof RW, Fishman G a. How strong is the evidence that nutritional supplements slow the progression of retinitis pigmentosa? Arch Ophthalmol 2010; 128: 493–495.
345. Snodgrass S. Vitamin neurotoxicity. Mol Neurobiol 1992; 6: 41–73.
346. Napoli JL. Retinoic acid: its biosynthesis and metabolism. Prog Nucleic Acid Res Mol Biol 1999; 63: 139–88.
347. Rutkowski M, Grzegorczyk K. Adverse effects of antioxidative vitamins. Int J Occup Med Environ Health 2012; 25: 105–121.
348. Kapil U. Time to stop giving indiscriminate massive doses of synthetic vitamin A to Indian children. Public Health Nutr 2009; 12: 285.
349. Penniston KL, Tanumihardjo S. The acute and chronic toxic effects of vitamin A. Am J Clin Nutr 2006; 83: 191–201.
350. Allen H, Haskell M. Estimating the potentual for vitamin A toxicity in women and young children. J Nutr 2002; 132: 2907–19S.
351. Lam H, Chow C, Poon W, et al. Risk of vitamin A toxicity from candy-like chewable vitamin supplements for children. Pediatrics 2006; 118: 820–4.
352. Olson J. Vitamin A. Present Knowledge in Nutrition. In: Present Knowledge in Nutrition. Washington, DC: The Nutrition Foundation, 1993, pp. 176–91.
353. Lawson J, McGuire J. The spectrum of skeletal changes associated with long-term administration of 13-cis-retinoic acid. Skelet Radiol 1987; 16: 91–7.
354. Geubel A, De Galocsy C, Alves N, et al. Liver damage caused by therapeutic vitamin A administration: estimate of dose-related toxicity in 41 cases. Gastroenterology 1991; 100: 1701–9.
355. Greenberg ER, Baron JA, Stukel TA, et al. A clinical trial of beta carotene to prevent basal-cell and squamous-cell cancer of the skin. N Engl J Med 1990; 323: 789–95.
356. Oliveira MR De. The neurotoxic effects of vitamin A and retinoids. 2015; 87: 1361– 1373.
357. Alpers DH. Vitamins as drugs: the importance of pharmacokinetics in oral dosing. Curr Opin Gastroenterol 2011; 27: 146–51.
358. Halliwell B. Establishing the significance and optimal intake of dietary antioxidants: the biomarker concept. Nutr Rev 1999; 57: 104–13.
359. European Food Safety Authority. Tolerable Upper Intake Levels Scientific Committee on Food Scientific Panel on Dietetic Products, Nutrition and Allergies. 2006.
360. Food and Nutrition Board I of M. Vitamin A. In: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington D.C.: National Academy Press, 2001, pp. 65–126.
361. Hoffman DR, Locke KG, Wheaton DH, et al. A randomized, placebo-controlled clinical trial of docosahexaenoic acid supplementation for X-linked retinitis pigmentosa. Am J Ophthalmol 2004; 137: 704–18.
362. Hoffman DR, Hughbanks-Wheaton DK, Pearson NS, et al. Four-year placebo-controlled trial of docosahexaenoic acid in X-linked retinitis pigmentosa (DHAX trial): a randomized clinical trial. JAMA Ophthalmol 2014; 132: 866–73.
363. Lee TKM, Clandinin MT, Hébert M, et al. Effect of docosahexaenoic acid supplementation on the macular function of patients with Best vitelliform macular dystrophy: randomized clinical trial. Can J Ophthalmol 2010; 45: 514–9.
364. Bahrami H, Melia M, Dagnelie G. Lutein supplementation in retinitis pigmentosa : PCbased vision assessment in a randomized double-masked placebo-controlled. BCM Ophthalmol 2006; 6: 23.
365. Dagnelie G, Melia B, Sunness J. Lutein supplementation in RP: Vision measures in the clinic. Invest Ophthalmol Vis Sci 2003; 44: 780.
366. Berson E, Rosner B, Sandberg M, et al. Clinical trial of lutein in patients with retinitis pigmentosa receiving vitamin A. Arch Ophthalmol 2010; 128: 403–11.






