Evaluar el RCV se ha convertido en el método más aceptado para tomar decisiones de prevención primaria en pacientes sin enfermedad cardiovascular. Después de varios años de utilización en nuestro medio de las tablas originales del estudio Framingham para el cálculo del riesgo coronario (RC), con la aparición de tablas adaptadas a la población española se ha suscitado cierta controversia sobre la utilización de las tablas Framingham originales, o en su lugar, las de los proyectos SCORE o REGICOR (tablas del estudio Framingham adaptadas a la población española).
Por ello, una de las preguntas que se plantean es ¿Qué tabla de RCV es la más adecuada para emplear en prevención primaria en nuestro entorno? y una vez respondida esta pregunta, ¿cuál debe ser el punto de corte a partir del cual recomendar la intervención terapéutica?.
Evidencia científica
La guía NICE16 señala que en población en prevención primaria de ECV se debe hacer una estimación del riesgo mediante la utilización de ecuaciones de cálculo de riesgo. Los pacientes deben recibir información clara sobre los riesgos y beneficios de una intervención durante un periodo de 10 años. La información debe presentarse de forma clara, con el riesgo de eventos presentados numéricamente, con diagramas y texto adecuado.
En cuanto a la identificación de población a la que habría que valorar el RCV, NICE recomienda hacer una identificación previa de las personas de mayor riesgo y aplicarles la ecuación de riesgo. Esta identificación se haría en base a la información recogida en la historia clínica sobre HTA, lípidos o tabaco. La prevención de la ECV debe hacerse utilizando estrategias de priorización de pacientes con mayor probabilidad de alto riesgo.
En la GPC de Osakidetza de 200814 se recomendaba el uso de las tablas de riesgo coronario del proyecto REGICOR como herramienta de ayuda para la toma de decisiones.
En los últimos años se han desarrollado varias funciones de riesgo. A nivel del estado español se han venido utilizando principalmente tres de ellas: Framinghan, REGICOR y SCORE. Las tablas de Framinghan sobreestiman el RCV en poblaciones con bajo riesgo36;37, por lo que no deberían emplearse en países como el nuestro al encontrarse entre los países que presentan las tasas de morbimortalidad por cardiopatía isquémica más bajas de Europa6.El proyecto SCORE, a partir del análisis de estudios de cohortes europeas, ha elaborado tablas para países de alto y bajo riesgo y tablas construidas con el colesterol total y con lipoproteínas de alta densidad38. En el diseño de esta función de riesgo se utilizaron predominantemente cohortes de base poblacional, pero se incluyeron también datos de cohortes ocupacionales de Francia, Italia y España para aumentar la representación de regiones de bajo riesgo. En estos estudios, la cohorte española aportó un 6,1% en el desarrollo de las tablas para países de bajo riesgo y un 2,8% del total.
La tabla SCORE estima el riesgo de muerte cardiovascular (muerte coronaria, por enfermedad cerebrovascular, arteriopatia periférica, insuficiencia cardíaca, aneurisma disecante de aorta y otras) en sujetos de 40 a 65 años, y considera un riesgo alto cuando la probabilidad de muerte cardiovascular a los 10 años es mayor o igual al 5%.
SCORE no incluye pacientes diabéticos, que considera que tienen un riesgo similar a los de prevención secundaria, aunque hay estudios39;40 que han demostrado que la diabetes y la cardiopatía isquémica no son equivalentes de riesgo cardiovascular, ya que los pacientes diabéticos sin antecedente de enfermedad cardiovascular tienen menor incidencia de cardiopatía isquémica y mortalidad cardiovascular que los pacientes con infarto de miocardio previo sin diabetes.
Se ha realizado un estudio de calibración de la función de riesgo SCORE para España41 en el que el riesgo fue un 13% mayor que el estimado con la función de bajo riesgo. Esto supone que la utilización de SCORE calibrado implicaría tratar con estatinas a más pacientes (de 3 a 12 veces más) que con las funciones SCORE de bajo riesgo y SCORE-HDL42.
El IV Documento Conjunto de las Guías Europeas de Prevención Cardiovascular11 y la adaptación española del CEIPC recomiendan la tabla SCORE para calcular el riesgo (para países de bajo riesgo), utilizando el CT o cociente CT/c-HD43, decisión criticada por algunos autores44.
El proyecto REGICOR adaptó la función de Framinghan mediante la calibración de la misma para su uso en la población española, utilizando para ello datos del registro poblacional REGICOR36. Posteriormente, se realizó un estudio de validación consistente en el seguimiento durante cinco años de una cohorte española de 35-74 años de edad (estudio VERIFICA). Este estudio ha conseguido adaptar y validar la función de Framinghan-REGICOR a nuestra realidad epidemiológica, demostrando predecir bien la tasa de eventos coronarios a los cinco años. Además se puede aplicar en un rango etario más amplio, al incluir personas de 35 a 74 años de edad. En el estudio de validación se incluyeron pacientes diabéticos, no observando diferencias significativas entre la tasa de eventos estimados y los observados en esta cohorte para este subgrupo (941 pacietes diabéticos), por lo que también puede aplicarse a la población diabética.
No hay que olvidar que, aunque las funciones de riesgo cardiovascular constituyen la mejor herramienta para establecer prioridades en prevención primaria, las tablas de riesgo actualmente disponibles son un método bastante impreciso de predecir el riesgo individual, por lo que sólo deberían utilizarse como aproximación al mismo.
Hay varios estudios que han analizado el impacto de la utilización de una u otra ecuación de riesgo en la práctica clínica en nuestra realidad epidemiológica45-48, obteniéndose diferentes resultados en la comparación entre las diferentes ecuaciones de riesgo.
En la población canaria, la función de Framingham estimó mejor las tasas de mortalidad que la función SCORE. Las dos funciones de SCORE (alto y bajo riesgo) predijeron riesgos que duplican o triplican las tasas poblacionales reales49.
Varios estudios han observado que la aplicación de SCORE en mayores de 60 años sobreestima el riesgo cardiovascular45;46, pudiendo llegar a triplicar el número de sujetos de alto riesgo candidatos a medidas preventivas en varones de 60-79 años47.
En el estudio de Maiques, la utilización de la tabla SCORE comparada con Framinghan exluiría de tratamiento con hipolipemiantes a un porcentaje elevado de pacientes con riesgo alto según Framingham (que calcula el riesgo coronario). El grupo de alto riesgo SCORE y bajo Framingham incluiría mayoritariamente a mujeres de edad avanzada, no fumadoras y con un nivel de colesterol moderado, dejando de considerar de alto riesgo a pacientes varones, edad media y colesterol elevado50.
La publicación del estudio de Marrugat y cols. publicado en 201151 diseñado para estudiar la distribución poblacional de riesgo cardiovascular de una cohorte seguida durante 10 años y analizar la validez, calibración y la discriminación de la función REGICOR, corrobora los hallazgos del estudio VERIFICA.
El estudio de Buitrago52 en una cohorte de 608 pacientes entre 40 y 65 años sin antecedentes de enfermedad cardiovascular, concluyó que SCORE obtiene mejores criterios de validez que REGICOR en la población general, aunque mientras REGICOR infraestima el riesgo coronario en un 38% (un 4,9% frente al 7,9%; p<0,001), SCORE sobreestima el riesgo de mortalidad cardiovascular en un 40%. La validez de este estudio ha sido puesta en tela de juicio por otros autores53.
El grupo elaborador de la guía ha optado por recomendar la utilización de la función REGICOR para el cálculo del riesgo coronario por: 1) disponer de un estudio de validación en nuestro medio; 2) poder aplicarse a un rango mayor de edad, sobre todo considerando que la mayor parte de los eventos y mortalidad cardiovascular se van a producir después de los 60 años en varones y 65 en mujeres54; y 3) por poder utlizarse en un mayor número de pacientes, incluidos los pacientes diabéticos.
Probablemente, en la población no diabética de 40-65 años sin evidencia de enfermedad cardiovascular podrían utilizarse ambas tablas (REGICOR y SCORE), pues identificarían a un porcentaje similar de pacientes de alto riesgo (7,9% y 9,2%, respectivamente, p=0,41) candidatos a recibir tratamiento hipolipemiante55, aunque las características de los pacientes son diferentes y la concordancia baja (kappa 0,45). Esto es comprensible, puesto que ambas miden riesgos diferentes, coronario REGICOR y cardiovascular SCORE. La función REGICOR puntúa más la presencia de sexo masculino, tabaquismo y concentraciones bajas de c-HDL, mientras que SCORE da más valor a la edad y la HTA, resultados compatibles con el riesgo coronario y cardiovascular que estiman estas funciones, respectivamente. También se tiene que tener en cuenta este hecho, ya que la eficacia del tratamiento hipolipemiante es superior en caso de cardiopatía isquémica. En este sentido, la proporción de pacientes con cifras medias de colesterol total serían superiores con la ecuación de Framingham-REGICOR56. Dado que las funciones de riesgo sirven para priorizar el uso de estatina en los pacientes en prevención primaria, la función de REGICOR podría tener más utilidad para racionalizar el uso de estos fármacos.
Como en el caso de otras guías, la consideración de qué es lo que constituye un nivel de riesgo alto, moderado, bajo o muy bajo, es una valoración subjetiva del porcentaje de riesgo que puede considerarse excesivo.
En la GPC de Osakidetza se definieron las siguientes categorías: Riesgo alto: ≥ 20%; Riesgo moderado: entre el 10 y el 19%; Riesgo bajo: entre el 5 y el 9%; Riesgo muy bajo: menor del 5%. En este caso, se fijó en el 10% el nivel de riesgo a partir del cual es necesario realizar intervenciones para reducir los eventos cardiovasculares de estos pacientes.
moderada
En este caso, se ha considerado adoptar los niveles de riesgo propuestos por Marrugat y cols., aceptando los niveles de corte pero manteniendo la denominación anterior.
moderada
moderada
Resumen de la evidencia
| Calidad moderada |
La función de riesgo coronario del proyecto REGICOR está validada en población española58. |
| Calidad moderada |
La función predice bien la tasa de eventos coronarios a los cinco años, se puede aplicar a personas de entre 35 y 74 años y en población diabética41. |
| Calidad moderada |
La sensibilidad y especificidad del punto de corte al 10% son del 37% y 88%, respectivamente42. |
Los aspectos que han determinado la fuerza y la dirección de esta recomendación han sido los siguientes:
- La calidad global de la evidencia es moderada.
Se trata de estudios de cohortes de buena calidad. La escala ha sido validada y calibrada de forma reciente por el estudio VERIFICA. - El balance entre beneficios y riesgos: los beneficios superan ligeramente los riesgos/ inconvenientes.
Aunque no es conocido el beneficio de aplicar una ecuación de riesgo para la estratificación de pacientes sin enfermedad cardiovascular en la reducción de eventos cardiovasculares, la evidencia indirecta apunta en el sentido de que la actuación sobre múltiples factores de riesgo disminuye la morbimortalidad cardiovascular. - Valores y preferencias de pacientes y/o sus cuidadores: probable incertidumbre y variabilidad en la opinión sobre los desenlaces.
- Costes y uso de recursos: los costes son bajos en relación a los beneficios.
Por lo tanto, se considera que las funciones de riesgo son el mejor instrumento actualmente disponible para detectar a los pacientes de alto riesgo, aunque su rendimiento predictivo a nivel individual es bajo. Estudios de cohortes han demostrado que las ecuaciones de riesgo, cuando se aplican a poblaciones similares a aquellas a partir de cuales se han elaborado, predicen con un alto grado de exactitud lo estimado previamente.
Recomendaciones
| Débil | Se sugiere la utilización de tablas adaptadas y validadas a la población de nuestro entorno epidemiológico. |
| Débil | Se sugiere la utilización de la ecuación de riesgo REGICOR en la valoración inicial del riesgo en las personas sin antecedentes de enfermedad cardiovascular. En el grupo de edad entre 40 y 65 años se podría utilizar también SCORE en la valoración inicial del riesgo cardiovascular. |
| Fuerte | Se recomienda no calcular el riesgo coronario según la ecuación de riesgo REGICOR en personas mayores de 74 años, ni ante la presencia de enfermedad vascular establecida, hipercolesterolemia familiar o dislipemias genéticas. |
| Fuerte | Se recomienda no calcular el riesgo cardiovascular según la ecuación SCORE en personas mayores de 65 años, ni ante la presencia de enfermedad vascular establecida, hipercolesterolemia familiar o dislipemias genéticas. |
| Débil | Se sugiere no calcular el riesgo coronario según la ecuación de riesgo REGICOR en situaciones en las que la cifra de colesterol total sea >320 mg/dl o c-LDL >230 mg/dl. |
| Débil | Se sugiere el 10% como punto de corte a partir del cual se debe recomendar la intervención farmacológica, previa actuación sobre otros factores de riesgo. |
| √ | A partir de un nivel de LDL >190 mg/dl o de un nivel de CT >290 mg/dl habría que descartar hiperlipemias genéticas teniendo en cuenta otros signos clínicos, como xantomas tendinosos o arco corneal en mayores de 45 años) y antecedentes de enfermedad precoz en el caso índice o en los familiares de primer grado. |
Las guías recomiendan el cribado de colesterol apoyándose, para ello en evidencias indirectas9;10;60;61. Se basan, en primer lugar, en la reducción de la morbimortalidad observada en los estudios de prevención secundaria realizados en pacientes con enfermedad cardiovascular. Además, dada la relación lineal observada entre colesterol y RCV y la posibilidad de predecir el RCV, se asume que se puede extrapolar a la población general los beneficios observados en los ensayos de prevención secundaria. Bajo esta premisa, el cribado de la población para detectar a los pacientes con cifras elevadas de colesterol con riesgo coronario moderado-alto y posteriormente tratarlos, disminuiría la morbimortalidad. En esta misma línea se posiciona la US Task Force sobre cuidados preventivos62.
Evidencia científica
En la GPC de Osakidetza14 se señala que en ausencia de estudios que valoren la efectividad del cribado para disminuir la morbimortalidad cardiovascular, las recomendaciones sobre la efectividad del cribado deberían apoyarse fundamentalmente en los resultados de los ensayos de prevención primaria en los diferentes subgrupos de riesgo en población general. Cabe señalar que estos ensayos se han realizado sobre poblaciones mayores de 40 años y en general, con pacientes con riesgo moderado a alto. Hay que tener en cuenta, además, que en estos ensayos de prevención primaria el número de pacientes a tratar para reducir un evento cardiovascular supera en general la cifra de 50 personas. Por otra parte, en caso de mujeres sin enfermedad coronaria, no hay evidencia de que los hipolipemiantes modifiquen la mortalidad ni la morbilidad coronaria. A estas consideraciones cabe añadir que el periodo medio de seguimiento de estos estudios fue de 4,3 años, con un rango de 3,2 a 5,2 años, y que la edad media de los participantes en los ensayos varió entre 55,1 y 75,4 años63.
En relación con la edad más recomendable para el inicio del cribado, la decisión debe estar igualmente relacionada con la efectividad de las intervenciones derivadas de la estimación de un RCV elevado. En el caso de mujeres susceptibles de prevención primaria incluso no hay evidencias que demuestren un efecto beneficioso con la intervención hipolipemiante. A pesar de ello, todas las GPC analizadas recomiendan el cribado.
Frente a los beneficios potenciales del cribado lipídico hay que situar los efectos adversos de la terapia hipolipemiante, así como el perjuicio de etiquetar a una persona como «de riesgo» y por tanto, candidata a tratamiento farmacológico, debiendo seguir por ello una serie de controles médicos durante muchos años cuando, probablemente, nunca desarrollará la enfermedad.
En la GPC de Osakidetza de 2008 se recomendaba el inicio del cribado a los 40 años en varones y a los 45 años en mujeres, así como la repetición del cálculo del riesgo coronario cada cuatro años (incluye PA, historia de diabetes, tabaco, CT y c-HDL).
base*
Resumen de la evidencia
| GPC base*(1++) |
En población entre 40 y 70 años con RCV moderado o alto el tratamiento hipolipemiante disminuye los eventos coronarios64-68. |
Recomendaciones
| √* | En población general se aconseja el cribado con perfil lipídico a los 40 años en hombres y 45 en mujeres al objeto de calcular el riesgo coronario de estas personas. |
| √* | A partir de los 40 años, en personas con riesgo bajo en la evaluación inicial mediante la función de REGICOR, debe repetirse el cálculo del riesgo coronario cada cuatro años. |
| En personas mayores de 75 años no hay evidencias que apoyen el cálculo del riesgo coronario. |
4.3. Evaluación inicial
- ¿Qué pruebas deben incluirse en el estudio inicial de un paciente para valoración de su riesgo coronario?*
- ¿En qué condiciones se deben realizar las pruebas analíticas?*
- ¿Qué marcadores pueden ayudar a mejorar la predicción de las ecuaciones de riesgo?
- ¿Cuáles son las cifras objetivo de c-LDL en prevención primaria, en prevención secundaria y en el paciente con diabetes?
¿Qué pruebas deben incluirse en el estudio inicial de un paciente para valoración de su riesgo coronario?
En la GPC de Osakidetza14, se señalaba que además de los datos necesarios para el cálculo del RC según la ecuación del proyecto REGICOR (edad, sexo, cifras de tensión arterial diastólica y sistólica, diabetes, CT, lipoproteína de alta densidad (c-HDL) y hábito tabáquico), es imprescindible realizar una anamnesis detallada sobre los antecedentes personales y familiares del paciente para descartar situaciones que confieren al paciente un RC mayor que el de la población general.
Así, la anamnesis debería incluir los antecedentes personales y familiares de enfermedad cardiovascular, interrogar sobre la aparición de eventos cardiovasculares en parientes de primer grado < 55 años en hombres y < 65 años en mujeres y sobre antecedentes familiares de alteraciones lipídicas en parientes de primer grado para descartar hiperlipidemias congénitas aterogénicas.
En cuanto a la exploración física, se debería recoger el peso y la talla (para calcular el Índice de Masa Corporal (IMC)).
Por otro lado, no se recogía la necesidad de realización de otras pruebas, como el electrocardiograma (ECG), que van a depender más de la existencia de otros factores de riesgo cardiovascular o de la existencia de patología asociada9;10;60;61;69-74.
base*
Recomendaciones
| √* | En el estudio inicial del paciente, además de recoger los datos necesarios para calcular el RC según la ecuación del proyecto REGICOR, se debe realizar una anamnesis detallada sobre los antecedentes personales y familiares de enfermedad cardiovascular o de alteraciones lipídicas en parientes de primer grado, así como registrar los datos de peso y talla. |
¿En qué condiciones se deben realizar las pruebas analíticas?*
En la GPC de Osakidetza se señalaba que para la determinación del CT y del c-HDL no es necesario extraer la muestra en ayunas, aunque la medida del c-HDL en esta situación infraestima el valor del c-HDL en un 5-10%9.
Sin embargo, una toma de decisiones de intervención, derivada de un RC moderado- alto, requiere la obtención de un valor de c-LDL por lo que es necesario realizar un perfil lipídico completo (CT, c-HDL y triglicéridos (TG)), y para ello, la analítica en ayunas es necesaria. El periodo de tiempo de ayuno necesario para obtener determinaciones fiables es de 12 horas. En cualquier caso, el periodo de ayuno no debe ser inferior a nueve horas, e incluso en estos individuos es posible que se infraestime en un 2 al 4% los valores del c-LDL9;75.
Por otro lado, considerando la variabilidad fisiológica y analítica de las mediciones, no es suficiente con una sola determinación para la toma de decisiones de diagnóstico, y menos aún, para el inicio de tratamiento y seguimiento. Entre las diferentes mediciones debe transcurrir por lo menos una semana75.
Para minimizar variaciones en las cifras de c-HDL, se recomienda a los pacientes mantener su dieta habitual y no perder peso en las dos semanas anteriores. Además, las determinaciones no deberían realizarse antes de las 12 semanas tras un IAM, y antes de las ocho semanas tras cirugía, infección bacteriana o viral, o parto, ya que estos procesos descienden las cifras de c-HDL y aumentan los valores de los TG75.
A ser posible, la extracción de sangre se debería realizar con el paciente sentado al menos durante los cinco minutos previos a la extracción. Se debe evitar la venooclusión prolongada y, en el caso de que no se consiga la extracción, el torniquete debe de soltarse al minuto de la aplicación e intentarse la extracción en el otro brazo o, como alternativa, esperar unos minutos para intentar nuevamente la punción75.
En la interpretación de los resultados analíticos es necesario valorar la variabilidad en las cifras de c-LDL que debería ser menor del 25%, y de las cifras de TG que debería ser también inferior al 50%. Si existe una variabilidad mayor se debe realizar una tercera determinación y tomar como cifra basal la media de las tres determinaciones75.
base*
Resumen de la evidencia
| GPC base*(3) |
Los valores de c-LDL, c-HDL y TG varían en un mismo individuo, tanto por fluctuaciones biológicas como por variaciones en la técnica de medición75. |
| GPC base*(3) |
El periodo de tiempo de ayuno necesario para obtener determinaciones fiables es de 12 horas. Periodos de ayuno de nueve horas es posible que infraestimen de un 2 a un 4 % los valores del c-LDL75. |
| GPC base*(3) |
El IAM, embarazo, procesos infecciosos virales o bacterianos y traumatismos que requieren cirugía, descienden las cifras de c-HDL y aumentan las de los TG75. |
Recomendaciones
| D* | Para estimar el riesgo coronario es suficiente con la determinación de CT y c-HDL como variables lipídicas. |
| D* | Para la toma de decisiones de inicio de intervención hipolipemiante es necesario realizar un perfil lipídico completo obtenido en condiciones de ayuno de 12 horas. |
| D* | Se recomienda un mínimo de dos determinaciones del perfil lipídico antes de tomar decisiones de intervención hipolipemiante. |
| D* | La extracción de sangre se debe realizar con el paciente sentado, al menos durante los cinco minutos previos a la extracción. Se debe evitar la venooclusión prolongada. Si esta no se consigue, habría que soltar el torniquete al minuto de la aplicación e intentar la extracción en el otro brazo, o bien, esperar unos minutos para intentar nuevamente la punción. |
| √* | En los resultados de los análisis clínicos se debe evitar la referencia a unas cifras de colesterol deseables o a rangos de normalidad en las cifras de lípidos, ya que la relevancia de estas dependerá de las situaciones particulares de los pacientes, como son la presencia de enfermedad cardiovascular, hipercolesterolemia familiar, hiperlipidemia familiar combinada, antecedentes familiares de enfermedad o de mortalidad cardiovascular prematura o, en ausencia de estos, del riesgo coronario de los pacientes. |
¿Qué marcadores pueden ayudar a mejorar la predicción de las ecuaciones de riesgo?
A pesar de que estas ecuaciones de riesgo predicen con bastante exactitud lo observado a nivel poblacional, cuando se aplican a nivel individual la incertidumbre sobre el verdadero riesgo individual prevalece. Una gran proporción de eventos ocurren en el grupo de individuos de riesgo intermedio, y es en este nivel de riesgo donde mayor incertidumbre se produce16.
Con el propósito de mejorar la predicción de las funciones de riesgo, sobre todo en este nivel de riesgo intermedio, se han postulado diferentes marcadores para mejorar su capacidad predictiva y ayudar en la discriminación de los pacientes de alto riesgo.
Aunque la asociación de algunos nuevos factores de riesgo (FR) con el riesgo de ECV ha sido establecido en diferentes estudios, lo que nos interesa conocer es si la adición a las ecuaciones de riesgo de nuevos marcadores mejora la discriminación, la reclasificación y, por tanto, el rendimiento del modelo de predicción.
Evidencia científica
En la GPC de Osakidetza14 se hacía una recomendación a favor de valorar la realización del índice tobillo/brazo cuando se planteaba el tratamiento farmacológico en personas con riesgo coronario entre el 10 y el 19% en la función de REGICOR, y de valorar los antecedentes familiares de enfermedad cardiovascular o de alteraciones lipídicas en familiares de primer grado.
Antecedentes familiares de enfermedad cardiovascular
Varios estudios prospectivos han mostrado que la historia familiar prematura de enfermedad coronaria es un factor de riesgo independiente de los FR tradicionales, aumentando el riesgo de desarrollar enfermedad coronaria tanto en hombres como en mujeres con familiares de primer grado con enfermedad coronaria76.
En un estudio de cohortes reciente77 con 22.841 participantes y un seguimiento de 10,9 años, se ha observado que añadir la historia familiar de enfermedad coronaria en el subgrupo de individuos en riesgo intermedio resulta en una mejoría modesta de la reclasificación neta del 2,5 % hacia una categoría de riesgo más precisa.
En otro estudio de cohortes publicado en 201278 con el objetivo de comparar la mejoría en la predicción de la incidencia de EC/ECV de seis marcadores de riesgo en participantes con riesgo intermedio, la historia familiar ofrece una modesta mejora en la reclasificación neta para los eventos coronarios (8,5% de participantes correctamente clasificados para los eventos y 7,5% para no eventos), con un NRI de 0,160.
Varias ecuaciones de riesgo79;81 han incorporado los antecedentes familiares para mejorar la predicción del riesgo, apuntando a la idea de que añadir los antecedentes familiares puede mejorar el rendimiento de los modelos de predicción del riesgo cardiovascular.
Proteína C reactiva (PCR)
En un metaanálisis de estudios prospectivos82 con más de 160.000 pacientes sin antecedente de enfermedad cardiovascular, se observó una asociación del incremento de la PCR con el aumento del riesgo de enfermedad coronaria, ictus isquémico y mortalidad cardiovascular, aunque esta asociación disminuye cuando se ajusta por los FR convencionales y el fibrinógeno.
Sin embargo, lo que se quiere conocer es si la adición de la PCR a los modelos de predicción mejora la predicción de los eventos cardiovasculares y coronarios.
En la revisión sistemática publicada por el U.S. Preventive Services Task Force (USPSTF) en 200983 para analizar la utilidad clínica de nueve nuevos FR, se observó que niveles elevados de PCR predicen un mayor riesgo de enfermedad coronaria (RR 1,58; IC95% de 1,37 a 1,83 para niveles de PCR >3,0 mg/L comparado con niveles < 1,0 mg/L). Sin embargo, los autores concluyen que la evidencia no apoya el uso rutinario de ninguno de los nuevos factores analizados para mejorar la estratificación del riesgo en el grupo de personas de riesgo intermedio.
moderada
moderada
moderada
La posibilidad de realizar el cálculo en «dos pasos», es decir, con la calculadora de Framingham primero e incluyendo a los que tienen un RCV intermedio, si tienen un ITB <0,9 aumenta el número de sujetos incluidos, cosa que también se podría realizar bajando el nivel de riesgo del Framingam a un 18 % según Murphy y cols.96. A este respecto, se está realizando un estudio en población catalana que responderá de forma más adaptada a nuestra realidad a esta pregunta97.
La adición de cada uno de estos marcadores al modelo de predicción basal mejoró el AUC. El calcio en la arteria coronaria (CAC) proporcionó una mejor discriminación y reclasificación del riesgo de eventos coronarios que el resto de los FR (el calcio en la arteria coronaria fue el que produjo el mayor incremento en el área bajo la curva ROC (0,623 vs 0,784)).
Una RS reciente98 de 25 estudios observó que la adición de información sobre el grosor de la íntima-media carotidea y la calcificación arterial coronaria (CAC) mejora la predicción de enfermedad cardiovascular en individuos de riesgo intermedio asintomáticos.
moderada
Resumen de la evidencia
| Calidad moderada | La historia familiar de enfermedad coronaria precoz produce una modesta mejoría en la reclasificación y un mayor incremento en el área bajo la curva ROC60-63;65. |
| Calidad moderada | No se ha demostrado que la inclusión de otros marcadores (el ITB y la PCR) en el cálculo del RCV mejore sus resultados20;62;66-81 |
| Calidad moderada | El calcio en la arteria coronaria proporcionó una mejor discriminación y reclasificación del riesgo de eventos coronarios que el resto de los FR. El calcio en la arteria coronaria fue el que produjo el mayor incremento en el área bajo la curva ROC (0,623 vs 0,784)82. |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de estas recomendaciones, teniendo en cuenta las siguientes comparaciones: 1) C1: Añadir antecedentes familiares de enfermedad coronaria vs. No añadir antecedentes familiares; 2) C2: Añadir calcio en arteria coronaria vs. No añadir calcio en arteria coronaria; 3) C3: Añadir ITB vs. No añadir ITB; 4) C4: Añadir PCR vs. No añadir PCR, han sido los siguientes:
-
- La calidad global de la evidencia es moderada para todas las comparaciones.
- El balance entre beneficios y riesgos:
- C1: Los beneficios superan ligeramente los riesgos.
- C2: Los riesgos/inconvenientes superan ligeramente los beneficios.
- C3: Los riesgos/inconvenientes superan ligeramente los beneficios.
- C4: Los riesgos/inconvenientes superan ligeramente los beneficios.
La historia familiar de enfermedad coronaria precoz produce una mejoría modesta en la reclasificación y mejoría del área bajo la curva ROC.
No se ha demostrado que la inclusión de otros marcadores (el ITB o la PCR) en el cálculo del RCV mejore sus resultados.
El calcio en la arteria coronaria proporcionó una mejor discriminación y reclasificación del riesgo de eventos coronarios que el resto de los FR (el calcio en la arteria coronaria fue el que produjo el mayor incremento en el área bajo la curva ROC (0,623 vs 0,784)).
La medida del calcio coronario, sin embargo, no está exenta de riesgos. La exposición a la radiación ionizante, la falta de protocolos estandarizados para su utilización en la práctica clínica, la incertidumbre sobre su beneficio real para mejorar la discriminación y el coste de esta técnica limitan actualmente su uso.
- Valores y preferencias de pacientes y/o sus cuidadores: poca incertidumbre y opiniones similares (sin variabilidad)
No se sabe, pero es lógico suponer que los pacientes estarán de acuerdo con la no realización de pruebas que no mejoran el diagnóstico de la enfermedad.
- Costes y uso de recursos:
- C1: Los costes son bajos en relación a los beneficios.
- C2, C3 y C4: Los costes son altos en relación a los beneficios.
Por lo tanto, se considera que la utilización de los antecedentes familiares de enfermedad coronaria precoz podría mejorar modestamente el rendimiento del modelo clásico de predicción del riesgo, pero que la inclusión de PCR, ITB y CAC no mejora de manera relevante la discriminación de los pacientes en situación de mayor riesgo.
Recomendaciones
| Débil | Se sugiere tener en cuenta la historia familiar de enfermedad cardiovascular precoz (hombres <55 años y mujeres < 65 años) como factor que puede aumentar su riesgo cardiovascular. |
| Débil | Se sugiere no considerar otros marcadores (como la PCR, el ITB, el CAC) para el cálculo del RCV. |
¿Cuáles son las cifras objetivo de c-LDL en prevención primaria, en prevención secundaria y en el paciente con diabetes?
Numerosos estudios han puesto de manifiesto que hay una relación continua y lineal entre CT e incidencia de enfermedad coronaria sin ningún umbral de CT definido que separe mayor o menor riesgo. Además, la incidencia de eventos coronarios fatales y no fatales varía de forma importante de unas zonas geográficas a otras, a pesar de niveles sanguíneos de colesterol simiares5. El RCV es un continuum asociado a las cifras de colesterol pero también a otros factores, por lo que parece más oportuno y práctico establecer el nivel de riesgo que puede considerarse excesivo, en lugar de definir la hipercolesterolemia (HC) de forma aislada a la de otros FR.
Por este motivo, en esta guía se evita delimitar los parámetros que definen la hipercolesterolemia, por considerarse que la toma de decisiones de intervención ante un paciente dado debe hacerse considerando de forma conjunta la presencia de los diferentes factores de RCV en esa persona.
Evidencia científica
La guía del NICE16 no recomienda el uso de cifras objetivo en prevención primaria. Para la prevención secundaria, y también para la prevención primaria en pacientes con diabetes tipo 2 en tratamiento con simvastatina, se considera una cifra objetivo de 77 mgdl.
No hay estudios que valoren la eficacia en reducir el riesgo de evento cardiovascular de un tratamiento para alcanzar cifras objetivo en prevención primaria ni en prevención secundaria. Los únicos estudios que se han identificado son metaanálisis que calculan la reducción del riesgo de enfermedad cardiovascular por cada mmol que se reduce el nivel de c-LDL, tanto cuando se compara el tratamiento con estatinas frente a placebo como cuando se compara el tratamiento con estatinas a dosis bajas frente a dosis altas99-102.
Además, no se conoce si hay diferencia en la reducción de riesgo de eventos cardiovasculares entre los pacientes respondedores frente a los no respondedores en términos de redución del nivel de c-LDL.
Se ha identificado la actualización de la Guía del American College of Cardiology sobre el tratamiento del colesterol sanguíneo para reducir el riesgo de enfermedad cardiovascular aterosclerótica en adultos103 en la que se da un giro a la estrategia de tratamiento, hasta ahora centrada en alcanzar determinados niveles objetivo de c-LDL, basándose en que: 1) los ECA actuales no indican cuáles son las cifras objetivo que se deben alcanzar; 2) no se sabe cuál es la reducción adicional del riesgo obtenido por alcanzar una determinada cifra objetivo frente a otra, y 3) no se han tenido en cuenta los potenciales efectos adversos de la utilización de tratamientos combinados para alcanzar dichos niveles objetivo.
muy baja
Resumen de la evidencia
| Calidad muy baja |
Sólo existen metaanálisis que calculan la reducción del riesgo de enfermedad cardiovascular por cada mmol que se reduce el nivel de c-LDL, tanto en prevención primaria como en secundaria99-102. |
De la Evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de estas recomendaciones han sido los siguientes:
- La calidad global de la evidencia es muy baja.
En prevención primaria, no hay estudios que evalúen la eficacia de un tratamiento para alcanzar cifras objetivo en prevención primaria frente al tratamiento sin cifras objetivo. Sí existen metaanálisis que estudian la reducción del riesgo de eventos vasculares graves por cada mmol de reducción de c-LDL en pacientes tratados con estatinas.Tanto en prevención primaria de pacientes con diabetes como en prevención secundaria, guiar el tratamiento de pacientes por niveles objetivo llevaría a aumentar la dosis de estatinas e incluso a utilizar otros tratamientos en combinación con las estatinas en aquellos pacientes que no consigan alcanzar dichas cifras, con el posible aumento de efectos adversos producidos por estos tratamientos. - El balance entre beneficios y riesgos: los riesgos/ inconvenientes superan los beneficios.En prevención primaria, no está demostrado que tratar por cifras objetivo a personas sin ECV sea eficaz. Además, podría llevar a utilizar dosis altas de estatinas.
En prevención secundaria, guiar el tratamiento de pacientes por niveles objetivo llevaría a aumentar la dosis de estatinas e incluso a utilizar otros tratamientos en combinación con las estatinas en aquellos pacientes que no consigan alcanzar dichas cifras, con el posible aumento de efectos adversos producidos por estos tratamientos.
En prevención primaria de pacientes con diabetes, guiar el tratamiento por niveles objetivo llevaría a aumentar la dosis de estatinas e incluso a utilizar otros tratamientos en combinación con las estatinas en aquellos pacientes que no consigan alcanzar dichas cifras, con el posible aumento de efectos adversos producidos por estos tratamientos.
- Valores y preferencias de pacientes y/o sus cuidadores: probable incertidumbre y variabilidad en la opinión sobre los desenlaces, aunque no se conoce cuál puede ser la opinión de los pacientes al respecto.
- Costes y uso de recursos: los costes son altos en relación a los beneficios.Se supone que el coste de tratar según cifras objetivo será mayor, dado que se intensificará el tratamiento en personas que no los hayan alcanzado (un alto porcentaje de los pacientes de los ECA no los alcanzan).
Por lo tanto, no se justifica el tratamiento por niveles objetivo de c-LDL, tanto en prevención primaria y secundaria como en prevención primaria en pacientes con diabetes.
Recomendaciones
| Fuerte | No se recomienda el tratamiento por niveles objetivo de c-LDL para la prevención primaria de eventos cardiovasculares. |
| Fuerte | No se recomienda el tratamiento por niveles objetivo de c-LDL para la prevención secundaria de eventos cardiovasculares. |
| Fuerte | No se recomienda el tratamiento por niveles objetivo de c-LDL para la prevención primaria de eventos cardiovasculares en pacientes con diabetes. |
La HF es un trastorno hereditario autosómico dominante con una penetrancia del 100 %, causada por mutaciones del receptor del c-LDL, en el gen APOB y PCSK9. Cursa con alteración del metabolismo de las lipoproteínas, caracterizado por una concentración plasmática de c-LDL muy alta, historia familiar de hipercolesterolemia, xantomas tendinosos y un aumento del riesgo de enfermedad coronaria prematura.
Es importante identificar a estos pacientes de forma precoz para establecer las medidas terapéuticas oportunas. Para el diagnóstico de la HF se han empleado diversas pruebas diagnósticas, que presentan diferente validez en función de la presencia o no de antecedentes familiares de hipercolesterolemia familiar heterozigota (HFh).
Evidencia científica
En la GPC de Osakidetza14 se señala que en la HF los niveles de c-LDL son aproximadamente el doble que los de la población general variando entre 190 y 400 mg/dl, mientras que los TG se encuentran generalmente en niveles normales104. Sin embargo, las cifras de colesterol aisladas no son suficientes para confirmar el diagnóstico de HF, debido a que el rango en el que varían estas cifras se solapa con el de hipercolesterolemia poligénica no hereditaria, con un 8 % y 18 % de falsos positivos y negativos, respectivamente105.
El estudio US MedPed propone unas cifras de CT y c-LDL para establecer el diagnóstico de sospecha de HF en función de la edad y antecedentes familiares de HF59.
En el caso de parientes de primer grado de pacientes con HF, los criterios US MedPed Program tienen una sensibilidad del 87 % y una especificidad del 98 %, respectivamente. Sin embargo, su validez como diagnóstico en población general es escasa debido a su baja sensibilidad59;106.
En un estudio realizado sobre 819 individuos con HF en España, la concentración media de CT fue de 407(DE:83) mg/dl, las cifras de c-LDL eran de 312 (DE:79 mg/dl) y las de c-HDL 53 (DE:15 mg/dl). El 22,5 % de los sujetos estudiados presentaba xantomas tendinosos y el 45,5% arco corneal. Además, 190 personas (23,2%) tenían antecedentes de enfermedad cardiovascular, siendo ésta prematura en 178 casos. La frecuencia de enfermedad cardiovascular prematura en familiares de primer y segundo grado fue del 50,3% en varones y 49,5% en mujeres. En definitiva, las características clínicas de la HF son similares a las descritas en otros países, siendo la frecuencia de enfermedad cardiovascular muy elevada en relación a la observada en población general, tanto en varones como en mujeres107.
Se han desarrollado diferentes reglas de predicción que tienen en cuenta además otras características clínicas106:
• Simon Broume Register Group (SBR): valora los niveles de colesterol, las características clínicas, el diagnóstico molecular y la historia familiar. Un diagnóstico definitivo se hace si el paciente tiene niveles altos de CT y xantomas o si el paciente tiene una mutación en el gen del r-LDL o en el gen de la apolipoproteína B-10.
• Dutch Lipid Clinic Network (DLC) o Duch MedPed: similar a la anterior. Se asignan puntos en función de la historia familiar de hiperlipidemia o de enfermedad cardíaca, según características clínicas, y finalmente en función de los niveles de c-LDL. Una puntuación mayor o igual a 8 se considera definitiva.
Respecto a su sensibilidad y especificidad, la evidencia es escasa. En un estudio108 realizado en población danesa con sospecha de HF, se testó la validez de estas pruebas diagnósticas (SBR, US MedPed y DLC) en el diagnóstico de la HF, comparándolo con el análisis genético molecular de rutina que se tomó como prueba de referencia.
El diagnóstico molecular reveló escasa diferencia en sensibilidad y especificidad entre el SBR y el Duch MedPed (ver tabla 1).
Finalmente, y aunque ninguna está validada en nuestro medio, el International Panel on Management of Familial Hypercholesterolemia y la Fundación de Hipercolesterolemia familiar, en su documento de consenso sobre Diagnóstico y Tratamiento de la Hipercolesterolemia familiar en España propone la utilización de los criterios clínicos propuestos por el Dutch Lipid Clinic Network104;109.
Tabla 1. Sensibilidad y especificidad de las diferentes reglas de criterios clínicos para el diagnóstico de HF
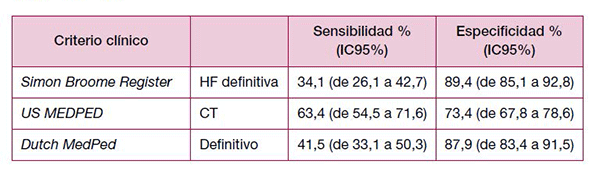
En la GPC de Osakidetza se señala que se debería realizar un cribado de hipercolesterolemia familiar a todos los familiares de primer grado de individuos con enfermedad diagnosticada. Para ello, debe hacerse una determinación de c-LDL. El diagnóstico clínico de probable HF se realizará si cumple cualquiera de los siguientes criterios104:
- Xantomas tendinosos.
- Arco corneal antes de los 45 años de edad con c-LDL ≥190 mg/dl
- LDL >250 mg/dl en individuos mayores de 18 años.
También se debería de realizar un cribado en individuos con enfermedad cardiovascular temprana y cifras de CT elevadas ( >320 mg/dl)107.
En el estudio de Civeira110 se definieron los mejores umbrales para el diagnóstico clínico con el máximo valor de la suma de sensibilidad y especificidad. En este escenario, el umbral para el diagnóstico clínico de hipercolesterolemia familar fue de 230, 238, 260 y 255 mg/dl para sujetos de <30, de 30 a 39, de 40 a 49 y >50 años, respectivamente. Estos puntos de corte son casi idénticos a los propuestos por MEDPED. Se investigó también un punto de corte con la mayor sensibilidad y con una especificidad >50%. En este segundo escenario, los puntos de corte para el diagnóstico fueron de 220, 225, 235 y 235 mg/dl para sujetos <30, de 30 a 39, de 40 a 49 y >50 años, respectivamente, ligeramente inferiores a los anteriores.
En sujetos con LDL >190 mg/dl son necesarios otros criterios, como la historia familiar de HF o xantomas tuberosos para poder establecer con una alta sospecha un diagnóstico clínico de HF.
En el mismo artículo, los autores dicen que los criterios MEDPED basados en LDL colesterol solo muestran una alta sensibilidad, especificidad, VPP y VPN. La precisión fue del 76,7%. Los criterios DLCN fueron altamente específicos (82,6%) y sensibles (88,7%), y a pesar de utilizar un sistema de puntación más complejo sus valores de precisión son comparables a los obtenidos con el MEDPED basados solo en el LDL colesterol.
base*
Resumen de la evidencia
| GPC base*(4) |
El estudio US MEDPED propone unas cifras de CT y c-LDL para establecer el diagnóstico de sospecha de HF en función de la edad y los antecedentes familiares de HF. Estas cifras de CT y c-LDL presentan una especificidad del 98 % para el diagnóstico de HF59. |
Recomendaciones
| √* | Se debe sospechar una hipercolesterolemia familiar en:
|
| √* | Se recomienda realizar una determinación de colesterol total en todos los familiares de primer grado de pacientes con hipercolesterolemia familiar a partir de los 10 años. |
| √* | A los individuos con sospecha de hipercolesterolemia familiar se les debe realizar el test Dutch MedPed (Dutch Lipid Clinic Network) y consultar con la atención especializada. |
Bibliografía 4. Evaluación del riesgo cardiovascular
(6) Müller-Nordhorn J, Binting S, Roll S, Willich SN. An update on regional variation in cardiovascular mortality within Europe. Eur Heart J. 2008 May;29(10):1316-26.
(9) Scottish Intercollegiate Guidelines Network (SIGN). Risk estimation and the prevention of cardiovascular disease: a national clinical guideline. Edinburgh 2007. Disponible en: http://www.sign.ac.uk/pdf/sign97.pdf.
(10) National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002 Dec 17;106(25):3143-421.
(11) European Association for Cardiovascular Prevention & Rehabilitation, Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, Agewall S, Alegria E, Chapman MJ, Durrington P, Erdine S, Halcox J, Hobbs R, Kjekshus J, Filardi PP, Riccardi G, Storey RF, Wood D; ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committees. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011 Jul;32(14):1769-818.
(14) San Vicente Blanco R, Pérez Irazusta I, Ibarra Amarica J, Berraondo Zabalegui I, Uribe Oyarbide F, Urraca Garcia de Madinabeitia J, et al. Guía de Práctica Clínica sobre el manejo de los lípidos como factor de riesgo cardiovascular. Osakidetza. Vitoria-Gasteiz. 2008.
(16) NICE. Cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease CG67. 2008.
(20) Brunetti M, Shemilt I, Pregno S, Vale L, Oxman AD, Lord J, et al. GRADE guidelines: 10. Considering resource use and rating the quality of economic evidence. J Clin Epidemiol. 2013 Feb;66(2):140-50.
(36) Marrugat J, D'Agostino R, Sullivan L, Elosua R, Wilson P, Ordovas J, et al. An adaptation of the Framingham coronary heart disease risk function to European Mediterranean areas. J Epidemiol Community Health. 2003 Aug;57(8):634-8.
(37) Ramos R, Solanas P, Cordón F, Rohlfs I, Elosua R, Sala J, et al. Comparación de la función de Framingham original y la calibrada del REGICOR en la predicción del riesgo coronario poblacional. Med Clin (Barc). 2003;121:521-6.
(38) Conroy RM, Pyörälä K, Fitzgerald AP, Sans S, Menotti A, De Backer D, et al., onbehalf of the SCORE Project group. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE Project. Eur Heart J. 2003;24:987-1003.
(39) Bulugahapitiya U, Siyambalapitiya S, Sithole J, Idris I. Is diabetes a coronary risk equivalent? Systematic review and meta-analysis. Diabetic Medicine. 2009;26:142-8.
(40) Cano JF, Baena-Diez JM, Franch J, Vila J, Tello S, Sala J, et al. Long-term cardiovascular risk in type 2 diabetic compared with nondiabetic first acute myocardial infarction patients: a population-based cohort study in southern Europe. Diabetes Care. 2010;33:2004-9.
(41) Sans S, Fitzgerald AP, Royo D, Conroy R, Grahan I. Calibración de la tabla SCORE de riesgo cardiovascular para España. Calibración de la tabla SCORE de riesgo cardiovascular para España. Rev Esp Cardiol. 2007;(60):476-85.
(42) Brotons C, Moral I, Soriano N, Cuixart L, Osorio D, Bottaro D, et al. Impacto de la utilización de las diferentes tablas SCORE en el cálculo del riesgo cardiovascular. Rev Esp Cardiol. 2014;67(2):94-100.
(43) Royo-Bordonada MA, Lobos JM, Villar F, Sans S, Pérez A, Pedro J, et al., en nombre del Comité Español Interdisciplinario para la Prevención Cardiovascular (CEIPC). Comentarios del Comité Español Interdisciplinario de Prevención Cardiovascular (CEIPC) a las guías europeas de prevención cardiovascular 2012. Rev Esp Salud Publica. 2013;87:103-20.
(44) Miguel-Garcia F, Merino-Senovilla A, Montero-Alonso MJ, Garcia-Ortiz A, Sanz-Cantalapiedra R, Maderuelo-Fernandez JA. La prevención según el Comité Español Interdisciplinario para la Prevención Cardiovascular: una valoración crítica. Rev Esp Salud Publica. 2010 Mar;84(2):185-201.
(45) Álvarez A, Díaz L, López V, Prieto MA, Suárez S. Comparación de los modelos SCORE y Framinghan en el cálculo de alto riesgo cardiovascular para una muestra de varones de 45 y 65 años de Asturias. Rev Esp Salud Publica. 2005;79:465-73.
(46) Baena JM, del Val JL, Salas LH, Sánchez R, Altes E, Deixens B, et al. Comparación de los modelos SCORE y REGICOR para el cálculo del riesgo cardiovascular en sujetos sin enfermedad cardiovascular atendidos en un centro de salud de Barcelona. Rev Esp Salud Publica. 2005;79:453-64.
(47) Mostaza JM, Vicente F, Taboada M, Laguna F, Echaniz A, García-Iglesias F. La aplicación de las tablas del SCORE a varones de edad avanzada triplica el número de sujetos clasificados de alto riesgo en comparación con la función de Framingham. Med Clin (Barc). 2005;124:487-90.
(48) Brotons C, Moral I, Fernández D, Cuixart L, Muñox A, Soteras A, et al. Consecuencias clínicas de la utilización de las nuevas tablas de riesgo cardiovascular SCORE OP para pacientes mayores de 65 años. Med Clin (Barc). 2016;147(9):381-6.
(49) Cabrera A, Alemán JJ, Rodríguez MC, Del Castillo JC, Dominguez S, Almeida D, et al. En la población Canaria, la función de Framingham estima mejor el riesgo de mortalidad cardiovascular que la función SCORE. Gac Sanit. 2009;33(3):216-21.
(50) Maiques A, Antón F, Franch M, Albert X, Aleixandre E, Collado A. Riesgo cardiovascular comparado con el de Framingham. Consecuencias del cambio propuesto por las Sociedades Europeas. Med Clin (Barc). 2004;123(18):681-5.
(51) Marrugat J, Vila J, Baena-Diez JM, Grau M, Sala J, Ramos R, et al. Validez relativa de la estimación del riesgo cardiovascular a 10 años en una cohorte poblacional del estudio REGICOR. Rev Esp Cardiol. 2011;64(5):385-94.
(52) Buitrago F, Cañón L, Díaz N, Cruces E, Bravo B, Pérez I. Comparación entre la tabla del SCORE y la función Framingham-REGICOR en la estimación del riesgo cardiovascular en una población urbana seguida durante 10 años. Med Clin (Barc). 2006;127(10):368-73.
(53) Ramos R, Solanas P, Subirana I, Vila J. Cartas al editor. Med Clin (Barc). 2007;128(12):477-9.
(54) Baena JM, Álvarez B, Piñol P, Martín R, Nicolau M, Altés A. Asociación entre la agrupación (clustering) de factores de riesgo cardiovascular y el riesgo de enfermedad cardiovascular. Rev Esp Salud Publica. 2002;76(7):15.
(55) Buitrago F, Cañón-Barroso L, Díaz-Herrera N, Crices-Muro E, Escobar-Fernández M, Serrano-Arias JM. Comparación de las tablas REGICOR y SCORE para la clasificación del riesgo cardiovascular y la identificación de pacientes candidatos a tratamiento hipolipemiante o antihipertensivo. Rev Esp Cardiol. 2007;60:139-47.
(56) Baena JM, Grau M, Sánchez R, Altes E, Salas LH, Hernández MR. La función calibrada REGICOR mejora la clasificación de los pacientes de alto riesgo tratados con estatinas respecto a Framingham y SCORE en la población española. Rev Esp Cardiol. 2009;62(10):1134-40.
(57) Comin E, Solanas P, Cabezas C, Subirana I, Ramos R, Gene-Badia J, et al. [Estimating cardiovascular risk in Spain using different algorithms]. Rev Esp Cardiol. 2007 Jul;60(7):693-702.
(58) Marrugat J, Subirana I, Comín E, Cabezas C, Vila J, Elosua R, et al. Validity of an adaptation of the Framingham cardiovascular risk function: the VERIFICA Study. J Epidemiol Community Health. 2007;61(1):40-7.
(59) Williams RR, Hunt SC, Schumacher MC, Hegele RA, Leppert MF, Ludwig EH, et al. Diagnosing heterozygous familial hypercholesterolemia using new practical criteria validated by molecular genetics. Am J Cardiol. 1993 Jul 15;72(2):171-6.
(60) New Zealand Guidelines group (NZGG). The Assessment and Management of Cardiovascular Risk. New Zealand Guidelines group 2003 January. Disponible en: www.nzgg.org.nz.
(61) Institute for Clinical Systems Improvement (ICSI). Lipid management in adults. Bloomington (MN): Institute for Clinical Systems Improvement (ICSI). 2007.
(62) U.S. Preventive Service Task Force. Clinical Preventive Task Force.[accedido noviembre 2007]. Disponible en: www.ahrq.gov/clinic/uspstfix.htm.
(63) Walsh JM, Pignone M. Drug treatment of hyperlipidemia in women. JAMA. 2004 May 12;291(18):2243-52.
(64) Downs JR, Clearfield M, Weis S, Whitney E, Shapiro DR, Beere PA, et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA. 1998 May 27;279(20):1615-22.
(65) Nakamura H, Arakawa K, Itakura H, Kitabatake A, Goto Y, Toyota T, et al. Primary prevention of cardiovascular disease with pravastatin in Japan (MEGA Study): a prospective randomised controlled trial. Lancet. 2006 Sep 30;368(9542):1155-63.
(66) Shepherd J, Blauw GJ, Murphy MB, Bollen EL, Buckley BM, Cobbe SM, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002 Nov 23;360(9346):1623-30.
(67) Sever PS, Dahlof B, Poulter NR, Wedel H, Beevers G, Caulfield M, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial--Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial. Lancet. 2003 Apr 5;361(9364):1149-58.
(68) Major outcomes in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin vs usual care: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT-LLT). JAMA. 2002 Dec 18;288(23):2998-3007.
(69) Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol. 2006;97:52C-60C.
(70) Cohen DE, Anania FA, Chalasani N. An assessment of statin safety by hepatologists. Am J Cardiol. 2006 Apr 17;97(8A):77C-81C.
(71) McKenney JM, Davidson MH, Jacobson TA, Guyton JR. Final conclusions and recommendations of the National Lipid Association Statin Safety Assessment Task Force. Am J Cardiol. 2006 Apr 17;97(8A):89C-94C.
(72) Pasternak RC, Smith SC, Jr., Bairey-Merz CN, Grundy SM, Cleeman JI, Lenfant C. ACC/AHA/NHLBI Clinical Advisory on the Use and Safety of Statins. Stroke. 2002 Sep;33(9):2337-41.
(73) Smellie WS, Wilson D, McNulty CA, Galloway MJ, Spickett GA, Finnigan DI, et al. Best practice in primary care pathology: review 1. J Clin Pathol. 2005 Oct;58(10):1016-24.
(74) Thompson PD, Clarkson PM, Rosenson RS. An assessment of statin safety by muscle experts. Am J Cardiol. 2006 Apr 17;97(8A):69C-76C.
(75) NIH From the Working Group on Lipoprotein Measurement. National Cholesterol education Porgram: Recommendations on Lipoprotein Measurement. National Insitute of health. National Heart, Lung and Blood Institute; 1995 Sep:Report No.:NIH Publication n.95-3044.
(76) Kashani M, Eliasson A, Vernalis M, Costa L, Terhaar M. Improving assessment of cardiovascular disease risk by using family history: an integrative literature review. J Cardiovasc Nurs. 2013 Nov;28(6):E18-E27.
(77) Sivapalaratnam S, Boekholdt SM, Trip MD, Sandhu MS, Luben R, Kastelein JJ, et al. Family history of premature coronary heart disease and risk prediction in the EPIC-Norfolk prospective population study. Heart. 2010 Dec;96(24):1985-9.
(78) Yeboah J, McClelland RL, Polonsky TS, Burke GL, Sibley CT, O'Leary D, et al. Comparison of novel risk markers for improvement in cardiovascular risk. JAMA. 2012;308(8):788-95.
(79) Ridker PM, Buring JE, Rifai N, Cook NR. Development and validation of improved algorithms for the assessment of global cardiovascular risk in women: the Reynolds Risk Score. JAMA. 2007;297(6):611-9.
(80) Hippisley-Cox J, Coupland C, Vinogradova Y, Robson J, Minhas R, Sheikh A, et al. Predicting cardiovascular risk in England and Wales: prospective derivation and validation of QRISK2. BMJ. 2008;336(7659):1475-82.
(81) Woodward M, Brindle P, Tunstall-Pedoe H, estimation Sgor. Adding social deprivation and family history to cardiovascular risk assessment: the ASSIGN score from the Scottish Heart Health Extended Cohort (SHHEC). Heart. 2007;93(2):172-6.
(82) Kaptoge S, Di Angelantonio E, Lowe G, Pepys MB, Thompson SG, Collins R, et al. C-reactive protein concentration and risk of coronary heart disease, stroke, and mortality: an individual participant meta-analysis. Lancet. 2010;375(9709):132-40.
(83) Helfand M, Buckley DI, Freeman M, Fu R, Rogers K, Fleming C, et al. Emerging risk factors for coronary heart disease: a summary of systematic reviews conducted for the U.S. Preventive Services Task Force. Ann Intern Med. 2009;151(7):496-507.
(84) Zethelius B, Berglund L, Sundstrom J, Ingelsson E, Basu S, Larsson A, et al. Use of multiple biomarkers to improve the prediction of death from cardiovascular causes. N Engl J Med. 2008 May 15;358(20):2107-16.
(85) Wilson PW, Pencina M, Jacques P, Selhub J, D'Agostino R, Sr., O'Donnell CJ. C-reactive protein and reclassification of cardiovascular risk in the Framingham Heart Study. Circ Cardiovasc Qual Outcomes. 2008 Nov;1(2):92-7.
(86) Ridker PM, Paynter NP, Rifai N, Gaziano JM, Cook NR. C-reactive protein and parental history improve global cardiovascular risk prediction: the Reynolds Risk Score for men. Circulation. 2008 Nov 25;118(22):2243-51, 4p.
(87) Melander O, Newton-Cheh C, Almgren P, Hedblad B, Berglund G, Engstrom G, et al. Novel and conventional biomarkers for prediction of incident cardiovascular events in the community. JAMA. 2009 Jul 1;302(1):49-57.
(88) Wannamethee SG, Welsh P, Lowe GD, Gudnason V, Di AE, Lennon L, et al. N-terminal pro-brain natriuretic Peptide is a more useful predictor of cardiovascular disease risk than C-reactive protein in older men with and without pre-existing cardiovascular disease. J Am Coll Cardiol. 2011 Jun 28;58(1):56-64.
(89) Daniels LB, Clopton P, Laughlin GA, Maisel AS, Barrett-Connor E. Growth-differentiation factor-15 is a robust, independent predictor of 11-year mortality risk in community-dwelling older adults: the Rancho Bernardo Study. Circulation. 2011 May 17;123(19):2101-10.
(90) Kavousi M, Elias-Smale S, Rutten JH, Leening MJ, Vliegenthart R, Verwoert GC, et al. Evaluation of newer risk markers for coronary heart disease risk classification: a cohort study. Ann Intern Med. 2012;156:438-44.
(91) Buckley DI, Fu R, Freeman M, Rogers K, Helfand M. C-reactive protein as a risk factor for coronary heart disease: a systematic review and meta-analyses for the U.S. Preventive Services Task Force. Ann Intern Med. 2009 Oct 6;151(7):483-95.
(92) Shah T, Casas JP, Cooper JA, Tzoulaki I, Sofat R, McCormack V, et al. Critical appraisal of CRP measurement for the prediction of coronary heart disease events: new data and systematic review of 31 prospective cohorts. Int J Epidemiol. 2009;38(1):217-31.
(93) Kaptoge S, Di AE, Pennells L, Wood AM, White IR, Gao P, et al. C-reactive protein, fibrinogen, and cardiovascular disease prediction. N Engl J Med. 2012 Oct 4;367(14):1310-20.
(94) Fowkes FG, Murray GD, Butcher I, Heald CL, Lee RJ, Chambless LE, et al. Ankle brachial index combined with Framingham Risk Score to predict cardiovascular events and mortality: a meta-analysis. JAMA. 2008;300(2):197-208.
(95) Lin JS, Olson CM, Johnson ES, Whitlock EP. The ankle-brachial index for peripheral artery disease screening and cardiovascular disease prediction among asymptomatic adults: a systematic evidence review for the u.s. Preventive services task force. Ann Intern Med. 2013;159(5):333-41.
(96) Murphy TP, Dhangana R, Pencina MJ, D'Agostino RB, Sr. Ankle-brachial index and cardiovascular risk prediction: an analysis of 11,594 individuals with 10-year follow-up. Atherosclerosis. 2012;220(1):160-7.
(97) Marti R, Parramon D, Garcia-Ortiz L, Rigo F, Gomez-Marcos MA, Sempere I, et al. Improving interMediAte risk management. MARK study. BMC Cardiovasc Disord. 2011;11:61.
(98) Peters SA, den Ruijter HM, Bots ML, Moons KG. Improvements in risk stratification for the occurrence of cardiovascular disease by imaging subclinical atherosclerosis: a systematic review. Heart. 2012 Feb;98(3):177-84.
(99) Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670-81.
(100) Mihaylova B, Emberson J, Blackwell L, Keech A, Simes J, Barnes EH, et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012;380:581-90.
(101) Taylor F, Huffman MD, Macedo AF, Moore TH, Burke M, Davey Smith G, et al. Statins for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2013;1:CD004816.
(102) Amarenco P, Labreuche J. Lipid management in the prevention of stroke: review and updated meta-analysis of statins for stroke prevention. Lancet Neurol. 2009 May:8:453-63.
(103) Stone NJ, Robinson J, Lichtenstein AH, Bairey Merz CN, Lloyd-Jones DM, Blum CB, et al. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013.
(104) Civeira F. Guidelines for the diagnosis and management of heterozygous familial hypercholesterolemia. Atherosclerosis. 2004 Mar;173(1):55-68.
(105) Marks D, Thorogood M, Neil HA, Humphries SE. A review on the diagnosis, natural history, and treatment of familial hypercholesterolaemia. Atherosclerosis. 2003 May;168(1):1-14.
(106) Austin MA, Hutter CM, Zimmern RL, Humphries SE. Genetic causes of monogenic heterozygous familial hypercholesterolemia: a HuGE prevalence review. Am J Epidemiol. 2004 Sep 1;160(5):407-20.
(107) Alonso R, Castillo S, Civeira F, Puzo J, de la Cruz JJ, Pocovi M, et al. [Heterozygous familial hypercholesterolemia in Spain. Description of 819 non related cases]. Med Clin (Barc). 2002 Apr 13;118(13):487-92.
(108) Damgaard D, Larsen ML, Nissen PH, Jensen JM, Jensen HK, Soerensen VR, et al. The relationship of molecular genetic to clinical diagnosis of familial hypercholesterolemia in a Danish population. Atherosclerosis. 2005 May;180(1):155-60.
(109) Mata P, Alonso R, Ruiz A, Gonzalez-Juanatey JR, Badimón L, Díaz-Díaz JL, Muñoz MT, Muñiz O, Galve E, Irigoyen L, Fuentes-Jiménez F, Dalmau J, Pérez-Jiménez F, otros colaboradores. Diagnóstico y tratamiento de la hipercolesterolemia familiar en España: documento de consenso. Aten Primaria. 2015;47(1):56-65.
(110) Civeira F, Ros E, Jarauta E, Plana N, Zambon D, Puzo J, et al. Comparison of genetic versus clinical diagnosis in familial hypercholesterolemia. Am J Cardiol. 2008 Nov 1;102(9):1187-93, 1193.






