Preguntas a responder:
- ¿Se debe utilizar la oxigenoterapia en pacientes con TTCNG que no presentan hipoxia?
- ¿La oxigenoterapia de alto flujo es más eficaz que la oxigenoterapia convencional en el tratamiento de la insuficiencia respiratoria en pacientes adultos con TTCNG?
- ¿Se debe pautar profilaxis antibiótica en pacientes ingresados con TTCNG y contusión pulmonar?
- ¿Se debe pautar profilaxis antibiótica en pacientes ingresados con TTCNG a los que se les coloca un drenaje pleural?
- En los pacientes con TTCNG con o sin fracturas costales y patología pleural, ¿la toracocentesis en comparación con el drenaje pleural mejora la resolución de la afectación pleural?
- En los pacientes con TTCNG con o sin fracturas costales y neumotórax oculto en radiografía inicial, ¿es eficaz el manejo conservador sin la colocación de un drenaje pleural?
- En los pacientes con TTCNG, con o sin fracturas costales y hemotórax, ¿se debe realizar siempre un drenaje pleural?
- ¿Cuál es la localización más recomendable de la zona de inserción del drenaje torácico?
- ¿Cuál es el calibre del drenaje a utilizar en un neumotórax traumático? ¿Y en un hemotórax?
- ¿Cuál es el riesgo de hemotórax en pacientes con TTCNG?
- ¿Cuándo se debe suspender el tratamiento con anticoagulantes o antiagregantes en pacientes con TTCNG?
- ¿Se debe implementar un programa de rehabilitación respiratoria en pacientes con TTCNG para reducir complicaciones pulmonares postraumáticas?
- ¿Cuánto tiempo se debe esperar para iniciar la rehabilitación respiratoria en el paciente con TTCNG?
- ¿Se puede sustituir la fisioterapia respiratoria convencional por el uso de incentivador inspirométrico en pacientes con TTCNG?
- ¿Se debe añadir el uso de incentivador inspirométrico a la fisioterapia respiratoria convencional para reducir en mayor medida las complicaciones pulmonares en pacientes con TTCNG?
- Si se va a utilizar un incentivador inspirométrico, ¿se debe utilizar uno de tipo volumétrico o uno de flujo?
- ¿Cuánto tiempo debe durar la rehabilitación respiratoria en pacientes con TTCNG?
- ¿Se debe tratar con mucolíticos al paciente ingresado con TTCNG?
- ¿Se debe tratar con broncodilatadores inhalados al paciente ingresado con TTCNG?
- En pacientes con TTCNG ingresados, ¿se debe realizar profilaxis tromboembólica?
- ¿Cómo se debe realizar la valoración y el tratamiento del dolor del paciente con TTCNG?
- ¿Se debe implementar analgesia sistémica frente a analgesia locorregional en pacientes con TTCNG y fracturas costales ingresados en el hospital?
- En pacientes con TTCNG y con fracturas costales en los que se ha decidido implementar analgesia regional, ¿se debe elegir catéter epidural frente a catéter paravertebral?
7.1. Oxigenoterapia
- ¿Se debe utilizar la oxigenoterapia en pacientes con TTCNG que no presentan hipoxia?
Se define hipoxemia cuando la presión parcial de oxígeno en la sangre arterial se encuentra por debajo de 80 mmHg. Cuando los niveles bajan por debajo de 60 mmHg se trata de una situación de insuficiencia respiratoria con riesgo de producir hipoxia, esto es, aporte insuficiente de oxígeno en los tejidos.
Clásicamente en medicina se ha empleado la oxigenoterapia de manera indiscriminada en muchos pacientes, sobre todo al inicio de su atención y si se trataba de patología que afectaba al tórax antes de objetivar si se encontraban en situación de hipoxemia. Aunque la idea clásica más extendida es que el oxígeno es inocuo, hoy en día esta idea está más que cuestionada y la tendencia es a ser más conservador con el uso indiscriminado del oxígeno.
Con las mejoras de la monitorización y la concienciación de los riesgos de los tratamientos médicos, incluido el oxígeno, ésta práctica se está moderando.
Evidencia científica
De la búsqueda de RS y MA se preseleccionaron seis estudios (152-157), aunque finalmente se seleccionó una única revisión (152), por ser de entre las de mejor calidad metodológica la más reciente. En esta revisión (152) se estudia si hay diferencias en la mortalidad y morbilidad en pacientes “gravemente enfermos” (pacientes con hemorragia cerebral, sepsis, enfermedad crítica, cirugía de urgencia, traumatismo cerebral y síndrome coronario agudo) tratados con oxigenoterapia liberal frente a oxigenoterapia conservadora. Los autores identifican evidencia sobre el aumento de riesgo relativo de mortalidad intrahospitalaria, a los 30 días y a mayor tiempo de seguimiento, sin mejoras significativas en otros resultados importantes (discapacidad, riesgo de neumonía hospitalaria, riesgo de infecciones intrahospitalarias o duración de la estancia hospitalaria).
12 de los 25 ECA (n=13.389) incluidos en la revisión excluyen pacientes con hipoxemia basal, mientras que otros ensayos solo los excluyen si ésta es severa.
La suplementación liberal con oxígeno constituía una FiO2 (Fracción Inspirada de Oxígeno) mediana de 0,52 (rango de 0,28 a 1,00; RIC de 0,39 a 0,85) con una duración mediana de ocho horas (rango de 1 a 144 horas; RIC de 4 a 24 horas) comparado con la suplementación conservadora (FiO2 de 0,21 (rango de 0,21 a 0,50; RIC de 0,21 a 0,25). El aire ambiental o el oxígeno se proporcionaban por cánula nasal en cuatro de los estudios y por mascarilla facial en otros 13, siendo utilizada la ventilación mecánica invasiva en ocho estudios.
Los autores definen como tratamiento conservador al brazo del estudio con la cifra objetivo de oxígeno más baja (incluyendo el aire ambiente), y como tratamiento liberal al brazo del estudio que recibe el tratamiento con la cifra objetivo de oxígeno más alta.
En el grupo con tratamiento liberal el riesgo de mortalidad intrahospitalaria (RR de 1,21; IC95 % de 1,03 a 1,43; p=0,020; I2=0 %), mortalidad a los 30 días (RR 1,14; IC95 % de 1,01 a 1,20; I2=0 %; p=0,033) y mortalidad en un seguimiento más largo (RR de 1,10; IC95 % de 1,00 a 1,20; I2=0 %; p=0,044) fue mayor que en el grupo con tratamiento conservador.
Calidad
moderada
para todos
los
desenlaces
Resultados de la actualización
Se han identificado dos RS más recientes sobre el efecto de la hiperoxia y mortalidad en pacientes críticamente enfermos (158;159), con resultados similares a los ya descritos, un protocolo de RS sobre la hiperoxia perioperatoria y complicaciones cardíacas post-operatorias en pacientes adultos tras cirugía no cardíaca (160) y un estudio piloto (TRAUMOX 1) sobre el uso restrictivo frente al liberal en pacientes con traumatismo (161). Este último estudio, que es un estudio piloto, es el único que incluye pacientes con un traumatismo.
Los autores observan que la mortalidad en 30 días y/o la tasa de complicaciones pulmonares hospitalarias fue de 4/20 (20 %) en el grupo tratado de forma restrictiva frente a 6/18 (33,3 %) en el grupo tratado de forma liberal (OR de 0,87; IC95 % de 0,184 a 4,16). Dos pacientes murieron en cada grupo, y las complicaciones pulmonares importantes fueron de 2/20 (10 %) en el grupo restrictivo y de 4/18 (22 %) en el grupo liberal (OR de 0,398; IC95 % de 0,062 a 2,438).
Calidad
muy baja
para todos
los
desenlaces
Resumen de la evidencia
| Calidad Moderada | La oxigenoterapia liberal aumenta el riesgo de mortalidad intrahospitalaria, a los 30 días y a mayor tiempo de seguimiento, sin mejoras significativas en otros resultados importantes (discapacidad, riesgo de neumonía hospitalaria, riesgo de infecciones intrahospitalarias o duración de la estancia hospitalaria) en pacientes gravemente enfermos, en comparación con la oxigenoterapia restrictiva (152). |
| Calidad muy baja | En pacientes tras un traumatismo, el porcentaje de pacientes que sufre complicaciones hospitalarias es menor al recibir oxigenoterapia de forma restricitva, aunque la diferencia no es estadísticamente significativa (161). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es moderada, puesto que se trata de estudios que incluyen pacientes más graves que los considerados en esta guía. En pacientes tras un traumatismo, parece que ocurre lo mismo, aunque no de forma significativa (sólo hay un estudio piloto).
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados probablemente no favorecen la opción.
- Utilización de recursos: probablemente los recursos que se requieren para la oxigenoterapia rutinaria son bajos, aunque hay incertidumbre sobre el coste incremental en relación a los beneficios.
- Equidad: las desigualdades en salud probablemente aumentarían si se recomendara el uso de oxigenoterapia rutinaria en todos los pacientes, puesto que, en caso de pacientes atendidos en centros de salud o puntos de atención continuada, estos deberían ser trasladados a centros hospitalarios.
- Aceptabilidad: probablemente la opción sea aceptada, aunque si el uso de la oxigenoterapia tiene efectos adversos cuando no es necesaria, entonces la opción seguramente deje de ser aceptada por los implicados.
- Factibilidad: la opción probablemente sea factible.
Hay evidencia de calidad moderada contra el uso de la oxigenoterapia en pacientes que no presentan hipoxemia, ya que presentan un riesgo relativo mayor de mortalidad intrahospitalaria sin mejoras significativas en otras áreas, como son las infecciones intrahospitalarias, la discapacidad o la duración de la estancia hospitalaria.
Por lo tanto, la recomendación que se ha formulado ha sido la siguiente:
Recomendaciones
| Fuerte | Se recomienda no utilizar la oxigenoterapia sistemática en pacientes adultos con traumatismo costal o esternal cerrado, sin volet costal y sin evidencia de hipoxemia o insuficiencia respiratoria. |
Consideraciones para la implementación
- En la valoración inicial de los pacientes con TTCNG se debe de implementar el uso de la pulsioximetría para descartar la presencia de insuficiencia respiratoria.
- Actualmente no hay evidencia clara -ni a favor ni en contra- sobre si se debe de iniciar oxigenoterapia en pacientes con hipoxemia sin insuficiencia respiratoria, es decir, en los pacientes con PaO2 entre 60 y 80 mmHg. Ante esta incertidumbre, no se hace recomendación para estas situaciones, dejándolo a criterio del profesional que atienda a dicho paciente.
- ¿La oxigenoterapia de alto flujo es más eficaz que la oxigenoterapia convencional en el tratamiento de la insuficiencia respiratoria en pacientes adultos con TTCNG?
En la actualidad, se disponen de distintos dispositivos no invasivos para dispensar el oxígeno a los pacientes con insuficiencia respiratoria. El uso de la oxigenoterapia de alto flujo va en aumento, sobre todo, cuando la fracción inspirada de oxígeno requerida por el paciente es mayor del 50 %, pensando en la comodidad del paciente, ya que pasamos de una mascarilla facial a unas cánulas nasales. Independientemente del dispositivo que utilicemos, deberemos siempre evitar la hiperoxia individualizando la fracción inspirada de oxígeno a las necesidades de cada uno en cada momento, ya sea en oxigenoterapia convencional o en alto flujo.
Evidencia científica
De la búsqueda realizada se preseleccionaron 12 RS (162-173), aunque finalmente se eligió la RS Cochrane, por ser una de las más recientes y de mejor calidad metodológica (173). La RS Cochrane evaluó la efectividad de la oxigenoterapia de alto flujo respecto a la oxigenoterapia convencional en pacientes adultos con insuficiencia respiratoria en UCI, y para esta pregunta se analizaron solamente los resultados correspondientes a la comparación con respecto a la oxigenoterapia convencional.
Un total de 11 ECAs fueron incluidos (n=1.972 participantes), seis con pacientes con insuficiencia respiratoria y cinco con pacientes que requirieron oxígeno de forma posterior a la extubación. La mayoría de los estudios no presentaron de forma adecuada el método y la asignación de la secuencia de aleatorización.
De forma posterior a la RS Cochrane, se identificaron dos ECA de buena calidad metodológica, que evaluaron la efectividad de la oxigenoterapia de alto flujo respecto a la oxigenoterapia convencional en pacientes recientemente extubados (174;175). Los resultados de estos estudios se utilizaron para actualizar los presentados por la RS Cochrane. También se identificaron otros dos ECA posteriores, aunque se trata de un estudio piloto (176), que investiga el valor de la oxigenoterapia de alto flujo tras la extubación de pacientes con insuficiencia aguda respiratoria y otro estudio que terminó antes de tiempo por la baja tasa de reclutamiento conseguido y que evaluaba el uso de la oxigenoterapia de alto flujo en la prevención de la insuficiencia respiratoria post-extubación en pacientes no hipercápnicos de alto riesgo (177). Cabe mencionar que el primero de los estudios encuentra que la oxigenoterapia de alto flujo tiene una mayor tasa de éxito que la máscara con arrastre de aire y menor disconfort a las 24 horas (éxito del tratamiento: 90 % vs 63,33 %, respectivamente; p=0,012).
El fracaso del tratamiento fue evaluado como la necesidad de ventilación no invasiva o invasiva, y no se encontraron diferencias significativas entre la oxigenoterapia de alto flujo y la oxigenoterapia convencional (8 estudios; 1813 pacientes; RR de 0,79; IC 95 % de 0,52 a 1,20) (173-175).
Calidad
baja
En un análisis de subgrupo, no se encontraron diferencias según la indicación de la oxigenoterapia entre las intervenciones evaluadas (Chi2= 0,01, df = 1; p = 0,99; I2 = 0 %) ni diferencias entre grupos (fracaso respiratorio: 3 estudios; 466 pacientes; RR 0,79; IC95 % de 0,56 a 1.11; post extubación: 5 estudios; 1347 pacientes; RR 0,80; IC95 % de 0,33 a 1,90) (173-175).
No se identificaron diferencias significativas en cuanto a la mortalidad hospitalaria (5 estudios; 1502 pacientes; RR 0,67; IC95 % 0,44 a 1,02) [ (173-175) o la estancia en UCI. Tampoco se identificaron diferencias entre las dos intervenciones evaluadas (4 estudios; 770 pacientes; diferencia de medias [DM] 0,15, IC95 % -0,03 a 0,34) (173) ni en la ratio PaO2/FiO2 evaluado hasta 24 horas después del inicio de la oxigenoterapia (5 estudios; 1037 pacientes; DM de 3,71, IC95 % de -16,33 a 23,74) (173;175).
Calidad
baja
Calidad
baja
Calidad
muy baja
Diferentes estudios evaluaron el confort a corto plazo (hasta 4 horas después del inicio del tratamiento) informado por el paciente a través de escalas de cero a diez, sin encontrar diferencias significativas (3 estudios, 462 pacientes, DM 0,14; IC95 % de – 0,65 a 0,93) (173).
Calidad
baja
De forma similar se evaluó el confort a largo plazo (después de 24 horas) sin seguir encontrando diferencias significativas (2 estudios; 445 pacientes; DM -0,36; IC95 % de -3,7 a 2,98) (173).
Calidad
muy baja
Los eventos adversos notificados fueron: incidencia de neumonía nosocomial, visitas al médico de familia debido a complicaciones respiratorias hasta 28 días después, episodios de desaturación de oxígeno, pseudo-obstrucción aguda, arritmia cardiaca, sepsis, shock séptico, y paro cardiorrespiratorio. Ninguno de los estudios reportó diferencias significativas entre las dos intervenciones, excepto uno que reportó un menor número de episodios de desaturación con la oxigenoterapia de alto flujo (173;175).
Calidad
baja
Resultados de la actualización
Se han encontrado nueve RS y meta-análisis (MA) (163;168;178-184) en pacientes con insuficiencia respiratoria aguda, en pacientes críticamente enfermos o en UCI, pacientes extubados con hipoxemia posterior o la preoxigenación de pacienes que van a ser intubados. Las conclusiones a las que llegan estas revisiones son similares a lo descrito previamente, por lo que no se han realizado modificaciones al respecto.
Resumen de la evidencia
| Calidad baja | No hay diferencias significativas entre el tratamiento con oxigenoterapia de alto flujo y la oxigenoterapia convencional, con respecto al fracaso del tratamiento, mortalidad hospitalaria, duración de la estancia en cuidados intensivos, ratio PaO2/FiO2, el confort a corto y largo plazo ni con los efectos adversos en pacientes con insuficiencia respiratoria o pacientes que requieren O2 de forma posterior a la intubación (173-175). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es baja.
- Balance entre beneficios y riesgos: existe incertidumbre en el balance entre los efectos deseados y no deseados.
- Utilización de recursos: probablemente los recursos requeridos no son pequeños. Además, el incremento del coste en relación a los beneficios no es pequeño.
- Equidad: las desigualdades probablemente aumentarían, puesto que no todos los centros podrían proporcionar cánulas de alto flujo a los pacientes.
- Aceptabilidad: la aceptabilidad de la opción es incierta, aunque puede que los pacientes prefieran la oxigenoterapia con alto flujo.
- Factibilidad: la opción probablemente sea factible, aunque hay que tener en cuenta que su uso está restringido al ámbito hospitalario por lo que, en caso de ser necesario, el paciente necesitaría ser trasladado.
No se han encontrado diferencias significativas entre la oxigenoterapia convencional frente a la de alto flujo en los resultados de mortalidad hospitalaria, en la necesidad de ventilación mecánica, la estancia en unidades de críticos, ni en la incidencia de neumonía nosocomial. Al mismo tiempo, hay controversia sobre el confort de los pacientes con terapia respiratoria con alto flujo. Por ello, el grupo considera que no hay evidencia suficiente para hacer una recomendación a favor de la utilización de la oxigenoterapia de alto flujo en pacientes con traumatismo torácico cerrado e insuficiencia respiratoria frente a la oxigenoterapia convencional.
Recomendaciones
| Por el momento, no hay evidencia suficiente para hacer una recomendación con respecto al uso de la oxigenoterapia de alto flujo en pacientes con traumatismo torácico cerrado e insuficiencia respiratoria frente a la oxigenoterapia convencional. |
7.2. Profilaxis antibiótica
- ¿Se debe pautar profilaxis antibiótica en pacientes ingresados con TTCNG y contusión pulmonar?
- ¿Se debe pautar profilaxis antibiótica en pacientes ingresados con TTCNG a los que se les coloca un drenaje pleural?
La neumonía y el empiema postraumático son potenciales complicaciones que pueden aparecer en los pacientes con traumatismo torácico asociado a contusión pulmonar o tras la colocación de un drenaje pleural. El uso de antibióticos de manera rutinaria en estas situaciones con intención profiláctica ha sido propuesto por muchos autores con el objetivo de disminuir la aparición de estas complicaciones. No obstante, la eficacia de esta estrategia continúa siendo controvertida dada la escasa calidad de la evidencia científica a este respecto y a la creciente preocupación en torno al uso excesivo de fármacos antimicrobianos y la aparición de gérmenes multirresistentes como resultado de su uso inadecuado.
Evidencia científica
De la búsqueda realizada se preseleccionaron ocho referencias (dos RS (185;186), tres guías (187-189) y tres estudios individuales posteriores a 2012 (190-192)), aunque para responder a esta pregunta se han tenido finalmente en cuenta el MA de Bosman et al de 2012 (185) y el ECA posterior de Heydari et al, de 2014 (190).
Tratamiento antibiótico para drenaje pleural
En el MA de Bosman (185), el análisis de todos los datos de forma conjunta (pacientes con traumatismo torácico penetrante o cerrado) demuestra un efecto favorable de la profilaxis antibiótica sobre la incidencia de complicaciones infecciosas en general, siendo el OR de 0,24 (IC95 % de 0,12 a 0,49).
Sin embargo, en el análisis de subgrupos realizado se encontró que en pacientes con traumatismo torácico cerrado el OR para la reducción de complicaciones infecciosas fue de 1,30 (IC95 % de 0,46 a 3,67) (3 estudios; n=171 pacientes). Por otro lado, si tenemos en cuenta los resultados del ECA identificado con posterioridad (190) en el que la duración media del drenaje fue de 6,8 días, seis pacientes desarrollaron neumonía (dos en grupo A (antibióticos) y cuatro en el B (placebo)). Un paciente del grupo B desarrolló empiema (diferencias no significativas). Este estudio señala que la profilaxis no disminuyó de forma significativa la incidencia de neumonía o empiema, aunque el número de eventos es muy pequeño.
La duración de la colocación del tubo de drenaje podría influir también en el riesgo de infección, aunque ninguno de los estudios incluidos proporcionó datos para este desenlace.
Calidad
muy baja
Tratamiento antibiótico para contusión pulmonar
No se han identificado estudios específicos sobre la profilaxis antibiótica en pacientes con traumatismo torácico y contusión pulmonar.
No hay
estudios
Resultados de la actualización
En la actualización tampoco se han identificado estudios relevantes para responder a esta pregunta.
Resumen de la evidencia
| Calidad muy baja | En pacientes con traumatismo torácico cerrado que fueron drenados y recibieron profilaxis antibiótica, el OR para la reducción de complicaciones infecciosas fue de 1,30 (IC95 % de 0,46 a 3,67). En el ECA posterior (190), con una duración media de drenaje de 6,8 días, la profilaxis no disminuyó la incidencia de neumonía o empiema, aunque como el número de eventos era muy pequeño, hacen falta estudios de mayor tamaño que lo confirmen. |
| No hay estudios | No hay estudios sobre la eficacia de la profilaxis antibiótica en el manejo de pacientes con traumatismo torácico y contusión pulmonar. |
De la evidencia a la recomendación
En el caso de la profilaxis antibiótica de pacientes con traumatismo torácico cerrado y drenaje, los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza sobre la evidencia en relación a la eficacia de la profilaxis de pacientes con TTCNG es muy baja, y no hay estudios para pacientes con traumatismo torácico y contusión pulmonar.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados probablemente no favorezca la opción (profilaxis frente a no profilaxis).
- Utilización de recursos: hay incertidumbre sobre si los recursos requeridos serían pequeños y si el incremento del coste en relación a los beneficos sería pequeño.
- Equidad: las desigualdades en salud probablemente aumentarían.
- Aceptabilidad: la opción probablemente sea aceptada.
- Factibilidad: la opción probablemente sea factible.
Los estudios disponibles sobre el uso de antibióticos de manera rutinaria en pacientes con drenaje pleural para profilaxis de empiema o neumonía presentan serias limitaciones en cuanto al escaso número de pacientes reclutados, la heterogeneidad de sus poblaciones (traumatismo penetrante frente a traumatismo abierto), el antibiótico utilizado, la duración del tratamiento y la definición de las complicaciones (empiema y neumonía). En cualquier caso, sus resultados son contradictorios. No obstante, en la RS de Bosman et al (185), en el análisis de subgrupos de pacientes con traumatismo torácico cerrado no se demostró ningún impacto de la antibioterapia rutinaria en las complicaciones infecciosas en estos pacientes. Debido a esto, y a la creciente preocupación acerca del uso excesivo de fármacos antimicrobianos y a la selección de gérmenes multi-resistentes, se sugiere no utilizar de forma sistemática antibióticos con intención profiláctica en pacientes con traumatismo torácico cerrado a los que se coloca un drenaje pleural. En cuanto a la utilización de antibióticos en la prevención de complicaciones infecciosas en pacientes con contusión pulmonar, no se han identificado estudios, por lo que no se hace una recomendación al respecto.
Recomendaciones
| Débil | Se sugiere no utilizar de forma sistemática profilaxis antibiótica en pacientes con TTCNG a los que se coloca un drenaje torácico. |
| No se hace una recomendación sobre la profllaxis antibiótica en el manejo de pacientes con TTCNG y contusión pulmonar. |
7.3. Toracocentesis y drenaje pleural
7.3.1. Toracocentesis
- En los pacientes con traumatismo torácico con o sin fracturas costales y patología pleural, ¿la toracocentesis en comparación con el drenaje pleural mejora la resolución de la afectación pleural?
Como complicación asociada, los pacientes que han sufrido un traumatismo torácico pueden desarrollar patología del espacio pleural, ya sea neumotórax o derrame pleural (derrame pleural postraumático o hemotórax). En la mayor parte de los pacientes, la acumulación de aire o líquido es escasa y no se precisa ningún tratamiento adicional, salvo la observación clínica y radiológica. En otros, sin embargo, está indicada la evacuación del espacio pleural, habitualmente mediante la colocación de un drenaje torácico, permitiendo la correcta re-expansión pulmonar, así como la monitorización del posible sangrado y la fuga aérea.
En algunas GPC de tratamiento del neumotórax espontáneo primario se ha propuesto una estrategia basada en la punción simple del espacio pleural y la aspiración del aire acumulado, sin necesidad de dejar colocado un drenaje en la cavidad pleural, habiéndose demostrado que esta estrategia es equiparable a la colocación del drenaje en términos de seguridad y eficacia.
En el caso del traumatismo torácico cerrado con patología pleural asociada, esta opción no ha sido explorada. Hay que tener en cuenta que la probabilidad de fuga aérea y/o sangrado activo, incluso diferido, así como la necesidad de monitorización de estas situaciones es mayor en el paciente traumático, por lo que la opción punción-aspiración pudiera ser inferior en estos pacientes en términos de seguridad y eficacia.
Evidencia científica
No se han identificado en la búsqueda RS sobre la eficacia de la toracocentesis en comparación con el drenaje pleural en pacientes con traumatismo torácico, con o sin fracturas costales y patología pleural.
Sí se ha encontrado una RS Cochrane de 2017 (195) que compara el tratamiento con toracocentesis o aspiración simple frente al drenaje en pacientes con neumotorax espontáneo primario, pero no se ha considerado útil para responder a esta pregunta.
En la búsqueda de estudios individuales, no se identificaron estudios que respondieran a esta pregunta.
No hay
estudios
Resultados de la actualización
En la actualización de la búsqueda, no se han identificado estudios relevantes.
Resumen de la evidencia
| No hay estudios | No hay evidencia sobre la eficacia y seguridad de la toracocentesis en el paciente que ha sufrido un TTCNG y que presenta patología pleural. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: no hay estudios que comparen el uso de la toracocentesis en pacientes con TTCNG.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados es incierto, puesto que, aunque los efectos deseables esperados podrían ser grandes en términos de comodidad para el paciente y la reducción de estancias, no se sabe si es igualmente seguro y eficaz que el drenaje. De hecho, existe probabilidad de fuga aérea, sangrado y recidiva que obligue a una reintervención o reingreso.
- Utilización de recursos: los recursos que se requerirían serían probablemente pequeños, así como el incremento del coste en relación a los beneficos (en caso de que realmente tuviera la misma eficacia y seguridad que el drenaje).
- Equidad: existe incertidumbre sobre el impacto de la opción en las desigualdades en salud.
- Aceptabilidad: existe incertidumbre, puesto que los pacientes pueden no aceptar la opción de la alternativa más conservadora.
- Factibilidad: la opción probablemente sea factible.
Los únicos estudios que se han encontrado incluyen pacientes con neumotórax espontáneo primario, y excluyen precisamente los pacientes con neumotórax por traumatismo torácico. Por esto, y por lo anteriormente comentado, el grupo ha realizado la siguiente recomendación de tipo consenso:
Recomendaciones
| √ | Se considera preferible el drenaje pleural frente a la toracocentesis en pacientes con TTCNG para la resolución de la afectación pleural. |
7.3.2. Drenaje pleural del neumotórax oculto
- En los pacientes con TTCNG con o sin fracturas costales y neumotórax oculto en la radiografía inicial, ¿es eficaz la conducta expectante sin la colocación de un drenaje pleural?
En el traumatismo torácico, una de las principales complicaciones es el neumotórax que se puede producir por diferentes mecanismos (barotrauma, laceración pulmonar, rotura de la vía aérea, etc). La gravedad del neumotórax es muy variable, oscilando entre una situación leve que no requiere tratamiento y no altera la evolución del traumatismo, hasta una complicación grave que compromete la vida del paciente. En algunas ocasiones se puede presentar un neumotórax que, por la escasa cantidad de aire alojado en el espacio pleural, se detecta mediante la TC torácica pero no se observa en la radiografía simple de tórax. Esta situación se denomina neumotórax oculto. Si el paciente no presenta un deterioro desde el punto de vista respiratorio y hemodinámico, este tipo de neumotórax ofrece dudas sobre el manejo terapéutico óptimo. Una de las opciones es tratar directamente el neumotórax mediante la colocación de un drenaje pleural. Teóricamente, tiene las ventajas de conseguir una resolución más rápida del neumotórax y evitar los riesgos de una progresión del neumotórax. No obstante, en algunos casos estaremos realizando un procedimiento invasivo, no exento de riesgos, para situaciones que se podrían haber resuelto sin intervención. La otra opción es no realizar un tratamiento directo y observar la evolución del neumotórax mediante control radiológico. De esta forma, evitaremos realizar un tratamiento invasivo, pero tenemos el riesgo principal de la progresión del neumotórax y sus posibles complicaciones. Ante esta duda, se ha realizado la revisión de la evidencia científica existente, en busca de estudios comparativos entre el tratamiento con drenaje pleural frente a la observación en el manejo del neumotórax oculto para ver su influencia en los diferentes desenlaces clínicos propuestos para poder realizar una recomendación al respecto.
Evidencia científica
Además del documento de la Sociedad Francesa de Anestesia y Reanimación de 2017 sobre las recomendaciones de actuación durante las primeras 48 horas tras un traumatismo torácico (187), se han identificado dos RS, Yadav et al (202) y Lesquen et al (188), que comparan la eficacia de la conducta expectante frente al drenaje pleural en pacientes con neumotórax oculto en la radiografía inicial, tras un traumatismo cerrado o penetrante. De las dos revisiones, se ha seleccionado la de mayor calidad (202).
Esta RS incluye tres ECA: Enderson et al (203), Brasel et al (204) y Ouellet et al (205), que examinan los beneficios del manejo expectante como alternativa al drenaje para el tratamiento del neumotórax oculto en pacientes hemodinámicamente estables con o sin ventilación con presión positiva.
Los tres estudios definen al neumotórax oculto como aquel visualizado en la TC torácica u abdominal, pero no en la radiografía de tórax supina AP. Dos de los ECA (204;205) incluyeron pacientes con traumatismo cerrado, mientras que el tercero (203) también incluyó pacientes con traumatismo penetrante. La progresión del neumotórax se define como expansión significativa que requiere en el grupo con manejo expectante (GE), una toracostomía o intubación endotraqueal, y en el grupo con toracostomia (GT), la colocación de tubos torácicos adicionales u otros procedimientos.
La RS (202) no compara pacientes ventilados y no ventilados, aunque de los estudios incluidos dos (204;205) no encuentran diferencias significativas entre los pacientes ventilados tratados con manejo expectante o con un drenaje. El tercer ECA (203) proporciona resultados a favor de la realización de toracostomía en pacientes con neumotórax oculto y ventilación a presión positiva.
Después del periodo de búsqueda de la RS (202) (enero 2010) se han identificado un ECA (206) y dos estudios retrospectivos (ER) (207;208) que comparan el drenaje pleural frente al manejo expectante en pacientes con traumatismo y neumotórax oculto.
El ECA de Kirkpatrick (206) es un análisis provisional de un estudio de neumotórax oculto en UCI [Occult Pneumothoraces in Critical Care (OPTICC)]. Este ECA no cegado, multicéntrico prospectivo compara el manejo expectante con el drenaje pleural en pacientes con traumatismo y neumotórax oculto con ventilación a presión positiva e incluye los datos del estudio piloto de Ouellet et al (205).
El desenlace principal fue el distrés respiratorio (DR) (desenlace no incluido en la RS identificada). La colocación de un tubo de drenaje se valoró como fracaso en el grupo con manejo expectante.
Uno de los ER identificado fue realizado en Singapur y su objetivo era determinar si el neumotórax oculto puede tratarse de forma conservadora sin la necesidad de un drenaje y si la conducta expectante tiene efectos adversos (hemotórax y neumotórax a tensión) en el paciente (207).
Los autores, tras revisar 1.564 casos, incluyeron finalmente 83 pacientes con neumotórax oculto con o sin ventilación a presión positiva.
El estudio retrospectivo de Llaquet Bayo et al (208) tuvo como objetivo principal evaluar la eficacia y los efectos adversos del tratamiento conservador del neumotórax oculto.
Se revisaron 1.087 casos de pacientes politraumatizados graves mayores de 16 años ingresados en la UCI, incluyendo finalmente 126 pacientes con neumotórax oculto, con o sin ventilación a presión positiva.
A continuación, se describen los resultados encontrados por la revisión seleccionada y los estudios posteriores identificados.
Comparación manejo conservador vs. toracostomía en pacientes con y sin
ventilación a presión positiva
Dos ECA (203;204) y dos ER (207;208) comparan la eficacia del manejo expectante frente a la toracostomia en pacientes con neumotórax oculto que reciben o no ventilación a presión positiva.
En cuanto a la progresión del neumotórax oculto, en el primer ECA (203), ocho de los 21 pacientes del grupo GE experimentó una progresión de neumotórax oculto que requirió la colocación de un tubo torácico, incluyendo tres con neumotórax a tensión, mientras que en el grupo GT no hubo ningún evento (38,1 % vs. 0 %). En el segundo ECA (204), dos pacientes del GE requirieron tubo torácico frente a un paciente que requirió intubación endotraqueal en el GT (9,5 % (2/21) vs. 5,6 % (1/18); RR:1,7; IC95 % de 0,17 a 17,38), aunque las diferencias no fueron significativas (dato no reportado).
En el ER (207), cuatro pacientes del grupo con manejo expectante presentaron expansión del neumotórax con posterior drenaje, frente a ningún paciente del grupo tratamiento (8,3 % (4/48) vs. 0 % (0/35)).
Calidad
muy baja
Dos ER (207;208) presentan datos sobre mortalidad. El primero (207) no encuentra diferencias significativas (GT: 2/35 (5,7 %); GE: 1/48 (2,1 %); p=0,57), al igual que el segundo (208) (cinco muertes en el GE (6,85 %, 5/73) vs. ocho en el GT (15,09 %, 8/53); p=0,133).
Calidad
muy baja
Dos ECA (203;204) y un ER (208) presentan datos sobre la estancia en la UCI. En el primer ECA (203) la estancia media es de 3,2 días (DS+/-1,3) en el grupo GE y de 2,8±0,8 en el grupo GT (DM: 0,4; IC95 % de −0,30 a 1,10; p NR), y en el segundo (204) la estancia mediana es de 1 día (rango de 0 a 9) en el grupo GE y de 1 día en el GT (rango de 0 a 19) (p no reportada).
Calidad
muy baja
En el ER (208) la duración de la estancia en la UCI fue de 13 días de mediana (RIC de 7,5 a 24) para el grupo de manejo expectante y de 15 para el grupo tratamiento (RIC de 6,4 a 22,4; p=0,617).
Dos ECA (203;204) y dos ER (207;208) presentan datos al respecto. Un ECA (203) proporcionan datos sobre la duración de la estancia hospitalaria, con una estancia media de 17,6 días (DS±4.3) en el grupo GE y de 12,9±1,8 en el grupo GT (DM 4,7 días; IC95 % de 2,55 a 6,85; p NR) y el segundo (204) una estancia mediana de cinco días (RIC de 1 a 30) en el grupo GE y de ocho en el GT (RIC de 3 a 23; p no reportada).
Calidad
muy baja
En una de las cohortes retrospectivas (208), los pacientes del GT permanecieron en el hospital una mediana de 13 días en comparación con los 5,5 días del GE (p=0,008). El otro ER (208) (208) no encontró diferencias entre grupos (GE: mediana de 4; RIC de 2,1 a 8,6 vs. GT: 5,5; RIC de 2,9 a 15; p=0,301).
Los dos ER (207;208) presentan datos sobre el fracaso del tratamiento conservador (necesidad posterior de drenaje). En el primero (207) cuatro de los 48 pacientes del GE (8.3 %) fracasaron al manejo expectante, y en el segundo (208) fueron nueve pacientes los que requirieron drenaje pleural (12 %).
Calidad
muy baja
En un ECA (203) un paciente de cada grupo presenta neumonía (GE: 5 % (1/21) vs. GT: 5 % (1/19); RR de 0,9; IC95 % de 0,06 a 13,46; p no reportada), y en el segundo ECA (204) presentan neumonía dos pacientes del GT (11 %, 2/18) y ninguno en el GE.
Calidad
muy baja
En cuanto al empiema, solo notifica datos el ECA de Enderson (203), un paciente en el GE (5 %; 1/21) y ninguno en el grupo GT (0 %).
Calidad
muy baja
En un estudio retrospectivo (207) siete pacientes del GT (20 %) y cuatro del GE (8,3 %) presentaron complicaciones. Al controlar el análisis por edad, duración de la estadía y ventilación a presión positiva, la OR fue de 9,9 (IC95 % de 2,83 a 34,75), a favor del GE (p=0,001).
Calidad
muy baja
En uno de los ER (208) tres pacientes presentaron complicaciones relacionadas con el drenaje (6 %, 3/53): dos por colocación del drenaje en el tejido subcutáneo y un caso de pérdida de drenaje a las pocas horas. Los tres casos requirieron recolocación del drenaje.
Calidad
muy baja
Comparación manejo expectante vs. toracostomía en pacientes con ventilación a presión positiva
Cuatro ECA (203-206) y dos ER (207;208) comparan la eficacia del tratamiento expectante frente al drenaje torácico en pacientes ventilados con neumotórax oculto. En general, la calidad de los estudios es baja o muy baja.
En tres ECA (203-205) y en una de las cohorte retrospectivas (207) se valora la progresión del neumotórax. En el estudio de Enderson et al de los 15 pacientes del GE ventilados, hubo progresión del neumotórax oculto en ocho (colocación del tubo torácico), incluyendo tres con neumotórax a tensión frente a ninguno de los 12 pacientes del grupo GT (53 % vs. 0 %). En el ECA de Brasel et al, en dos de los nueve pacientes con ventilación a presión positiva (22 %) del GE progresó el neumotórax oculto, aunque sin complicaciones importantes. En el tercer ECA en el 31 % (4/13) de los pacientes del GE progresa el neumotórax oculto frente al 11 % (1/9) del GT (RR de 2,8; IC95 % de 0,37 a 20,88).
En el ER (207), de los cinco pacientes con ventilación a presión positiva del grupo conservador solo uno tuvo expansión del neumotórax oculto con posterior drenaje (20 %, 1/5) y ninguno del GT (0/7).
Calidad
muy baja
Un ECA (205) comunica dos muertes en el grupo de GE (15 %, 2/13) frente a dos muertes en el grupo GT (22 %, 2/9) (RR 0,7; IC95 % de 0,11 a 4,01). En otro ECA (206) se notificaron cuatro muertes en cada grupo (GO 8 %, 4/50; vs. GT 10 %, 4/40) (RR 1,25; IC95 % de 0,33 a 4,69; p 0,724), y el ER (208), presenta tres muertes en el GE (18,8 %, 3/16) vs. ocho en el GT (30,8 %, 8/26); p=0,485.
Calidad
muy baja
La mediana de la duración de la estancia en UCI en el ECA de Ouellet fue de cuatro días en el GE y de tres días en el GT. En el ECA de Kirkpatrick et al no se encontraron diferencias significativas entre los grupos (Mediana: 5,0; RIC de 2,0 a 11,5) vs 4,0; RIC de 1,0 a 9,5); p=0,365).
En el ER (208), la duración mediana fue de 17,2 días (RIC de 8,3 a 27,9) en el GE y de 19,5 (RIC de 6,4 a 28,4) en el GT (p=0,784).
Calidad
muy baja
Un ECA (205) informa de una mediana de 16 días en el GE y de 10 días en el GT de duración de la estancia hospitalaria. El ECA (206) posterior a la RS no encontró diferencias significativas entre grupos (GE mediana: 18.0 (RIC de 10,0 a 47,0); GT mediana de 16; RIC de 8,5 a 42,0; p=0,776), y el ER tampoco (GE: mediana de 8,4 días; RIC de 7 a 20,3) vs. GT: 16,1; RIC de 6,7 a 22,8; p= 0,455).
Calidad
muy baja
Un ECA (206) y los dos ER (207;208) presentan datos sobre el fracaso del tratamiento conservador. En el ECA (206), en diez pacientes del GE (20 %, 10/50) fracasó el tratamiento conservador.
En el ER (207), de los cinco pacientes con ventilación a presión positiva del grupo conservador solo uno fracasó al manejo expectante (20 %, 1/5). En el ER (208) tres pacientes del GE requirieron drenaje pleural (19 %, 3/16).
Calidad
muy baja
En el ECA de Ouellet et al un paciente en cada grupo presento neumonía (GE 8 %(1/13) vs. GT:11 %(1/9), RR:0,7; IC95 % de 0,04 a 9,58). En el ECA de Kirkpatrick et al, 13 pacientes del GO (26,0 %) y siete del GT (17,5 %) presentaron neumonia (RR 2,11; IC95 % de 0,71 a 6,25; p=0,610), diferencia no significativa).
Un ECA presenta una mediana de tres días para los días con ventilación en cada grupo (GE 3; RIC de 0 a 27) vs. GT 3 (RIC de 0 a 8) y el ECA de Kirkpatrick de tres (RIC de 0 a 8) en el grupo GE vs. 2,5 (RIC de 0 a 6,5) días en el grupo GT (p=0,381).
Calidad
muy baja
En el estudio piloto un paciente en cada grupo presenta distrés respiratorio (GE: 7,7 % (1/13) vs. GT: 11,1 % (1/9)) y en el ECA de Kirkpatrick dos pacientes del GE (42 %, 21/50) frente a 12 pacientes del grupo GT (30 %, 12/40) (RR: 0,71; IC95 % de 0,40 a 1,27; p=0,225).
En el ER (207), de los cinco pacientes con ventilación a presión positiva del grupo conservador solo uno tuvo expansión del neumotórax oculto con posterior drenaje (20 %, 1/5) y ninguno del GT (0/7).
Calidad
muy baja
Un ECA (206) presenta datos sobre la necesidad de traqueostomía. Se realizó una traqueostomía a cinco de los 50 pacientes del grupo control (10 %, 5/50) frente a tres pacientes del GT (7,5 %, 3/40); p=1,00.
Un ECA, (206) presenta una mediana de cinco días de duración para el grupo tratamiento (RIC de 4,0 a 8,0).
Calidad
muy baja
En el estudio retrospectivo (207) un paciente en cada grupo presenta complicaciones (GE: 20 % (1/5) vs. GT:14,3 % (1/7)).
Calidad
muy baja
Comparación manejo expectante vs. toracostomía en pacientes sin ventilación a presión positiva.
Dos ECA (203;204) y dos estudios retrospectivos (207;208) comparan la eficacia de la observación frente a la toracostomía en pacientes no ventilados con neumotórax oculto, aunque la calidad de los estudios es baja (203) o muy baja (204;207;208).
La progresión del neumotórax oculto se da en uno de los doce pacientes sin ventilación a presión positiva del ECA de Brasel et al (204) (8,3 %), frente a uno de los nueve pacientes del GT (11,1 %). Ningún paciente presenta progresión del neumotórax oculto en el ECA de Enderson (GE:0/6 vs. GT:0/7).
Calidad
muy baja
En el ER de Llaquet Bayo et al (208), dos pacientes mueren en el GE (3,5 %, 2/57) frente a ninguno del GT.
Calidad
muy baja
Un ER (208) presenta datos sobre el fracaso del tratamiento, siendo este un 11 % para el tratamiento expectante en el grupo de pacientes no ventilados (6 de 57 pacientes).
Calidad
muy baja
El estudio retrosectivo (207) que compara ambos tratamientos en pacientes sin ventilación a presión positiva proporciona datos sobre la aparición de complicaciones (definidas en la comparación con y sin ventilación a presión positiva). Así, seis pacientes del GT (21,4 %, 6/28) y tres del GE (7 %, 3/43) presentan complicaciones para el tratamiento.
Calidad
muy baja
Resultados de la actualización
En la actualización realizada hasta junio de 2019, se ha identificado un estudio descriptivo (209) que refuerza lo que ya se ha descrito previamente, y es que las implicaciones clínicas (tasas de ingreso y de drenajes) de los neumotórax y hemotórax observados solo en TC y de los neumotórax o hemotórax aislados son menores que aquellos que ya son visibles en la radiografía y en aquellos que presentan además otras lesiones torácicas. En cuanto a los estudios sobre el manejo expectante o drenaje de los neumotórax, se han identificado tres estudios observacionales que concluyen que en los casos de neumotórax aislados 210) o no asociados a hemotórax (211) y de pequeño tamaño, incluso en pacientes con ventilación con presión positiva (212), el manejo expectante es seguro. Estos estudios refuerzan lo que ya se había discutido en la pregunta.
Resumen de la evidencia
| Calidad muy baja | El drenaje se asocia a un mayor número de complicaciones que el manejo expectante (203-208), sobre todo en pacientes sin ventilación a presión positiva. Parece haber diferencias entre pacientes sin o con ventilación a presión positiva en relación al fracaso del tratamiento conservador (10 % frente al 20 %, respectivamente), aunque los datos son escasos. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: a confianza en los resultados de la evidencia es muy baja.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados probablemente no favorezca la opción (drenaje frente al manejo expectante).
- Utilización de recursos: hay incertidumbre sobre si los recursos que se requerirían serían pequeños y si el incremento del coste en relación a los beneficos sería pequeño.
- Equidad: las desigualdades en salud probablemente aumentarían.
- Aceptabilidad: la opción del manejo expectante probablemente sea aceptada.
- Factibilidad: la opción del manejo expectante probablemente sea factible.
Recomendaciones
| Débil | Se sugiere no instaurar drenaje torácico en los pacientes con TTCNG que presentan neumotórax oculto, si estos no presentan deterioro clínico, vigilando su evolución. |
| √ | El paciente con TTCNG que va a ser sometido a ventilación con presión positiva en el contexto de una intervención quirúrgica por lesiones asociadas puede ser también observado y no necesariamente precisará de drenaje torácico. |
| √ | Definir un protocolo de seguimiento para aquellos pacientes con TTCNG en los que se decida realizar tratamiento conservador: monitorización clínica continua, radiografía de tórax a las 12 horas o en caso de empeoramiento clínico, y disponibilidad para la colocación de drenaje torácico inmediato. |
Consideraciones para la implementación
- Para realizar la observación de neumotórax ocultos en pacientes con un TTCNG el centro hospitalario debe definir un protocolo de seguimiento y se debe ingresar al paciente, aunque no se realice un drenaje inmediato.
7.3.3. Drenaje pleural del neumotórax oculto
- En los pacientes con TTCNG, con o sin fracturas costales y hemotórax, ¿se debe realizar siempre un drenaje pleural?
En el traumatismo torácico, una de las principales complicaciones pleurales es el hemotórax que se define como la acumulación de sangre en el espacio pleural. El origen es más frecuentemente de vasos de la circulación sistémica (pared torácica), si bien también puede provenir de la circulación pulmonar. La gravedad del hemotórax es muy variable, oscilando entre una situación leve que no requiere tratamiento y no altera la evolución del traumatismo, hasta una complicación grave que compromete la vida del paciente. La indicación y tipo de tratamiento del hemotórax dependerá de la situación clínica del paciente, de la cantidad de líquido que se observe en el espacio pleural, así como su velocidad de instauración. En algunas ocasiones se puede presentar un hemotórax que, por la escasa cantidad de líquido alojado en el espacio pleural, se detecta mediante la TC torácica pero no se observa en la radiografía simple de tórax. Asimilando esta situación a la del neumotórax, se podría catalogar como hemotórax oculto. Habitualmente, para la detección de un derrame pleural en la radiografía simple de tórax es necesaria la existencia de una cantidad mayor de 100 ml en el espacio pleural. Si el paciente se encuentra sin alteración respiratoria o hemodinámica, la presencia de un hemotórax ofrece dudas sobre el manejo terapéutico óptimo y nos guiaremos en función de la cantidad de líquido estimada en las exploraciones radiológicas. No obstante, esta cantidad de líquido que indicaría la necesidad de realizar un tratamiento no está establecida. Una de las opciones es tratar directamente el hemotórax mediante la colocación de un drenaje pleural. Teóricamente, tiene las ventajas de conseguir una resolución más rápida del hemotórax evitando los riesgos de una progresión y las posibles secuelas por la presencia de sangre en el espacio pleural. No obstante, en algunos casos estaremos realizando un procedimiento invasivo, no exento de complicaciones como el empiema, para situaciones que se podrían haber resuelto sin intervención. La otra opción es no realizar un tratamiento directo y observar la evolución del hemotórax mediante control radiológico. Ante esta duda, se ha realizado la revisión de la evidencia científica existente, en busca de estudios comparativos entre el tratamiento con drenaje pleural frente al manejo expectante en el hemotórax traumático para ver su influencia en los diferentes desenlaces clínicos propuestos para poder realizar una recomendación al respecto.
Evidencia científica
En cuanto al estudio retrospectivo (214), se trata de un estudio que incluye pacientes con traumatismo con hemotórax y un ISS ≥ 12 (mediana de 25, RIC de 20 a 34 en ambos grupos). Se incluyeron un total de 635 pacientes con 749 hemotórax, de los que el 66 % (n=491) fue drenado, mientras que el 34 % (n=258) fue manejado de forma expectante. Los factores que predecían la necesidad de drenaje fueron la presencia de volet costal ipsilateral concominante (OR 3,03; IC95 % de 1,04 a 8,80), neumotórax (OR 6,19; IC95 % de 1,79 a 21,5) y el tamaño del hemotórax (OR por un aumento de 10cc de 1,12; IC95 % de 1,04 a 1,21). Aunque el OR ajustado de mortalidad no difirió de forma significativa (OR 3,99; IC95 % de 0,87 a 18,30; p=0,08), el drenaje pleural se asoció con un aumento ajustado del 47,14 % de la duración de la estancia hospitalaria. Los empiemas (n=29) solo ocurrieron entre pacientes con drenaje pleural.
En cuanto al ensayo aleatorizado en marcha (213), aunque todavía no hay datos al respecto, se trata de un estudio que incluirá pacientes con un hemotórax de tamaño moderado-grande (volumen mayor de 300 cc estimados por TC) tras un traumatismo torácico cerrado, sin indicación clínica urgente para drenaje, donde se medirá la tasa de intervenciones torácicas adicionales, complicaciones torácicas severas, duración de la estancia y mortalidad.
Calidad
muy baja
para todos
los
desenlaces
Resumen de la evidencia
| Calidad muy baja | Existe un estudio retrospectivo en pacientes con traumatismo torácico y hemotórax y un ISS ≥ 12 que concluye que la estrategia de manejo expectante del hemotórax traumático se asociaba con una menor duración de la estancia hospitalaria y no se asociaba con la presencia de empiema o aumento de mortalidad (214). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en la evidencia es muy baja.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados probablemente no favorece la opción (drenar frente a observar).
- Utilización de recursos: realizar un drenaje supone un uso de recursos importante si tenemos en cuenta la poca evidencia que hay sobre su mayor eficacia frente al manejo expectante en estos casos.
- Equidad: al disminuir la realización de drenajes se reduce el uso de recursos y el número de complicaciones derivadas del proceso, al menos en los casos en los que se ha podido evitar, por lo que las desigualdades en salud probablemente disminuirían.
- Aceptabilidad: la opción del manejo expectante probablemenete sea aceptada, aunque podría suponer un retraso en el tratamiento con el aumento de días de estancia que se podrían haber evitado en caso de haber colocado el drenaje precozmente.
- Factibilidad: existe incertidumbre sobre la factibilidad de la opción, puesto que, para realizar el manejo expectante, hace falta vigilar al paciente y tener a mano la posibilidad de drenaje rápido en caso de que éste sea finalmente necesario.
En pacientes sin alteraciones respiratorias o hemodinámicas con un hemotórax de escasa cuantía (< 300 ml) no se ha observado evidencia científica que permita recomendar la colocación de un drenaje pleural. No se ha observado empeoramiento en la evolución de los pacientes manejados de forma conservadora. Por el contrario, sí se ha constatado una mayor estancia y la presencia de empiemas en los pacientes tratados con drenaje pleural, aunque estos resultados se deben leer con cautela por derivarse de un único estudio retrospectivo. El grupo considera importante señalar la existencia de un estudio en marcha para valorar la pertinencia del drenaje en hemotórax de escasa cuantía, aunque actualmente no se puede realizar una recomendación al respecto.
Recomendaciones
| Por el momento, no se realiza una recomendación con respecto a la pertinencia del drenaje en hemotórax de escasa cuantía. |
7.3.4. Localización del drenaje
- ¿Cuál es la localización más recomendable de la zona de inserción del drenaje torácico?
Existe cierta confusión y variabilidad en la elección del lugar anatómico en el que llevar a cabo la inserción del drenaje torácico, probablemente derivada del uso de la descompresión del neumotórax traumático mediante agujas y catéteres de calibre fino en la pared anterior del tórax línea medio-clavicular 2º-3º espacio intercostal. Esta vía es efectiva sobre todo para drenar neumotórax a tensión, a menudo en ambiente extra-hospitalario, y es habitualmente recomendada para una descompresión urgente y transitoria. La eficacia de esta maniobra en estos supuestos y su presunta menor dificultad técnica ha servido, en algunos casos, como justificación para recomendar este acceso como el de elección para todos los drenajes torácicos en el contexto traumático en detrimento del formalmente establecido acceso lateral en 5º-6º espacio intercostal línea axilar anterior.
Por ello, parece justificado evaluar la evidencia que pudiera existir en cuanto a la recomendación sobre cuál debe ser el acceso a implementar en los casos en que deba colocarse un drenaje torácico a los pacientes objeto de nuestra guía.
Evidencia científica
Para esta pregunta no se ha realizado una búsqueda específica de GPC, aunque en la guía alemana sobre el manejo del traumatismo grave o con lesiones múltiples utilizada para la definición del paciente se señala que no se puede hacer una recomendación sobre el mejor lugar para la inserción del drenaje torácico, incluso aunque parezca que la zona anterior es igual de segura que la lateral (4).
En otras guías, sí se hace referencia a la localización de la inserción del drenaje o de la aguja cuando se tiene un neumotórax a tensión, señalando como primera opción la localización entre el segundo y tercer espacio intercostal de la línea media clavicular, aunque en la guía de Dennis et al (215) señalan que alternativamente, la decompresión puede ser realizada de forma efectiva en la quinta o sexta espacio intercostal en la línea axilar anterior. Los autores hacen referencia a un MA reciente (216) que concluye que la evidencia obtenida de estudios observacionales sugiere que el espacio entre la cuarta y quinta línea intercostal de la línea axilar anterior es la zona que menor tasa de fracaso registra para la descompresión por aguja.
En la búsqueda de RS, se ha identificado una revisión de 2007 (217), sobre la descompresión con aguja y colocación de drenaje de tórax tras un traumatismo torácico, donde solo se referencia un estudio prospectivo en trauma penetrante. Este estudio señala que el éxito del drenaje tras un neumotórax o hemotórax no depende de la inserción del drenaje en el segundo u octavo espacio intercostal o en la línea media clavicular o axilar.
Por otro lado, se ha identificado una revisión narrativa (218), en la que se señala que la localización anatómica adecuada para la colocación de un drenaje es el triángulo de seguridad (zona anatómica limitada por el borde anterior del músculo dorsal ancho, el borde lateral del músculo pectoral mayor, una línea imaginaria por encima de la mamila, y el vértice de la axila), aunque esta zona puede no ser apropiada en algunas indicaciones, como es el caso de neumotórax apicales aislados.
En cuanto a los estudios individuales identificados, la mayoría describen las complicaciones encontradas tras la inserción de un drenaje torácico (219;220), las diferencias en la tasa de complicaciones según quién realiza la inserción (o el tipo de centro en el que se realiza) (221), la reducción de la tasa de complicaciones tras la implementación de diferentes programas de training (222-225) y tres estudios sobre cómo localizar la zona segura para realizar la inserción del drenaje (226-228).
Entre los artículos que sí mencionan diferencias en los resultados (complicaciones y malaposición del drenaje) en función del zona de inserción del drenaje, el único que responde a la pregunta es el estudio de Huber-Wagner S et al (233), estudio prospectivo que incluye los datos de todos los pacientes a los que se les inserta un drenaje tanto de forma pre o intrahospitalaria (97,1 % por traumatismo cerrado), con un ISS >16 (ISS medio de 38), y a los que se realizó una TC posterior a la inserción del drenaje. Los autores recogen si la inserción fue ventral (en el segundo o tercer espacio intercostal) o lateral (entre el cuarto y sexto espacio intercostal). Se insertaron 101 tubos en 68 pacientes con traumatismo múltiple. En 21 casos se utilizó una aproximación ventral y en 80 lateral. La TC reveló una mala colocación en dos de los drenajes ventrales (2/21; 9,5 %) y en 20 de los laterales (20/80; 25 %). En total se registraron 6 casos (5,9 %) con un drenaje mal colocado y con consecuencias clínicas (un caso de 20 de los insertados de forma ventral (4,76 %) y cinco casos entre los 80 insertados de forma lateral (6,25 %)).
Calidad
muy baja
para todos
los
desenlaces
Resumen de la evidencia
| Calidad muy baja | No hay diferencias significativas en cuanto al número de drenajes mal colocados con consecuencias clínicas, ni en la tasa de complicaciones asociadas a la inserción del drenaje en la zona lateral o anterior del tórax (233). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en la evidencia encontrada para responder a la pregunta es muy baja.
- Balance entre beneficios y riesgos: existe incertidumbre sobre si el balance entre los efectos desados y no deseados favorece la opción.
- Utilización de recursos: probablemente los recursos requeridos son muy pequeños, así como el incremento del coste en función a los beneficios.
- Equidad: existe incertidumbre sobre el impacto de la opción en las desigualdades en salud.
- Aceptabilidad: existe incertidumbre sobre la aceptabilidad de la opción.
- Factibilidad: probablemente la opción sea factible.
El grupo no ve posible realizar una recomendación en base a la evidencia disponible, puesto que sólo hay un estudio y de mala calidad para responder a esta pregunta. Sin embargo, debido al alto grado de consenso existente, se considera necesario realizar una recomendación de buena práctica sobre la localización lateral como la preferida a la hora de insertar un drenaje pleural. Por ello, la recomendación de tipo consenso que se realiza es la siguiente:
Recomendaciones
| √ | En pacientes con traumatismo torácico y neumotórax normotensivo y/o hemotórax, considerar la colocación del drenaje en la línea axilar anterior en quinto-sexto espacio intercostal en todos los supuestos. |
7.3.5. Calibre del drenaje
- ¿Cuál es el calibre del drenaje a utilizar en un neumotórax traumático? ¿Y en un hemotórax?
Una vez tomada la decisión de colocar un tubo de drenaje torácico en el contexto de la atención al paciente traumatizado, existe cierta controversia acerca del calibre del drenaje a utilizar. Los drenajes de grueso calibre ofrecerían, a priori, menos posibilidades de obstrucción y facilitarían el drenaje de contenidos más espesos como el hemotórax. Sin embargo, la inserción de tubos de grueso calibre supone mayor demanda de cualificación técnica toda vez que las posibilidades de iatrogenia o complicaciones podrían ser también mayores. Una mayor cualificación podría requerir el concurso de cirujanos especializados que aumentaría la demanda de recursos humanos necesarios y quizás también de centros de referencia.
Por otra parte, en la práctica habitual de las unidades de Cirugía Torácica, los drenajes de calibre menor utilizados para la evacuación de neumotórax y en el postoperatorio de los procedimientos de resección pulmonar constituyen una realidad extendida. Por el contrario, en el contexto del traumatismo, la escasa información bibliográfica acerca de los calibres de los drenajes empleados apunta hacia un uso de los de mayor diámetro (28-32 Fr.).
Parece oportuno orientar, desde la evidencia si fuera posible, al personal facultativo encargado del tratamiento de estos pacientes hacia qué calibre es más oportuno utilizar.
Evidencia científica
Para esta pregunta no se ha realizado una búsqueda de GPC específica. Sí se han realizado búsquedas de RS, identificándose una revisión BET de 2013 sobre la importancia del tamaño del tubo para el drenaje de un hemotórax traumático (235), así como varias revisiones narrativas sobre la eficacia y seguridad de drenajes de diferente calibre en el manejo de neumotórax (principalmente neumotórax primario espontáneo), efusión pleural maligna o infección pleural, aunque en este último caso se ha considerado la revisión de McCraquen et al (236) por ser la que mejor describe la evidencia.
Calibre del drenaje en el manejo de hemotórax/hemoneumotórax traumático
En la revisión BET (235), de los cuatro estudios individuales identificados por los autores se han excluido dos por comparar la inserción de un drenaje de calibre 28-32F frente a uno de 36-40F (237) (diámetros excesivamente grandes) y el otro (240) por comparar la inserción de un catéter venoso central frente a un tubo de drenaje convencional.
En la búsqueda posterior a la publicación del BET, se han identificado dos estudios más, aunque uno no ha sido tenido en cuenta por incluir pacientes a los que se realizaba un drenaje de urgencia (242). El segundo estudio es un artículo de los mismos autores que el estudio de Kulvatunyou et al (239) pero que incluye más datos (241). Por ello, finalmente se han tenido en cuenta este último estudio (241) y el estudio de Rivera et al (238).
Estos dos estudios evalúan la inserción de un drenaje de menor calibre (entre 10-14F) frente a uno de mayor calibre (entre 32-40F).
El estudio de Rivera et al (238) incluye todos los pacientes con lesión torácica (neumotórax, hemotórax, empiema, efusión o loculaciones pleurales) a los que se les realiza una toracostomía, tratándose en 157 casos (n=359) de un procedimiento no urgente. Entre estos casos, en 63 se utilizó un tubo de drenaje grande y en 107 uno pequeño. Cuando se utilizaba un tubo de menor calibre, el drenaje se realizaba más tarde (a los 5,5 días vs. 2,3 días) que en los de mayor calibre, con menor ISS (18,9 vs. 24,3; <0,01) y estancia hospitalaria (10,5 vs. 16,5 días). Los tubos de menor calibre eran colocados con mayor frecuencia en el drenaje de efusiones (31,3 % vs 9,9 %) y con menor frecuencia en el manejo de neumotórax (45,8 % vs 69 %) y hemotórax (27,5 % vs, 35,2 %), aunque esta última diferencia no fue estadísticamente significativa.
El estudio de Bauman et al incluye 496 pacientes con hemotórax traumáticos que requerían drenaje, siendo 270 no urgentes (109 con catéteres de gran tamaño y 161 con catéter pigtail). Tambíen había diferencias en la edad y tipo de trauma (cerrado o penetrante) en la elección del tipo de catéter.
En el estudio de Bauman et al (241), la tasa de fracaso en pacientes que no necesitan drenaje de emergencia es del 17 % frente al 18 % (calibre pequeño frente al calibre grande), y las diferencias en el volumen drenado inicialmente (400ml vs 350ml; p=0,08) y la tasa de complicaciones asociadas a la inserción (9 % vs 3 %; p=0,05) no llegaron a ser estadísticamente significativas. Si se tienen en cuenta los resultados del segundo estudio, la tasa de complicaciones (neumotórax, hemotórax, hidrotórax, fibrotórax, empiema, descolocación del tubo o mala posición) fue similar en ambos grupos (pequeño vs. grande: 25,2 % vs 29,6 %, respectivamente), aunque la tasa de fibrotórax fue menor en el grupo drenado con tubos de menor calibre (0 % vs. 4,1 %; p<0,05). El tubo fue mal colocado sólo en un caso de los de pequeño calibre, mientras que la descolocación del tubo se dio en dos casos de los de mayor calibre y en ninguno de los tubos de pequeño calibre (238).
Calidad
muy baja
para todos
los
desenlaces
Calibre del drenaje en el manejo de neumotórax traumático
En cuanto al neumotórax, se han identificado varias revisiones narrativas en relación a la eficacia del diámetro del tubo de drenaje en la resolución del mismo. De todas ellas se ha preseleccionado una de 2018 (236), aunque sólo incluye estudios en efusión pleural maligna, infección pleural y neumotórax espontáneo.
Por otro lado, se ha identificado un pequeño ECA de 2014 (243) sobre la eficacia del catéter Pigtail (14F) frente al tubo de drenaje torácico (28F) en pacientes con un neumotórax traumático no complicado. El objetivo del estudio era evaluar en pacientes que no requieren una evacuación de urgencia, si el dolor en la zona de inserción del tubo era menor al utilizar un catéter Pigtail. En el estudio se incluyeron 40 pacientes, ninguno con volet costal o hemotórax. Los autores encuentran que los resultados en cuanto a la tasa de éxito (95 % vs 90 %), las complicaciones relacionadas con la inserción del tubo (10 % vs. 10 %), la duración (2 (RIC 2 a 3) vs. 2 (RIC 2 a 6) y la estancia hospitalaria (4 (3-7) vs. 4 (3-7) son similares entre grupos. Sin embargo, aunque el dolor basal era similar entre grupos, en el lugar de la inserción del tubo el dolor era mayor para el grupo con un tubo torácico (día 0: 3,2(0,6) vs 7,7 (0,6); día 1: 1,9 (0,5) vs 5,5 (1,0); día 2: 2,1 (1,1) vs 5,5 (1,0)). El uso durante 24 h de medicación para el dolor fue menor para los pacientes del grupo con catéter, aunque la diferencia no fue significativa.
Calidad
muy baja
para todos
los
desenlaces
Resumen de la evidencia
| Calidad muy baja | No hay diferencias en la eficacia y seguridad entre la utilización de tubos de pequeño o mayor diámetro. Sin embargo, hay diferencias entre las características de los pacientes a los que se les inserta un tubo de menor o mayor calibre en los estudios, por lo que no está claro que para todos los pacientes la eficacia y la seguridad sea la misma (238;241). |
| Calidad baja | En un ECA de pequeño tamaño no se encuentran diferencias en la eficacia y seguridad del uso de tubos de 14F frente al tubo de 28F en pacientes con neumotórax traumático no complicado, aunque parece que el dolor en la zona de inserción es mayor en pacientes en los que se utilizan tubos de mayor calibre (243). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia para los hemotórax es muy baja, y para el neumotórax, es baja.
- Balance entre beneficios y riesgos: hay incertidumbre sobre el balance entre los efectos deseados y no deseados.
- Utilización de recursos: probablemente los recursos requeridos sean pequeños, y el incremento del coste en relación a los beneficios probablemente también sea pequeño.
- Equidad: existe incertidumbre sobre el impacto de la opción en las desigualdades en salud.
- Aceptabilidad: existe incertidumbre sobre la aceptabilidad de la opción, puesto que puede haber diferentes opiniones en relación a los profesionales que realizan el procedimiento, que no estén acostumbrados a utilizar tubos de drenaje de distintos calibres.
- Factibilidad: la opción probablemente sea factible.
En el momento agudo parece razonable que el uso de tubos de drenaje de calibre menor favorezca la recuperación funcional y disminuya las posibilidades de producir complicaciones iatrogénicas relacionadas con la inserción de los mismos.
No hay clara evidencia que apoye la necesidad de colocar un tubo de calibre grueso en estos pacientes, por lo que recomendamos el uso de los de menor calibre (menor o igual de 20F) si el contexto sugiere neumotórax, y de los de calibre moderado (24-28F) serían suficientes en el contexto de hemotórax o hemoneumotórax. Por ello, las recomendaciones que se han formulado han sido las siguientes:
Recomendaciones
| √ | Utilizar drenajes de un calibre menor o igual de 20F si la condición sugiere neumotórax con indicación de drenaje y de un calibre entre 24-28F en el contexto de hemotórax o hemoneumotórax. |
7.4. Anticoagulantes y antiagregantes
Preguntas para responder:
- ¿Cuál es el riesgo de hemotórax en pacientes con TTCNG?
- ¿Cuándo se debe suspender el tratamiento con anticoagulantes o antiagregantes en pacientes con TTCNG?
El uso de fármacos anticoagulantes y antiagregantes es cada vez más prevalente en nuestra población. Ante un paciente traumatizado, nos encontramos en la disyuntiva de qué tendrá más impacto: la hemorragia derivada del mismo o el riesgo trombótico o tromboembólico -si suspendemos y/o revertimos el tratamiento crónico- por la enfermedad de base del mismo. Cuando se tratan hemorragias de riesgo vital, disminuyen las dudas para retirar -o revertir- fármacos anticoagulantes, ya que el riesgo es evidente. El problema se nos presenta en los traumatismos menos graves, en estos casos debemos ponderar de manera individualizada el riesgo-beneficio del mantenimiento de los anticoagulantes y antiagregantes.
Evidencia científica
Para determinar el riesgo de hemorragia (principalmente hemotórax) de pacientes anticoagulados y/o antiagregados que han sufrido un TTCNG, se ha buscado lo siguiente:
- Riesgo de hemotórax en pacientes que sufren un TTCNG en general.
- Riesgo de hemotórax en pacientes que sufren un TTCNG que están anticoagulados y/o antiagregados.
- Riesgo de hemorragia de pacientes que sufren un TTCNG y están anticoagulados y/o antiagregados y a los que se les va a colocar un drenaje pleural o se les va a insertar un catéter epidural o paravertebral.
Para los dos primeros puntos, se han realizado revisiones sistemáticas para conocer cuál es el riesgo de hemotórax basal de los pacientes que han sufrido un traumatismo torácico no grave con o sin tratamiento previo anticoagulante o antiagregante.
Para la determinación del riesgo de hemorragia al insertar un catéter epidural o paravertebral, se han utilizado las tablas de riesgo de hemorragia de los procedimientos anestésicos que se describen en el Documento de Consenso sobre el manejo postoperatorio y periprocedimiento del tratamiento antitrombótico de Vivas et al (244).
En el caso de la colocación de un drenaje pleural, el grupo elaborador de la guía ha realizado búsquedas específicas para determinar cuál puede ser dicho riesgo. En esa búsqueda se han encontrado tres revisiones, dos sobre el riesgo de hemorragia de intervenciones pulmonares (245;246) y otra sobre riesgo de hemorragia de los procedimientos (247), que abordan este tema.
Para determinar el riesgo trombótico y tromboembólico de un paciente anticoagulado y/o antiagregado, el grupo elaborador de la guía ha decidido utilizar las tablas que definen el riesgo trombótico y tromboembólico del Documento de Consenso mencionado anteriormente (244).
No se han identificado guías sobre el manejo de pacientes con traumatismo no grave en tratamiento previo con anticoagulantes o antiagregantes, ni estudios que comparen si el suspender o no el tratamiento tiene efectos sobre los desenlaces de estos pacientes. Por lo tanto, para considerar si tras un TTCNG hay que suspender o no el tratamiento anticoagulante o antiagregante, el grupo considera que lo único que puede tenerse en cuenta es el balance entre: 1) el riesgo trombótico o tromboembólico del paciente si se le suspende el tratamiento y 2) el riesgo de hemorragia si no se le suspende.
7.4.1. Riesgo de hemorragia (hemotórax)
Riesgo de hemotórax tras un traumatismo torácico no grave
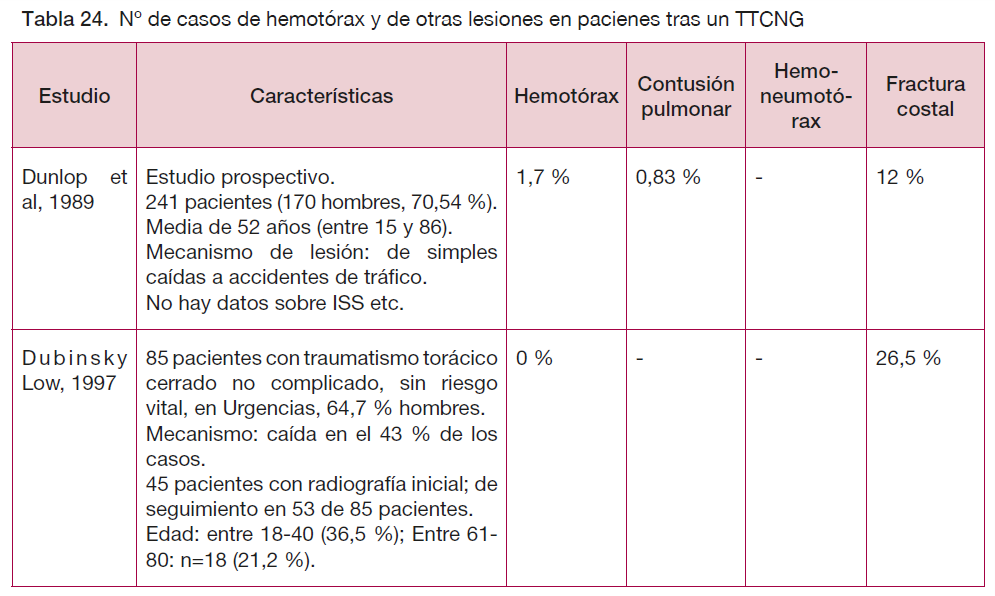
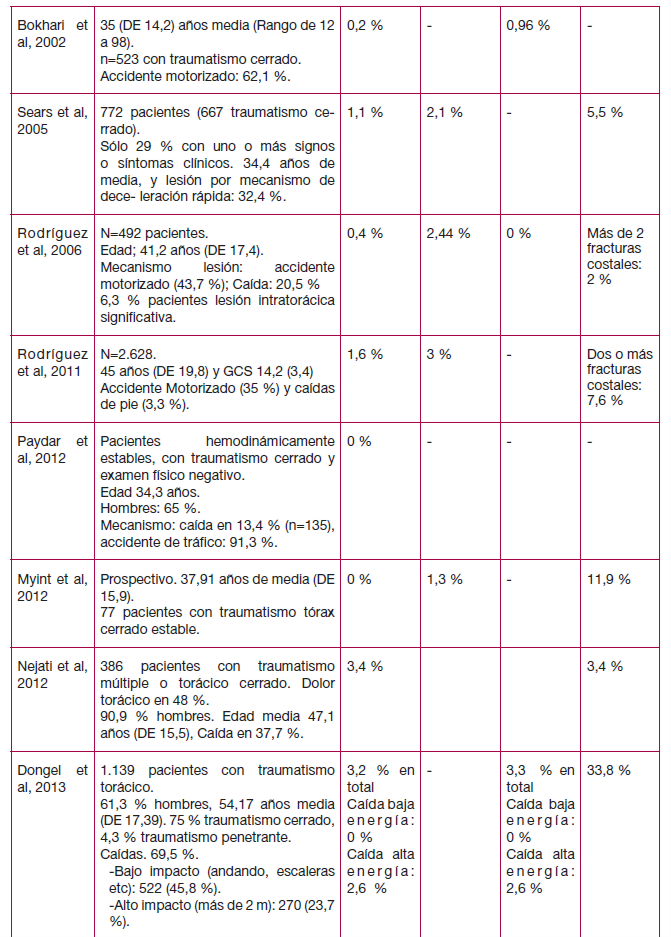
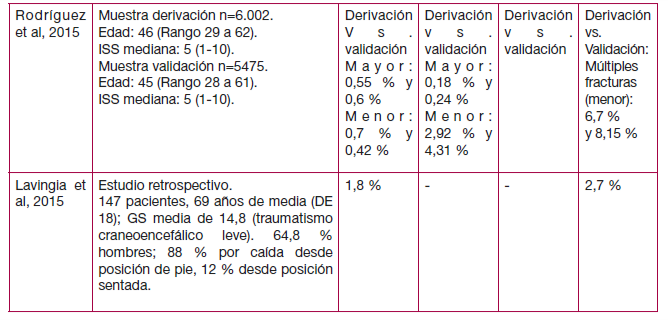
La incidencia de hemotórax y de otro tipo de lesiones en los pacientes que acuden a urgencias por un traumatismo torácico es muy baja (Hemotórax: mediana de 1 % (rango de 0 % a 3,4 %); media de 1,09 % (DE 0,011 %)). En estos pacientes, la prevalencia de fractura costal también es baja (menor del 26,5 %) (ver tabla 23).
Calidad
moderada
Los estudios no valoran el riesgo en función de las características del traumatismo o de los pacientes, salvo el estudio de Dongel et al (248), en el que los autores describen la prevalencia de las lesiones en función del mecanismo lesional del traumatismo. Así, aunque en el 3,2 % de los casos hubo un hemotórax (n total=1.109) y en un 3,3 % un hemoneumotórax, en los pacientes que sufrieron una caída de baja energía no hubo ningún caso. Asimismo, en los pacientes que sufrieron una caída de alta energía la prevalencia de hemotórax y hemoneumotórax fue del 2,6 % y 2,2 %, respectivamente.
En este estudio, el 33,8 % de los pacientes presentaron fracturas costales, aunque en su mayoría (61 %) con una única fractura costal. Ninguno de los pacientes que sufrió una caída de baja energía presentó más de tres fracturas costales frente al 5,6 % de los pacientes que sufrieron una caída de alta energía.
Calidad
baja
Resumen de la evidencia
| Calidad moderada | La incidencia de hemotórax en pacientes que han sufrido un traumatismo torácico cerrado es muy baja (mediana de 1 % (rango de 0 % a 3,4 %)). (26;27;31-27;82;84;248). |
| Calidad baja | En un estudio (248) señalan que aunque la incidencia general de hemotórax fue del 3,2 % (n total=1.109), en los pacientes que sufrieron una caída de baja energía no hubo ningún caso. |
Riesgo de hemotórax en pacientes con traumatismo torácico no grave anticoagulados y/o antiagregados
No se han identificado estudios que evalúen el riesgo de hemorragia (riesgo de hemotórax, entre otros) en pacientes anticoagulados que sufren un TTCNG. Lo único que se ha encontrado son estudios que describen mayor riesgo de hemorragia intracraneal y mortalidad subsecuente, o mortalidad total, en pacientes traumatizados anticoagulados (incluyendo todo tipo de mecanismos) (249;252;253) o en pacientes que han sufrido una caída (con lesiones asociadas, sobre todo TCE) (250;251).
No hay
estudios
De forma indirecta, se ha descrito que el uso de anticoagulantes, entre otros factores, predice el desarrollo de complicaciones (no sólo hemotórax) tras un traumatismo torácico cerrado (109) (ver capítulo sobre criterios de ingreso u observación hospitalaria), aunque no definen qué anticoagulantes previos, por qué razón se utilizaban y no se hacía un análisis por tipo de complicación. Los autores del modelo ya habían publicado dos estudios retrospectivos en los que identificaron dichos factores (106;254).
Calidad
baja
En dos estudios que determinan la incidencia de complicaciones tardías (principalmente hemotórax y neumotórax) (255;256) aunque recogen si los pacientes recibían o no tratamiento previo anticoagulante, el primero (255) no señala si el riesgo de aparición de complicaciones diferidas depende de haber recibido tratamiento previo anticoagulante y, aunque el segundo (256) señala que el tratamiento previo con aspirina o warfarina es más frecuente en pacientes que presentaron complicaciones diferidas, en el análisis multivariante el tratamiento previo con aspirina deja de ser significativo.
Calidad
baja
Resumen de la evidencia
| No hay estudios | No se han identificado estudios que evaluén si el riesgo de presentar hemotórax tras un TTCNG es mayor en los pacientes que recibían tratamiento previo anticoagulante frente a los que no lo recibían. |
| Calidad baja | El uso previo de anticoagulantes (todo tratamiento anticoauglante y antiagregante a cualquier dosis) (109) predice de forma significativa, junto con otros factores de riesgo, el desarrollo de complicaciones (entre las que se encuentra el hemotórax, entre otros desenlaces), en pacientes que sufren un traumatismo torácico cerrado. |
| Calidad baja | La incidencia de complicaciones tardías puede aumentar en pacientes en tratamiento previo con aspirina o warfarina (255;256). |
Riesgo de hemorragia en inserción de tubo de drenaje torácico y procedimientos anestésicos
En referencia a los procedimientos anestésicos, en el documento consenso sobre el Manejo perioperatorio y periprocedimiento del tratamiento antitrombótico español (244), se considera que tanto la analgesia epidural como la paravertebral son procedimientos de riesgo alto.
En cuanto al riesgo de hemorragia tras la inserción de un drenaje torácico, se han identificado tres revisiones: dos sobre el riesgo de sangrado de pacientes en tratamiento con anticoagulantes o antiagregantes que van a ser sometidos a intervenciones pulmonares (245;246) y una revisión sobre el riesgo de hemorragia de las intervenciones (247). En la revisión de Wolfe et al (247) se señala que el riesgo de hemorragia para un drenaje torácico está entre el 0,2 y el 1,4 %, en función del diámetro del tubo insertado, y que algunas guías recomiendan retrasar la inserción del tubo hasta que el INR sea menor de 1,5 si las circunstancias clínicas lo permiten (257), aunque no hay estudios de calidad que apoyen dicha recomendación.
Consenso
En esta revisión señalan dos artículos en los que se examina la colocación del tubo de drenaje (en la línea media axilar guiado por ecografía) en pacientes con clopidrogel, observando que no hubo un aumento de la incidencia de hemorragia en estos pacientes (232;258).
Calidad
baja
Tanto en la revisión de Pathak et al (245) como en la de Herman et al (246) se incluyen estos dos estudios (232;258). Estos dos estudios excluyeron los pacientes que tenían un INR >2 o un contaje de plaquetas <50.000 plaquetas µl-1.
Resumen de la evidencia
| Consenso | El riesgo de hemorragia de los procedimientos anestésicos es alto debido al impacto clínico que pueden tener (244). |
| No hay estudios | No se han identificado estudios que valoren si el riesgo de hemotórax tras la colocación de un drenaje pleural aumenta en pacientes anticoagulados. |
| Calidad baja | El riesgo de hemorragia tras la colocación de un drenaje pleural no aumenta en aquellos pacientes en tratamiento con clopidrogel (232;258). |
7.4.2. Riesgo tromboembólico o trombótico
En cuanto al riesgo tromboembólico o trombótico, en el documento consenso del manejo perioperatorio y periprocedimiento del tratamiento antitrombótico (244), se describen dos tablas de riesgo: una para los pacientes en tratamiento anticoagulante y otra para los pacientes en tratamiento antiagregante (ver Figura 4).
En el caso del riesgo tromboembólico anual (tanto arterial como venoso) éste se clasifica como bajo (<5 %), moderado (entre el 5-10 %) o alto (>10 %) según el motivo del tratamiento anticoagulante. En el caso de riesgo trombótico en pacientes antiagregados, el riesgo se clasifica en bajo, moderado o alto en función de la patología de base que lleva a la indicación del tratamiento antiagregante. En la Figura 4 se resumen dichos riesgos (con permisos de reproducción de las tablas de riesgo del deocumento consenso sobre el Manejo Perioperatorio y periprocedimiento del tratamiento antitromótico español (244).
Por otro lado, se ha identificado un estudio (259) en pacientes con traumatismo torácico aislado (aunque no se dan las características de edad, gravedad, mecanismo de lesión etc…) en el que se señala, entre otros factores, la presencia de hemotórax como factor de riesgo para presentar eventos tromboembólicos (OR de 3,9; IC95 % de 1,3 a 11,7), aunque no se puede saber si en realidad esto se debe a la dificultad de instaurar profilaxis para enfermedad tromboembólica en estos pacientes.
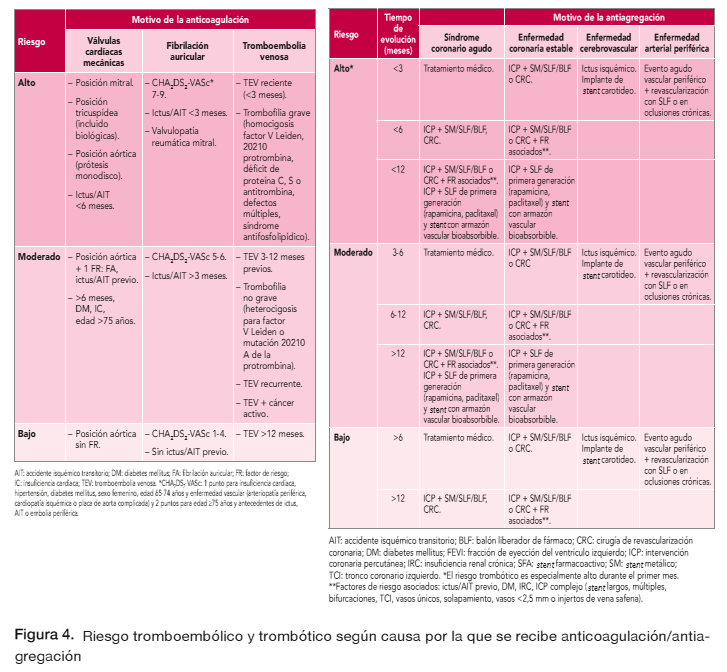
*Imágenes modificadas con el permiso de Elsevier. Fuente original: Vivas et al, 2018. Manejo perioperatorio y periprocedimiento del tratamiento antitrombótico: documento de consenso de SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH, SETH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENEC, SEO, SEPA, SERVEI, SECOT y AEU. Rev Esp Cardiol (Engl Ed). 2018 Jul;71(7):553-564.
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: no hay estudios que comparen los desenlaces de suspender o mantener el tratamiento anticoagulante o antiagregante en pacientes que han sufrido un TTCNG. Se entiende que cuando hay hemorragia activa, no hacen falta estudios que determinen la eficacia de suspender el tratamiento anticoagulante. Por otro lado, 1) la incidencia de hemorragia en pacientes que sufren un TTCNG es baja (calidad moderada); 2) el tratamiento con anticoagulantes es un factor que predice un aumento de complicaciones (variable compuesta) (calidad moderada), 3) el riesgo de hemorragia por la colocación de un drenaje pleural en pacientes con clopidrogel es bajo (calidad baja) y el riesgo de los procedimientos anestésicos es alto. Por lo tanto, todo esto habría que balancearlo con el riesgo trombótico o tromboembólico del paciente según la causa por la que se indica tratamiento anticoagulante o antiagregante.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados es incierto.
- Utilización de recursos: hay incertidumbre sobre si los recursos que se requerirían serían pequeños, puesto que en los pacientes anticoagulados, ante ambas situaciones -mantener o suspender-debemos monitorizar con estudios de coagulación y hemograma a los pacientes, por lo que no cambian los recursos requeridos. En el caso de los ACOD (anticoagulantes de acción directa) la monitorización de su efecto no es un análisis tan rutinario como con los ACO (anticoagulantes orales), por lo que aumentaría la necesidad de recursos. En cuanto al incremento del coste en relación a los beneficios, probablemente este sería pequeño, puesto que en el caso de los pacientes anticoagulados, en ambas situaciones, se mantienen los costes derivados de los estudios necesarios para la monitorización del estado de coagulación del paciente. En el caso de los ACOD el coste de su monitorización es más alto. En los pacientes antiagregados, no aumentaría el coste, incluso bajarían en el caso de suspenderlos temporalmente.
- Equidad: existe incertidumbre sobre el impacto de la opción en las desigualdades en salud, sobre todo en cuanto a suspender el tratamiento cuando no haya hemorragia activa.
- Aceptabilidad: existe incertidumbre sobre la aceptabilidad de la opción, puesto que puede haber diferentes opiniones de cuándo suspender o mantener el tratamiento en pacientes que han sufrido un TTCNG, porque se trata de pacientes que no son tan predecibles como los pacientes que ingresan para la realización de una cirugía programada.
- Factibilidad: la opción probablemente sea factible.
No existen estudios de calidad para poder sacar conclusiones basadas en evidencia en este tema, únicamente, se ha visto que pacientes que toman anticoagulantes o antiagregantes con TCE presentan mayor mortalidad que los que no lo toman, por lo que en un paciente con traumatismo torácico y TCE asociado -aunque sea leve- se debe de seguir las guías de práctica clínica del TCE.
Tanto la hemorragia como la trombosis (tromboembolismo) están asociadas a una importante morbi-mortalidad. Por lo que, lo primero que se debe de hacer es aclarar el motivo por el que el paciente está en tratamiento anticoagulante o antiagregante -para valorar el riesgo trombótico de la patología que presenta- y los riesgos de suspender o revertir el efecto de los fármacos empleados. Para ello, recomendamos conocer las tablas de los motivos de anticoagulación y antiagregación y riesgo trombótico del Documento Consenso sobre el manejo postoperatorio y periprocedimiento del tratamiento antitrombótico de Vivas et al. El riesgo que se estime, lo enfrentaremos al grado de sospecha de hemorragia activa en el paciente por el traumatismo que presente, de manera que valoramos el riesgo-beneficio del manteniemiento del tratamiento crónico de manera individualizada.
Por todo ello, las recomendaciones que se han formulado han sido las siguientes:
Recomendaciones
| Anticoagulantes y antiagregantes | |
|---|---|
| √ | En pacientes anticoagulados o antiagregados que han sufrido un TTCNG, descartar traumatismo craneoencefálico, aunque sea leve. En caso de que exista, se remite para su manejo a las guías de práctica clínica correspondientes. |
| Anticoagulantes | |
| √ | En pacientes anticoagulados que han sufrido un TTCNG sin TCE asociado y con sospecha clínica de hemorragia activa, suspender y revertir el tratamiento anticoagulante. |
| √ | En pacientes que han sufrido un TTCNG que requieran procedimientos analgésicos invasivos y estén anticoagulados, dado que el riesgo hemorrágico asociado a la técnica es alto, se aconseja esperar a la normalización de la coagulación siempre que la situación clínica del paciente lo permita. |
| √ | En pacientes que han sufrido un TTCNG que requieran procedimientos de drenaje torácico y estén anticoagulados, pese a que la evidencia disponible sugiere que el riesgo de hemorragia es bajo, normalizar el estado de coagulación antes de llevar a cabo el procedimiento, siempre que la situación clínica del paciente lo permita. |
| √ | En los pacientes con TTCNG y en tratamiento anticoagulante oral con inhibidores directos o indirectos de la vitamina k se debe documentar el tiempo trascurrido desde la última dosis, realizar un hemograma, estudio de la función renal y el estudio de coagulación dirigido según el tratamiento de base (Tiempo de protrombina, INR, tiempo de trombina diluida, Tiempo de Trombina parcial activada, Anti Factor Xa). |
| √ | Se aconseja consultar con el Servicio de Hematología para consensuar las medidas necesarias para la corrección de la dosis. |
| √ | En aquellos pacientes anticoagulados que han sufrido un TTCNG en los que se haya optado por mantener la anticoagulación, se extremará la vigilancia clínico-radiológica. |
| √ | En pacientes con TTCNG y con baja sospecha de hemorragia, valorar el balance riesgo beneficio de mantener la anticoagulación en función de la patología de base. |
| Antiagregantes | |
| √ | En pacientes con TTCNG y tratamiento con ácido acetil salicílico (AAS) como prevención primaria, suspender el tratamiento independientemente de la sospecha de sangrado. En pacientes en prevención secundaria, el ácido acetil salicílico se mantiene siempre. |
| √ | En pacientes con TTCNG en prevención secundaria, hemorragia activa y en tratamiento sólo con tienopiridinas, suspender el tratamiento si el riesgo trombócio es bajo. Si el riesgo trombótico es alto, individualizar en equipo multidisciplinar si suspender o no el tratamiento. |
| √ | En pacientes con TTCNG con doble antiagregación por prevención secundaria, riesgo trombótico bajo y sospecha de hemorragia activa, mantener aspirina y suspender el segundo antiagregante. |
| √ | En pacientes que han sufrido un TTCNG con doble antiagregación por prevención secundaria, riesgo trombótico alto y sospecha de hemorragia activa, mantener AAS y decidir de forma individualizada en equipo multidisciplinar si suspender o no el segundo antiagregante. |
| √ | Pueden realizarse procedimientos analgésicos invasivos en pacientes con TTCNG que estén antiagregados con AAS. Sin embargo, en aquellos que están en tratamiento con tienopiridinas se desaconseja su realización. |
7.5. Rehabilitación respiratoria
Preguntas para responder:
- ¿Se debe implementar un programa de rehabilitación respiratoria en pacientes con TTCNG para reducir complicaciones pulmonares postraumáticas?
- ¿Cuánto tiempo se debe esperar para iniciar la rehabilitación respiratoria en el paciente con TTCNG?
- ¿Se debe añadir el uso de incentivador inspirométrico a la fisioterapia respiratoria convencional para reducir en mayor medida las complicaciones pulmonares en pacientes con TTCNG?
- ¿Se puede sustituir la fisioterapia respiratoria convencional por el uso de incentivador inspirométrico en pacientes con TTCNG?
- Si se va a utilizar un incentivador inspirométrico, ¿se debe utilizar un incentivador de tipo volumétrico o uno de flujo?
- ¿Cuánto tiempo debe durar la rehabilitación respiratoria en pacientes con TTCNG?
La consecuencia principal del traumatismo torácico es el dolor. Este dolor va a producir una alteración de la mecánica respiratoria con una respiración superficial que provocará una hipoventilación pulmonar de predominio bibasal, además de una tos ineficaz. Esta situación conlleva un aumento del riesgo de aparición de atelectasias, derrame pleural, retención de secreciones, infecciones respiratorias y/o neumonías.
Además, el traumatismo torácico per sé puede provocar la aparición de contusión pulmonar y de derrame pleural – hemotórax.
La rehabilitación respiratoria entendida como el conjunto de intervenciones para disminuir estas complicaciones, tendría un papel fundamental para prevenir – tratar estas situaciones.
Dichas intervenciones abarcarían desde tratamiento analgésico adecuado, medidas de cambios posturales y de movilización precoz hasta ejercicios específicos de fisioterapia respiratoria (dirigidos a mejorar la mecánica respiratoria y a movilizar secreciones), así como técnicas instrumentales como los incentivadores inspirométricos (flujo y volumétrico), dirigidos a mejorar la función pulmonar.
El objetivo de la revisión bibliográfica realizada es responder qué tipo de intervención es más eficaz, tanto de fisioterapia respiratoria como de técnica instrumental, así como la duración de la misma, para formular las respuestas a las preguntas planteadas.
Evidencia científica
Se han seleccionado las siguientes revisiones para identificar posibles estudios individuales que pueden responder a las preguntas planteadas:
- Agostini et al (260)
- Carvalho CRF et al (261)
- Rodriguez-Larraz et al (262)
De las revisiones que analizan el uso de incentivadores inspirométricos, la revisión de Agostini et al (260) identifica cinco estudios relevantes: tres ECA, dos de los cuales comparan la fisioterapia respiratoria frente a la adición del uso del incentivador inspirométrico a la fisioterapia (264;265) y un tercer ECA que compara el uso de la fisioterapia respiratoria junto con el incentivador inspirométrico frente a no tratamiento (266), y un último estudio (no aleatorizado) que compara el uso de fisioterapia intensiva frente al incentivador inspirométrico (267) en pacientes lobectomizados.
La revisión de Carvalho et al (261) no identifica nuevos estudios sobre cirugía torácica a los ya incluidos en Agostini et al (260).
La revisión de Rodriguez-Larrad et al (262) sobre fisioterapia perioperatoria en pacientes con cáncer de pulmón sometidos a resección pulmonar, identifica tres nuevos estudios individuales (268-270), de los que se seleccionan dos (268;270), puesto que el tercero (269) trata sobre la eficacia del ejercicio físico temprano.
De la búsqueda de estudios individuales desde 2011, entre los estudios que pueden responder a las preguntas sobre el uso adicional del incentivador y la sustitución de la fisioterapia respiratora por un incentivador inspirométrico se han identificado los estudios de Rodriguez-Larraz et al (273), Gunay et al (274) y Malik et al (275).
Para la pregunta sobre si se debe utilizar un incentivador de tipo volumétrico o de flujo, se ha realizado una búsqueda de estudios individuales, encontrando sólo cinco estudios en voluntarios sanos que comparan su efecto sobre expansión torácica, patrón respiratorio, sincronía toraco-abdominal, la actividad de los músculos respiratorios y la función pulmonar, entre otros.
Para la pregunta sobre el tiempo que ha de durar la rehabilitación, se han descrito los tiempos de duración de las intervenciones en los estudios incluidos.
En cuanto a la pregunta de cuánto tiempo se debe esperar para iniciar la rehabilitación respiratoria, al no encontrar estudios que compraran los efectos de iniciar o no de forma temprana la rehabilitación respiratoria, se ha realizado una búsqueda de estudios sobre la incidencia de complicaciones diferidas y el tiempo en el que éstas aparecen con mayor frecuencia.
7.5.1. Programas de rehabilitación respiratoria
- ¿Se debe implementar un programa de rehabilitación respiratoria en pacientes con TTCNG para reducir complicaciones pulmonares postraumáticas?
Son dos los estudios que pueden responder a esta pregunta: (270;273).
El estudio de Rodriguez-Larrad et al (277) es un estudio cuasiexperimental (del tipo antes y después) que evalúa los efectos de un programa intensivo de fisioterapia postoperatoria basado en ejercicios respiratorios en pacientes lobectomizados mediante toracotomía abierta. Los 102 pacientes del grupo control recibieron atención médica/de enfermería estándar (incentivador inspirómetro volumétrico en sala preoperatorio) y los del grupo experimental (n=106) además se sometieron a un programa de fisioterapia diaria (ejercicios respiratorios: sesiones individuales de fisioterapia respiratoria hasta la fecha del alta hospitalaria: que los pacientes dominasen las técnicas de reexpansión pulmonar y que fueran autónomos en las maniobras de limpieza de las vías respiratorias).
El estudio de Reeve et al (270) describe si la fisioterapia respiratoria postoperatoria disminuye la incidencia de complicaciones pulmonares y la duración de la estancia hospitalaria en pacientes sometidos a resección pulmonar por toracotomía. El grupo intervención recibe fisioterapia respiratoria diaria hasta el alta, y el grupo control los cuidados habituales. Al grupo intervención se le animaba a practicar los ejercicios fuera de las intervenciones del fisioterapeuta, aunque no de manera supervisada. Al alta hospitalaria, al grupo tratamiento se le administró una hoja con consejos y ejercicios que proporcionaban información específica sobre los ejercicios a realizar en casa. El grupo control no recibió intervención sobre fisioterapia postoperatoria.
La incidencia de complicaciones pulmonares postoperatorias en el estudio de Rodriguez-Larrad (273) fue de un 6,6 % en el grupo experimental y de 20,6 % en el grupo control (p=0,003), aunque en el estudio de Reeve et al (270) no hubo diferencias entre grupos (grupo intervención 4,8 % vs. Grupo control 2,9 %; DM de 1,8 % (IC95 % de -10,6 a 13,1 %)).
Calidad
muy baja
para todos
los
desenlaces
En cuanto a la duración de la estancia hospitalaria, ésta fue similar entre grupos en ambos estudios. En el de Rodriguez-Larrad et al (273) la duración fue de 12 días (RIC de 6) para el grupo con rehabilitación respiratoria y de 14 días (RIC de 7) para el grupo control, mientras que en el de Reeve et al (270), no se encontraron diferencias en la duración de la estancia hospitalaria (mediana de 6 días en ambos grupos; p=0,87).
En el estudio de Rodriguez-Larrad et al (273), el modelo de regresión logística identificó la fisioterapia y el porcentaje de volumen espiratorio forzado el primer segundo (VEF1) como factores protectores frente al desarrollo de complicaciones pulmonares postoperatorias en pacientes intervenidos de lobectomía. Por otro lado, en el estudio de Reeve et al, los autores encontraron que una VEF1 % preoperatoria de 1,5l o menor (p=0,005) y la presencia de EPOC (p=0,008) se asociaban a la presencia de complicaciones pulmonares.
Resumen de la evidencia
| Calidad muy baja | La implementación de un programa de rehabilitación respiratoria disminuye la incidencia de complicaciones pulmonares postoperatorias en un estudio (273) (6,6 % frente 20,6 %; p=0,003), aunque en otro (281) no hubo diferencias entre grupos (Intervención 4,8 % vs. Control 2,9 %; DM de 1,8 % (IC95 % de -10,6 a 13,1 %)). La duración de la estancia hospitalaria fue similar (270;273).
Rodriguez-Larrad et al (273) identificaron como factores protectores a la fisioterapia y el porcentaje de VEF1, y Reeve et al (270) encontraron que una VEF1 % preoperatoria de 1,5l o menor (p=0,005) y la presencia de EPOC (p=0,008) se asociaban a la presencia de complicaciones pulmonares. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es muy baja.
- Balance entre beneficios y riesgos: probablemente el balance entre efectos deseados y no deseados favorece la opción.
- Utilización de recursos: en cuanto a los recursos requeridos, el estudio de Varela et al, se calcula un ahorro de 41.084,69 euros para el hospital desde que se implementó el programa de rehabilitación respiratoria (a pesar de inversión para incluir fisioterapeutas etc, se reduce el tiempo hospitalario, por lo que el balance es positivo al final).
- Equidad: en cuanto al impacto en las desigualdades en salud, puede haber diferencias si no existe acceso a la fisioterapia respiratoria en todos los centros.
- Aceptabilidad: la opción probablemente sea factible.
- Factibilidad: la factibilidad sería variable, dependiendo de los recursos de los centros y de la organización de los cuidados.
En resumen, la evidencia disponible señala que la fisioterapia respiratoria puede reducir la incidencia de complicaciones postoperatorias y mejorar la función pulmonar.
Los clínicos deberían tener en cuenta que una fisioterapia regular y organizada es el mecanismo más eficaz para la recuperación del paciente y evitar complicaciones respiratorias.
Por lo tanto, las recomendaciones que se han formulado han sido las siguientes:
Recomendaciones
| Débil | Se sugiere un programa de fisioterapia respiratoria (respiración diafragmática, expansión torácica, tos protegida eficaz, ciclo activo) y movilización precoz para prevenir la aparición de complicaciones pulmonares posteriores en los pacientes con TTCNG. |
| √ | En todos los casos, asegurar un manejo eficiente del dolor para poder implementar la rehabilitación respiratoria en los pacientes con TTCNG. |
7.5.2. Tiempo de inicio de la rehabilitación respiratoria
- ¿Cuánto tiempo se debe esperar para iniciar la rehabilitación respiratoria en el paciente con TTCNG?
No se han identificado estudios que respondan de forma directa a la pregunta.
Como evidencia indirecta, se ha realizado una búsqueda de estudios individuales para determinar cuál es la incidencia de complicaciones diferidas en pacientes con TTCNG y cuándo ocurren en el tiempo. Como resultado se han identificado nueve estudios de interés:
- Cuatro estudios sobre neumotórax diferido (35;256;281;282).
- Cinco estudios sobre hemotórax diferido (35;255;256;282;283).
- Dos estudios sobre neumonía (104;105).
- Tres estudios sobre discapacidad funcional (dolor) a los 30-90 días tras el traumatismo (255;284;285), que se tendrán en cuenta en la pregunta relacionada con el seguimiento del paciente.
Cuatro estudios proporcionan datos sobre la incidencia del neumotórax diferido (35;256;281;282), que oscila entre el 0 % y el 5,42 %.
Calidad
moderada
En cuanto a la necesidad de drenaje de los neumotórax diferidos, en el estudio de Lu et al (281), fueron drenados nueve de los 16 neumotórax diferidos (56,3 %). Plourde et al no evaluaron la importancia clínica (fueron diagnosticados mediante radiografía de seguimiento y no por clínica), y en Misthos et al (282), el 57 % de los neumotórax diferidos fueron observados. En el estudio de Dubinsky et al (35) no hubo ningún caso.
Calidad
baja
En cuanto al tiempo de aparición de neumotórax diferido, este se da mayoritariamente en los dos primeros días tras el traumatismo (2,25 días de media (mediana de 2 días; DE de 1,62; Rango de 1 a 7) (281), dos casos en los dos primeros días y otros dos entre el segundo y septimo día (256) y en el primer día tras la consulta (media de 23,4h (de 8 a 48 h) en el 78,5 % de los casos (282)).
Calidad
moderada
Son cinco los estudios que presentan datos sobre la incidencia de hemotórax diferido (35;255;256;282;283), que oscila entre el 0 % y 23 % (éste último en caso de fractura costal, aunque solo el 1 % es intervenido). En Misthos et al (282) la incidencia de hemotórax diferido fue del 7,4 % (n=52) (colección de sangre en el espacio pleural clínica o radiológicamente evidente uno o más días después de una radiografía normal en el ingreso). En Plourde et al (256), la incidencia fue del 11,8 % (n=53) y en Emond et al (285) del 12,2 % (n=59). En Racine et al (255), la incidencia variaba en función de la presencia de fractura esternal, costal o si no había ningún tipo de fractura, siendo ésta del 12,5 %, 23 % o del 6 %, respectivamente.
Calidad
moderada
En relación a la necesidad de drenaje del hemotórax diferido, en Misthos et al (282) el 84,6 % fue tratado mediante drenaje pleural. En Plourde et al (256) y en Emond et al (285) no se señala el manejo posterior de los pacientes. En Racine et al (255), sólo a tres de los pacientes con fractura costal (1 %) se les colocó un drenaje pleural.
Calidad
muy baja
En cuanto al tiempo de aparición, éste puede presentarse aproximadamente en los siete días posteriores al traumatismo. En Misthos et al (282), todos los hemotorax aparecen antes de los 14 días (media de 7,32 días; de 2 a 1). En Racine et al (255), todos se dieron antes de los siete días. En el estudio de Plourde et al (256), más de la mitad de los hemotórax (n=28; 52,8 %) aparecieron en los dos primeros días, el 34 % (n=18) entre el segundo y séptimo día y los siete restantes (13,2 %) entre el séptimo y decimocuarto día.
Calidad
moderada
Por último, Emond et al (285) señala que en el 87 % tuvieron lugar antes de los 7 días, y el 12,2 % en 14 días.
De los estudios que describen la incidencia de neumonía en pacientes que han sido dados de alta tras un traumatismo torácico menor, se han identificado dos estudios (104;105). Ho et al (104) (cohorte poblacional retrospectiva), encuentran que la incidencia de la neumonía a los 30 días en pacientes con fracturas costales aisladas menores es muy baja (1,55 %; n=11/709), y que tanto la edad avanzada (mayor o igual a 65 años; HRa de 5,60 (1,97 a 15,89)), como la presencia de EPOC (HRa de 5,41 (1,02 a 3,59)) o de una o dos fracturas costales (HRa de 3,97 (1,09-15,89) o 17,13 (6,66 a 44,04)), respectivamente) aumentan dicho riesgo.
Calidad
baja
En un estudio prospectivo y multicéntrico (105) realizado en cuatro servicios de urgencias de Canadá, se observó que la incidencia de neumonía a las dos semanas en pacientes con un traumatismo torácico menor era muy baja (0,6 % (IC 95 % de 0,24 a 1,17 %). Tras el análisis multivariante, el RR para pacientes con enfermedad pulmonar preexistente y fractura costal diagnosticada por radiografía era de 8,6 (IC95 % de 1,05 a 70,9).
Calidad
baja
Resumen de la evidencia
| No hay estudios | No hay estudios que evalúen la eficacia y seguridad del inicio temprano o tardío de la rehabilitación respiratoria en pacientes que han sufrido un TTCNG. |
| Calidad moderada | La incidencia de neumotórax diferido en pacientes con traumatismo torácico cerrado se sitúa entre el 0 % y el 5,4 % (4 estudios) (35;256;281;282), presentándose en la mayoría de los casos en los primeros dos días postrauma (256;281;282). |
| Calidad baja | Dos de los cuatro estudios notifican la necesidad de drenaje del neumotórax diferido, que aproximadamente es de 57 % (281;282). |
| Calidad moderada | La incidencia de hemotórax diferido oscila entre el 0 % y el 23 % (5 estudios) (35;255;256;282;283), y suele presentarse con más frecuencia en los siete días posteriores al traumatismo. |
| Calidad muy baja | Solo dos de los cinco estudios comunican la necesidad de drenaje del hemotórax diferido, que oscila entre el 84,6 % (282) y el 1 % (256). |
| Calidad baja | La incidencia de neumonía en pacientes dados de alta tras un traumatismo torácico menor es muy baja, de 0,6 % a las dos semanas (105) y de 1,55 % a los 30 días (104). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: no hay estudios que comparen los resultados de iniciar la rehabilitación respiratoria de forma temprana o de forma tardía. Sí hay estudios que describen cuál es la incidencia de complicaciones diferidas y el tiempo en el que éstas pueden aparecer, siendo la calidad entre moderada y baja en general.
- Balance entre beneficios y riesgos: el balance entre los beneficios y los riesgos de iniciar o no de forma temprana la rehabilitación respiratoria es incierto.
- Utilización de recursos: si iniciar de forma inmediata la rehabilitación respiratoria aumenta los riesgos, los costes aumentarían por generar complicaciones adicionales al paciente.
- Equidad: en cuanto al impacto en las desigualdades en salud, la equidad no se vería afectada.
- Aceptabilidad: la opción de iniciar de forma temprana la rehabilitación respiratoria probablemente no sea aceptada.
- Factibilidad: la opción de retrasar el inicio de la rehabilitación sería factible.
En resumen, no existen estudios que comparen los efectos del inicio temprano frente al inicio 48 horas después del traumatismo, pero se han encontrado estudios que definen el número de casos y el tiempo de aparición de neumotórax y hemotórax diferidos, por lo que el grupo establece un tiempo prudencial de espera de 48 horas antes de iniciar la rehabilitación respiratoria.
Por lo tanto, la recomendación que se ha formulado ha sido la siguiente:
Recomendaciones
| √ | Comenzar la rehabilitación respiratoria a partir de las primeras 48 horas tras el TTCNG, teniendo en cuenta que el riesgo de hemotórax diferido puede extenderse hasta los siete días o incluso más. |
7.5.3. Adición de incentivador inspirométrico a la fisioterapia respiratoria
- ¿Se debe añadir el uso de incentivador inspirométrico a la fisioterapia respiratoria convencional para reducir en mayor medida las complicaciones pulmonares en pacientes con TTCNG?
Se han identificado tres ECA (264;265;268;275) que responden a esta pregunta. El estudio de Malik et al (275) pretende determinar si el uso adicional de un incentivador inspirómetro de tipo flujo a la fisioterapia respiratoria resulta en una menor tasa de complicaciones pulmonares, en comparación con sólo fisioterapia.
En los estudios de Gosselink et al (264) y Agostini et al (268), lo que realmente se compara es si utilizar un incentivador volumétrico para la realización de ejercicios de respiración profunda es más efectivo que realizarlos sin ningún tipo de dispositivo.
En cuanto al uso de incentivador de forma adicional a la fisioterapia respiratoria (que ya incluye la realización de ejercicios de respiración profunda) (275), no se encuentran diferencias en la incidencia de complicaciones respiratorias entre ambos grupos (incentivador adicional, 12,3 %, frente a fisioterapia respiratoria ,13 %), en la duración de la estancia hospitalaria (mediana de cuatro días en ambos grupos), ni en las tasas de readmisión hospitalaria (10,3 % vs, 9,9 %, respectivamente).
Calidad
baja para
todos los
desenlaces
En cuanto a la realización de ejercicios de respiración profunda mediante el uso de incentivador volumétrico o sin él, no se han encontrado diferencias en cuanto a la aparición de complicaciones respiratorias postoperatorias en el estudio de Agostini et al (DM de 2,5 %; RIC de -7,9 a 12,9 %) ni en el de Gosselink (11,43 % vs 12,5 %, respectivamente). Cabe destacar que en el análisis de Agostini se descartaron cuatro pacientes del grupo intervención y uno del grupo control porque presentaron complicaciones pulmonares en el primer día postoperatorio. Tampoco se han encontrado diferencias en la duración de la estancia hospitalaria (en Gosselink, 15 días (±7) vs. 14 (±8); en Agostini, en pacientes de alto riesgo, 5 días (1) vs. 6 días (3)), ni en la recuperación del VEF1 % postcirugía (en Gosselink et al, la diferencia no es significativa; en Agostini et al, 72 % vs.71 %; DM 1 % (IC95 % de -5,4 % a 7,5 %)).
Calidad
baja
Resumen de la evidencia
| Calidad baja | No se encuentran diferencias en la incidencia de complicaciones respiratorias (13 % vs. 12,3 %), duración de la estancia hospitalaria (mediana de cuatro días en ambos grupos) o en las tasas de readmisión hospitalaria (10,3 % vs, 9,9 %, respectivamente) entre la fisioterapia respiratoria y el uso adicional del incentivador a la fisioterapia (275). |
| Calidad muy baja | No se han encontrado diferencias significativas entre la realización de ejercicios de respiración profunda con o sin incentivador volumétrico en la aparición de complicaciones respiratorias postoperatorias, la duración de la estancia hospitalaria o la recuperación del VEF 1 % postcirugía. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la calidad de la evidencia es baja para la fisioterapia sólo frente a la fisioterapia junto con el uso de incentivador y muy baja para la realización de ejercicios respiratorios con o sin incentivador.
- Balance entre beneficios y riesgos: el balance entre beneficios y riesgos probablemente no favorece la opción (adición de incentivador a la fisioterapia respiratoria).
- Utilización de recursos: en cuanto a los recursos requeridos, habría que tener en cuenta el coste de los incentivadores. Si resulta que no éstos no aportan nada a la fisioterapia respiratoria convencional, sería un gasto inútil.
- Equidad: en cuanto al impacto en las desigualdades en salud, se cree que la opción no afectaría a la equidad.
- Aceptabilidad: la aceptabilidad de la opción sería incierta.
- Factibilidad: en cuanto a la factibilidad, la adición de un incentivador a la fisioterapia convencional sería factible.
El incentivador inspirométrico se utiliza para favorecer la expansión pulmonar tras la cirugía. Sin embargo, su uso aislado no reemplaza ni mejora de forma significativa los resultados obtenidos por los fisioterapeutas, aunque es una medida relativamente buena de la función pulmonar y puede ser utilizada para valorar la recuperación respiratoria tras la cirugía torácica.
Los clínicos deberían tener en cuenta que una fisioterapia regular y organizada es el mecanismo más eficaz para la recuperación del paciente y evitar complicaciones respiratorias.
Por lo tanto, la recomendación que se ha formulado ha sido la siguiente:
Recomendaciones
| √ | Aunque los estudios señalan que puede no haber diferencias en realizar respiraciones profundas con o sin incentivador volumétrico, su uso permite valorar el grado de recuperación de la función pulmonar y proporciona información sobre la evolución y adherencia del paciente al tratamiento, por lo que se puede considerar su uso en tanto en cuanto pueda ayudar al paciente a realizar ejercicios de expansión torácica. |
7.5.4. Incentivador inspirométrico frente a fisioterapia respiratoria convencional
- ¿Se puede sustituir la fisioterapia respiratoria convencional por el uso de incentivador inspirométrico en pacientes con TTCNG?
Hay dos estudios que comparan la eficacia de utilizar el incentivador sin otras medidas rehabilitadoras frente a fisioterapia convencional: un ECA (274) y un estudio transversal con controles históricos (no aleatorizado) (267).
El ECA (274) compara los efectos del uso de un incentivador (no define cuál) frente a la fisioterapia con un fisioterapeuta respiratorio o con experiencia en pacientes con efusión pleural a los que se realiza toracoscopia, y el estudio de Varela (267) valora el coste de la fisioterapia torácica en pacientes lobectomizados.
En cuanto a la mortalidad a los 30 días, esta fue menor en el grupo con fisioterapia, aunque la diferencia no fue estadísticamente significativa (0,8 % en grupo con fisioterapia vs. 3,5 % en grupo control; OR 0,23 (IC95 % de 0,03 a 1,79) (267).
Calidad
muy baja
para todos
los
desenlaces
Tanto las atelectasias como las neumonías son más frecuentes en el grupo con solo incentivador inspirométrico que en el grupo con fisioterapia respiratoria (atelectasia: 1,7 % vs. 7,7 %; OR de 0,20 (IC95 % de 0,05 a 0,86); neumonía 5 % vs. 9,2 %; OR 0,52 (IC95 % de 0,22 a 1,25)), aunque en el caso de la neumonía la diferencia no fue estadísticamente significativa (267).
Además, la duración de la estancia hospitalaria en el grupo que recibe fisioterapia respiratoria es menor que en el grupo tratado sólo con incentivador inspirométrico (2 estudios; 5,7 días; rango de 3 a 22 vs 8,33; rango de 3 a 40 en Varela et al (267); 8,63 días (3,86) vs. 10,12 días (3,34) en Gunay et al (274)).
En cuanto a la recuperación de VEF1 %, en el ECA de Gunay et al (274) se encuentra que ésta es mejor en el grupo intervención que en el grupo con solo incentivador (-0,35 (02) vs -0,2 (0,17), respectivamente).
Resumen de la evidencia
| Calidad muy baja | La fisioterapia respiratoria reduce la duración de la estancia hospitalaria, favorece la recuperación del VEF1 % y la mortalidad a los 30 días (aunque esta última no de forma significativa (267) en comparación al uso único de un incentivador inspirométrico. Por otro lado, las atelectasias y neumonías son más frecuentes cuando solo se usa el incentivador inspirométrico, aunque no de forma significativa en las neumonías (267). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es muy baja (fisioterapia convencional vs. incentivador inspirométrico).
- Balance entre beneficios y riesgos: el balance probablemente no favorece la opción.
- Utilización de recursos: aunque los incentivadores fueran igualmente eficaces, su uso podría no ser más barato que la fisioterapia respiratoria con un fisioterapeuta con experiencia, dependerá de cómo o quién enseñe a utilizar el incentivador al paciente. De hecho, en el ECA de Gunay et al, se observa que no hay diferencias en los costes del grupo con fisioterapia frente al grupo con incentivador inspirométrico (437,87 Euros (83,45) vs 464,43 (86,43) (p=0,414)).
- Equidad: en cuanto al impacto en las desigualdades en salud, si fuesen igualmente eficaces, el uso de incentivadores sería más accesible que el acceso a fisioterapeutas respiratorios.
- Aceptabilidad: la opción probablemente no sea aceptada.
- Factibilidad: en cuanto a la factibilidad, la opción sería factible.
Los clínicos deberían tener en cuenta que una fisioterapia regular y organizada es el mecanismo más eficaz para la recuperación del paciente y evitar complicaciones respiratorias.
Por lo tanto, la recomendación que se ha formulado ha sido la siguiente:
Recomendaciones
| Débil | Se sugiere no sustituir la fisioterapia respiratoria convencional por el uso de un incentivador inspirométrico en los pacientes con TTCNG. |
7.5.5. Incentivador inspirométrico de tipo volumétrico o de flujo
- Si se va a utilizar un incentivador inspirométrico, ¿se debe utilizar un incentivador de tipo volumétrico o uno de flujo?
No se han identificado estudios que comparen los resultados clínicos en pacientes que han sufrido un TTCNG al utilizar un incentivador de tipo volumétrico frente a un incentivador de tipo flujo.
Solo se han identificado cinco estudios en voluntarios sanos que comparan el efecto de ambos tipos de incentivadores sobre la expansión torácica, el patrón respiratorio, la sincronía toraco-abdominal, la actividad de los músculos respiratorios y la función pulmonar, por lo que no hay datos sobre su efecto en la disminución de complicaciones posteriores al traumatismo. Por ello, la calidad de la evidencia va a ser de muy baja calidad para la pregunta planteada, porque se trata de evidencia indirecta tanto por el tipo de población (población sana frente a pacientes con TTCNG), como por el tipo de resultados que se presentan (calidad muy baja para todos los desenlaces).
De los cinco estudios identificados en voluntarios sanos, tres incluyen personas menores de 45 años (276-278) y los otros dos personas ancianas sanas (279;280).
El estudio de Paisani et al (276) encuentra que el incentivador de tipo volumétrico (TV) aumenta el volumen de la pared torácica en mayor medida que el de tipo flujo (TF) (TV 2,48 L (DE 1,22) vs. TF 2,08 L (DE 0,99); p<0,05), produciendo un mayor aumento en los diferentes compartimentos. Por otro lado, el de tipo flujo provoca una mayor actividad muscular (p<0,001) (músculo esternocleidomastoideo: TV 18,1 (DE 21,5) vs. TF 22,8 (DE 20,4) 10-3 mV) y mayor tiempo inspiratorio (TV 3,81 s (DE 3,30) vs. TF 2,17 s (DE 1,06); p<0,05) que el de tipo volumétrico.
Calidad
muy baja
para todos
los
desenlaces
El estudio de Yamaguti WP et al (277) encuentra que la movilidad diafragmática es significativamente mayor con el uso del incentivador volumétrico que con el de tipo flujo (70,16 ±12,83 mm vs. 63,66 ±10,82 mm; p=0,02), y que incluso la respiración diafragmática llevó a una mayor movilidad que el incentivador de tipo flujo (69,62 ± 11,83 mm vs. 63,66 ± 10,82 mm; p=0,02).
En el estudio de Tomich et al (278), que compara el patrón respiratorio, la sincronía toracoabdominal y la actividad muscular producidos por la respiración diafragmática, el incentivador de tipo flujo (Triflo II) o uno de tipo volumétrico (Voldyne), se observó un aumento significativo del Volumen tidal (de 307,75 ml basales a 1.475,01 ml con la respiración profunda y a 1.263,35 vs. 1738,75 ml con los incentivadores de tipo flujo y volumétrico), y del ángulo de fase (PhAng) en todos los casos (de 11,42º basales a 30,32º con la respiración profunda, 34,81º con el de tipo flujo y 30,94º con el volumétrico), entre otros. Los autores observaron una mayor frecuencia respiratoria y actividad esternocleidomastoidal al utilizar el incentivador de tipo flujo (Triflo II) (p<0,05) con respecto a la respiración diafragmática y el de tipo volumétrico (Voldyne).
En cuanto a los estudios realizados en pacientes ancianos, Lunardi et al (279) valora el efecto de los incentivadores volumétricos o de tipo flujo en ancianos sanos, en comparación con la de adultos jóvenes sanos. Se observó que, en los ancianos los dos incentivadores aumentaron el volumen de la pared torácica de forma similar, mientras que en adultos sanos el volumétrico conseguía mayores volúmenes que el de tipo flujo. La sincronía toracoabdominal era similar en ancianos con ambos incentivadores, mientras que en los adultos sanos el de tipo flujo indujo una menor sincronía que el volumétrico. En ambos grupos, el de tipo flujo requería mayor actividad muscular.
El último estudio (280) es el único ECA que compara el uso prolongado del incentivador de tipo flujo frente al de tipo volumétrico (tras 12 días de uso continuado) en ancianos sanos (48 ancianos entre 60 y 84 años). Los autores observan que ambos incentivadores fueron efectivos en mejorar la función pulmonar, la fuerza muscular y la movilidad toracoabominal.
Resumen de la evidencia
| No hay estudios | No hay estudios que comparen el efecto de los incentivadores de tipo flujo o volumétrico sobre el desarrollo de complicaciones posteriores en pacientes con TTCNG. |
| Calidad muy baja | En adultos sanos menores de 45 años, el incentivador de tipo volumétrico aumenta el volumen de la pared torácica en mayor medida que el de tipo flujo (276;278). El incentivador de tipo flujo produce una mayor actividad muscular (276;278), frecuencia respiratoria (278) que la respiración diafragmática y el incentivador de tipo volumétrico. La respiración diafragmática lleva a una mayor movilidad diafragmática que el incentivador de tipo flujo (277). |
| Calidad muy baja | En pacientes ancianos, ambos incentivadores son efectivos en mejorar la función pulmonar, la fuerza muscular y la movilidad toracoabominal (279;280), aunque el de tipo flujo requiere mayor actividad muscular. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es muy baja.
- Balance entre beneficios y riesgos: el balance probablemente favorece la opción.
- Utilización de recursos: en cuanto a los recursos requeridos, el precio de los incentivadores es similar.
- Equidad: en cuanto al impacto en las desigualdades en salud, la opción no afectaría a la equidad.
- Aceptabilidad: la aceptabilidad de la opción sería variable.
- Factibilidad: en cuanto a la factibilidad, la opción es factible.
En resumen, aunque no se han encontrado estudios en pacientes con traumatismo torácico, los estudios en voluntarios sanos señalan que con el incentivador de tipo volumétrico los resultados que se obtienen son mejores. Esto, junto con la experiencia clínica de la médica rehabilitadora del grupo de trabajo, ha llevado a sugerir que en caso de utilizar un incentivador inspirométrico, se utilice mejor el volumétrico que el de tipo flujo.
Por lo tanto, la recomendación que se ha formulado ha sido la siguiente:
Recomendaciones
| Débil | Se sugiere priorizar la utilización de un incentivador volumétrico en vez de uno de tipo flujo. |
7.5.6. Duración de la rehabilitación respiratoria
- ¿Cuánto tiempo debe durar la rehabilitación respiratoria en pacientes con TTCNG?
No hay estudios que comparen la eficacia y seguridad en función de la duración de los programas de rehabilitación respiratoria. Lo único que se ha encontrado es la descripción de la duración de los programas utilizados en los estudios identificados para responder a las preguntas anteriores. Así, en los estudios identificados, la duración de la intervención se ha descrito como sigue:
- Duración de la intervención hasta el alta hospitalaria del paciente:
- Seis días de mediana (RIC de 4) (270), aunque los autores señalan que al paciente se le da una hoja de ejercicios para que la realice en casa.
- Mediana de 12 días (RIC de 6) (intervención) frente a 14 días (RIC de 7) (cuidados habituales) (273).
- En grupo de “alto riesgo de desarrollar complicaciones pulmonares: mediana de cinco días (RIC de 1) y de seis (RIC de 3) en grupo control; en grupo de bajo riesgo: mediana de cinco días (RIC de 3) y seis (RIC de 4) (268).
- Grupo de fisioterapia 15 días (DE 7) y grupo con incentivador 14 días (DE 8). Se deduce que la duración de la fisioterapia es hasta el alta hospitalaria, pero no lo señalan claramente (264).
- Duración hasta 30 días postcirugía (275), aunque no se supervisa la cumplimentación del tratamiento.
- Duración de la intervención hasta el 3er día posticugía (274).
Resumen de la evidencia
| No hay estudios | No hay estudios que comparen la eficacia de los programas de rehabilitación respiratoria en función de la duración de los mismos. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: no hay estudios que evalúen el tiempo que debe durar un programa de rehabilitación respiratoria.
- Balance entre beneficios y riesgos: el balance es incierto.
- Utilización de recursos: en cuanto a los recursos requeridos, la cantidad de recursos variará en función de si trata de una intervención con seguimiento o no.
- Equidad: en cuanto al impacto en las desigualdades en salud, dependerá de la duración que se estime, del tipo de rehabilitación que se recomiende y del seguimiento que se realice… todo influirá en el acceso equitativo por parte de todos los pacientes.
- Aceptabilidad: la aceptabilidad de la opción será variable.
- Factibilidad: en cuanto a la factibilidad, existe incertidumbre.
Aunque no hay estudios que comparen los resultados en función al tiempo de duración de la misma, tras la revisión bibliográfica realizada el grupo considera que se puede extrapolar la duración de la rehabilitación hasta el período máximo de aparición de complicaciones retardadas. Este período sería desde 14 dás en el hemotórax retardado hasta los 30 días en la neumonía.
Por lo tanto, la recomendación de buena práctica que se ha formulado ha sido la siguiente:
Recomendaciones
| √ | En pacientes que han sufrido un TTCNG, los ejercicios respiratorios y el seguimiento clínico deberían mantenerse hasta los 30 días postraumatismo. |
7.6. Mucolíticos y broncodilatadores
7.6.1. Mucolíticos
- ¿Se debe tratar con mucolíticos al paciente ingresado con TTCNG?
Los pacientes con traumatismo torácico pueden presentar alteraciones de la fisiología y de la mecánica respiratoria por múltiples factores (lesión pulmonar secundaria al traumatismo, restricción secundaria a lesiones óseas, dolor o tratamiento analgésico, inmovilización…) que pudieran disminuir la movilización de secreciones respiratorias y provocar complicaciones. En este contexto, en algunas ocasiones se prescriben en estos pacientes tratamientos mucolíticos con el fin de evitar potenciales complicaciones relacionadas con el acumulo de secreciones. No obstante, la ausencia o escasa eficacia de estas intervenciones en otros escenarios clínicos y la escasa evidencia científica en pacientes con traumatismo torácico suscitan dudas sobre el beneficio de esta práctica.
Evidencia científica
No se han identificado en la búsqueda RS sobre de la eficacia de los mucolíticos en pacientes ingresados con traumatismo torácico.
Sí se identificó una RS (288) y un metanálisis (289) sobre la eficacia de los mucolíticos comparada con placebo o grupo control en pacientes con síndrome de distrés respiratorio agudo (SDRA) y lesión pulmonar aguda que incluían en sus estudios a pacientes politraumatizados. Sin embargo, el grupo consideró que esta evidencia no era extrapolable a los pacientes de la guía al ser complicaciones de enfermedad crítica y a valorarse como mucolíticos la N-acetilcisteína (NAC) en la revisión y el ambroxol en el metanálisis, por lo que no se tuvieron finalmente en cuenta para responder a la pregunta.
En la búsqueda de estudios individuales, no se identificó ningún estudio que pudiera responder a la pregunta. Así, no se ha encontrado evidencia sobre la eficacia del tratamiento con mucolíticos en pacientes ingresados con traumatismo torácico.
No hay
estudios
Resultados de la actualización de la búsqueda
No se han identificado estudios relevantes en la actualización realizada en junio de 2019.
Resumen de la evidencia
| No hay estudios | No hay estudios sobre la eficacia y seguridad de los mucolíticos en el tratamiento del paciente que ha sufrido un traumatismo torácico no grave y que es ingresado en el hospital. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: no se han identificado estudios al respecto.
- Balance entre beneficios y riesgos: hay incertidumbre en el balance entre los efectos deseados y no deseados.
- Utilización de recursos: hay incertidumbre sobre el coste de los recursos requeridos y en cuanto a si el coste incremental es pequeño en relación a los beneficios netos.
- Equidad: existe incertidumbre sobre el impacto de la opción en las desigualdades en salud.
- Aceptabilidad: existe incertidumbre sobre la aceptabilidad de la opción.
- Factibilidad:la opción probablemente sea factible.
Por lo tanto, aunque no haya evidencia, el grupo ha formulado la siguiente recomendación de tipo consenso:
Recomendaciones
| √ | No hay evidencia que avale el uso de mucolíticos en los pacientes con TTCNG, por lo que el grupo considera que no está justificado su uso. |
7.6.2. Broncodilatadores
- ¿Se debe tratar con broncodilatadores inhalados al paciente ingresado con TTCNG?
La alteración de la mecánica respiratoria en pacientes con traumatismo torácico, especialmente en aquellos con enfermedades pulmonares obstructivas preexistentes puede generar preocupación sobre la posible aparición de broncoespasmo u otras complicaciones respiratorias en estos pacientes. Esto puede desencadenar con frecuencia la prescripción “profiláctica” o rutinaria de fármacos broncodilatadores inhalados en este contexto. No obstante, la escasa evidencia científica disponible sobre el uso de estos fármacos en este escenario clínico suscita dudas sobre los beneficios de esta práctica.
Evidencia científica
No se han identificado en la búsqueda RS sobre de la eficacia de los broncodilatadores inhalados en pacientes ingresados con traumatismo torácico. Sí que se identificó una revisión narrativa (RN) (290) sobre terapias inhalatorias (aerosoles o gases) en la prevención y el tratamiento del SDRA dentro de las cuales están los broncodilatadores. En esta revisión se describen tres ECA (291-293) que incluyen pacientes con traumatismo: dos analizan la eficacia de los beta-2 agonistas selectivos para el SDRA, informando que no proporcionaban beneficios clínicos y empeoran los resultados cuando se administran por vía intravenosa.
Sin embargo, el grupo considera que esta evidencia no es extrapolable a los pacientes de la guía al ser el SDRA una complicación de enfermedad crítica. Por lo tanto, finalmente no se tienen en cuenta sus resultados.
En la búsqueda de estudios individuales, se identificaron dos reportes de casos (294;295) sobre el tratamiento con oxido nítrico (ON) inhalado en pacientes con traumatismo severo.
Como conclusión, no hay estudios que respondan a la pregunta. Así, no hay evidencia sobre la eficacia de los broncodilatadores en el tratamiento de pacientes ingresados con traumatismo torácico no grave.
No hay
estudios
Resultados de la actualización de la búsqueda
No se han identificado estudios relevantes en la actualización realizada en junio de 2019.
Resumen de la evidencia
| No hay estudios | No hay estudios sobre la eficacia y seguridad de los broncodilatadores en el tratamiento del paciente que ha sufrido un TTCNG y que es ingresado en el hospital. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: no se han identificado estudios al respecto.
- Balance entre beneficios y riesgos: hay incertidumbre en el balance entre los efectos deseados y no deseados.
- Utilización de recursos: probablemente los recursos requeridos son pequeños, aunque existe incertidumbre sobre si el coste incremental es pequeño en relación a los beneficios netos.
- Equidad: existe incertidumbre sobre el impacto de la opción en las desigualdades en salud.
- Aceptabilidad: se cree que existe variabilidad sobre la aceptabilidad de la opción.
- Factibilidad: la opción probablemente sea factible.
Por todo ello, y en base a la experiencia clínica, se han formulado las siguientes recomendaciones:
Recomendaciones
| √ | No prescribir de forma rutinaria fármacos broncodilatadores inhalados en pacientes con TTCNG. |
| √ | En pacientes con TTCNG y con enfermedad pulmonar preexistente en tratamiento previo con broncodilatadores inhalados mantener su tratamiento habitual.
Valorar su uso, por vía inhalatoria, según indicación habitual en pacientes con síntomas o signos clínicos de broncoespasmo. |
7.7. Profilaxis tromboembólica
- En pacientes con TTCNG ingresados, ¿se debe realizar profilaxis tromboembólica?
Los pacientes con traumatismo torácico son un grupo de pacientes en riesgo de desarrollar trombosis venosa profunda que potencialmente puede dar lugar a eventos tromboembólicos que son una importante causa de mortalidad.
Debido fundamentalmente al traumatismo y a la inmovilización que lo acompaña estos pacientes presentan un mayor riesgo de desarrollar enfermedad tromboembólica venosa (ETV) que puede constituir un riesgo de morbimortalidad nada desdeñable.
El riesgo aumentado viene determinado por las características de los pacientes que han sufrido un traumatismo (escasa movilización y alteraciones en la coagulación) y que puede predisponer a la formación de trombos venosos.
Existe discrepancia en la literatura médica acerca de la necesidad de instaurar profilaxis sistemática de la ETV en los pacientes que sufren un traumatismo torácico y que son objeto de esta GPC. Tampoco existe consenso en cuanto al tipo de profilaxis (mecánico o farmacológico) a llevar a cabo en caso de ser finalmente indicada.
La mayoría de la evidencia científica publicada se basa en estudios realizados en pacientes politraumatizados y en menor cuantía afectados por traumatismo torácico.
Evidencia científica
En la búsqueda realizada se ha identificado una RS (296) en pacientes ingresados con traumatismo, que evalúa los efectos de la tromboprofilaxis sobre la mortalidad, el riesgo de trombosis venosa profunda (TVP) y de embolia pulmonar (EP). Los autores excluyeron los estudios con pacientes ambulatorios, con sólo fracturas de cadera, o lesiones espinales agudas. Las intervenciones valoradas fueron profilaxis farmacológica: Heparina sin fraccionar (HNF) y Heparina de bajo peso molecular (HBPM), y profilaxis mecánicas con dispositivos de compresión secuencial (DCS), dispositivos de comprensión intermitente (DCI), bombas de muslo-pantorrilla, bombas de pantorrilla-pie, electroestimulación muscula, dispositivo de impulso arteriovenoso (DIA) y medias de compresión elásticas, realizando comparaciones múltiples entre ellas.
En la actualización de la búsqueda de la RS seleccionada se han encontrado dos RS posteriores (297;298) que no han sido tenidas en cuenta por evaluar la eficacia y seguridad de los filtros de vena cava inferior (FVCI).
La RS identificada incluye un total de 16 ECA (299-314), con un total de 1898 pacientes con traumatismo cerrado y 225 con traumatismo penetrante. El promedio del ISS varía entre 13 y 30, aunque cinco de los estudios no comunicaron ese dato.
Diez de los 16 estudios no incluyen pacientes con traumatismo torácico, dos no aclaran la localización del traumatismo y sólo cuatro ECA (301;302;306;307) incluyen pacientes con traumatismo torácico (30 % (118/395) (301), 55,7 % (83/149) (302), 39 % (172/442) (306) y 35,4 % (40/113) (307), respectivamente).
Cuatro ensayos compararon un método de profilaxis (farmacológico o mecánico) vs. sin profilaxis (311;303;308;313). Dos ensayos compararon dos métodos farmacológicos entre sí (300;305). Tres ECA compararon dos métodos mecánicos (299;302;311). Seis estudios compararon métodos farmacológicos con mecánicos, tres compararon HBPM vs. CNI (Compresión neumática intermitente) (306;310;314), dos HNF vs. SCD (307;308) y otro HBPM vs. DCS o DIA (309). Tres ensayos compararon una combinación de intervenciones farmacológicas y mecánicas. El estudio de Knudson 1994 (310) se dividió en cuatro grupos:
Knudson 1994, todos los grupos, Knudson 1994 grupo I (HNF vs DCS vs Placebo), Knudson 1994 grupo II (HNF vs Placebo) y Knudson 1994 grupo III (DCS vs Placebo).
Según los autores la revisión refuerza las recomendaciones de las guías de práctica clínica de Eastern Association for the Surgery of Trauma (315) y American College of Chest Physicians (316;317), proporcionando evidencia adicional para tromboprofilaxis en pacientes con traumatismo severo.
De la actualización de estudios individuales, adaptando la estrategia de búsqueda de la revisión de Barrera et al de 2013 se identificaron 667 referencias, de las que fueron preseleccionadas tres (318-320), aunque finalmente no fueron incluidas.
A continuación, se describen los resultados encontrados para cada comparación.
Comparación 1: Profilaxis (farmacológica o mecánica) vs. Ninguna profilaxis
Cuatro ECA (311;303;308;313) con 997 pacientes compararon el efecto de cualquier tipo de profilaxis (mecánica y/o farmacológica) (n=573) vs. no profilaxis (n=424). Solo un ECA incluye pacientes con TT (301).
La profilaxis redujo el riesgo de TVP en pacientes con traumatismo (RR 0,52; IC 95 %: 0,32 a 0,84) y no hubo evidencia de heterogeneidad estadística entre los ensayos (I2=12 %; Chi2 p=0,96).
Calidad
muy baja
para todos
los
desenlaces
No hubo evidencia de un efecto sobre el riesgo de EP (RR 0,65; IC 95 %: 0,29 a 1,43) o mortalidad (RR 0,59; IC 95 %: 0,20 a 1,70).
Tres ensayos (301;308;313) (n=553) informaron presencia de hemorragia como efecto adverso, sin ningún evento comunicado.
Comparación 2: Profilaxis mecánica vs. Ninguna profilaxis
Cinco estudios con 907 pacientes (301;303;308;313) (Knudson 1994 group I y III) compararon el efecto de la profilaxis mecánica (n=510) vs. sin profilaxis (n=397). La calidad de los estudios es muy baja en cuatro (301;308;313) y baja en uno (307). Solo un ECA incluye pacientes con TT (215).
La profilaxis mecánica redujo el riesgo de TVP (RR 0,55; IC95 % de 0,34 a 0,90). Con heterogeneidad estadística entre los ensayos de I2=59 %, Chi2 p=0,05. No hubo evidencia que la profilaxis mecánica redujera el EP (RR 0,77; IC 95 % de 0,36 a 1,66) o muerte (RR 0,74; IC 95 % de 0,27 a 2,04).
Calidad
muy baja
para todos
los
desenlaces
Cuatro estudios (215;308;313) (n=603 pacientes) informaron sobre el sangrado como efecto adverso, aunque no hubo eventos en ninguno de los estudios.
Comparación 3: Profilaxis farmacológica vs. Profilaxis mecánica
Seis estudios (306-310;314) (Knudson 1994 group I) con 1033 pacientes compararon la profilaxis farmacológica (n=519) vs. profilaxis mecánica (n=514). La calidad de los estudios es muy baja en cinco (307-310;314) y uno de baja calidad (306). Dos ECA incluyen pacientes con TT (306;307).
La profilaxis farmacológica fue más efectiva que la mecánica en reducir el riesgo de TVP (RR 0,48; IC 95 % de 0,25 a 0,95). No hubo evidencia de heterogeneidad entre los ensayos (I2 = 0 %, Chi2 p=0,56). No hubo evidencia de una diferencia de efecto en el riesgo de EP (RR 0,94; IC95 % de 0,36 a 2,42) o mortalidad (RR 1,50; IC95 % de 0,44 a 5,16).
Cinco ECA (306-311) (n=953) informaron datos de hemorragia. La profilaxis farmacológica (n=479) aumentó el riesgo de hemorragia (RR 2,04; IC95 % de 1,08 a 3,86) en comparación con los métodos mecánicos (n=474). No hubo evidencia de heterogeneidad (I2 = 0 %, Chi2 p=0,53).
Calidad
muy baja
para todos
los
desenlaces
Tres estudios (306;309;310) (n=764 pacientes, PF n=398; PM n=366) distinguieron entre sangrado mayor y menor. No hubo diferencia de efecto en el riesgo de hemorragia mayor (RR 1,03; IC95 % de 0,26 a 4,06). Sin embargo, la profilaxis farmacológica aumentó el riesgo de hemorragia menor (RR 2,37; IC95 % de 1,13 a 4,98). No hubo evidencia de heterogeneidad entre los ensayos (I2 = 0 %; Chi2 p=0,64).
Comparación 4: Comparación 4: Profilaxis farmacológica con HBPM vs. Profilaxis farmacológica con HNF
Dos ensayos (300;305) con 331 pacientes compararon HBPM (n=163) vs. HNF (n=168).
La HBPM pareció reducir el riesgo de TVP en comparación con la HU (RR 0,68; IC95 % de 0,50 a 0,94). No hubo heterogeneidad entre los ensayos (I2=0 %, Chi2 p=0,39). No hubo diferencias estadísticamente significativas en el riesgo de EP entre los dos grupos (RR 3,16; IC95 % de 0,13 a 76,91) y no se informaron muertes en ningún ECA.
Calidad
muy baja
para todos
los
desenlaces
No hubo diferencias estadísticamente significativas en el riesgo de hemorragia entre HBPM y HU (RR 1,63; IC95 % de 0,63 a 4,22), sangrado mayor (RR 1,46; IC95 % de 0,55 a 3,85) o menor (RR 3,16; IC95 % de 0,13 a 76,91).
Comparación 5: Profilaxis mecánica+profilaxis farmacológica vs. Profilaxis farmacológica
Tres ECA (304;312;314) con 507 pacientes compararon la profilaxis mecánica y profilaxis farmacológica (n=254) vs. sólo profilaxis farmacológica (n=253). La calidad de los estudios es muy baja. Ningún ECA incluye pacientes con TT.
Los pacientes que recibieron profilaxis mecánica y farmacológica tuvieron menor riesgo de TVP (RR 0,34; IC95 % de 0,19 a 0,60). Sin embargo, hubo heterogeneidad estadística entre los ensayos (I2 = 69 %, Chi2 p= 0,04). No hubo evidencia de una diferencia en el efecto sobre el riesgo de EP (RR 0,32; IC95 % de 0,05 a 2,01) o mortalidad (RR: 0,50; IC95 % de 0,05 a 5,30).
Calidad
muy baja
para todos
los
desenlaces
Un ensayo (314) (n=200) evaluó el efecto sobre el sangrado y no encontró diferencias en el riesgo de hemorragia entre los dos grupos (RR 0,99; IC 95 % de 0,56 a 1,78).
Comparación 6: Profilaxis mecánica+profilaxis farmacológica vs. Profilaxis mecánica
Un estudio de muy baja calidad, con 80 pacientes comparó la profilaxis mecánica y farmacológica (n=40) vs. profilaxis mecánica (n=40) (314) y no encontró diferencia entre los grupos comparados en riesgo de TVP, de EP y mortalidad (RR 0,50; IC95 % de 0,10 a 2,58) para las tres variables de resultados. No informan sobre la localización del traumatismo.
Calidad
muy baja
para todos
los
desenlaces
Comparación 7: Profilaxis mecánica (muslo pantorrilla) vs. Profilaxis mecánica (pantorrilla-pie)
Tres ECA (299;302;311) (n=373) compararon bomba de muslo pantorrilla (n=177) vs. Bomba de pantorrilla pie (n=196) y no encontraron diferencias estadísticas en riesgo de TVP (RR 0,69; IC95 % de 0,37 a 1,32) y de EP (RR 0,79; IC95 % de 0,12 a 5,10), Notificaron un único efecto adverso en uno de los ECA (hemorragia, RR 3,04; IC95 % de 0,13 a 63,44) y ninguna muerte en los tres estudios. Solo un ECA incluye pacientes con TT (302).
Calidad
muy baja
para todos
los
desenlaces
Resumen de la evidencia
| Calidad muy baja para todas las comparaciones | La tromboprofilaxis fue más eficaz que no realizar profilaxis en la prevención de eventos tromboembólicos (303;308;313).
La profilaxis farmacológica fue más eficaz que la profilaxis mecánica en la prevención de eventos tromboembólicos (306-310;314). La HBPM fue más eficaz en reducir el riesgo de eventos tromboembólicos que la HNF (300;305). Los pacientes que recibieron tromboprofilaxis farmacológica tienen un riesgo de sangrado mayor que los que recibieron terapia mecánica, aunque los resultados se basan en pocos estudios de muestra pequeña y baja calidad (306-310;314). |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es muy baja para todas las comparaciones presentadas.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados no favorece probablemente la opción (tromboprofilaxis rutinaria en pacientes con traumatismo torácico no grave ingresados en el hospital). Los estudios presentados no demuestran una clara diferencia en el riesgo de eventos tromboembólicos entre pacientes con o sin profilaxis tromboembólica.
- Utilización de recursos: los recursos probablemente no sean pequeños, aunque los estudios no comparan el coste de cada alternativa frente a la no utilización o el coste entre las diferentes alternativas.
- Equidad: las desigualdades en salud probablemente se reducirían.
- Aceptabilidad: existe incertidumbre sobre la aceptabilidad de la opción.
- Factibilidad: la opción probablemente sea factible.
En el paciente objeto de esta guía no hay evidencia que soporte el uso de tromboprofilaxis salvo que concurran factores de riesgo específicos que así lo aconsejen. Teniendo esto en cuenta y los otros resultados encontrados en la literatura, el grupo ha formulado las siguientes recomendaciones.
Recomendaciones
| Débil | Se sugiere no utilizar la tromboprofilaxis de forma generalizada en pacientes con TTCNG e ingresados, salvo que concurran factores de riesgo específicos (edad avanzada, inmovilización, multimorbilidad o lesiones asociadas, historia previa de enfermedad tromboembólica venosa…) que así lo aconsejen. |
| Débil | En caso de pacientes con TTCNG en los que la tromboprofilaxis estuviera indicada, se sugiere realizar la misma con heparina de bajo peso molecular (HBPM). |
| √ | En pacientes con TTCNG y con riesgo de compromiso vital por sangrado, considerar la utilización de medidas mecánicas aisladas. |
| √ | En cualquier paciente con TTCNG ingresado, extremar los cuidados de fisioterapia respiratoria y movilización precoz, siempre que no haya contraindicación por lesiones asociadas. |
7.8. Manejo del dolor
- ¿Cómo se debe realizar la valoración y el tratamiento del dolor del paciente con TTCNG?
Las fracturas costales se asocian frecuentemente a dolor moderado o severo. Existe evidencia de que el dolor es un factor de riesgo asociado a morbilidad tras un traumatismo torácico, así como de que el tratamiento analgésico adecuado en el momento agudo, favorece la movilización precoz y la fisioterapia respiratoria, disminuyendo la estancia hospitalaria, la incidencia de complicaciones respiratorias y la probabilidad de dolor crónico e incapacidad acompañante.
En pacientes adultos sin alteraciones cognitivas, el uso de escalas numéricas de 0 a 10 ha demostrado ser un método válido y fiable para cuantificar la intensidad del dolor, por lo que debe ser incluido de manera rutinaria en la anamnesis del paciente objeto de esta GPC.
Sin embargo, el tratamiento del dolor puede resultar complejo debido la gran variabilidad interindividual que existe en la percepción y la tolerabilidad al dolor, así como en la respuesta a diferentes tratamientos analgésicos. Del mismo modo, existe una amplia variedad de grupos farmacológicos con efecto analgésico, y diferentes vías para su administración, lo que permite establecer distintos perfiles de eficacia y seguridad para cada individuo.
De modo general, se recomienda el uso de estrategias de analgesia multimodal, de manera que se combinen de manera escalonada y proporcional a la intensidad del dolor referido por el paciente, medidas no farmacológicas, fármacos de diferentes grupos y diferentes vías de administración. Este abordaje trata de aumentar la eficacia analgésica al tiempo que se minimizan los efectos adversos, individualizando la terapia según las características e intensidad del dolor, la respuesta al tratamiento, y el riesgo de efectos adversos en función de patologías asociadas o tratamientos concomitantes.
Por lo tanto, el grupo ha formulado las siguientes recomendaciones de buena práctica.
Recomendaciones
| √ | Medir la intensidad del dolor en pacientes con TTCNG mediante escalas numéricas. |
| √ | Iniciar precozmente el tratamiento analgésico en pacientes con TTCNG. |
| √ | Utilizar estrategias de tratamiento multimodal personalizado en pacientes con TTCNG. |
7.8.1. Analgesia sistémica frente a analgesia locorregional
- ¿Se debe implementar analgesia sistémica frente a analgesia locorregional en pacientes con TTCNG y fracturas costales ingresados en el hospital?
Las fracturas costales se asocian frecuentemente a dolor moderado o intenso. Existe evidencia de que el dolor es un factor relacionado con una gran parte de la morbilidad asociada al traumatismo torácico. El tratamiento analgésico adecuado de estas lesiones favorece la movilización precoz y la fisioterapia respiratoria, disminuyendo la estancia hospitalaria y la incidencia de complicaciones respiratorias.
Existen diferentes opciones para el tratamiento analgésico, que pueden ser clasificadas en dos grandes grupos en función del lugar de efecto de los fármacos administrados (analgesia sistémica y regional). La eficacia y seguridad de ambas modalidades de administración de fármacos analgésicos ha sido evaluada en diversos estudios.
Evidencia científica
De la búsqueda realizada inicialmente se tuvieron en cuenta cinco revisiones publicadas a partir de 2010: Brasel KJ et al (321), Unsworth et al, 2015 (263), y dos revisiones con MA (Duch et al (322) y Peek J et al (323)), así como una guía sobre el manejo del dolor en pacientes con traumatismo torácico cerrado de la Eastern Association for the surgery of traumatismo and Trauma Anesthesiology Society (324).
Fuera de esta estrategia de búsqueda, también se identificó la guía de la SFAR (Sociedad Francesa de Anestesia y Reanimación) de 2017 (187), con recomendaciones relacionadas con la anelgesia regional.
Para la identificación de estudios individuales se tuvieron en cuenta las revisiones de Duch et al (322) y Peek J et al (323), así como la guía de la EAST (324), y se han excluido Brasel KJ et al (321) y Unsworth A et al (263).
De la búsqueda de estudios individuales a partir de 2017 (posterior a la publicación de las RS seleccionadas) se identificaron 62 referencias, entre las que solo se seleccionó el estudio de Yeying et al (325), que ya estaba incluido en la revisión de Peek J et al (323).
Finalmente son nueve estudios individuales incluidos para reponder a esta pregunta. Cinco estudios compararon analgesia epidural con analgesia sistémica intravenosa (IV) (326-330) (uno con analgesia controlada por el paciente o IV administrado por enfermería (329), otro con infusión continua o cada tres o cuatro horas (330)), dos estudios compararon la analgesia epidural con analgesia controlada exclusivamente por el paciente (PCA – patient-controlled analgesia) (331;332), un estudio el catéter intrapleural con la analgésica sistémica IV (344), y el último y más reciente el bloqueo paravertebral frente a la analgesia sistémica IV (325). A continuación, se describen los principales desenlaces de interés.
Neumonía
Cuatro estudios notificaron casos de neumonía (327-329;333). Tres compararon analgesia epidural respecto a analgesia sistémica IV (327-329) y uno analgesia intrapleural respecto a analgesia sistémica IV (333). No se identificaron estudios que compararan analgesia epidural respecto a analgesia PCA, para este desenlace.
No se encontraron diferencias significativas entre la analgesia regional y la analgesia sistémica IV (4 estudios; 138 pacientes; RR 0,48; IC95 % de 0,21 a 1,07); entre la analgesia epidural y la analgesia sistémica IV (3 estudios; 96 pacientes; RR 0,49; IC 95 % de 0,21 a 1,13) ni entre la analgesia intrapleural y la analgesia sistémica (1 estudio; 42 pacientes; RR 0,33; IC 95 % de 0,001 a 7,74).
Calidad
muy baja
para todas
las
comparaciones
Dolor y fracaso del tratamiento
Seis estudios comunicaron datos sobre el dolor y el fracaso del tratamiento (325;327;329;331-333): dos presentaron el número de pacientes con dolor en reposo (327), con la tos (331) o la tos y la inspiración profunda (327); uno presentó de forma narrativa si existían o no diferencias significativas en cuanto al dolor entre los grupos comparados (332), otro la puntuación EAV (Escala Analógica Visual) obtenida en reposo, a los 60 min y tras uno, dos y tres días postratamiento (325) y dos el de fallo del tratamiento que requirió un cambio del mismo (329;333). Dos estudios compararon analgesia epidural respecto a analgesia sistémica IV (327;329), dos estudios compararon analgesia epidural respecto a PCA (331;332), uno analgesia intrapleural respecto a analgesia sistémica IV (333) y el último analgesia paravertebral frente a analgesia sistémica IV (325).
Analgesia epidural respecto a analgesia sistémica IV
Un estudio evaluó el dolor en reposo, así como el dolor con la tos o la inspiración profunda usando una EAV de 0 a 100 (327) y el otro el no control del dolor que fue analizado como fracaso del tratamiento (329).
No se encontraron diferencias significativas para el dolor en reposo o el dolor con la tos o la inspiración profunda entre las dos intervenciones (1 estudio; 32 pacientes; DM -5,00; IC95 % de -21,99 a 11,99 y DM -17.00; IC95 % de -34,69 a 0,69, respectivamente) (327).
Calidad
muy baja
En cuanto al fracaso del tratamiento por mal control del dolor, no se encontraron diferencias significativas entre las intervenciones (1 estudio; 46 pacientes; RR 1.09; IC95 % de 0,25 a 4,85) (329).
Calidad
muy baja
Analgesia epidural respecto a PCA
Dos estudios compararon estas dos intervenciones (331;332). Uno reportó que la analgesia epidural obtuvo valores significativamente más bajos en la escala del dolor a las 24 y 36 horas en comparación con la PCA (p<0,04) pero no a las 48 o las 72 horas (datos no aportados) (332). El otro estudio reportó una reducción significativa del dolor a las 24 y 36 horas con la analgesia epidural frente a la PCA (p<0,05), pero no a las 48 horas. No se notificaron resultados a las 72 horas de seguimiento (331).
Calidad
baja
Analgesia intrapleural respecto a analgesia sistémica IV
Un estudio comparó estas dos intervenciones (333). Tres pacientes en el grupo de analgesia sistémica tuvieron que recibir analgesia intrapleural por fracaso del tratamiento (definido como una disminución de la CVF mayor del 10 %). Un paciente en el grupo de analgesia intrapleural requirió intubación por fallo del tratamiento. No se encontraron diferencias estadísticamente significativas entre ambas intervenciones.
Calidad
baja
Analgesia paravertebral respecto a analgesia sistémica IV
Un estudio comparó ambas técnicas (325). En este estudio, hubo un descenso significativo en la puntuación EAV (medida de 0 a 10) en reposo y durante la tos en todos los puntos temporales medidos tras analgesia en comparación con los valores basales en ambos grupos. Las puntuaciones en reposo a la hora y tras el primer día eran significativamente menores en el grupo con analgesia paravertebral que en el grupo con analgesia intravenosa. Además, se encuentra una diferencia significativa, aunque no muy importante, en las puntuaciones durante la tos en todos los puntos temporales que favorece al grupo con analgesia paravertebral.
Calidad
muy baja
Estancia hospitalaria
Cinco estudios notificaron datos sobre la estancia hospitalaria (326;327; 329;332;333): Tres compararon analgesia epidural con analgesia sistémica IV (326;327;329), uno comparó la analgesia epidural con PCA (332) y un último estudio la analgesia intrapleural con la analgesia sistémica IV (333). Dos comunicaron los resultados de forma narrativa (332;333).
Analgesia epidural respecto a analgesia sistémica IV
Tres estudios notificaron datos sobre la duración de la estancia hospitalaria (326;327;329). Uno de los estudios, realizado en una UCI quirúrgica (326), reportó una media de días de estancia hospitalaria para las dos intervenciones mucho mayores que los otros dos estudios, que fueron realizados en unidades de traumatismo (327;329). Los participantes del estudio realizado en la UCI quirúrgica requirieron mayor uso de ventilación asistida, por lo que sus resultados no se incluyen en el análisis conjunto de los resultados para este desenlace.
No se notificaron diferencias significativas en cuanto a los días de estancia hospitalaria entre la analgesia epidural y la analgesia sistémica IV (2 estudios; 76 pacientes; DM 1,66; IC95 % de -1,68 a 5,00) (327;329).
Calidad
baja
El estudio realizado en la UCI quirúrgica reportó una disminución del número total de días de estancia hospitalaria con la analgesia epidural comparada con la analgesia sistémica IV (1 estudio; 28 pacientes; DM -32,84; IC95 % de -46,54 a -19,14) (326).
Calidad
muy baja
Analgesia epidural respecto a PCA
Un estudio comparó los días de estancia hospitalaria entre la analgesia epidural y PCA (332), no encontrando diferencias significativas entre las intervenciones comparadas (1 estudio; 22 pacientes; 10,8 días de estancia hospitalaria con analgesia epidural frente a 15,9 días con PCA).
Calidad
baja
Analgesia intrapleural respecto a analgesia sistémica IV
Un estudio reportó los días de estancia hospitalaria para estas dos intervenciones dependiendo del porcentaje medio inicial de la CVF (mayor o menor del 20 %) (333). En el grupo con una CVF inicial menor al 20 %, los días de estancia hospitalaria fueron 7,5 en quienes recibieron analgesia intrapleural y de 8,2 en quienes recibieron analgésica sistémica IV. En el grupo de pacientes con una CVF inicial mayor del 20 %, los días de estancia en quienes recibieron anestesia intrapleural fueron de 8,8, y en quienes recibieron analgesia sistémica IV de 8,6 días, sin encontrar diferencias en ningún caso.
Calidad
baja
Estancia en unidad de cuidados intensivos
Seis estudios presentaron los días de estancia en UCI (326;328-330;332;333): cuatro compararon analgesia epidural con analgesia sistémica IV (326;329), uno comparó la analgesia epidural con PCA (332) y el ultimo comparó la analgesia intrapleural con la sistémica IV (333).
Analgesia epidural respecto a analgesia sistémica IV
Cuatro estudios compararon los días en UCI en pacientes que recibieron analgesia epidural respecto a analgesia sistémica IV (326;328-330).
El pull de la DM de los días de duración de la estancia fue de 4,7 días menos (de 10,84 días menos a 1,43 días más) en el grupo con analgesia epidural frente al grupo con analgesia sistémica IV.
Calidad
muy baja
Analgesia epidural respecto a PCA
No se encontraron diferencias significativas en los días de estancia en UCI entre la analgesia epidural y la PCA (1 estudio; 22 pacientes; días en UCI analgesia epidural 3,1; días en UCI PCA 6,6; no significativo) (332).
Calidad
baja
Analgesia intrapleural respecto a analgesia sistémica IV
Un estudio reportó los días de estancia hospitalaria para estas dos intervenciones dependiendo del porcentaje medio inicial de la CVF (mayor o menor del 20 %) (333). En el grupo de pacientes con una CVF inicial menor al 20 %, los días de estancia en UCI fueron 1,9 en quienes recibieron analgesia intrapleural y de 0,2 en quienes recibieron analgésica sistémica IV. En el grupo de pacientes con una CVF inicial mayor del 20 %, los días de estancia en fueron de 0,6 para las dos intervenciones. No se encontraron diferencias entre las intervenciones en ninguno de los grupos evaluados.
Calidad
baja
Función respiratoria
Se identificaron cinco estudios que evaluaron diferentes parámetros de la función respiratoria (324-328;333); tres compararon la analgesia epidural respecto a la analgesia sistémica IV (326-328), uno la analgesia intrapleural respecto a la analgesia sistémica IV (333) y el último la analgesia paravertebral respecto a la sistémica (324).
Analgesia epidural respecto a analgésica sistémica IV
El primer estudio comparó la analgesia epidural respecto a la analgesia sistémica IV y reportó una mejora significativa en la CV respecto a valores basales pre-tratamiento con las dos intervenciones evaluadas (CV 5,1 +/- 6,5 cc/kg analgesia epidural y 2,8 +/- 4,5 cc/kg analgesia sistémica IV; p<0,005), así como una mejora significativa respecto a valores basales en la presión inspiratoria máxima con la analgesia epidural (17 +/- 20 cm H2O), pero no con la analgesia sistémica IV (5,3 +/-19 cm H2O) (339). No se encontraron diferencias en el volumen tidal (VT) en reposo (cc/kg), la frecuencia respiratoria en reposo, o el volumen minuto en reposo (cc/kg) en ninguna de las dos intervenciones.
El segundo estudio reportó un aumento significativo del VT 24 horas post tratamiento con la analgesia epidural (604,2 +/- 81,8 mm) respecto a la analgesia sistémica IV (405,6 +/- 41,2 mm; p<0,007) (337). No se encontraron diferencias significativas en cuanto a la CV 24 horas post tratamiento entre las intervenciones evaluadas (1212,5 +/- 144,5 ml y 1225 +/- 233 ml, respectivamente).
El tercero reportó un aumento significativo del volumen tidal en las primeras 24 horas en el grupo con analgesia epidural (328).
Calidad
baja
Analgesia epidural respecto a PCA
No se encontraron estudios que compararan este desenlace en estas dos intervenciones.
No hay
estudios
Analgesia intrapleural respecto analgesia sistémica IV
Un estudio reportó el cambio de la CVF medida en el alta hospitalaria respecto a los valores basales para estas dos intervenciones dependiendo del porcentaje medio inicial de la CVF (mayor o menor del 20 %) (334). En el grupo de pacientes con una CVF inicial menor al 20 %, el cambio de la CVF fue del 21,8 % en quienes recibieron analgesia intrapleural y de 26 % en quienes recibieron analgésica sistémica IV. En el grupo de pacientes con una CVF inicial mayor del 20 %, el cambio en la CVF fue del 23,1 % en el grupo de pacientes que recibió analgesia intrapleural y de 10,7 % para los que recibieron analgesia sistémica IV. Se encontró una diferencia significativa entre las dos intervenciones en este último grupo de pacientes (p<0,005).
Calidad
baja
Analgesia paravertebral respecto a analgesia sistémica IV
Un estudio reportó una mejoría en CVF, VEF1/CVF y FEM (Flujo espiratorio máximo) tras analgesia en ambos grupos, aunque la mejoría era más importante en el grupo con analgesia paravertebral.
Calidad
baja
Prurito
Analgesia epidural respecto a analgesia sistémica IV
Se identificaron tres estudios que presentaron datos sobre prurito (326;327;329): uno de ellos lo evaluó utilizando una EAV (327), los otros dos estudios lo presentaron como el número de pacientes que desarrollaron prurito durante el tratamiento (326;329).
La analgesia epidural se asoció a mayor desarrollo de prurito (evaluado con una EAV) comparada con la analgesia sistémica IV (1 estudio; 46 pacientes; DM 11,40; IC95 % de 0,45 a 22,35) (327). Estos resultados contrastan con los identificados por otro estudio en el cual no se encontraron diferencias significativas en número de pacientes que desarrollaron prurito en las intervenciones evaluadas (1 estudio; 46 pacientes; RR 1.09; IC95 % de 0,36 a 3,27) (327). El otro estudio identificado solo reportó resultado para el grupo que recibió anestesia epidural y ningún paciente desarrollo prurito durante el tratamiento (326).
Calidad
muy baja
Analgesia epidural vs. PCA
No se encontraron estudios que presentaran las diferencias en cuanto al desarrollo de prurito entre la analgesia epidural y PCA.
No hay
estudios
Analgesia intrapleural vs. Analgesia sistémica IV
No se encontraron estudios que presentaran las diferencias en cuanto al desarrollo de prurito entre la analgesia intrapleural y la analgesia sistémica IV.
No hay
estudios
Resumen de la evidencia
| Analgesia epidural frente a analgesia sistémica IV | |
|---|---|
| Muy baja | No hay diferencias en los casos de neumonía (3 estudios; 96 pacientes; RR 0,49; IC95 % 0,21 a 1,13), ni en el dolor en reposo o dolor con la tos o la inspiración profunda ((1 estudio; 32 pacientes; DM -5,00; IC95 % -21,99 a 11,99 y DM -17,00; IC95 % -34,69 a 0,69, respectivamente) (327). Tampoco en el fracaso del tratamiento por no control del dolor (1 estudio; 46 pacientes; RR 1,09; IC95 % de 0,25 a 4,85) (329).
No se comunicaron diferencias significativas en los días de estancia hospitalaria (2 estudios; 76 pacientes; DM 1,66; IC 95 % -1,68 a 5,00) (327;329), salvo en el estudio realizado en la UCI quirúrgica que reportó una disminución del número total de días de estancia hospitalaria (1 estudio; 28 pacientes; DM -32,84; IC95 % -46,54 a -19,14) (326). |
| Analgesia epidural frente a PCA | |
| Baja | Un estudio reportó que la analgesia epidural obtuvo valores significativamente más bajos en la escala del dolor a las 24 y 36 horas (p<0,04) pero no a las 48 o las 72 horas (332). El otro estudio reportó una reducción significativa del dolor a las 24 y 36 horas con la analgesia epidural (p<0,05), pero no a las 48 horas (331). No hubo diferencias en los días de estancia hospitalaria entre ambas intervenciones (332). |
| Analgesia intrapleural vs. Analgesia sistémica IV | |
| Muy baja | No hay diferencias en los casos de neumonía (1 estudio; 42 pacientes; RR 0,33; IC95 % de 0,001 a 7,74).
En cuanto al fracaso al tratamiento, no se encontraron diferencias estadísticamente significativas entre ambas intervenciones. Tampoco se encuentran diferencias en los días de estancia hospitalaria según el porcentaje medio inicial de la CVF (mayor o menor del 20 %) (333). |
| Analgesia paravertebral vs. Analgesia sistémica IV | |
| Muy baja | En un estudio (325) hubo un descenso significativo en la puntuación EAV (medida de 0 a 10) en reposo y durante la tos, favoreciendo a la analgesia paravertebral. |
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es muy baja en general.
- Balance entre beneficios y riesgos: el balance entre los efectos deseados y no deseados probablemenete no favorezca la opción (analgesia sistémica frente a locorregional).
- Utilización de recursos: los recursos probablemente no sean pequeños, puesto que hacen falta especialistas, monitorizar al paciente y ambiente hospitalario. El coste de insertar un catéter epidural sería de 550 euros (datos de facturación de Osakidetza, 2018).
- Equidad: No va a ser posible poner una epidural torácica o paravertebral en cualquier Hospital, ni lo puede realizar un profesional no entrenado, por lo que las desigualdades en salud probablemente aumentarían si se favoreciera esta opción.
- Aceptabilidad: puede existir variabilidad en la aceptabilidad de la opción, puesto que dependerá del profesional sanitario y de la experiencia de los pacientes que podrían preferir (o no) la analgesia epidural.
- Factibilidad: la opción de la anestesia locorregional probablemente sea factible en hospitales con los medios disponibles necesarios.
Existe evidencia de baja o muy baja calidad de que las técnicas de analgesia regional son más eficaces que la administración de analgésicos por vía sistémica, con un efecto positivo sobre el dolor, la función pulmonar, la incidencia de complicaciones respiratorias (neumonía), y la estancia hospitalaria. Sin embargo, el hecho de que se trate de técnicas invasivas que deben ser aplicadas por especialistas, y no estén exentas de efectos adversos, las sitúa como tratamientos de segunda línea para el grupo de pacientes objeto de esta GPC. Por lo tanto, la recomendación que se ha formulado es la siguiente:
Recomendaciones
| Débil | Se sugiere el uso de técnicas regionales frente la analgesia sistémica en aquellos pacientes con TTCNG en los que no se consiga un adecuado control del dolor con las dosis recomendadas habitualmente, aparezcan efectos adversos, o en aquellos que por las características de las lesiones o patologías asociadas tengan mayor riesgo de complicaciones. |
Consideraciones para la implementación
- Si se va a utilizar analgesia regional en el tratamiento del dolor de pacientes con un TTCNG, es necesario contar con personal entrenado y disponibilidad de medios (monitorización, ecografía, etc).
7.8.2. Uso de catéter epidural frente a catéter paravertebral
- En pacientes con TTCNG y con fracturas costales en los que se ha decidido implementar analgesia regional, ¿se debe elegir catéter epidural frente a catéter paravertebral?
Las técnicas de analgesia regional han demostrado ser más eficaces que la administración de analgésicos por vía sistémica, con un efecto positivo sobre el dolor, la función pulmonar, la incidencia de complicaciones respiratorias (neumonía), y la estancia hospitalaria en algunos grupos de pacientes.
Existe una variedad de técnicas analgésicas regionales disponibles para el tratamiento del dolor asociado a un traumatismo torácico. La analgesia epidural es la técnica mejor estudiada y constituye el estándar con el que se comparan las otras técnicas regionales. Implica la administración de opiáceos y/o anestésicos locales en el espacio epidural a nivel torácico o lumbar, obteniendo un efecto analgésico metamérico o central en función de los fármacos utilizados. En el bloqueo paravertebral torácico, se inyectan anestésicos locales en el espacio paravertebral, provocando el bloqueo unilateral de uno o varios nervios espinales.
La analgesia intrapleural (a veces también conocida en la literatura como analgesia “interpleural”) implica la administración de un fármaco anestésico local en el espacio pleural, que al difundir a través de la pleura parietal bloquea múltiples dermatomas unilaterales. Los bloqueos nerviosos intercostales se realizan mediante la inyección de anestésicos locales en el segmento posterior de uno o varios espacios intercostales.
Evidencia científica
Se han identificado dos guías que realizan recomendaciones en relación a la analgesia locorregional y sistémica: la guía de la SFAR (Sociedad Francesa de Anestesia y Reanimación) de 2017 (187) y la guía de la Eastern Association for the Surgery of Trauma and Trauma Anesthesiology Society (324) sobre el manejo del dolor en traumatismo torácico cerrado.
En la búsqueda específica de RS realizada no se identificó ninguna referencia, aunque sí estudios individuales en las dos revisiones y las dos guías utilizadas para responder a la pregunta sobre analgesia locoregional frente a sistémica (187;322-324).
Los cinco estudios seleccionados compararon: analgesia con catéter paravertebral frente a catéter epidural (334;335), analgesia con catéter intrapleural frente a catéter epidural (336;337) y bloqueo intercostal frente a analgesia con catéter epidural (338). A continuación, se describen los principales desenlaces de interés.
Analgesia paravertebral respecto a analgesia epidural
Dos ECA compararon la analgesia paravertebral respecto a la analgesia epidural (334;335). Uno de los estudios fue en pacientes con múltiples fracturas costales, volet costal o contusión pulmonar (n=50) (334) y otro ECA en pacientes con tres o más fracturas costales unilaterales (n=30) (335). Los resultados no fueron descritos de forma numérica, sino a través de gráficos, por lo que se hace un resumen narrativo de los resultados encontrados por desenlace de interés.
Los dos ensayos notificaron una mejoría significativa del dolor (evaluado con EAV) posterior a la administración de analgesia comparado con niveles basales para las dos técnicas analizadas (p< 0,0001), siendo el nivel de mejoría fue similar entre las dos intervenciones (334;335).
Calidad
baja
Se reportó una mejoría en el VEF1, la CV, flujo espiratorio forzado (FEF25-75) (334) y en la tasa de FEM (336) respecto a los valores basales en los dos grupos evaluados.
Calidad
baja
Respecto a la presión arterial, uno de los estudios reportó una disminución significativa en los dos grupos evaluados comparado con niveles basales (334), sin diferencias significativas entre los grupos (334). El otro estudio reportó un mayor desarrollo de hipotensión con la analgesia epidural comparado con la analgesia paravertebral (p = 0,04) (335).
Calidad
muy baja
Se identificó una disminución de la frecuencia respiratoria con respecto a valores basales en las dos intervenciones evaluadas (p< 0,05), sin identificarse diferencias significativas entre grupos (p = 0,092) (335).
Calidad
baja
No se notificaron eventos adversos asociados a la técnica de inserción del catéter en ninguna de las dos intervenciones evaluadas (parestesia, dolor, punción pleural, neumotórax, hematoma durante la inserción de la aguja o el catéter) (268), y tampoco en el desarrollo de neumonía, efusión pleural, hemotórax o fiebre (335).
Calidad
baja
Analgesia intrapleural respecto a analgesia epidural
Dos ECA evaluaron estas dos intervenciones (336;337): un estudio cruzado en pacientes con hemotórax con indicación de drenaje torácico (n=17) (337) y otro estudio en pacientes con un traumatismo torácico severo, con más de tres fracturas costales unilaterales, volet costal o contusión pulmonar unilateral (n=19) (336).
Los resultados no fueron descritos de forma numérica sino a través de gráficos, por lo que se hace un resumen narrativo de los resultados encontrados por desenlace de interés.
En uno de los estudios, la reducción del dolor fue significativamente menor comparado con niveles basales con la analgesia epidural (p < 0,05) (336). Con la analgesia intrapleural también se observó una disminución del dolor respecto a valores basales, aunque no de forma significativa (336). Estos resultados contrastan con los del otro estudio identificado, donde se observaron diferencias significativas en la reducción del dolor respecto a valores basales en las dos intervenciones evaluadas (p < 0,05) (337). En este último estudio, la duración de la analgesia fue similar entre grupos.
Calidad
muy baja
El volumen tidal y la fuerza inspiratoria negativa mejoró significativamente con la analgesia epidural comparado con la analgesia intrapleural (p <0,05) (340). No se identificaron diferencias en cuanto a la FiO2, ventilación por minuto, frecuencia respiratoria o CV entre grupos.
Calidad
baja
Uno de los estudios reportó una disminución de la presión arterial con la analgesia epidural en todos los pacientes (336). En el segundo estudio los pacientes que recibieron analgesia epidural también presentaron una disminución de la presión arterial después de su administración (337).
Calidad
baja
En uno de los estudios, la frecuencia respiratoria disminuyó significativamente en ambos grupos (p < 0,01), peor sin encontrar diferencias significativas entre los mismos (337).
Calidad
baja
En ninguno de los dos estudios se presentaron otras complicaciones como infecciones asociadas al catéter, toxicidad por bupivacaína, neumotórax, perforación dural, déficit neurológico, o broncoespasmo en ninguna intervención evaluada (334;335).
Calidad
baja
Analgesia intercostal respecto a analgesia epidural
Se identificó un ECA que evaluó la efectividad bloqueo intercostal respecto a la analgesia epidural en el tratamiento del dolor en pacientes con más de una fractura costal (n=60) (338).
La analgesia epidural presentó una disminución significativa del dolor en reposo comparada con el bloqueo intercostal (DM de 1,10; IC95 % de 0,65 a 1,55) (338). Resultados similares se presentaron respecto al dolor con la tos, siendo la analgesia epidural más efectiva en la reducción del dolor con la tos (DM de 1,90; IC95 % de 1,43 a 2,37) (338).
Calidad
baja
No se encontraron diferencias en cuanto a volumen tidal (DM -0,04; IC95 % de -0,12 a 0,04), la CV (DM 0,03; IC 95 % de -0,06 a 0,12), en el volumen minuto (DM 1,03; IC95 % de -2,65 a 4,71), ni en la capacidad residual funcional (DM 0,13; IC95 % de -3,16 a 3,42) entre ambas intervenciones (338).
Calidad
baja
Se identificaron diferencias significativas en cuanto a la frecuencia cardiaca durante la hospitalización, siendo más baja con el bloqueo epidural (DM 6,75; IC95 % de -12,86 a -0,64) (338).
Calidad
baja
No se encontraron diferencias significativas en cuanto a la media de la presión arterial (DM 0,20; IC95 % de -0,06 a 0,46).
Calidad
muy baja
Tampoco se encontraron diferencias en la frecuencia respiratoria (DM -1,60; IC95 % de -4,88 a 1,68) durante la hospitalización entre los grupos evaluados (349) ni en la incidencia de complicaciones respiratorias (medidas del efecto no presentadas) (338).
Calidad
baja
Resumen de la evidencia
| Analgesia paravertebral respecto a analgesia epidural | |
|---|---|
| Muy baja | El dolor mejora de forma significativa y de manera similar con las dos técnicas analizadas (p< 0,0001) (334;335). Sin embargo, la presión arterial y la frecuencia respiratoria disminuyen en ambos casos, aunque solo uno de los dos estudios señala mayor desarrollo de hipotensión con la analgesia epidural (p=0,04) (335). No se notificaron eventos adversos asociados a la técnica de inserción del catéter en ninguna de las dos intervenciones (268) ni en el desarrollo de neumonía, efusión pleural, hemotórax o fiebre (335). |
| Analgesia intrapleural a analgesia epidural | |
| Muy baja | La reducción del dolor fue significativa con la analgesia epidural (p < 0,05) y no con la intrapleural (336). Estos contrastan con el otro estudio identificado, donde se observaron diferencias significativas con respecto a valores basales en las dos intervenciones evaluadas (p < 0,05) (337). En ambos estudios se notifica una disminución de la presión arterial con la analgesia epidural (336;337) y en uno de los estudios la frecuencia respiratoria disminuye en ambos grupos (p < 0,01) sin encontrar diferencias significativas (337). |
| Analgesia intercostal respecto a analgesia epidural | |
| Muy baja | La analgesia epidural presentó una disminución significativa del dolor en reposo comparada con el bloqueo intercostal (DM 1,10; IC95 % de 0,65 a 1, 55) (338) y del dolor con la tos (DM 1,90; IC 95 % de 1,43 a 2,37) (338). La frecuencia cardíaca durante la hospitalización fue más baja con el bloqueo epidural (DM -6,75; IC 95 % de -12,86 a -0,64) (338). No se encontraron diferencias significativas en la presión arterial (DM 0,20; IC 95 % de -0,06 a 0,46) y frecuencia respiratoria (DM de -1,60; IC 95 % de -4,88 a 1,68) durante la hospitalización entre los dos grupos (338). |
Resultados de la actualización de la búsqueda
En la actualización de la búsqueda, no se han identificado estudios relevantes para responder a esta pregunta.
De la evidencia a la recomendación
Los aspectos que han determinado la fuerza y dirección de las recomendaciones han sido los siguientes:
- Calidad global de la evidencia: la confianza en los resultados de la evidencia es muy baja para todas las comparaciones.
- Balance entre beneficios y riesgos: existe incertidumbre sobre el balance entre los efectos deseados y no deseados. En los pacientes en los que esté indicado el uso de una técnica de analgesia regional, el uso de catéteres paravertebrales, intercostales o interpleurales no ha demostrado ventajas significativas en cuanto a eficacia y seguridad respecto al uso de catéteres epidurales.
- Utilización de recursos: el coste es similar en ambos casos.
- Equidad: no habría impacto sobre las desigualdades en salud.
- Aceptabilidad: existiría variabilidad en la aceptación de la opción. Las dos técnicas requieren recursos humanos y materiales similares, aunque puede existir variabilidad en la formación y la experiencia del profesional sanitario que tenga que realizarlas.
- Factibilidad: la opción probablemente sea factible, aunque puede ser necesaria la formación del profesional sanitario que tenga que realizarlas.
Diversos estudios, que incluyeron mayoritariamente pacientes a los que se les realizó una toracotomía, han demostrado con una baja calidad de evidencia que el uso de catéteres paravertebrales comparado con el uso de catéteres epidurales redujo el riesgo de complicaciones menores (hipotensión leve, náuseas y vómitos, prurito y retención urinaria), sin diferencias significativas en la incidencia de complicaciones mayores. Sin embargo, el uso de diferentes fármacos (opiáceos y/o anestésicos locales), a diferentes concentraciones y en diferentes volúmenes, hace que las diferencias en los resultados puedan deberse a los efectos farmacológicos más que al lugar de administración (posición del catéter) (339). Por ello, el grupo ha formulado las siguientes recomendaciones de tipo consenso:
Recomendaciones
| √ | La elección de una técnica epidural o paravertebral debe ser individualizada en función de las características del paciente con TTCNG y la lesión (lesiones uni o bilaterales, número de dermatomas a bloquear), así como de la experiencia del anestesiólogo que la realice. |
| √ | En el caso de utilizar un catéter paravertebral, considerar el uso de control ecográfico durante su colocación. |
Bibliografía 7. Tratamiento
26. Rodriguez RM, Hendey GW, Marek G, Dery RA, Bjoring A. A pilot study to derive clinical variables for selective chest radiography in blunt trauma patients. Ann Emerg Med. 2006;47(5):415-8.
27. Rodriguez RM, Hendey GW, Mower W, Kea B, Fortman J, Merchant G, et al. Derivation of a decision instrument for selective chest radiography in blunt trauma. J Trauma. 2011;71(3):549-53.
31. Myint KS, French S, Williams-Johnson J, Williams E, Johnson P, Reid MO, et al. Role of routine chest radiographs in the evaluation of patients with stable blunt chest trauma--a prospective analysis. West Indian Med J. 2012;61(1):64-72.
32. (Paydar S, Johari HG, Ghaffarpasand F, Shahidian D, Dehbozorgi A, Ziaeian B, et al. The role of routine chest radiography in initial evaluation of stable blunt trauma patients. Am J Emerg Med. 2012;30(1):1-4.
33. Sears BW, Luchette FA, Esposito TJ, Dickson EL, Grant M, Santaniello JM, et al. Old fashion clinical judgment in the era of protocols: is mandatory chest X-ray necessary in injured patients? J Trauma. 2005;59(2):324-30.
34. Bokhari F, Brakenridge S, Nagy K, Roberts R, Smith R, Joseph K, et al. Prospective evaluation of the sensitivity of physical examination in chest trauma. J Trauma. 2002;53(6):1135-8.
35. Dubinsky I, Low A. Non-life-threatening blunt chest trauma: appropriate investigation and treatment. Am J Emerg Med. 1997;15(3):240-3.
36. Dunlop MG, Beattie TF, Preston PG, Steedman DJ. Clinical assessment and radiograph following blunt chest trauma. Arch Emerg Med. 1989;6(2):125-7.
37. Nejati A, Khalaj S, Azizkhani R, Shahryarian S, Kolahdouzan M, Hossein MS. Evaluating validity of clinical criteria for requesting chest X-rays in trauma patients referred to emergency room. Adv Biomed Res. 2012;1:22.
43. Hoffstetter P, Dornia C, Schafer S, Wagner M, Dendl LM, Stroszczynski C, et al. Diagnostic significance of rib series in minor thorax trauma compared to plain chest film and computed tomography. J Trauma Manag Outcomes. 2014;8:10.
45. Verma SM, Hawkins HH, Colglazier S, Kraemer LA, Wiot JF. The clinical utility of rib detail films in the evaluation of trauma. Emergency Radiology. 1995;2(5):264-6.
82. Rodriguez RM, Langdorf MI, Nishijima D, Baumann BM, Hendey GW, Medak AJ, et al. Derivation and validation of two decision instruments for selective chest CT in blunt trauma: a multicenter prospective observational study (NEXUS Chest CT). PLoS Med. 2015;12(10):e1001883.
83. Raja AS, Mower WR, Nishijima DK, Hendey GW, Baumann BM, Medak AJ, et al. Prevalence and Diagnostic Performance of Isolated and Combined NEXUS Chest CT Decision Criteria. Acad Emerg Med. 2016;23(8):863-9.
84. Lavingia KS, Collins JN, Soult MC, Terzian WH, Weireter LJ, Britt LD. Torso Computed Tomography Can Be Bypassed after Thorough Trauma Bay Examination of Patients Who Fall from Standing. Am Surg. 2015;81(8):798-801.
86. Chardoli M, Hasan-Ghaliaee T, Akbari H, Rahimi-Movaghar V. Accuracy of chest radiography versus chest computed tomography in hemodynamically stable patients with blunt chest trauma. Chin J Traumatol. 2013;16(6):351-4.
104. Ho SW, Teng YH, Yang SF, Yeh HW, Wang YH, Chou MC, et al. Risk of pneumonia in patients with isolated minor rib fractures: a nationwide cohort study. BMJ Open. 2017;13;7(1):e013029.
105. Chauny JM, Emond M, Plourde M, Guimont C, Le SN, Vanier L, et al. Patients with rib fractures do not develop delayed pneumonia: a prospective, multicenter cohort study of minor thoracic injury. Ann Emerg Med. 2012;60(6):726-31.
106. Battle CE, Hutchings HF, James KF, Evans PA. The risk factors for the development of complications during the recovery phase following blunt chest wall trauma: a retrospective study. Injury. 2013;44(9):1171-6.
109. Battle C, Hutchings H, Lovett S, Bouamra O, Jones S, Sen A, et al. Predicting outcomes after blunt chest wall trauma: development and external validation of a new prognostic model. Crit Care. 2014;18(3):R98.
152. Chu DK, Kim LH, Young PJ, Zamiri N, Almenawer SA, Jaeschke R, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta-analysis. Lancet. 2018;391(10131):1693-705.
153. Barbateskovic M, Schjorring OL, Jakobsen JC, Meyhoff CS, Rasmussen BS, Perner A, et al. Oxygen supplementation for critically ill patients-A protocol for a systematic review. Acta Anaesthesiol Scand. 2018 Aug;62(7):1020-30.
154. Cohen B, Schacham YN, Ruetzler K, Ahuja S, Yang D, Mascha EJ, et al. Effect of intraoperative hyperoxia on the incidence of surgical site infections: a meta-analysis.. Br J Anaesth. 2018 Jun;120(6):1176-86.
155. Pieczkoski SM, Margarites AGF, Sbruzzi G. Noninvasive Ventilation During Immediate Postoperative Period in Cardiac Surgery Patients: Systematic Review and Meta-Analysis. Brazilian journal of cardiovascular surgery. 2017;32(4):301-11.
156. Stolmeijer R, Bouma HR, Zijlstra JG, Drost-de Klerck AM, ter Maaten JC, Ligtenberg JJM. A Systematic Review of the Effects of Hyperoxia in Acutely Ill Patients: Should We Aim for Less?. Biomed Res Int. 2018;2018:7841295.
157. Zhu Y, Yin H, Zhang R, Wei J. High-flow nasal cannula oxygen therapy vs conventional oxygen therapy in cardiac surgical patients: A meta-analysis. J. Crit. Care. 2017;38:123-8.
158. Ni YN, Wang YM, Liang BM, Liang ZA. The effect of hyperoxia on mortality in critically ill patients: a systematic review and meta analysis. BMC Pulm Med. 2019;19(1):53.
159. You J, Fan X, Bi X, Xian Y, Xie D, Fan M, et al. Association between arterial hyperoxia and mortality in critically ill patients: A systematic review and meta-analysis. J. Crit. Care. 2018;47:260-8.
160. Petersen C, Wetterslev J, Meyhoff CS. Perioperative hyperoxia and post-operative cardiac complications in adults undergoing non-cardiac surgery: Systematic review protocol. Acta Anaesthesiol Scand. 2018;62(7):1014-9.
161. Baekgaard JS, Isbye D, Ottosen CI, Larsen MH, Andersen JH, Rasmussen LS, et al. Restrictive vs liberal oxygen for trauma patients-the TRAUMOX1 pilot randomised clinical trial. Acta Anaesthesiol Scand. 2019 Aug;63(7):947-55.
162. Ni YN, Luo J, Yu H, Liu D, Liang BM, Liang ZA. The effect of high-flow nasal cannula in reducing the mortality and the rate of endotracheal intubation when used before mechanical ventilation compared with conventional oxygen therapy and noninvasive positive pressure ventilation. A systematic review and meta-analysis. Am J Emerg Med. 2018;36(2):226-33.
163. Ni YN, Luo J, Yu H, Liu D, Ni Z, Cheng J, et al. Can High-flow Nasal Cannula Reduce the Rate of Endotracheal Intubation in Adult Patients With Acute Respiratory Failure Compared With Conventional Oxygen Therapy and Noninvasive Positive Pressure Ventilation?: A Systematic Review and Meta-analysis. Chest. 2017;151(4):764-75.
164. Zhu Y, Yin H, Zhang R, Wei J. High-flow nasal cannula oxygen therapy versus conventional oxygen therapy in patients with acute respiratory failure: a systematic review and meta-analysis of randomized controlled trials. BMC Pulm Med. 2017;17(1):201.
165. Leeies M, Flynn E, Turgeon AF, Paunovic B, Loewen H, Rabbani R, et al. High-flow oxygen via nasal cannulae in patients with acute hypoxemic respiratory failure: a systematic review and meta-analysis. Syst Rev. 2017;6(1):202.
166. Lin SM, Liu KX, Lin ZH, Lin PH. Does high-flow nasal cannula oxygen improve outcome in acute hypoxemic respiratory failure? A systematic review and meta-analysis. Respir Med. 2017;131:58-64.
167. Ou X, Hua Y, Liu J, Gong C, Zhao W. Effect of high-flow nasal cannula oxygen therapy in adults with acute hypoxemic respiratory failure: a meta-analysis of randomized controlled trials. CMAJ. 2017;189(7):E260-E267.
168. Liesching TN, Lei Y. Efficacy of High-Flow Nasal Cannula Therapy in Intensive Care Units: A Meta-Analysis of Physiological and Clinical Outcomes. J Intensive Care Med. 2017:885066616689043.
169. Lee CC, Mankodi D, Shaharyar S, Ravindranathan S, Danckers M, Herscovici P, et al. High flow nasal cannula versus conventional oxygen therapy and non-invasive ventilation in adults with acute hypoxemic respiratory failure: A systematic review. Respir Med. 2016;121:100-8.
170. Maitra S, Som A, Bhattacharjee S, Arora MK, Baidya DK. Comparison of high-flow nasal oxygen therapy with conventional oxygen therapy and noninvasive ventilation in adult patients with acute hypoxemic respiratory failure: A meta-analysis and systematic review. J Crit Care. 2016;35:138-44.
171. Monro-Somerville T, Sim M, Ruddy J, Vilas M, Gillies MA. The Effect of High-Flow Nasal Cannula Oxygen Therapy on Mortality and Intubation Rate in Acute Respiratory Failure: A Systematic Review and Meta-Analysis. Crit Care Med. 2017;45(4):e449-e456.
172. Nedel WL, Deutschendorf C, Moraes Rodrigues FE. High-Flow Nasal Cannula in Critically Ill Subjects With or at Risk for Respiratory Failure: A Systematic Review and Meta-Analysis. Respir Care. 2017;62(1):123-32.
173. Corley A, Rickard CM, Aitken LM, Johnston A, Barnett A, Fraser JF, et al. High-flow nasal cannulae for respiratory support in adult intensive care patients. Cochrane Database Syst Rev. 2017;5:CD010172.
174. Futier E, Paugam-Burtz C, Godet T, Khoy-Ear L, Rozencwajg S, Delay JM, et al. Effect of early postextubation high-flow nasal cannula vs conventional oxygen therapy on hypoxaemia in patients after major abdominal surgery: a French multicentre randomised controlled trial (OPERA). Intensive Care Med. 2016;42(12):1888-98.
175. Hernandez G, Vaquero C, Gonzalez P, Subira C, Frutos-Vivar F, Rialp G, et al. Effect of Postextubation High-Flow Nasal Cannula vs Conventional Oxygen Therapy on Reintubation in Low-Risk Patients: A Randomized Clinical Trial. JAMA. 2016;315(13):1354-61.
176. Song HZ, Gu JX, Xiu HQ, Cui W, Zhang GS. The value of high-flow nasal cannula oxygen therapy after extubation in patients with acute respiratory failure. Clinics (Sao Paulo). 2017;72(9):562-7.
177. Fernandez R, Subira C, Frutos-Vivar F, Rialp G, Laborda C, Masclans JR, et al. High-flow nasal cannula to prevent postextubation respiratory failure in high-risk non-hypercapnic patients: a randomized multicenter trial. Ann Intensive Care. 2017 Dec;7(1):47.
178. Beng LL, Wei MN, Wei FL. High flow nasal cannula oxygen versus noninvasive ventilation in adult acute respiratory failure: a systematic review of randomized-controlled trials. Eur J Emerg Med. 2019;26(1):9-18.
179. Rochwerg B, Granton D, Wang DX, Helviz Y, Einav S, Frat JP, et al. High flow nasal cannula compared with conventional oxygen therapy for acute hypoxemic respiratory failure: a systematic review and meta-analysis. Intensive Care Med. 2019;45(5):563-72.
180. Xu Z, Li Y, Zhou J, Li X, Huang Y, Liu X, et al. High-flow nasal cannula in adults with acute respiratory failure and after extubation: a systematic review and meta-analysis. Respir Res. 2018;19(1):202.
181. Bocchile RLR, Cazati DC, Timenetsky KT, Serpa NA. The effects of high-flow nasal cannula on intubation and re-intubation in critically ill patients: a systematic review, meta-analysis and trial sequential analysis. Rev Bras Ter Intensiva. 2018;30(4):487-95.
182. Huang H-B, Peng J-M, Weng L, Liu G-Y, Du B. High-flow oxygen therapy in immunocompromised patients with acute respiratory failure: A review and meta-analysis. J Crit Care. 2018;43:300-5.
183. Zhu Y, Yin H, Zhang R, Ye X, Wei J. High-flow nasal cannula oxygen therapy versus conventional oxygen therapy in patients after planned extubation: a systematic review and meta-analysis. Crit Care. 2019;23(1):180.
184. Lu Z, Chang W, Meng S, Xue M, Xie J, Xu J, et al. The Effect of High-Flow Nasal Oxygen Therapy on Postoperative Pulmonary Complications and Hospital Length of Stay in Postoperative Patients: A Systematic Review and Meta-Analysis. J Intensive Care Med. 2018;885066618817718.
185. Bosman A, de Jong MB, Debeij J, van den Broek PJ, Schipper IB. Systematic review and meta-analysis of antibiotic prophylaxis to prevent infections from chest drains in blunt and penetrating thoracic injuries. Br J Surg. 2012;99(4):506-13.
186. Sanabria A, Valdivieso E, Gomez G, Echeverry G. Prophylactic antibiotics in chest trauma: a meta-analysis of high-quality studies. World J Surg. 2006;30(10):1843-7.
187. Bouzat P, Raux M, David JS, Tazarourte K, Galinski M, Desmettre T, et al. Chest trauma: First 48 hours management. Anaesth Crit Care Pa. 2017;36(2):135-45.
188. De LH, Avaro JP, Gust L, Ford RM, Beranger F, Natale C, et al. Surgical management for the first 48 h following blunt chest trauma: state of the art (excluding vascular injuries). Interact Cardiovasc Thorac Surg. 2015;20(3):399-408.
189. Moore FO, Duane TM, Hu CK, Fox AD, McQuay N, Jr., Lieber ML, et al. Presumptive antibiotic use in tube thoracostomy for traumatic hemopneumothorax: an Eastern Association for the Surgery of Trauma practice management guideline. J Trauma Acute Care Surg. 2012;73(5 Suppl 4):S341-S344.
190. Heydari MB, Hessami MA, Setayeshi K, Sajadifar F. Use of prophylactic antibiotics following tube thoracostomy for blunt chest trauma in the prevention of empyema and pneumonia. J Inj Violence Res. 2014;6(2):91-2.
191. Kong VY, Sartorius B, Oosthuizen GV, Clarke DL. Prophylactic antibiotics for tube thoracostomy may not be appropriate in the developing world setting. Injury. 2015;46(5):814-6.
192. Grigorescu D, Maghiar A. Efficacy of antibiotic prophylaxis for preventing intrathoracic infections, after thoracostomy, for traumatic haemo/pneumothorax - experience of Oradea county emergency hospital. Rev Med Chir Soc Med Nat Iasi. 2012;116(4):1157-61.
193. Gonzalez RP, Holevar MR. Role of prophylactic antibiotics for tube thoracostomy in chest trauma. Am Surg. 1998;64(7):617-20.
194. Maxwell RA, Campbell DJ, Fabian TC, Croce MA, Luchette FA, Kerwin AJ, et al. Use of presumptive antibiotics following tube thoracostomy for traumatic hemopneumothorax in the prevention of empyema and pneumonia--a multi-center trial. J Trauma. 2004;57(4):742-8.
195. Carson-Chahhoud KV, Wakai A, van-Agteren JEM, Smith BJ, McCabe G, Brinn MP, et al. Simple aspiration versus intercostal tube drainage for primary spontaneous pneumothorax in adults. Cochrane Database Syst Rev. 2017;9:CD004479.
196. Andrivet P, Djedaini K, Teboul JL, Brochard L, Dreyfuss D. Spontaneous pneumothorax. Comparison of thoracic drainage vs immediate or delayed needle aspiration. Chest. 1995;108(2):335-9.
197. Ayed AK, Chandrasekaran C, Sukumar M. Aspiration versus tube drainage in primary spontaneous pneumothorax: a randomised study. Eur Respir J. 2006;27(3):477-82.
198. Harvey J, Prescott RJ. Simple aspiration versus intercostal tube drainage for spontaneous pneumothorax in patients with normal lungs. British Thoracic Society Research Committee. BMJ. 1994;309(6965):1338-9.
199. Ho KK, Ong ME, Koh MS, Wong E, Raghuram J. A randomized controlled trial comparing minichest tube and needle aspiration in outpatient management of primary spontaneous pneumothorax. Am J Emerg Med. 2011;29(9):1152-7.
200. Noppen M, Alexander P, Driesen P, Slabbynck H, Verstraeten A. Manual aspiration versus chest tube drainage in first episodes of primary spontaneous pneumothorax: a multicenter, prospective, randomized pilot study. Am J Respir Crit Care Med. 2002;165(9):1240-4.
201. Parlak M, Uil SM, van den Berg JW. A prospective, randomised trial of pneumothorax therapy: manual aspiration versus conventional chest tube drainage. Respir Med. 2012;106(11):1600-5.
202. Yadav K, Jalili M, Zehtabchi S. Management of traumatic occult pneumothorax. Resuscitation. 2010;81(9):1063-8.
203. Enderson BL, Abdalla R, Frame SB, Casey MT, Gould H, Maull KI. Tube thoracostomy for occult pneumothorax: a prospective randomized study of its use. J Trauma. 1993;35(5):726-9.
204. Brasel KJ, Stafford RE, Weigelt JA, Tenquist JE, Borgstrom DC. Treatment of occult pneumothoraces from blunt trauma. J Trauma. 1999;46(6):987-90.
205. Ouellet JF, Trottier V, Kmet L, Rizoli S, Laupland K, Ball CG, et al. The OPTICC trial: a multi-institutional study of occult pneumothoraces in critical care. Am J Surg. 2009;197(5):581-6.
206. Kirkpatrick AW, Rizoli S, Ouellet JF, Roberts DJ, Sirois M, Ball CG, et al. Occult pneumothoraces in critical care: a prospective multicenter randomized controlled trial of pleural drainage for mechanically ventilated trauma patients with occult pneumothoraces. J Trauma Acute Care Surg. 2013;74(3):747-54.
207. Zhang M, Teo LT, Goh MH, Leow J, Go KT. Occult pneumothorax in blunt trauma: is there a need for tube thoracostomy? Eur J Trauma Emerg Surg. 2016;42(6):785-90.
208. Llaquet BH, Montmany VS, Rebasa P, Navarro SS. [Results of conservative treatment in patients with occult pneumothorax]. Cir Esp. 2016;94(4):232-6.
209. Rodriguez RM, Canseco K, Baumann BM, Mower WR, Langdorf MI, Medak AJ, et al. Pneumothorax and Hemothorax in the Era of Frequent Chest Computed Tomography for the Evaluation of Adult Patients With Blunt Trauma. Ann Emerg Med. 2019;73(1):58-65.
210. Saricam M, Ozkan B, Turk Y. Management of traumatic pneumothorax in isolated blunt chest trauma. EuRJ. 2019;5(2):306-10.
211. Bou Zein ES, Boyle KA, Dodgion CM, Davis CS, Webb TP, Juern JS, et al. Observing pneumothoraces: The 35-millimeter rule is safe for both blunt and penetrating chest trauma. J Trauma Acute Care Surg. 2019;86(4):557-64.
212. Walker SP, Barratt SL, Thompson J, Maskell NA. Conservative Management in Traumatic Pneumothoraces: An Observational Study. Chest. 2018;153(4):946-53.
213. Carver DA, Bressan AK, Schieman C, Grondin SC, Kirkpatrick AW, Lall R, et al. Management of haemothoraces in blunt thoracic trauma: study protocol for a randomised controlled trial. BMJ Open. 2018;8(3):e020378.
214. Wells BJ, Roberts DJ, Grondin S, Navsaria PH, Kirkpatrick AW, Dunham MB, et al. To drain or not to drain? Predictors of tube thoracostomy insertion and outcomes associated with drainage of traumatic hemothoraces. Injury. 2015;46(9):1743-8.
215. Dennis BM, Bellister SA, Guillamondegui OD. Thoracic Trauma. Surg Clin North Am. 2017;97 (5)(1558-3171 (Electronic)):1047-64.
216. Laan DV, Vu TD, Thiels CA, Pandian TK, Schiller HJ, Murad MH, et al. Chest wall thickness and decompression failure: A systematic review and meta-analysis comparing anatomic locations in needle thoracostomy. Injury. 2016;47(4):797-804.
217. Waydhas C, Sauerland S. Pre-hospital pleural decompression and chest tube placement after blunt trauma: A systematic review. Resuscitation. 2007;72(1):11-25.
218. Ritchie M, Brown C, Bowling M. Chest tubes: Indications, sizing, placement, and management. Clin Pulm Med. 2017;24(1):37-53.
219. Alrahbi R, Easton R, Bendinelli C, Enninghorst N, Sisak K, Balogh ZJ. Intercostal catheter insertion: are we really doing well? ANZ J Surg. 2012;82(6):392-4.
220. Harris A, O’Driscoll BR, Turkington PM. Survey of major complications of intercostal chest drain insertion in the UK. Postgrad Med J. 2010;86(1012):68-72.
221. Jones CW, Rodriguez RD, Griffin RL, McGwin G, Jansen JO, Kerby JD, et al. Complications Associated With Placement of Chest Tubes: A Trauma System Perspective. J Surg Res. 2019;239:98-102.
222. Grabo D, Inaba K, Hammer P, Karamanos E, Skiada D, Martin M, et al. Optimal training for emergency needle thoracostomy placement by prehospital personnel: Didactic teaching versus a cadaver-based training program. J Trauma Acute Care Surg. 2014;77(3 SUPPL. 2):S109-S113.
223. Santos C, Gupta S, Baraket M, Collett PJ, Xuan W, Williamson JP. Outcomes of an initiative to improve inpatient safety of small bore thoracostomy tube insertion. Intern Med J. 2019;49(5):644-9.
224. Kong VY, Oosthuizen GV, Sartorius B, Keene CM, Clarke DL. Correlation between ATLS training and junior doctors’ anatomical knowledge of intercostal chest drain insertion. J Surg Educ. 2015;72(4):600-5.
225. Anderson M, Fitzgerald M, Martin K, Santamaria M, Arendse S, O’Reilly G, et al. A procedural check list for pleural decompression and intercostal catheter insertion for adult major trauma. Injury. 2015;46(1):42-4.
226. Bing F, Fitzgerald M, Olaussen A, Finnegan P, O’Reilly G, Gocentas R, et al. Identifying a safe site for intercostal catheter insertion using the mid-arm point (MAP). JEMTAC. 2017:3.
227. Abood GJ, Davis KA, Esposito TJ, Luchette FA, Gamelli RL. Comparison of routine chest radiograph versus clinician judgment to determine adequate central line placement in critically ill patients. J Trauma. 2007;63(1):50-6.
228. Bowness JS, Nicholls K, Kilgour PM, Ferris J, Whiten S, Parkin I, et al. Finding the fifth intercostal space for chest drain insertion: guidelines and ultrasound. Emerg Med J. 2015;32(12):951-4.
229. Benns MV, Egger ME, Harbrecht BG, Franklin GA, Smith JW, Miller KR, et al. Does chest tube location matter? An analysis of chest tube position and the need for secondary interventions. J Trauma Acute Care Surg. 2015;78(2):386-90.
230. Matsumoto S, Sekine K, Funabiki T, Yamazaki M, Orita T, Shimizu M, et al. Chest tube insertion direction: is it always necessary to insert a chest tube posteriorly in primary trauma care? Am J Emerg Med. 2015;33(1):88-91.
231. Kumar S, Agarwal N, Rattan A, Rathi V. Does intrapleural length and position of the intercostal drain affect the frequency of residual hemothorax? A prospective study from north India. J Emerg Trauma Shock. 2014;7(4):274-9.
232. Dammert P, Pratter M, Boujaoude Z. Safety of ultrasound-guided small-bore chest tube insertion in patients on clopidogrel. J Bronchology Interv Pulmonol. 2013;20(1):16-20.
233. Huber-Wagner S, Korner M, Ehrt A, Kay MV, Pfeifer KJ, Mutschler W, et al. Emergency chest tube placement in trauma care - which approach is preferable? Resuscitation. 2007;72(2):226-33.
234. Curtin JJ, Goodman LR, Quebbeman EJ, Haasler GB. Thoracostomy tubes after acute chest injury: relationship between location in a pleural fissure and function. AJR Am J Roentgenol. 1994;163(6):1339-42.
235. BET 4: does size matter? Chest drains in haemothorax following trauma. Emerg Med J. 2013;30(11):965-7.
236. McCracken D, Psallidas I, Rahman N. Chest drain size: Does it matter? Eurasian J Pulmonol. 2018;20(1):1-6.
237. Inaba K, Lustenberger T, Recinos G, Georgiou C, Velmahos GC, Brown C, et al. Does size matter? A prospective analysis of 28-32 versus 36-40 French chest tube size in trauma. J Trauma Acute Care Surg. 2012;72(2):422-7.
238. Rivera L, O’Reilly EB, Sise MJ, Norton VC, Sise CB, Sack DI, et al. Small catheter tube thoracostomy: effective in managing chest trauma in stable patients. J Trauma. 2009;66(2):393-9.
239. Kulvatunyou N, Joseph B, Friese RS, Green D, Gries L, O’Keeffe T, et al. 14 French pigtail catheters placed by surgeons to drain blood on trauma patients: is 14-Fr too small? J Trauma Acute Care Surg. 2012;73(6):1423-7.
240. Yi JH, Liu HB, Zhang M, Wu JS, Yang JX, Chen JM, et al. Management of traumatic hemothorax by closed thoracic drainage using a central venous catheter. J Zhejiang Univ Sci B. 2012;13(1):43-8.
241. Bauman ZM, Kulvatunyou N, Joseph B, Jain A, Friese RS, Gries L, et al. A Prospective Study of 7-Year Experience Using Percutaneous 14-French Pigtail Catheters for Traumatic Hemothorax/Hemopneumothorax at a Level-1 Trauma Center: Size Still Does Not Matter. World J Surg. 2018;42(1):107-13.
242. Tanizaki S, Maeda S, Sera M, Nagai H, Hayashi M, Azuma H, et al. Small tube thoracostomy (20-22 Fr) in emergent management of chest trauma. Injury. 2017;48(9):1884-7.
243. Kulvatunyou N, Erickson L, Vijayasekaran A, Gries L, Joseph B, Friese RF, et al. Randomized clinical trial of pigtail catheter versus chest tube in injured patients with uncomplicated traumatic pneumothorax. Br J Surg. 2014;101(2):17-22.
244. Vivas D, Roldán I, Ferrandis R, Marín F, Roldán V, Tello-Montoliu A, et al. Manejo perioperatorio y periprocedimiento del tratamiento antitrombótico: documento de consenso de SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH, SETH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENEC, SEO, SEPA, SERVEI, SECOT y AEU. Rev Esp Cardiol. 2018;71(7):553-64.
245. Pathak V, Allender JE, Grant MW. Management of anticoagulant and antiplatelet therapy in patients undergoing interventional pulmonary procedures. Eur Respir Rev. 2017;26(145). 246. Herman DD, Thomson CC, Brosnhan S, Patel R, Trosini-Desert V, Bilaceroglu S, et al. Risk of bleeding in patients undergoing pulmonary procedures on antiplatelet or anticoagulants: A systematic review. Respir Med. 2019;153:76-84.
247. Wolfe KS, Kress JP. Risk of Procedural Hemorrhage. Chest. 2016;150(1):237-46.
248. Dongel I, Coskun A, Ozbay S, Bayram M, Atli B. Management of thoracic trauma in emergency service: Analysis of 1139 cases. Pak J Med Sci. 2013;29(1):58-63.
249. Ferrera PC, Bartfield JM. Outcomes of anticoagulated trauma patients. Am J Emerg Med. 1999;17(2):154-6.
250. Bhattacharya B, Maung A, Schuster K, Davis KA. The older they are the harder they fall: Injury patterns and outcomes by age after ground level falls. Injury. 2016;47(9):1955-9.
251. Pieracci FM, Eachempati SR, Shou J, Hydo LJ, Barie PS. Use of long-term anticoagulation is associated with traumatic intracranial hemorrhage and subsequent mortality in elderly patients hospitalized after falls: analysis of the New York State Administrative Database. J Trauma. 2007;63(3):519-24.
252. Bonville DJ, Ata A, Jahraus CB, Arnold-Lloyd T, Salem L, Rosati C, et al. Impact of preinjury warfarin and antiplatelet agents on outcomes of trauma patients. Surgery. 2011 Oct;150(4):861-8.
253. Hossri S, Ghanem S, Saouma S, Atanassov K. Impact of preinjury anticoagulation with warfarin on outcomes of adult trauma patients: Experience of a level 1 trauma center. Am Surg. 2017 Jun 1;83(6):e202-4.
254. Battle C, Hutchings H, Bouamra O, Evans PA. The effect of pre-injury anti-platelet therapy on the development of complications in isolated blunt chest wall trauma: a retrospective study. PLoS One. 2014;9(3):e91284.
255. Racine S, Emond M, Audette-Cote J-S, Sage NL, Guimont C, Moore L, et al. Delayed complications and functional outcome of isolated sternal fracture after emergency department discharge: A prospective, multicentre cohort study. CJEM. 2016;18(5):349-57.
256. Plourde M, mond ME, Lavoie A, Guimont C, Le SN, Chauny J-M, et al. Cohort study on the prevalence and risk factors for delayed pulmonary complications in adults following minor blunt thoracic trauma. CJEM. 2014;16(2):136-43.
257. Havelock T, Teoh R, Laws D, Gleeson F. Pleural procedures and thoracic ultrasound: British Thoracic Society Pleural Disease Guideline. 2010. Thorax 2010;65 Suppl 2:ii61-ii76.
258. Mahmood I, Tawfeek Z, El-Menyar A, Zarour A, Afifi I, Kumar S, et al. Outcome of concurrent occult hemothorax and pneumothorax in trauma patients who required assisted ventilation. Emerg Med Int. 2015;2015:859130.
259. Kahn SA, Schubmehl H, Stassen NA, Sangosanya A, Cheng JD, Gestring ML, et al. Risk factors associated with venous thromboembolism in isolated blunt chest trauma. Am Surg. 2013;79(5):502-5.
260. Agostini P, Calvert R, Subramanian H, Naidu B. Is incentive spirometry effective following thoracic surgery? Interact Cardiovasc Thorac Surg. 2008;7(2):297-300.
261. Carvalho CR, Paisani DM, Lunardi AC. Incentive spirometry in major surgeries: a systematic review. Rev Bras Fisioter. 2011;15(5):343-50.
262. Rodriguez-Larrad A, Lascurain-Aguirrebena I, Abecia-Inc, Seco J. Perioperative physiotherapy in patients undergoing lung cancer resection. Interact Cardiovasc Thorac Surg. 2014;19(2):269-81.
263. Unsworth A, Curtis K, Asha SE. Treatments for blunt chest trauma and their impact on patient outcomes and health service delivery. Scand J Trauma, Resusc Emerg Med. 2015;23:17.
264. Gosselink R, Schrever K, Cops P, Witvrouwen H, De LP, Troosters T, et al. Incentive spirometry does not enhance recovery after thoracic surgery. Crit Care Med. 2000 Mar;28(3):679-83.
265. Vilaplana J, Sabate A, Ramon R, Gasolibe V, Villalonga R. [Ineffectiveness of incentive spirometry as coadjuvant of conventional physiotherapy for the prevention of postoperative respiratory complications after thoracic and esophageal surgery]. Rev Esp Anestesiol Reanim. 1990;37(6):321-5.
266. Weiner P, Man A, Weiner M, Rabner M, Waizman J, Magadle R, et al. The effect of incentive spirometry and inspiratory muscle training on pulmonary function after lung resection. J Thorac Cardiovasc Surg. 1997;113(3):552-7.
267. Varela G, Ballesteros E, Jimenez MF, Novoa N, Aranda JL. Cost-effectiveness analysis of prophylactic respiratory physiotherapy in pulmonary lobectomy. Eur J Cardiothorac Surg. 2006;29(2):216-20.
268. Agostini P, Naidu B, Cieslik H, Steyn R, Rajesh PB, Bishay E, et al. Effectiveness of incentive spirometry in patients following thoracotomy and lung resection including those at high risk for developing pulmonary complications. Thorax. 2013;68(6):580-5.
269. Arbane G, Tropman D, Jackson D, Garrod R. Evaluation of an early exercise intervention after thoracotomy for non-small cell lung cancer (NSCLC), effects on quality of life, muscle strength and exercise tolerance: randomised controlled trial. Lung Cancer. 2011;71(2):229-34.
270. Reeve JC, Nicol K, Stiller K, McPherson KM, Birch P, Gordon IR, et al. Does physiotherapy reduce the incidence of postoperative pulmonary complications following pulmonary resection via open thoracotomy? A preliminary randomised single-blind clinical trial. Eur J Cardiothorac Surg. 2010;37(5):1158-66.
271. Senekal M, Eales C, Becker PJ. Penetrating stab wounds of the chest--when should chest physiotherapy commence? A comparative study. S Afr J Surg. 1995;33(2):61-6.
272. Ngubane C, de Charmoy T, Eales S. The treatment of stabbed chests at Ngwelezana Hospital, Kwazulu-Natal. S Afr J Physiother. 1999;55(1):23-5.
273. Rodriguez-Larrad A, Vellosillo-Ortega JM, Ruiz-Muneta C, Abecia-Inc, Seco J. Postoperative Respiratory Exercises Reduce the Risk of Developing Pulmonary Complications in Patients Undergoing Lobectomy. Arch. Bronconeumol. 2016;52(7):347-53.
274. Gunay S, Eser I, Ozbey M, Agar M, Koruk I, Kurkcuoglu IC. Evaluation of two different respiratory physiotherapy methods after thoracoscopy with regard to arterial blood gas, respiratory function test, number of days until discharge, cost analysis, comfort and pain control. Niger J Clin Pract. 2016;19(3):353-8.
275. Malik PRA, Fahim C, Vernon J, Thomas P, Schieman C, Finley CJ, et al. Incentive Spirometry After Lung Resection: A Randomized Controlled Trial. Ann Cardiothorac Surg. 2018;106(2):340-5.
276. Paisani DM, Lunardi AC, da Silva CC, Porras DC, Tanaka C, Carvalho CR. Volume rather than flow incentive spirometry is effective in improving chest wall expansion and abdominal displacement using optoelectronic plethysmography. Respir Care. 2013;58(8):1360-6.
277. Yamaguti WP, Sakamoto ET, Panazzolo D, Peixoto CC, Cerri GG, Albuquerque AL. Diaphragmatic mobility in healthy subjects during incentive spirometry with a flow-oriented device and with a volume-oriented device. J Bras Pneumol. 2010;36(6):738-45.
278. Tomich GM, Franca DC, Diorio AC, Britto RR, Sampaio RF, Parreira VF. Breathing pattern, thoracoabdominal motion and muscular activity during three breathing exercises. Braz J Med Biol Res. 2007;40(10):1409-17.
279. Lunardi AC, Porras DC, Barbosa RC, Paisani DM, Marques da Silva CC, Tanaka C, et al. Effect of volume-oriented versus flow-oriented incentive spirometry on chest wall volumes, inspiratory muscle activity, and thoracoabdominal synchrony in the elderly. Respir Care. 2014;59(3):420-6.
280. Pascotini FS, Ramos MC, Silva AM, Trevisan ME. Incentive spirometry volume-oriented versus flow-oriented on respiratory parameters in elderly people. Fisioter. Pesqui. [Internet]. 2013 [cited 2020 Mar 06]; 20(4):355-60. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1809-29502013000400009&lng=en. https://doi.org/10.1590/S1809-29502013000400009.
281. Lu MS, Huang YK, Liu YH, Liu HP, Kao CL. Delayed pneumothorax complicating minor rib fracture after chest trauma. Am J Emerg Med. 2008;26(5):551-4.
282. Misthos P, Kakaris S, Sepsas E, Athanassiadi K, Skottis I. A prospective analysis of occult pneumothorax, delayed pneumothorax and delayed hemothorax after minor blunt thoracic trauma. Eur J Cardiothorac Surg. 2004;25(5):859-64.
283. Emond M, Guimont C, Chauny JM, Daoust R, Bergeron E, Vanier L, et al. Clinical prediction rule for delayed hemothorax after minor thoracic injury: a multicentre derivation and validation study. CMAJ Open 2017;5(2):E444-E453.
284. Daoust R, Emond M, Bergeron E, LeSage N, Camden S, Guimont C, et al. Risk factors of significant pain syndrome 90 days after minor thoracic injury: trajectory analysis. Acad Emerg Med. 2013;20(11):1139-45.
285. Emond M, Sirois MJ, Guimont C, Chauny JM, Daoust R, Bergeron E, et al. Functional Impact of a Minor Thoracic Injury: An Investigation of Age, Delayed Hemothorax, and Rib Fracture Effects. Ann Surg. 2015;262(6):1115-22.
286. Simon BJ, Chu Q, Emhoff TA, Fiallo VM, Lee KF. Delayed hemothorax after blunt thoracic trauma: An uncemmon entity with significant morbidity. J Trauma Inj Infect Crit Care. 1998;45(4):673-6.
287. Sharma OP, Hagler S, Oswanski MF. Prevalence of delayed hemothorax in blunt thoracic trauma. Am Surg. 2005;71(6):481-6.
288. Adhikari N, Burns KE, Meade MO. Pharmacologic therapies for adults with acute lung injury and acute respiratory distress syndrome. Cochrane Database Syst Rev. 2004;(4):CD004477.
289. Wu X, Li S, Zhang J, Zhang Y, Han L, Deng Q, et al. Meta-analysis of high doses of ambroxol treatment for acute lung injury/acute respiratory distress syndrome based on randomized controlled trials. J Clin Pharmacol. 2014;54(11):1199-206.
290. Artigas A, Camprubi-Rimblas M, Tantinya N, Bringue J, Guillamat-Prats R, Matthay MA. Inhalation therapies in acute respiratory distress syndrome. Ann Transl Med. 2017;5(14):293.
291. Matthay MA, Brower RG, Carson S, Douglas IS, Eisner M, Hite D, et al. Randomized, placebo-controlled clinical trial of an aerosolized beta(2)-agonist for treatment of acute lung injury. Am J Respir Crit Care Med. 2011;184(5):561-8.
292. Gao SF, Perkins GD, Gates S, Young D, McAuley DF, Tunnicliffe W, et al. Effect of intravenous beta-2 agonist treatment on clinical outcomes in acute respiratory distress syndrome (BALTI-2): a multicentre, randomised controlled trial. Lancet. 2012;379(9812):229-35.
293. Festic E, Carr GE, Cartin-Ceba R, Hinds RF, Banner-Goodspeed V, Bansal V, et al. Randomized Clinical Trial of a Combination of an Inhaled Corticosteroid and Beta Agonist in Patients at Risk of Developing the Acute Respiratory Distress Syndrome. Crit Care Med. 2017;45(5):798-805.
294. Meaudre E, Goutorbe P, Boret H, Kaiser E, Salinier L, Cantais E, et al. Nitric oxide inhalation is useful in the management of right ventricular failure caused by myocardial contusion. Acta Anaesthesiol Scand. 2005;49(3):415-7.
295. Johannigman JA, Campbell RS, Davis K, Jr., Hurst JM. Combined differential lung ventilation and inhaled nitric oxide therapy in the management of unilateral pulmonary contusion. J Trauma. 1997;42(1):108-11.
296. Barrera LM, Perel P, Ker K, Cirocchi R, Farinella E, Morales Uribe CH. Thromboprophylaxis for trauma patients. Cochrane Database Syst Rev. 2013; (3):CD008303.
297. Haut ER, Garcia LJ, Shihab HM, Brotman DJ, Stevens KA, Sharma R, et al. The effectiveness of prophylactic inferior vena cava filters in trauma patients: a systematic review and meta-analysis. JAMA Surg. 2014;149(2):194-202.
298. Singh S, Haut ER, Brotman DJ, Sharma R, Chelladurai Y, Shermock KM, et al. Pharmacologic and Mechanical Prophylaxis of Venous Thromboembolism Among Special Populations [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US). 2013. Report No.: 13-EHC082-1.
299. Anglen JO, Bagby C, George R. A randomized comparison of sequential-gradient calf compression with intermittent plantar compression for prevention of venous thrombosis in orthopedic trauma patients: preliminary results. Am J Orthop (Belle Mead NJ). 1998;27(1):53-8.
300. Cohn SM, Moller BA, Feinstein AJ, Burns GA, Ginzburg E, Hammers LW. Prospective trial of low-molecular-weight heparin versus unfractionated heparin in moderately injured patients. Vascular Surgery. 1999;33(2):219-23.
301. Dennis JW, Menawat S, Von TJ, Fallon WF, Jr., Vinsant GO, Laneve LM, et al. Efficacy of deep venous thrombosis prophylaxis in trauma patients and identification of high-risk groups. J Trauma. 1993;35(1):132-8.
302. Elliott CG, Dudney TM, Egger M, Orme JF, Clemmer TP, Horn SD, et al. Calf-thigh sequential pneumatic compression compared with plantar venous pneumatic compression to prevent deep-vein thrombosis after non-lower extremity trauma. J Trauma. 1999;47(1):25-32.
303. Fisher CG, Blachut PA, Salvian AJ, Meek RN, O’Brien PJ. Effectiveness of pneumatic leg compression devices for the prevention of thromboembolic disease in orthopaedic trauma patients: a prospective, randomized study of compression alone versus no prophylaxis. J Orthop Trauma. 1995;9(1):1-7.
304. Fuchs S, Heyse T, Rudofsky G, Gosheger G, Chylarecki C. Continuous passive motion in the prevention of deep-vein thrombosis: a randomised comparison in trauma patients. J Bone Joint Surg Br. 2005;87(8):1117-22.
305. Geerts WH, Jay RM, Code KI, Chen E, Szalai JP, Saibil EA, et al. A comparison of low-dose heparin with low-molecular-weight heparin as prophylaxis against venous thromboembolism after major trauma. N Engl J Med. 1996;335(10):701-7.
306. Ginzburg E, Cohn SM, Lopez J, Jackowski J, Brown M, Hameed SM. Randomized clinicaltrial of intermittent pneumatic compression and low molecular weight heparin in trauma. Br J Surg. 2003;90(11):1338-44.
307. Knudson MM, Collins JA, Goodman SB, McCrory DW. Thromboembolism following multiple trauma. J Trauma. 1992;32(1):2-11.
308. Knudson MM, Lewis FR, Clinton A, Atkinson K, Megerman J. Prevention of venous thromboembolism in trauma patients. J Trauma. 1994;37(3):480-7.
309. Knudson MM, Morabito D, Paiement GD, Shackleford S. Use of low molecular weight heparin in preventing thromboembolism in trauma patients. J Trauma. 1996;41(3):446-59.
310. Kurtoglu M, Yanar H, Bilsel Y, Guloglu R, Kizilirmak S, Buyukkurt D, et al. Venous thromboembolism prophylaxis after head and spinal trauma: intermittent pneumatic compression devices versus low molecular weight heparin. World J Surg. 2004;28(8):807-11.
311. Stannard JP, Riley RS, McClenney MD, Lopez-Ben RR, Volgas DA, Alonso JE. Mechanical prophylaxis against deep-vein thrombosis after pelvic and acetabular fractures. J Bone Joint Surg Am. 2001;83(7):1047-51.
312. Stannard JP, Lopez-Ben RR, Volgas DA, Anderson ER, Busbee M, Karr DK, et al. Prophylaxis against deep-vein thrombosis following trauma: a prospective, randomized comparison of mechanical and pharmacologic prophylaxis. J Bone Joint Surg Am. 2006;88(2):261-6.
313. Velmahos GC, Petrone P, Chan LS, Hanks SE, Brown CV, Demetriades D. Electrostimulation for the prevention of deep venous thrombosis in patients with major trauma: a prospective randomized study. Surgery. 2005;137(5):493-8.
314. Yanar H, Kurtoglu M, Taviloglu K, Guloglu R, Ertekin C. Is intermittent pneumatic compression make low molecular weight heparin more efficient in the prophylaxis of venous thromboembolism in trauma patients. Eur J Trauma Emerg S. 2007;33((3 Suppl 2)):79-80.
315. Rogers FB, Cipolle MD, Velmahos G, Rozycki G, Luchette FA. Practice management guidelines for the prevention of venous thromboembolism in trauma patients: the EAST practice management guidelines work group. J Trauma. 2002;53(1):142-64.
316. Kahn SR, Lim W, Dunn AS, Cushman M, Dentali F, Akl EA, et al. Prevention of VTE in nonsurgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2 Suppl):e195S-e226S.
317. Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samama CM, Lassen MR, et al. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133(6 Suppl):381S-453S.
318. Li Q, Dai B, Xu J, Yao Y, Song K, Zhang H, et al. Can patients with femoral neck fracture benefit from preoperative thromboprophylaxis? A prospective randomized controlled trial. Medicine (Baltimore). 2017;96(29):e7604.
319. Lu JP, Knudson MM, Bir N, Kallet R, Atkinson K. Fondaparinux for prevention of venous thromboembolism in high-risk trauma patients: a pilot study. J Am Coll Surg. 2009;209(5):589-94.
320. Olson EJ, Bandle J, Calvo RY, Shackford SR, Dunne CE, Van Gent JM, et al. Heparin versus enoxaparin for prevention of venous thromboembolism after trauma: A randomized noninferiority trial. J Trauma Acute Care Surg. 2015;79(6):961-8.
321. Brasel KJ, Moore EE, Albrecht RA, deMoya M, Schreiber M, Karmy-Jones R, et al. Western Trauma Association Critical Decisions in Trauma: Management of rib fractures. J Trauma Acute Care Surg. 2017;82(1):200-3.
322. Duch P, Moller MH. Epidural analgesia in patients with traumatic rib fractures: a systematic review of randomised controlled trials. Acta Anaesthesiol Scand. 2015;59(6):698-709.
323. Peek J, Smeeing DPJ, Hietbrink F, Houwert RM, Marsman M, de Jong MB. Comparison of analgesic interventions for traumatic rib fractures: a systematic review and meta-analysis. Eur J Trauma Emerg Surg. 2019;45(4):597-622.
324. Galvagno SM, Jr., Smith CE, Varon AJ, Hasenboehler EA, Sultan S, Shaefer G, et al. Pain management for blunt thoracic trauma: A joint practice management guideline from the Eastern Association for the Surgery of Trauma and Trauma Anesthesiology Society. J Trauma Acute Care Surg. 2016;81(5):936-51.
325. Yeying G, Liyong Y, Yuebo C, Yu Z, Guangao Y, Weihu M, et al. Thoracic paravertebral block versus intravenous patient-controlled analgesia for pain treatment in patients with multiple rib fractures. J Int Med Res. 2017;45(6):2085-91.
326. Ullman DA, Fortune JB, Greenhouse BB, Wimpy RE, Kennedy TM. The treatment of patients with multiple rib fractures using continuous thoracic epidural narcotic infusion. Reg Anesth . 1989;14(1):43-7.
327. Mackersie RC, Karagianes TG, Hoyt DB, Davis JW. Prospective evaluation of epidural and intravenous administration of fentanyl for pain control and restoration of ventilatory function following multiple rib fractures. J Trauma. 1991;31(4):443-9.
328. Ahmed S, Athar M, Ali S, Doley K, Sidiqqi O, Usmani H. Acute pain services in flail chest-a prospective randomized trial of epidural versus parenteral analgesia in mechanically ventilated ICU patients. Egypt. J. Anaesth. 2015;31(4):327-30.
329. Bulger EM, Edwards T, Klotz P, Jurkovich GJ. Epidural analgesia improves outcome after multiple rib fractures. Surgery. 2004;136(2):426-30.
330. Sahin S, Uckunkaya N, Soyal S, Haci I. The role of epidural continuous pain treatment on duration of intubation, ventilation and ICU stay in flail chest patients. Agri Dergisi. 1993;5(4):18-20.
331. Moon MR, Luchette FA, Gibson SW, Crews J, Sudarshan G, Hurst JM, et al. Prospective, randomized comparison of epidural verss parenteral opioid analgesia in thoracic trauma. Ann Surg. 1999;229(5):684-91.
332. Pierre E, Martin P, Frohock J, Varon A, Barquist E. Lumbar Epidural Morphine Versus Patient-Controlled Analgesia Morphine in Patients with Multiple Rib Fractures. Anesthesiology. 2005;103:A289.
333. Gabram SG, Schwartz RJ, Jacobs LM, Lawrence D, Murphy MA, Morrow JS, et al. Clinical management of blunt trauma patients with unilateral rib fractures: a randomized trial. World J Surg 1995;19(3):388-93.
334. Singh S, Jacob M, Hasnain S, Krishnakumar M. Comparison between continuous thoracic epidural block and continuous thoracic paravertebral block in the management of thoracic trauma. Med J Armed Forces India. 2017;73(2):146-51.
335. Mohta M, Verma P, Saxena AK, Sethi AK, Tyagi A, Girotra G. Prospective, randomized comparison of continuous thoracic epidural and thoracic paravertebral infusion in patients with unilateral multiple fractured ribs--a pilot study. J Trauma. 2009;66(4):1096-101.
336. Luchette FA, Radafshar SM, Kaiser R, Flynn W, Hassett JM. Prospective evaluation of epidural versus intrapleural catheters for analgesia in chest wall trauma. J Trauma. 1994 ;36(6):865-9.
337. Shinohara K, Iwama H, Akama Y, Tase C. Interpleural block for patients with multiple rib fractures: comparison with epidural block. J Emerg Med. 1994;12(4):441-6.
338. Hashemzadeh S, Hashemzadeh K, Hosseinzadeh H, Aligholipour MR, Golzari SE. Comparison thoracic epidural and intercostal block to improve ventilation parameters and reduce pain in patients with multiple rib fractures. J Cardiovasc Thorac Res. 2011;3(3):87-91.
339. Davies RG, Myles PS, Graham JM. A comparison of the analgesic efficacy and side-effects of paravertebral vs epidural blockade for thoracotomy--a systematic review and meta-analysis of randomized trials. Br J Anaesth. 2006;96(4):418-26.
340. Radresa O, Chauny J-M, Lavigne G, Piette E, Paquet J, Daoust R. Current views on acute to chronic pain transition in post-traumatic patients: Risk factors and potential for pre-emptive treatments. J Trauma Acute Care Surg. 2014 Apr;76(4):1142-50.
341. Baker E, Xyrichis A, Norton C, Hopkins P, Lee G. The long-term outcomes and health-related quality of life of patients following blunt thoracic injury: a narrative literature review. Scand J Trauma Resusc Emerg Med. 2018;26(1):67.
342. Fabricant L, Ham B, Mullins R, Mayberry J. Prolonged pain and disability are common after rib fractures. Am J Surg. 2013;205(5):511-5.
343. Kerr-Valentic MA, Arthur M, Mullins RJ, Pearson TE, Mayberry JC. Rib fracture pain and disability: can we do better? J Trauma. 2003;54(6):1058-63.
344. Battle CE, Young K, Evans PA. Chronic pain in blunt chest wall trauma: A pilot study. Trauma (United Kingdom). 2016;18(4):261-5.






