Para la elaboración de la Guía de Práctica Clínica (GPC) se ha seguido el Manual metodológico «Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. (Actualización 2016)» (5), que puede ser consultado en la página Web de la Biblioteca de GPC del SNS, GuíaSalud (disponible en: https://portal.guiasalud.es/egpc/manual-elaboracion-introduccion/).
Los pasos que se han seguido son los siguientes:
3.1. Constitución del grupo elaborador de la Guía
El grupo elaborador de la guía (GEG) está integrado por un equipo multidisciplinar que cuenta con 10 expertos de diferentes especialidades relacionadas con el manejo del traumatismo torácico del ámbito hospitalario (cuatro cirujanos torácicos, una médica intensivista, una radióloga, una médica de urgencias, un médico anestesista, una médica rehabilitadora y un médico internista). El grupo lo completan dos expertos en metodología de elaboración de guías y una documentalista del Servicio de Evaluación de Tecnologías Sanitarias del País Vasco (Osteba).
Todas las personas que forman parte del GEG declararon por escrito los posibles conflictos de interés antes del inicio de la guía.
3.2. Selección de preguntas clínicas a responder
Para definir la estructura y las preguntas que se iban a formular en la guía, el grupo elaborador realizó dos reuniones presenciales y varias consultas por correo electrónico.
En una reunión inicial con el líder clínico de la guía, se elaboró un borrador con el listado de preguntas clínicas que podían ser abordadas. Este listado se envió vía email a todos los miembros del grupo elaborador y se realizó una primera reunión presencial para su discusión. Una vez realizadas las modificaciones propuestas por el grupo elaborador, se realizó una consulta vía email a los colaboradores expertos de la guía. Los comentarios recibidos fueron enviados a los miembros del grupo elaborador, y en una segunda reunión presencial, se definieron la estructura final de la guía (que iba a constar de seis capítulos) y las preguntas clínicas a incluir en la misma (un total de 36 preguntas clínicas).
El grupo elaborador de la guía respondió a todos los comentarios recibidos por parte de los colaboradores expertos. Las respuestas a estos comentarios se pueden consultar en el documento metodológico de la guía (https://portal.guiasalud.es/gpc/).
3.3. Estrategia metodológica utilizada para responder a las preguntas clínicas
Los pasos que se han seguido para poder responder a las preguntas clínicas planteadas se detallan a continuación.
3.3.1. Formulación de las preguntas en formato PICO
Las preguntas se han formulado siguiendo el formato PICO: P (pacientes), I (intervenciones), C (comparaciones) y O (outcomes o resultados).
3.3.2. Definición y valoración de los desenlaces críticos
Siguiendo la metodología del Grading of Recommendations Assessment, Development and Evaluation (GRADE) working group, el GEG ha definido los desenlaces que consideraba de interés para cada pregunta y ha valorado su importancia en una escala del 1 al 9 (de menos a más importante) (6;7).
3.3.3. Revisión y evaluación de la literatura
Búsqueda de guías, revisiones sistemáticas y estudios individuales
Para la búsqueda y revisión de la literatura, se ha utilizado una estrategia mixta escalonada que consta de las siguientes fases:
- Búsqueda de GPC sobre manejo de traumatismo torácico, a nivel nacional e internacional, para utilizarlas como revisiones sistemáticas (RS).
- Búsqueda de RS actuales y/o informes de evaluación que respondan de forma consistente a las preguntas planteadas y desde la publicación de las guías seleccionadas.
- Búsqueda de estudios originales específicos para cada pregunta cuando no se hayan encontrado estudios secundarios o cuando se debe analizar si se han publicado nuevos estudios desde la fecha de publicación de los estudios secundarios identificados.
El abordaje de cada pregunta clínica ha dependido de si las guías identificadas incluían la pregunta o de la existencia de RS que respondieran a la misma.
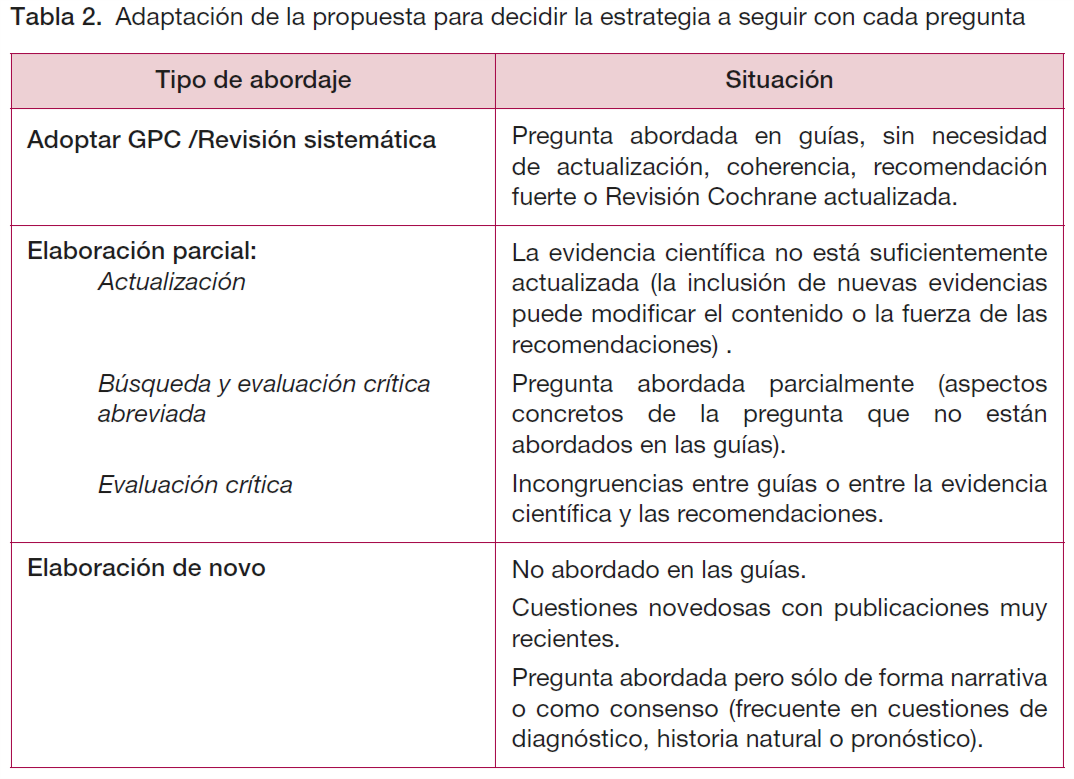
La búsqueda de GPC se ha realizado en las bases de datos de la National Guideline Clearinghouse (NGC), Guideline International Network (GIN), Tripdatabase, NICE y GuiaSalud.
En relación a los informes de evaluación, revisiones, y estudios originales, se han consultado las bases de la Cochrane Library, Centre for Reviews and Disseminations (CRD) y las bases de datos de Medline y Embase, Cinahl y PsyINFO. Además de las bases consultadas, también se han realizado búsquedas con texto libre y se han recogido las aportaciones bibliográficas realizadas por el grupo de trabajo, así como las aportaciones de los colaboradores expertos.
Las palabras clave y las estrategias de búsqueda utilizadas se encuentran disponibles en el documento metodológico disponible en la sección del Programa de Guías de Práctica Clínica del SNS del Portal de GuiaSalud (https://portal.guiasalud.es/gpc/).
Evaluación de la calidad de la literatura
La evaluación de la calidad de las GPC encontradas se ha realizado por pares y mediante el instrumento AGREE II (http://www.agreetrust.org/resource-centre/agree-ii/).
La evaluación de la calidad de las RS encontradas se ha realizado utilizando el Assessment of Multiple Systematic Reviews (AMSTAR) (http://www.biomedcentral.com/1471-2288/7/10/table/T2). En cuanto a los estudios individuales, el riesgo de sesgo en el diseño y ejecución de los estudios se ha valorado con diferentes herramientas, dependiendo del diseño de los estudios a evaluar. Para los ensayos clínicos aleatorizado (ECA) se ha utilizado el Risk of bias propuesto por la colaboración Cochrane; para las preguntas de tipo diagnóstico, la herramienta QUADAS, y para estudios de cohortes o casos controles, la escala Newcastle-Ottawa Quality Assessment Scale. En caso de ser necesario, la evaluación de los estudios de caso se realizó con el checklist de la guía del grupo Case reports (CARE).
3.3.4. Evaluación y síntesis de la evidencia
La evaluación de la calidad y síntesis de la evidencia se ha realizado siguiendo la metodología del Grupo GRADE (8-22).
La evidencia científica encontrada para cada pregunta se ha sintetizado por desenlace de interés. Para ello, el grupo elaborador de la guía ha definido y valorado de forma previa cuáles serían los desenlaces que son de interés para los pacientes con traumatismo torácico cerrado no grave (TTCNG).
Cuando se trata de preguntas de tipo intervención, el grupo GRADE considera que los ECA proporcionan evidencia de “calidad alta” y los estudios observacionales de “calidad baja”. No obstante, también se sugieren una serie de criterios que pueden disminuir la calidad de la evidencia proporcionada por los ECA, así como aumentar la de los estudios observacionales.
Los criterios que pueden disminuir la calidad de la evidencia de los ECA son los siguientes:
- Limitaciones en el diseño o ejecución del ECA: la ausencia de ocultamiento de la secuencia de aleatorización, un enmascaramiento inadecuado, la existencia de pérdidas importantes o la ausencia de análisis por intención de tratar, entre otros, pueden hacer disminuir la confianza que tenemos en los resultados presentados en los ECA.
- Resultados inconsistentes: si los estudios presentan estimaciones del efecto de un tratamiento muy dispares (heterogeneidad o variabilidad entre los estudios), esas diferencias pueden deberse a que los estudios incluyen poblaciones diferentes o que existan diferencias en la intervención, los desenlaces de interés o la calidad de los estudios. Por ello, cuando existe heterogeneidad entre los estudios y ésta no puede explicarse de manera razonable, la confianza que se tiene en la estimación global del efecto disminuye.
- Ausencia de evidencia científica directa: en caso de ausencia de comparaciones directas entre dos tratamientos (existen estudios que comparan cada tratamiento frente a placebo, pero no estudios que comparen ambos tratamientos entre sí) o la extrapolación de los resultados de un estudio, por ejemplo, con un determinado fármaco al resto de fármacos de su misma familia cuando no está demostrado un efecto de clase, también se considera evidencia científica indirecta. Asimismo, es frecuente que existan grandes diferencias entre la población en la que se van a aplicar las recomendaciones y la incluida en los estudios evaluados. Por último, deben ser también valorados los aspectos de la potencial aplicabilidad en nuestro entorno o la validez externa de la evidencia científica disponible. Todos estos aspectos pueden hacer bajar la confianza en la estimación del efecto por ausencia de evidencia directa.
- Imprecisión: cuando los estudios disponibles incluyen relativamente pocos eventos y pocos pacientes y, por tanto, presentan intervalos de confianza amplios, la confianza que tenemos en la estimación del efecto puede disminuir.
- Sesgo de notificación: en este caso la calidad o la confianza que se tiene en la estimación global del efecto puede disminuir si existe una duda razonable sobre la inclusión por parte de los autores de todos los estudios que existen (por ejemplo, el sesgo de publicación en el contexto de una RS) o si han incluido o no los resultados de todos los desenlaces relevantes (outcome reporting bias).
Por otro lado, los criterios que pueden aumentar la confianza en los resultados de los estudios observacionales son los siguientes:
- Efecto importante: cuando se observa una asociación fuerte (RR > 2 o < 0,5) o muy fuerte (RR > 5 o < 0,2) y consistente, (obtenida de estudios que no tienen factores de confusión), la confianza que se tiene en la estimación del efecto puede aumentar de baja a moderada, o incluso a alta.
- La presencia de un gradiente dosis-respuesta puede llevar a aumentar la confianza en la estimación global del efecto.
- Situaciones en las que todos los posibles factores de confusión podrían haber reducido la asociación observada: por ejemplo, cuando los pacientes que reciben la intervención de interés presentan un peor pronóstico y, aun así, presentan mejores resultados que el grupo control, es probable que el efecto observado real sea mayor que el efecto descrito, por lo que se podría aumentar la calidad de la evidencia a favor de la intervención.
En base a la valoración de todos esos criterios, la calidad o la confianza en la evidencia para cada desenlace de interés se clasifica como muy baja, baja, moderada o alta.
En el texto de la guía, la calidad de la evidencia para cada desenlace de interés se presenta en el margen derecho.
La calidad global de la evidencia en la que se fundamenta cada pregunta clínica depende de la calidad de cada desenlace individual considerado crítico para esa pregunta. Así, en principio, la calidad global vendrá definida por del desenlace crítico para el que se obtenga el nivel de evidencia más bajo.
3.3.5. Formulación de las recomendaciones
Para la elaboración de las recomendaciones se ha seguido el marco estructurado de GRADE denominado EtR- de la Evidencia a la Recomendación, en el que se tienen en cuenta los siguientes factores:
- Balance entre beneficios y riesgos: Para realizar una adecuada valoración del balance entre los beneficios y los riesgos es necesario tener en cuenta el riesgo basal de la población a la que va dirigida la recomendación, y el efecto tanto en términos relativos como absolutos.
- Calidad de la evidencia científica: antes de llevar a cabo una recomendación es necesario conocer la confianza en la estimación del efecto observado. Si la calidad de la evidencia científica no es alta, la confianza en los resultados disminuye y también por ello disminuiría la fuerza con la que se lleve a cabo una recomendación.
- Utilización de recursos: a diferencia de otros desenlaces de interés, los costes son variables en el tiempo, lugar y otros condicionantes. Un coste elevado disminuirá probablemente la fuerza de una recomendación, por lo que el contexto es crítico en la valoración final.
- Equidad, aceptabilidad y factibilidad: la incertidumbre sobre los valores y las preferencias de la población diana a la cual va dirigida la GPC será otro de los factores a tener en cuenta. El personal sanitario, el colectivo de pacientes o la sociedad en general deben ver reflejados sus valores y sus preferencias, lo que influirá en la graduación de las recomendaciones.
Así, las recomendaciones que se formulan pueden ser fuertes o débiles, dependiendo principalmente de la confianza que tiene el GEG en la evidencia identificada. En ambos casos, las recomendaciones pueden ser a favor o en contra de lo considerado en la pregunta clínica.
Para las intervenciones de las que no se dispone de evidencia y el grupo elaborador quiere resaltar un determinado aspecto, se formulan recomendaciones basadas en la experiencia clínica y el consenso del grupo elaborador, que se han identificado con el símbolo √.
3.3.6. Aspectos a tener en cuenta en preguntas de tipo diagnóstico
GRADE considera que el mejor diseño de estudio que puede demostrar la utilidad de una prueba diagnóstica es un ensayo clínico que distribuya de forma aleatoria los pacientes entre el grupo experimental (al que se aplica la prueba diagnóstica a estudio) y el grupo control (al que se le aplica la prueba estándar), y que mida el efecto sobre los desenlaces clínicos importantes para el paciente. Cuando se cuenta con este tipo de estudios, GRADE indica que se aplique el marco para preguntas de tipo intervención. Sin embargo, en la mayoría de los casos solo se dispone de estudios que miden la precisión diagnóstica de la prueba. Con estos estudios, el grupo elaborador deberá realizar inferencias sobre las consecuencias clínicas de obtener un determinado resultado de la prueba.
De manera similar al marco GRADE para preguntas de tipo intervención, cuando se dispone de estudios de pacientes consecutivos en los que se comparan los resultados de la prueba a estudio con los de la prueba estándar de referencia, se parte de evidencia de alta calidad, aunque ésta puede disminuir. Los otros diseños de estudios de precisión diagnóstica aportan evidencia de baja calidad.
La valoración de la calidad de la evidencia se realiza para cada uno de los desenlaces de interés. Para los estudios de pruebas diagnósticas con un resultado categórico (positivo o negativo) deben considerarse los desenlaces que dependen de la sensibilidad (S) (verdaderos positivos (VP) y falsos negativos (FN)), así como los que dependen de la especificidad (E) (verdaderos negativos (VN) y los falsos positivos (FP)).
En referencia al riesgo de sesgos de los estudios, se deben tener en cuenta los aspectos que definen la calidad de un buen estudio de precisión diagnóstica, como la representatividad de la población del estudio, o que tanto la prueba a estudio como la de referencia se hayan aplicado al conjunto de los pacientes del estudio.
La existencia de limitaciones serias en los estudios indicaría un posible riesgo de sesgos que lleven a disminuir la calidad de la evidencia en uno o dos niveles.
En cuanto a la valoración del carácter indirecto de la evidencia, su valoración en este caso presenta dificultades adicionales en comparación a las preguntas de intervención terapéutica. En primer lugar, se debe valorar cuál es la población, el escenario, la intervención (la prueba en estudio) y el comparador (otra prueba en estudio o el estándar de referencia). En estas situaciones es más frecuente que exista evidencia indirecta, por lo que el grupo elaborador deberá realizar inferencias sobre las consecuencias clínicas de obtener un determinado resultado de la prueba.
Lo que se debe valorar es si los beneficios de la correcta clasificación de parte de los pacientes pueden tener un mayor impacto que los daños potenciales derivados de la clasificación incorrecta del resto.
Para poder decir que una prueba o estrategia diagnóstica tiene un impacto sobre los desenlaces importantes para los pacientes suele ser necesario que exista evidencia de calidad sobre los efectos del manejo posterior. Sin embargo, aunque no haya un tratamiento efectivo disponible, utilizar una prueba precisa puede ser beneficioso si reduce los efectos adversos, el coste o la ansiedad, al descartar un diagnóstico ominoso o si se mejora el bienestar del paciente por la información que se le puede proporcionar sobre su pronóstico al confirmar el diagnóstico.
En principio, el resto de criterios (inconsistencia, imprecisión y sesgo de publicación), se consideran de forma similar al caso de preguntas de tipo intervención, aunque los métodos para determinar si se cumplen estos criterios están peor establecidos, con dificultades a la hora de valorar el criterio de la imprecisión o el del sesgo de publicación.
3.3.7. Evaluación de la calidad de la evidencia de preguntas de tipo pronóstico
El pronóstico refleja la probabilidad de que tenga lugar un desenlace en personas con una enfermedad o condición concreta o con una característica particular (edad, sexo o perfil genético). Los objetivos de este tipo de estudios pueden ser:
- Conocer el pronóstico de un paciente representativo de una población general definida.
- Establecer el impacto de las características de los pacientes sobre el riesgo de un determinado evento (factores pronósticos).
- Estimar el riesgo individual de un paciente mediante reglas de predicción clínica.
El grupo GRADE publicó un primer artículo sobre el abordaje de estudios que responden al primer objetivo, proporcionando una serie de indicaciones dirigidas a los elaboradores de RS que ofrecen información para guiar en la formulación de recomendaciones sobre este aspecto.
Los criterios propuestos para clasificar la calidad de la evidencia en las preguntas clínicas de pronóstico son los mismos que para las preguntas de tipo intervención, aunque en este caso los estudios longitudinales de cohortes partirían de una confianza alta, que podría disminuir según el riesgo de sesgo de diseño de los estudios incluidos (5).
En la elaboración de esta guía, cuando se han abordado preguntas de tipo pronóstico, se han tratado de seguir las indicaciones del grupo GRADE para valorar la calidad de la evidencia.
3.3.8. Actualización de las búsquedas realizadas para cada pregunta clínica
Las búsquedas de las preguntas realizadas antes de 2018 han sido actualizadas a junio de 2019, y en los casos en los que se han identificado artículos relevantes, éstos han sido incluidos en el texto. Las preguntas actualizadas a junio de 2019 han sido aquellas relacionadas con el drenaje, la oxigenoterapia, la toracocentesis, los broncodilatadores y mucolíticos, las preguntas relacionadas con el diagnóstico por imagen (tomografía computarizada (TC), radiografía y ecografía) y la pregunta relacionada con la petición de ECG (electrocardiograma) y la medición de enzimas cardíacas.
3.4. Revisión externa del contenido de la GPC
La revisión externa del contenido de la GPC ha sido realizada por expertos de diferentes especialidades y Sociedades Científicas.
Los comentarios recibidos han sido considerados por el GEG, que ha realizado las modificaciones pertinentes al borrador de la GPC. Las respuestas a cada uno de los comentarios han sido enviadas a los revisores externos. Dichas respuestas se han recogido en el documento metodológico de la GPC en forma de anexo (https://portal.guiasalud.es/gpc/).
3.5. Actualización de la GPC
Está prevista una actualización de la guía en plazos de tres a cinco años como máximo, o en plazos inferiores si se dispone de nueva evidencia científica que pueda modificar algunas de las recomendaciones que contiene. Las actualizaciones se realizarán sobre la versión electrónica de la guía.
El material donde se presenta de forma detallada la información con el proceso metodológico de la GPC (estrategia de búsqueda para cada pregunta clínica, tablas de perfil de evidencia GRADE y tablas EtR) está disponible tanto en la página web de GuíaSalud como en la de la Osteba, Servicio de Evaluación de Tecnologías Sanitarias del País Vasco. En la página web de GuíaSalud puede consultarse también el Manual Metodológico de elaboración de GPC, que recoge la metodología general empleada. Además, existe una versión resumida de la GPC, de menor extensión y una guía rápida con las recomendaciones principales. Estas versiones se encuentran en las páginas web citadas.
Bibliografía 3. Metodología
5. Grupo de trabajo para la actualización del Manual de Elaboración de GPC. Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud. Actualización del Manual Metodológico [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; Zaragoza: Instituto Aragonés de Ciencias de la Salud (IACS). 2016 [Febrero 2018]. Disponible en: [https://portal.guiasalud.es/wp-content/uploads/2019/01/manual_gpc_completo.pdf]
6. Guyatt GH, Oxman AD, Schunemann HJ, Tugwell P, Knottnerus A. GRADE guidelines: a new series of articles in the Journal of Clinical Epidemiology. J Clin Epidemiol. 2011;64(4):380-2.
7. Guyatt GH, Oxman AD, Schunemann HJ. GRADE guidelines-an introduction to the 10th-13th articles in the series. J Clin Epidemiol. 2013;66(2):121-3.
8. Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011;64(4):383-94.
9. Guyatt GH, Oxman AD, Kunz R, Atkins D, Brozek J, Vist G, et al. GRADE guidelines: 2. Framing the question and deciding on important outcomes. J Clin Epidemiol. 2011;64(4):395-400.
10. Balshem H, Helfand M, Schunemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011;64(4):401-6.
11. Guyatt GH, Oxman AD, Vist G, Kunz R, Brozek J, Alonso-Coello P, et al. GRADE guidelines: 4. Rating the quality of evidence--study limitations (risk of bias). J Clin Epidemiol. 2011;64(4):407-15.
12. Guyatt GH, Oxman AD, Montori V, Vist G, Kunz R, Brozek J, et al. GRADE guidelines: 5. Rating the quality of evidence--publication bias. J Clin Epidemiol. 2011;64(12):1277-82.
13. Guyatt GH, Oxman AD, Kunz R, Brozek J, Alonso-Coello P, Rind D, et al. GRADE guidelines 6. Rating the quality of evidence--imprecision. J Clin Epidemiol. 2011;64(12):1283-93.
14. Guyatt GH, Oxman AD, Kunz R, Woodcock J, Brozek J, Helfand M, et al. GRADE guidelines: 7. Rating the quality of evidence--inconsistency. J Clin Epidemiol. 2011;64(12):1294-302.
15. Guyatt GH, Oxman AD, Kunz R, Woodcock J, Brozek J, Helfand M, et al. GRADE guidelines: 8. Rating the quality of evidence--indirectness. J Clin Epidemiol. 2011;64(12):1303-10. 194 GUÍAS DE PRÁCTICA CLÍNICA EN EL SNS
16. Guyatt GH, Oxman AD, Sultan S, Glasziou P, Akl EA, Alonso-Coello P, et al. GRADE guidelines: 9. Rating up the quality of evidence. J Clin Epidemiol. 2011;64(12):1311-6.
17. Brunetti M, Shemilt I, Pregno S, Vale L, Oxman AD, Lord J, et al. GRADE guidelines: 10. Considering resource use and rating the quality of economic evidence. J Clin Epidemiol. 2013;66(2):140-50.
18. Guyatt G, Oxman AD, Sultan S, Brozek J, Glasziou P, Alonso-Coello P, et al. GRADE guidelines: 11. Making an overall rating of confidence in effect estimates for a single outcome and for all outcomes. J Clin Epidemiol. 2013;66(2):151-7.
19. Guyatt GH, Oxman AD, Santesso N, Helfand M, Vist G, Kunz R, et al. GRADE guidelines: 12. Preparing summary of findings tables-binary outcomes. J Clin Epidemiol. 2013;66(2):158-72.
20. Guyatt GH, Thorlund K, Oxman AD, Walter SD, Patrick D, Furukawa TA, et al. GRADE guidelines: 13. Preparing summary of findings tables and evidence profiles-continuous outcomes. J Clin Epidemiol. 2013;66(2):173-83.
21. Andrews J, Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013;66(7):719-25.
22. Andrews JC, Schunemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, et al. GRADE guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength. J Clin Epidemiol. 2013;66(7):726-35.






