Laura Martínez, Rafael Rotaeche, Itziar Etxeandia, Pablo Alonso.
13.1. Introducción
Las GPC, para ser útiles para la toma de decisiones de los profesionales de la salud y los ciudadanos, deben mantenerse actualizadas1. Entendemos la actualización de las GPC como un proceso iterativo y flexible con una metodología rigurosa y transparente que, por un lado, incorpora nueva información relevante, mediante la revisión de la nueva literatura científica que pueda aportar cambios significativos en las preguntas clínicas o en los factores que influyen la formulación de las recomendaciones; por otro, mejora la calidad de las GPC, mediante la introducción de mejoras metodológicas o la corrección de errores.
Diferentes estudios empíricos demuestran que a los dos o tres años de publicarse una GPC muchas de sus recomendaciones ya no son vigentes2-5. Las instituciones que elaboran GPC recomiendan actualizarlas como mínimo cada dos o tres años6,7, aunque reconocen la dificultad para cumplir estos plazos8,9.
La actualización de GPC debe realizarse con la misma metodología explícita que la elaboración de novo. Los manuales metodológicos de las principales instituciones elaboradoras de GPC incluyen apartados específicos sobre actualización6,7. Sin embargo, la mayoría no proporciona detalles sobre cómo llevar a cabo dicha actualización6,7. Además, la investigación sobre los métodos para actualizar GPC es limitada10.
Este capítulo, que sustituye al manual sobre actualización publicado por el Programa de GPC en el SNS en 200911, proporciona herramientas prácticas para la revisión y actualización de las GPC que puedan ser utilizadas tanto en el Programa de GPC en el SNS como por cualquier otro grupo elaborador.
13.2. Composición del grupo de trabajo
Es importante distinguir en el grupo de trabajo las funciones, las tareas y los perfiles de los diferentes agentes que participan en el proceso de actualización de las GPC (tabla 13.1), y que son parecidos a los descritos para el grupo de trabajo de elaboración de las GPC (ver capítulo 3, “Composición y funcionamiento del Grupo de Trabajo de la GPC”):
- Grupo de Actualización de la GPC (GAG): la tarea principal del GAG es decidir si es necesario actualizar las recomendaciones y modificarlas. Es recomendable contactar e invitar al GEG a participar en el proceso de actualización. Una vez recuperados parcial o totalmente los miembros del GEG, hay que valorar la necesidad de incorporar a nuevos miembros con perfiles similares para cubrir las bajas del GEG, o con otros perfiles adicionales, en el caso de que haya habido novedades importantes en el alcance. Dentro del GAG es fundamental la labor del equipo técnico o metodológico como encargado de identificar y evaluar la nueva evidencia que puede modificar las recomendaciones.
- Revisores externos: la tarea principal de los revisores externos es revisar de forma independiente los cambios introducidos en la GPC. De forma similar a la formación del GAG, se puede contactar e invitar a los revisores externos y, si es necesario, incorporar a nuevos miembros con perfiles similares, en caso de bajas, o con otros perfiles adicionales, en el caso de que haya habido novedades importantes en el alcance.
Tabla 13.1 Grupo de trabajo de la actualización de las GPC
Grupo de trabajo de la actualización de las GPC
La estrategia de actualización elegida determinará la composición cualitativa y cuantitativa del grupo de trabajo y los recursos necesarios para implantarla:
- Actualización continua de una GPC (cada 6 o 12 meses): requiere un grupo de trabajo más pequeño para la identificación y evaluación de la nueva evidencia, y la participación de todo el grupo de trabajo de manera puntual. Esta estrategia requiere disponer de forma permanente de un GAG y de recursos.
- Actualización periódica de una GPC (por ejemplo, cada 2 o 3 años): el GAG suele ser muy similar al de la GPC original. Los recursos se destinan a la formación de un grupo de trabajo durante un periodo determinado para un proyecto específico.
Los miembros del grupo de trabajo deberán cumplimentar su declaración de intereses (ver capítulo 3, “Composición y funcionamiento del Grupo de Trabajo de la GPC”). Los potenciales conflictos de interés se deberán tener en cuenta para decidir sobre la participación o exclusión de los diferentes miembros del GAG en las diferentes etapas del proceso de actualización y se revisarán periódicamente a lo largo del proceso de revisión y actualización.
13.3. Priorización de GPC para su actualización para su actualización
La priorización en las GPC tiene como objetivo asegurar que los recursos son destinados a problemas de salud relevantes para la población. En la elaboración de GPC tienen lugar, implícitamente o explícitamente, diferentes procesos de priorización: en la selección del tema de la GPC, en la selección de las preguntas clínicas que abordará la GPC y en la selección de las preguntas clínicas de la GPC que se revisarán y actualizarán12.
En el proceso de priorización de GPC se deberían considerar factores explícitos (tabla 13.2) para clasificar las guías e identificar las GPC prioritarias a actualizar (tabla 13.3).


La priorización ha de ser un proceso sistemático (utilizando criterios específicos), transparente (trazable y reproducible) y participativo (incluyendo a elaboradores, usua rios y grupos de interés). Las instituciones responsables de los programas de GPC tendrán el reto de mantener un equilibrio entre la necesidad de abordar nuevos temas y la necesidad de revisar los existentes, teniendo en cuenta los recursos disponibles.
Recientemente, la institución Cancer Care Ontario y la universidad de McMaster han desarrollado y aplicado dos cuestionarios para evaluar y priorizar las GPC (ver anexo 13.1 Cuestionarios para la priorización de GPC para su actualización”)13.
13.4. Etapas en la actualización
La revisión y actualización de una GPC es un proceso complejo e incluye diferentes etapas: 1) priorización de las preguntas clínicas, 2) identificación de la nueva evidencia, 3) evaluación de la nueva evidencia (la identificación y evaluación se pueden conceptualizar como el proceso de revisión) y 4) revisión y modificación de las recomendaciones6.
13.4.1. Mapeo de las preguntas clínicas
El objetivo de esta etapa es desarrollar un esquema de la GPC que relacione las preguntas clínicas, con sus recomendaciones y con las referencias correspondientes. La elaboración de esta herramienta facilita la consulta rápida de la información original y su enlace con la nueva evidencia, siendo útil tanto para la elaboración como para la actualización. En el anexo II se presenta un ejemplo de mapeo para una pregunta clínica.
13.4.2. Priorización de las preguntas clínicas
El objetivo de esta etapa es analizar las preguntas clínicas de la GPC previa y decidir qué preguntas clínicas es necesario priorizar para su revisión y actualización.
De forma parecida al proceso de priorización de GPC para su actualización, en el proceso de priorización de preguntas clínicas es importante considerar factores explícitos (ver tabla 13.4) para clasificar las preguntas clínicas e identificar las preguntas clínicas prioritarias a elaborar o a actualizar (ver tabla 13.5).


Cuando concluye la elaboración de la GPC es un buen momento para que el GEG identifique las preguntas clínicas o áreas con mayor o menor recambio de la información, basándose en el volumen de estudios manejado durante la elaboración de la guía, ya que será un factor a considerar en la priorización de preguntas clínicas a actualizar (ver tabla 13.4).
13.4.3. Identificación de la nueva evidencia
El objetivo de esta etapa es identificar nueva evidencia para actualizar las preguntas clínicas.
Los estudios sobre los métodos de identificación de evidencia en la actualización de GPC sugieren que una estrategia de búsqueda bibliográfica restrictiva —aquella que prioriza la precisión sobre la sensibilidad— es habitualmente suficiente para identificar la nueva evidencia relevante5,14,15. En el contexto del Programa de Guías de Práctica Clínica en el SNS, el diseño de estrategias de búsqueda restrictivas —búsqueda de las palabras clave de las preguntas clínicas en MEDLINE a través de PubMed— mostró ser una aproximación eficiente15. Por otro lado, por el momento, recursos como la base de datos de McMaster Premium Literature Service (PLUS) no han mostrado un rendimiento óptimo15.
Fuentes de información
Existen diferentes fuentes de información y métodos de búsqueda que pueden ser utilizados de forma complementaria durante la identificación de la nueva evidencia.
Búsqueda bibliográfica restrictiva
Teniendo en cuenta la evidencia disponible y los recursos limitados asignados a la actualización de GPC es recomendable llevar a cabo una búsqueda bibliográfica restrictiva, frente a una búsqueda exhaustiva, para identificar la nueva evidencia relevante.
Puntos a tener en cuenta al diseñar búsquedas bibliográficas restrictivas:
- Basar las búsquedas en las preguntas clínicas y en las estrategias diseñadas para la GPC original. La actualización de estas búsquedas es una oportunidad para revisar las estrategias previas, detectar errores e introducir mejoras.
- Ejecutar las búsquedas en una fuente de información seleccionada para la el tema objeto de la GPC (por ejemplo, MEDLINE) priorizando las RS.
- Combinar, como mínimo, un término descriptor (MeSH) para cada uno de los componentes clave de la pregunta clínica (PICO) con un término en texto libre relacionado y restringido al título o al resumen.
- Valorar el rendimiento de las estrategias, comprobando que identifican las referencias incluidas en las preguntas clínicas originales.
- Combinar estas estrategias con los filtros validados que ofrezcan una mejor especificidad para recuperar determinados diseños de estudio16-17.
- Ejecutar las búsquedas desde el año completo en el que se finalizó la búsqueda original en adelante.
Búsqueda de GPC recientes
Es recomendable recopilar las GPC más relevantes en las principales bases de datos de GPC (ver capítulo 5, “Búsqueda y selección de la evidencia científica”) y seleccionar aquellas más actuales y de mayor calidad (por ejemplo, las mejor valoradas con el instrumento AGREE-II).
Esta estrategia puede resultar eficiente en la identificación de evidencia relevante que dé respuesta a las preguntas clínicas priorizadas, así como para el conocimiento del volumen y patrón de publicaciones de cada pregunta.
Consulta a elaboradores expertos
Es recomendable complementar las búsquedas con referencias proporcionadas por los componentes del grupo de trabajo. En el anexo 13.3 se presenta un ejemplo de cuestionario para la consulta a elaboradores y expertos.
Alertas de farmacovigilancia sobre medicamentos y de seguridad sobre tecnologías sanitarias en general
Es importante implantar estrategias para recoger alertas de seguridad de las agencias reguladoras de medicamentos u otro tipo de tecnologías, como la Agencia Española de Medicamentos y Productos Sanitarios [www.aemps.gob.es] y la Agencia Europea de Medicamentos [www.ema.europa.eu/ema].
Estas alertas informan sobre los posibles riesgos o incidencias relacionados con los medicamentos y dispositivos, y pueden suponer la modificación de las recomendaciones que los incluyen. Algunas alertas desencadenan la retirada de un determinado medicamento o dispositivo, lo que obligaría a la modificación inmediata de las recomendaciones relacionadas (actualización excepcional).
En el contexto del Programa de Guías de Práctica Clínica en el SNS se ha establecido un sistema de prevención y vigilancia de posibles riesgos o incidencias relacionados con los medicamentos recogidos en las recomendaciones de las GPC19.
Periodicidad
La periodicidad debe considerarse dependiendo de diversos factores y puede variar por pregunta clínica. Algunos aspectos clave son el tema tratado, el recambio bibliográfico del tema o el cuerpo de evidencia publicada previamente20. Teniendo en cuenta estos aspectos se proponen los modelos que se pueden adoptar:
- Identificación continua de la nueva evidencia (ejecución de las búsquedas cada 6-12 meses) en los temas con un alto recambio bibliográfico o menor cuerpo de evidencia disponible.
- Identificación periódica de la nueva evidencia (ejecución de las búsquedas cada 2-3 años) en los temas con un bajo recambio bibliográfico o mayor cuerpo de evidencia disponible.
Es recomendable que el grupo de trabajo de la GPC original evalúe, una vez elaborada la GPC, el método más adecuado para actualizar las preguntas clínicas incluidas (identificación y evaluación continua o periódica de la nueva evidencia). Es recomendable optar por una identificación y evaluación continua de la nueva evidencia, ya que supone una inversión de recursos en principio similar a medio o largo plazo, y una carga de trabajo más asequible, aunque no hay evidencia pragmática que apoye esta asunción.
Las alertas electrónicas y las sindicaciones (por ejemplo, mediante RSS) contribuyen a centralizar de forma periódica la nueva literatura indexada o publicada.
13.4.4. Evaluación del impacto de la nueva evidencia
El objetivo de esta etapa es identificar una señal que indique que podría ser necesario modificar las recomendaciones para mantener su vigencia. Es necesario valorar si la nueva evidencia identificada puede conllevar cambios significativos en las preguntas clínicas pacientes, intervención, comparadores o desenlaces de interés) o en sus recomendaciones debidos a modificaciones de uno o varios de los factores que influyen en la formulación de las mismas (por ejemplo, calidad de la evidencia, balance entre beneficios y daños, importancia de los desenlaces de interés, uso de recursos y costes, equidad, aceptabilidad o factibilidad).
Los estudios metodológicos que han evaluado la vigencia de las recomendaciones de GPC proponen una evaluación inicial cualitativa de la evidencia identificada mediante un consenso entre los miembros del GAG para decidir el impacto de la nueva evidencia sobre las recomendaciones: las recomendaciones siguen siendo vigentes o es necesario revisarlas4. De la misma manera, los manuales metodológicos de las principales instituciones elaboradoras de GPC también utilizan una aproximación cualitativa inicial21-23.
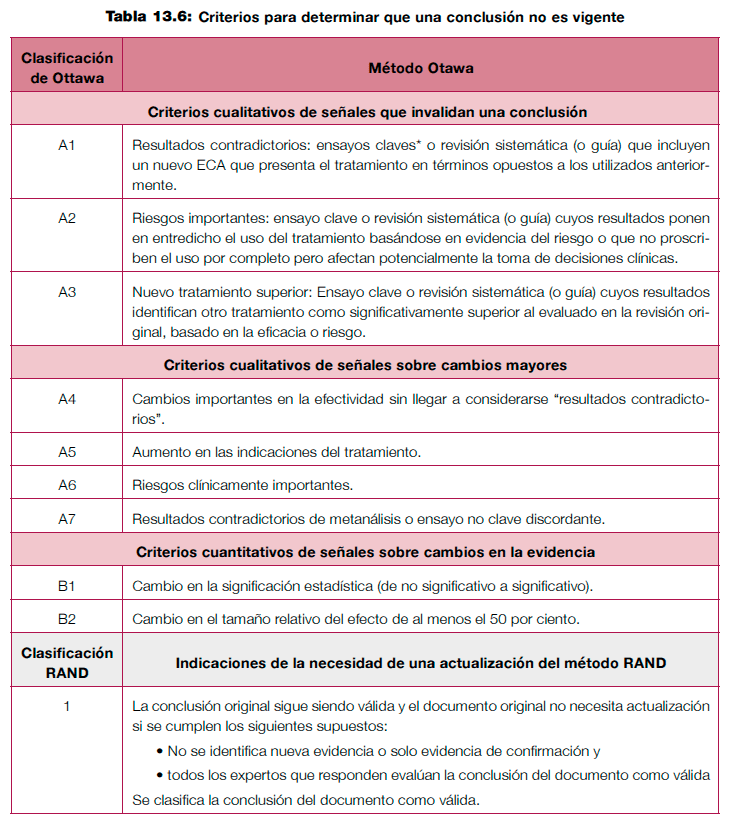
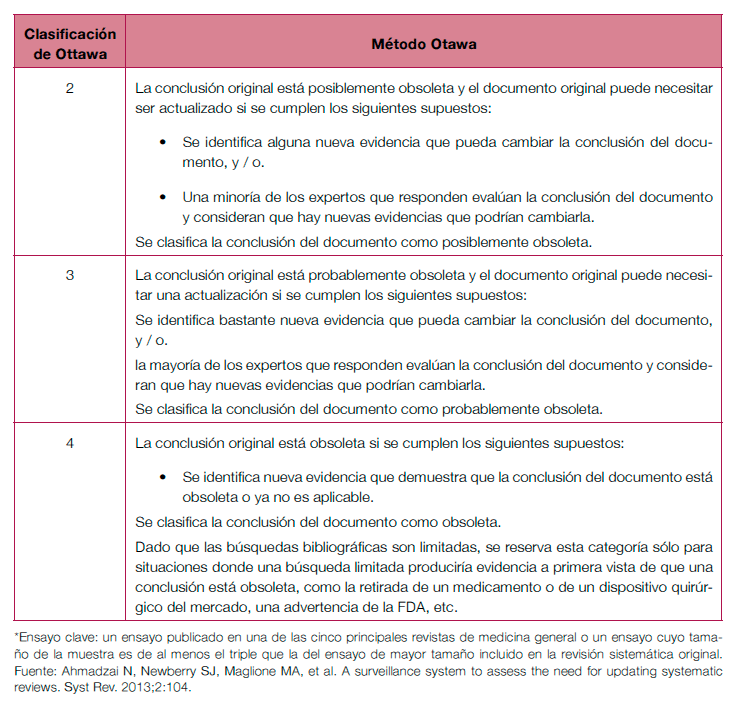
En el área de las revisiones sistemáticas, se han desarrollado principalmente dos métodos para evaluar la necesidad de actualizarlas: el método Ottawa (valoración cualitativa y/o cuantitativa) y el método RAND (valoración cualitativa) (ver tabla 13.6)24,25, mostrando un rendimiento similar26.
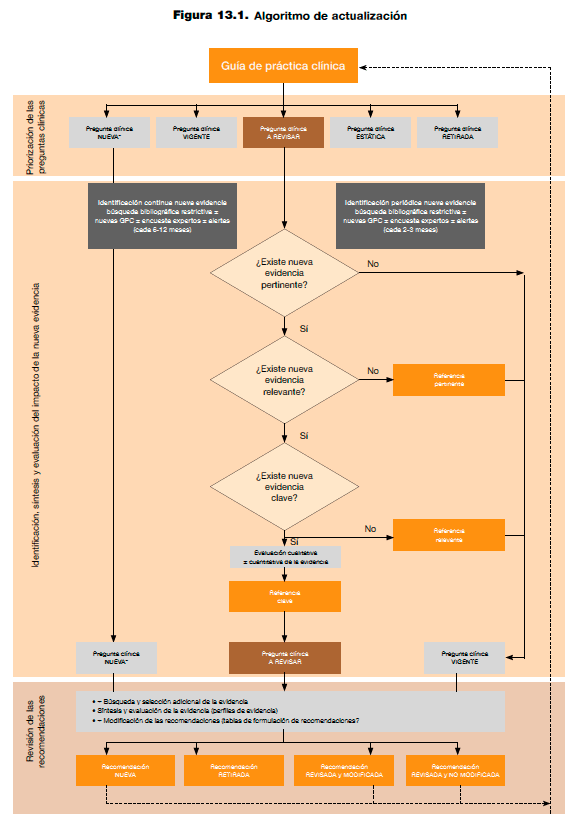
Cribado y clasificación de las referencias
Sea cual sea la periodicidad elegida en el proceso de identificación de la nueva evidencia, es recomendable seleccionar y clasificar las referencias que se vayan identificando. Dependiendo de su relación con los elementos de la pregunta clínica (PICO), la adecuación del diseño de estudio y la magnitud de sus resultados; las referencias pueden clasificarse en las siguientes categorías, que conllevarán acciones diferenciadas:
- Referencias pertinentes:referencias relacionadas con el tema de interés y con un diseño de estudio adecuado para responder a la pregunta clínica.
Acción: si no se identifican referencias pertinentes para una pregunta clínica, no será necesario modificar las recomendaciones de la pregunta. Cuando se identifiquen referencias pertinentes seguirá el proceso de evaluación de la misma (figura 13.1). - Referencias relevantes: referencias pertinentes que se pueden utilizar para actualizar una recomendación pero que no necesariamente desencadenan una modificación por sí mismas.
Acción: si no se identifican referencias relevantes para una pregunta clínica, no será necesario modificar las recomendaciones de la pregunta; aunque sí se presentarán en la actualización de las preguntas como referencias nuevas identificadas que siguen apoyando las recomendaciones originales (pregunta clínica vigente). Cuando se identifiquen referencias relevantes seguirá el proceso de evaluación de la misma (figura 13.1). - Referencias clave: referencias relevantes que potencialmente podrían conllevar una modificación de las recomendaciones por sí mismas. Según las características de los datos originales se puede realizar una valoración cualitativa o cuantitativa de las referencias relevantes para valorar si son referencias clave o no.
Acción: Si no se identifican referencias clave para una pregunta clínica, no será necesario modificar las recomendaciones de la pregunta. Aunque sí se presentarán en la actualización de las preguntas como referencias nuevas identificadas que siguen apoyando la recomendación original (pregunta clínica vigente). Cuando se identifiquen referencias clave, estas conllevarán un proceso de revisión de la pregunta clínica (figura 13.1).
Criterios cualitativos para clasificar las referencias relevantes como clave:
-
-
- El nuevo estudio introduce un cambio en el alcance de la pregunta clínica (pacientes, intervención, comparadores o desenlaces de interés). Puede darse el caso de que la nueva evidencia permita matizar la recomendación en un subgrupo de interés o incluir nuevas intervenciones en una recomendación sobre el uso de una prueba diagnóstica o de un tratamiento.
- El nuevo estudio introduce un cambio substancial en los factores que influencian la formulación de las recomendaciones. Estos cambios pueden significar convertir recomendaciones débiles en fuertes o cambiar el sentido de una recomendación.
-
Criterios cuantitativos para clasificar las referencias relevantes como clave. Se derivan de la evaluación de los estimadores de resultado de los estudios y, en ocasiones, después de metanalizar los datos originales con los datos de las potenciales referencias clave25:
-
-
- Cambio en la significación estadística en un desenlace clave.
- Cambio en el tamaño relativo del efecto de al menos el 50 por ciento en un desenlace clave.
-
Puede darse el caso que el cambio se consiga en base a más de una referencia relevante; por ejemplo, al realizar un nuevo metanálisis con varias referencias relevantes.
Procesamiento de la nueva evidencia
Es recomendable elaborar un documento de trabajo interno donde conste la siguiente información:
- Fecha de la búsqueda bibliográfica.
- Número de referencias identificadas.
- Número de referencias pertinentes, relevantes y claves.
- Resumen de los resultados principales de las referencias clave.
- Justificación de cómo pueden afectar potencialmente las referencias clave a las preguntas clínicas y a las recomendaciones previas.
Evaluación del impacto de la nueva evidencia
En base al impacto de la nueva evidencia, el GAG deberá consensuar qué preguntas clínicas necesitan ser revisadas y potencialmente modificadas. En ocasiones el GAG necesitará decidir si tiene suficientes recursos de tiempo y personal para revisar todas las preguntas, o decide priorizar algunas de ellas en base a los criterios expuestos en el apartado 13.4.2, “Priorización de las preguntas clínicas”.
13.4.5. Revisión de las recomendaciones
Búsqueda y selección adicional de la evidencia
Aunque se recomienda utilizar únicamente las referencias identificadas con la búsqueda restrictiva para revisar las recomendaciones, en algunas ocasiones puede ser necesario realizar también una búsqueda exhaustiva. Por ejemplo, cuando los expertos identifiquen una referencia clave no recuperada con la búsqueda restrictiva o cuando una GPC reciente, utilizada como fuente de información, incluya unas referencias discordantes con las identificadas en la búsqueda restrictiva.
Síntesis y evaluación de la evidencia
En la fase de síntesis y evaluación de la evidencia, es necesario recopilar todo el cuerpo de la evidencia identificada para cada pregunta clínica, elaborar las tablas de los nuevos estudios identificados, evaluar su calidad, elaborar o actualizar los metanálisis, y elaborar o actualizar los perfiles de evidencia.
Es importante resaltar que, en caso de que la pregunta clínica original se hubiera elaborado con el sistema SIGN, tal y como ocurre actualmente en la mayoría de las guías elaboradas dentro del Programa de Guías de Práctica Clínica en el SNS, es necesario realizar los perfiles de evidencia de novo. Esto implica evaluar tanto el cuerpo de evidencia de la pregunta clínica original como las nuevas referencias relevantes y clave identificadas en el proceso de actualización.
Modificación de las recomendaciones
El proceso de formulación o modificación de las recomendaciones está guiado por la elaboración y utilización de las tablas de formulación de las recomendaciones (Evidence To Decisión framework – EtD).
En base a las tablas de formulación de las recomendaciones para cada pregunta clínica, el GAG deberá consensuar la modificación de las recomendaciones. Al final del proceso se dispondrá de estos tipos de recomendaciones:
- Recomendaciones nuevas.
- Recomendaciones revisadas y modificadas (con referencias clave).
- Recomendaciones revisadas y no modificadas (con referencias relevantes).
- Recomendaciones retiradas.
Es crucial llevar un registro de las modificaciones y su justificación. Es recomendable que esta información esté disponible para los usuarios en forma de anexo (ver en el anexo 13.4 un ejemplo para registrar las modificaciones en las recomendaciones). En el apartado “13.6. Edición de la actualización” se detalla el proceso de edición de los cambios en la actualización de las GPC.
Revisión externa y exposición pública
Tras la elaboración de un borrador con los cambios de la GPC es importante desarrollar un proceso de revisión externa. Esta etapa es similar a la contemplada en el capítulo 11 en relación a la elaboración (ver capítulo 11 “Revisión externa y exposición pública de las GPC”).
13.5. Actualizaciones excepcionales
La actualización excepcional de una pregunta clínica es necesaria cuando se identifica nueva evidencia relevante, de carácter excepcional, a través de las alertas, de la identificación continua de la nueva evidencia o del conocimiento de los expertos, antes de la revisión formal programada, o cuando se identifican errores en las recomendaciones tras la publicación de la GPC.
La nueva evidencia que desencadena este tipo de actualización debe ser lo suficientemente robusta como para dar lugar, con probabilidad, a alguno de los siguientes casos:
- Una o más recomendaciones necesitan una actualización de tal manera que la práctica clínica cambiará de manera significativa21.
- Una o más recomendaciones deben ser abordadas de nuevo por cuestiones de seguridad del paciente21.
13.6. Edición de la actualización
La edición de la actualización de una GPC debe cumplir los mismos principios de estilo recomendados en la elaboración de novo (ver capítulo 12 “Edición de las Guías de Práctica Clínica”).
Existe poca investigación sobre estrategias para comunicar recomendaciones que han sido rigurosamente priorizadas, evaluadas y actualizadas. Únicamente un análisis de GPC actualizadas de NICE observó una gran variabilidad en los formatos de presentación de los cambios en las recomendaciones y una falta de justificación de los mismos24. Desafortunadamente, tampoco el proyecto europeo DECIDE (www.decide-collaboration.eu), iniciativa del grupo GRADE, que ha desarrollado formatos óptimos de presentación de las recomendaciones en el área de la salud para diferentes grupos de interés (clínicos, ciudadanos y decisores en salud)28,29, ha abordado por el momento la presentación de recomendaciones actualizadas.
Hasta el momento, solo en el campo de las revisiones sistemáticas se ha evaluado el formato de presentación de los resultados de una actualización30, observándose que diferentes grupos de interés tienen diferentes necesidades de información. Por ejemplo, los decisores en salud necesitan tener acceso a todos los datos y análisis de una revisión sistemática, los originales y los actualizados; en cambio, los usuarios se benefician de síntesis que muestran claramente qué es lo que ha cambiado30.
Actualmente se está desarrollando una lista de verificación para evaluar la información que debería incluir una GPC actualizada31. Esta lista, todavía no publicada, aborda los siguientes aspectos de edición que una GPC actualizada debería reflejar (ver anexo anexo 13.5):
- La versión actualizada se diferencia con facilidad de la versión original de la GPC.
- Las secciones revisadas en el proceso de actualización están descritas.
- Las recomendaciones están claramente presentadas y etiquetadas como nuevas, modificadas o sin cambios. Las recomendaciones retiradas están claramente identificadas.
- Los miembros del GAG están descritos.
- La justificación para actualizar la GPC está incluida.
- Los cambios en el alcance y los objetivos entre la versión actualizada y la original están descritos y justificados.
- Los cambios en las recomendaciones están descritos y justificados.
- Los métodos utilizados para la búsqueda e identificación de la nueva evidencia en el proceso de actualización están descritos.
- Los métodos utilizados para seleccionar la evidencia en el proceso de actualización están descritos.
- Los métodos utilizados para evaluar la calidad de la evidencia incluida en el proceso de actualización están descritos.
- Los métodos utilizados para sintetizar la evidencia en el proceso de actualización están descritos.
- Los métodos para implementar en la práctica los cambios de la versión actualizada están descritos.
- Los métodos para la revisión externa de la versión actualizada están descritos.
- Los métodos para actualizar la nueva versión están descritos.
- La declaración sobre los posibles conflictos de interés del GAG están registrados.
- El financiador o patrocinador de la versión actualizada está identificado y descrito.
Resumen de los Aspectos Clave
Bibliografía 13. Actualización de la GPC
1. Institute of Medicine (U.S.). Committee on Standards for Developing Trustworthy Clinical Practice Guidelines. Clinical practice guidelines we can trust [Internet]. Graham R, et al., editores. Washington, D.C.: The National Academies Press; c2011 [consultado 09/03/2016]. Disponible en: http://www.nap.edu/read/13058/chapter/1.
2. Neuman MD, Goldstein JN, Cirullo MA, Schwartz JS. Durability of class I American College of Cardiology/American Heart Association clinical practice guideline recommendations. JAMA [Internet[. 2014 May;311(20):2092-100 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4346183/.
3. Alderson LJ, Alderson P, Tan T. Median life span of a cohort of National Institute for Health and Care Excellence clinical guidelines was about 60 months. J Clin Epidemiol. 2014 Jan;67 (1):52-5.
4. Martínez García L, Sanabria AJ, García Alvarez E, Trujillo-Martín MM, Etxeandia-Ikobaltzeta I, Kotzeva A, et al. The validity of recommendations from clinical guidelines: a survival analysis. CMAJ [Internet]. 2014 Nov;186(16):1211-9 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4216254/ .
5. Shekelle PG, Ortiz E, Rhodes S, Morton SC, Eccles MP, Grimshaw JM, et al. Validity of the Agency for Healthcare Research and Quality clinical practice guidelines: how quickly do guidelines become outdated? JAMA. 2001 Sep;286(12):1461-7.
6. Vernooij RW, Sanabria AJ, Solà I, Alonso-Coello P, Martínez García L, et al. Guidance for updating clinical practice guidelines: a systematic review of methodological handbooks. Implement Sci [Internet]. 2014 jan;9:3 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3904688/.
7. Becker M, Neugebauer EA, Eikermann M. Partial updating of clinical practice guidelines often makes more sense than full updating: a systematic review on methods and the development of an updating procedure. J Clin Epidemiol. 2014 Jan;67(1):33-45.
8. Alonso-Coello P, Martínez García L, Carrasco JM, Solà I, Qureshi S, Burgers JS, et al. The updating of clinical practice guidelines: insights from an international survey. Implement Sci [Internet]. 2011 Sep;6:107 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3191352/.
9. Burgers JS, Grol R, Klazinga NS, Mäkelä M, Zaat J; AGREE Collaboration. Towards evidence-based clinical practice: an international survey of 18 clinical guideline programs. Int J Qual Health Care [Internet]. 2003 Feb;15(1):31-45 [consultado 09/03/2016]. Disponible en: http://intqhc.oxfordjournals.org/content/15/1/31.long.
10. Martínez García L, Arévalo-Rodríguez I, Solà I, Haynes RB, Vandvik PO, Alonso-Coello P, et al. Strategies for monitoring and updating clinical practice guidelines: a systematic review. Implement Sci [Internet]. 2012 Nov;7:109 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3520818/.
11. Grupo de trabajo sobre actualización de GPC. Actualización de Guías de Práctica Clínica en el Sistema Nacional de Salud. Manual Metodológico. Madrid: Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social. Instituto Aragonés de Ciencias de la Salud-IACS; 2009. (Guías de Práctica Clínica en el SNS: IACS Nº 2007/02-01) [consultado 26/02/2016].
Disponible en: https://portal.guiasalud.es/wp-content/uploads/2019/01/manual_actualizacion.pdf.
12. Schünemann HJ, Wiercioch W, Etxeandia I, Falavigna M, Santesso N, Mustafa R, et al. Guidelines 2.0: systematic development of a comprehensive checklist for a successful guideline enterprise. CMAJ [Internet]. 2014 Feb;186(3):E123-42 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3928232/.
13. Agbassi C, Messersmith H, McNair S, Brouwers M. Priority-based initiative for updating existing evidence-based clinical practice guidelines: the results of two iterations. J Clin Epidemiol [Internet]. 2014 Dec;67(12):1335-42 [consultado 09/03/2016]. Disponible en: http://www.sciencedirect.com/science/article/pii/S0895435614002698.
14. Gartlehner G, West SL, Lohr KN, Kahwati L, Johnson JG, Harris RP, et al. Assessing the need to update prevention guidelines: a comparison of two methods. Int J Qual Health Care [Internet]. 2004 Oct;16(5):399-406. Disponible en: http://intqhc.oxfordjournals.org/content/16/5/399.long.
15. Martínez García L, Sanabria AJ, Araya I, et al. Efficiency of alternative search strategies to update clinical guidelines recommendations (pendiente de publicar).
16. Wilczynski NL, McKibbon KA, Walter SD, Garg AX, Haynes RB. MEDLINE clinical queries are robust when searching in recent publishing years. J Am Med Inform Assoc [Internet]. 2013 Mar-Apr;20(2):363-8 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3638187/.
17. Selva A, Solà I, Zhang Y, Sanabria AJ, Pequeño S, Rigau D. Development of a search strategy for studies about patients’ values and preferences. Hyderabad, India: 22nd Cochrane Colloquium ; 2014.
18. University of York. Centre for Reviews and Dissemination (CDR). Guide to Searching En: University of York. CDR [Internet]. York: CDR; 2016 [actualizado 26/10/2015; consultado 10/03/2016]; Disponible en http://www.crd.york.ac.uk/CRDWeb/GuideToSearching.asp.
19. GuíaSalud–Biblioteca de GPC del SNS. Procedimiento para la gestión de incidencias de medicamentos en las guías del Programa de GPC en el SNS. 2014. (Sin publicar).
20. Peterson K, McDonagh MS, Fu R. Decisions to update comparative drug effectiveness reviews vary based on type of new evidence. J Clin Epidemiol. 2011 Sep;64(9):977-84.
21. National Institute for Health and Care Excellence (NICE). Developing NICE guidelines: the manual. Manchester: NICE; 2014.
22. National Institute for Health and Care Excellence (NICE). Interim clinical guideline surveillance process and methods guide 2013. London: NICE; 2014.
23. Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN; 2014.
24. Shekelle P, Newberry S, Maglione M, Shanman R, Johnsen B, Carter J, et al. Assessment of the Need to Update Comparative Effectiveness Reviews: Report of an Initial Rapid Program Assessment (2005–2009) [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2009. (AHRQ Methods for Effective Health Care) [publicado 09/2009; consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0077133.
25. Shojania KG, Sampson M, Ansari MT, Ji J, Doucette S, Moher D. How quickly do systematic reviews go out of date? A survival analysis. Ann Intern Med [Internet] 2007 Aug;147(4):224-33 [consultado 09/03/2016]. Disponible en: http://annals.org/article.aspx?articleid=736284.
26. Chung M, Newberry SJ, Ansari MT, Yu WW, Wu H, Lee J, et al. Two methods provide similar signals for the need to update systematic reviews. J Clin Epidemiol [Internet]. 2012 Jun;65(6):660-8 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4141462/.
27. Martínez García L, McFarlane E, Barnes S, Sanabria AJ, Alonso-Coello P, Alderson P. Updated recommendations: an assessment of NICE clinical guidelines. Implement Sci [Internet]. 2014 Jun;9(1):72 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4067507/.
28. Treweek S, Oxman AD, Alderson P, Bossuyt PM, Brandt L, Brozek J, et al. Developing and Evaluating Communication Strategies to Support Informed Decisions and Practice Based on Evidence (DECIDE): protocol and preliminary results. Implement Sci [Internet]. 2013 Jan;8:6 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC355 3065/.
29. Kristiansen A, Brandt L, Alonso-Coello P, Agoritsas T, Akl EA, Conboy T, et al. Development of a novel, multilayered presentation format for clinical practice guidelines. Chest. 2015 Mar;147(3):754-63.
30. Newberry SJ, Shekelle PG, Vaiana M, Motala A. Reporting the findings of updated systematic reviews of comparative effectiveness: how do users want to view new information? Research White Paper [Internet]. Rockville, MD: Agency for Healthcare Research and Quality; 2013. (AHRQ Publication No. 13-EHC093-EF) [publicado 05/2013; consultado 10/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK143984/pdf/Bookshelf_NBK143984.pdf.
31. Vernooij R, Sanabria A, Martínez García L, Makarski J, Brouwers M, Alonso-Coello P. P329 Developing a strategy to assess the reporting of the updating process in clinical practice guideline: a draft checklist. BMJ Qual Saf. 2013;22(Suppl 1):85-6.
Lecturas recomendadas
• Vernooij RW, Sanabria AJ, Solà I, Alonso-Coello P, Martínez García L, et al. Guidance for updating clinical practice guidelines: a systematic review of methodological handbooks. Implement Sci [Internet]. 2014 jan;9:3 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3904688/..
Revisión sistemática sobre como los manuales metodológicos de elaboración de GPC abordan el proceso de actualización. La revisión constata carencias en aspectos esenciales de este proceso como la identificación de la necesidad de actualización ,la evaluación de nueva evidencia y como ésta puede modificar las recomendaciones de la GPC.
• Martínez García L, Arévalo-Rodríguez I, Solà I, Haynes RB, Vandvik PO, Alonso-Coello P, et al. Strategies for monitoring and updating clinical practice guidelines: a systematic review. Implement Sci [Internet]. 2012 Nov;7:109 [consultado 09/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3520818/..
Revisión sistemática sobre investigaciones sobre el proceso de actualización de GPC. La mayoría de los estudios identificados se centran en las estrategias de identificación de la nueva evidencia. La escasa evidencia identificada apoya el uso de estrategias restrictivas de búsqueda.
Anexos
Anexo 13.1. Cuestionarios para la priorización de GPC para su actualización.
Anexo 13.2. Mapeo de la Guía de práctica clínica de atención en el embarazo y puerperio.
Anexo 13.3. Cuestionario para la recogida de evidencia de los elaboradores y expertos.
Anexo 13.4. Registro de las modificaciones en las recomendaciones originales.
Anexo 13.5. Lista de verificación para evaluar GPC actualizadas.
Tablas y figuras
Tabla 13.1. Grupo de trabajo de la actualización de las GPC.
Tabla 13.2. Posibles factores a considerar en la priorización de GPC para su actualización.
Tabla 13.3. Clasificación de las GPC según su necesidad de actualización.
Figura 13.1. Algoritmo de actualización.
Tabla 13.4. Posibles factores a considerar en la priorización de preguntas clínicas para su actualización.
Tabla 13.5. Clasificación de las preguntas clínicas según su necesidad de actualización.
Tabla 13.6. Criterios para determinar que una conclusión no es vigente.