Rafael Rotaeche, Máximo Bernabeu, Ignacio Marín, Manuel Ollero, Milagros Rico, Pilar Román
9.1. Introducción
Las GPC hasta ahora han estado orientadas hacia un solo proceso y no han tenido en cuenta la comorbilidad a la hora de formular sus recomendaciones1. Sin duda, a esto ha contribuido que los pacientes pluripatológicos, con comorbilidad o de edad avanzada frecuentemente son excluidos en los ensayos clínicos2 y las GPC basadas en la evidencia son documentos que recogen la mejor investigación disponible.
Es sabido que el cumplimiento de diferentes GPC orientadas hacia un solo proceso, aplicadas en un mismo paciente con múltiples enfermedades crónicas suponen, en ocasiones, recomendaciones contradictorias y una carga de trabajo que puede ser inviable para pacientes y cuidadores3.
Como es lógico, existe un interés creciente entre los profesionales, las organizaciones sanitarias y los grupos elaboradores de GPC en que las guías puedan también resultar útiles en la atención a pacientes con múltiples enfermedades crónicas, aunque hasta el momento son escasas las propuestas metodológicas que abordan este problema4. En nuestro medio se ha desarrollado una primera aproximación al problema que ha servido de base para la elaboración de este capítulo3.
Dado que nos encontramos en las fases iniciales del abordaje metodológico en el desarrollo de GPC que contemplen la pluripatología y comorbilidad, es previsible que este capítulo deba modificarse a medida que se avance en el desarrollo internacional de dicha área.
9.2. Integración de la comorbilidad y pluropatología en las etapas de desarrollo de una GPC
La pluripatología o multimorbilidad se ha definido como la presencia de varias enfermedades crónicas de forma simultánea en un individuo o en una población3. La multimorbilidad es un concepto de ámbito más epidemiológico, aceptando la definición de morbilidad como la proporción de personas que enferman en un lugar durante un tiempo determinado; por ello, la multimorbilidad hace referencia a la presencia de múltiples enfermedades en una proporción de personas de un determinado ámbito geográfico3.
La pluripatología es un término clínico que hace referencia a aquellos pacientes con dos o más enfermedades crónicas. Esta población de pacientes supone un paradigma emergente en Atención Primaria y Hospitalaria, con elevada mortalidad, vulnerabilidad clínica, tendencia al deterioro funcional, y la dependencia y elevado consumo de recursos sanitarios3.
El término comorbilidad se refiere a la presencia de diferentes enfermedades que acompañan a modo de satélite a una enfermedad protagonista crónica3.
Sabemos que determinadas enfermedades crónicas se agrupan en ciertos individuos con un patrón definido de patologías (por ejemplo, tabaquismo/EPOC/cardiopatía isquémica), constituyendo los denominados “conjuntos” (clusters en la bibliografía anglosajona) de enfermedades; y conocemos que a mayor edad aumenta la comorbilidad. Por su parte, el bajo nivel socioeconómico y la enfermedad mental determinan que la agrupación aparezca a edades más tempranas5,6.
En el desarrollo de este capítulo se repasan las diferentes fases de elaboración de una GPC y se exponen, para cada fase, los aspectos clave a considerar para facilitar el abordaje de la comorbilidad y pluripatología.
9.2.1. Alcance y objetivos
Una de las primeras decisiones a adoptar por el GEG es si la GPC se realizará para pacientes con un determinado conjunto de enfermedades o con una patología índice teniendo en cuenta la edad avanzada del paciente o determinadas comorbilidades asociadas7. En función de diferentes objetivos pueden darse diferentes escenarios (figura 9.1):
- Una única patología o problema índice y cómo afecta a su atención la presencia de algunas comorbilidades. Por ejemplo, una GPC sobre HTA que responda al tratamiento farmacológico según la presencia de insuficiencia cardiaca o diabetes o EPOC o cualquier combinación de las anteriores (figura 1-A).
- Una única patología o problema índice formulando recomendaciones dependiendo de determinados niveles de riesgo. Por ejemplo, GPC de diabetes mellitus en atención primaria con apartado específico en el anciano (figura 1-B).
- Más de un problema índice con parecida importancia. Por ejemplo, GPC sobre nefropatía diabética (figura 1-C).
- La GPC aborda la organización en la atención a los pacientes con multimorbilidad. En este caso, el objetivo de la GPC no es una patología concreta sino el conjunto de los pacientes con pluripatología. Por ejemplo, puede plantearse una GPC sobre la atención domiciliaria de pacientes con pluripatología en función de su grado de dependencia, o el objetivo de la GPC puede ser la prevención de caídas en dicho colectivo. En el primer caso, como es lógico, muchas de las preguntas clínicas que deberá responder la GPC girarán en torno a la efectividad de las intervenciones organizativas en el seguimiento de dichos pacientes (enfermería de enlace, telemedicina, etc.) (figura 1-D).
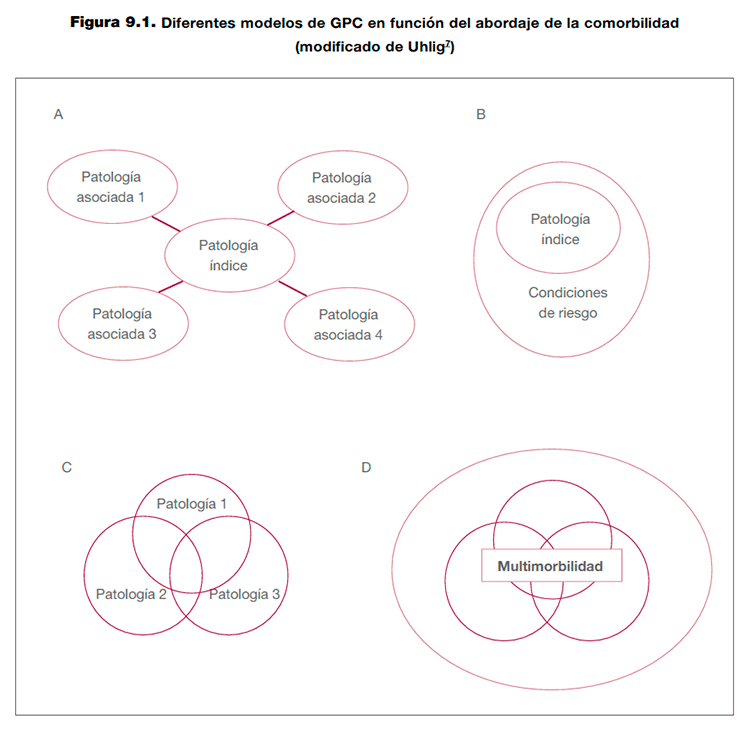
Sea cual sea el escenario finalmente contemplado, hay una serie de aspectos que el GEG debe tener en consideración: Son los siguientes:
- La prevalencia de determinados agrupamientos de enfermedades crónicas.
- La incorporación específica de recomendaciones dirigidas al control sintomático y confort de los pacientes en las fases más avanzadas de sus enfermedades.
- Las implicaciones que tiene el uso de múltiples fármacos en un mismo paciente para la definición de las intervenciones y la elección de las variables de resultado: adecuación, conciliación en las transiciones interfases asistenciales, adherencia terapéutica, efectos secundarios e interacciones. Especialmente importante resulta la valoración de la adecuación farmacológica del paciente con comorbilidad mediante instrumentos específicos8-12.
- Los valores y preferencias de los pacientes y familiares13.
- La incorporación de recomendaciones específicas para los cuidadores principales, en el caso de enfermedades que conlleven una elevada dependencia funcional y/o deterioro cognitivo.
- La carga global de enfermedad y la carga de cuidados, con su impacto en la salud mental de los pacientes y las recomendaciones dirigidas a mejorarla.
- El papel de la rehabilitación y las recomendaciones al respecto, como pilar no farmacológico esencial en la recuperación o en la prevención del deterioro funcional.
9.2.2. Composición y funcionamiento del grupo elaborador de la GPC
La elección de cualquiera de las posibilidades descritas en la figura 9.1 para elaborar una GPC determina los criterios de selección para constituir el GEG. En el GEG deben participar expertos implicados en la atención a pacientes con el conjunto de comorbilidad.
Dentro de los perfiles de profesionales con experiencia en la atención a la población con comorbilidad, además de los especialistas en medicina de familia, geriatría, medicina interna y especialidades, no hay que olvidar a los profesionales de enfermería, en especial a aquellos expertos en funciones como la gestión de casos crónicos o la atención domiciliaria; a los farmacéuticos, como expertos en el fenómeno de la polimedicación; o a los trabajadores sociales, como asesores en aspectos sociosanitarios. En caso de que la guía contemple intervenciones organizativas, debe valorarse la incorporación de perfiles no clínicos, tales como gestores y expertos en organizaciones sanitarias con experiencia al respecto.
Es importante disponer en el grupo de una panorámica de la percepción competitiva entre riesgo y beneficios desde la perspectiva de los pacientes con patologías coexistentes. Hay numerosos estudios que confirman que las prioridades de los pacientes no tienen por qué coincidir con las de los sanitarios14. La opinión de los pacientes puede complementarse con una revisión bibliográfica que identifique sus preferencias en las patologías de interés. Esta revisión resulta obligada en los casos en que no existan pacientes en el GEG. Es ilustrativa una exploración sobre la percepción de salud en los pacientes con EPOC en Estados Unidos, en que se observó que el 50% de los pacientes tenía tres o más condiciones de comorbilidad. Cada comorbilidad añadida elevaba en un 43% la posibilidad de que el paciente puntuara peor su estado de salud y, además, la prioridad de “beneficio” que buscaba cada paciente dependía de la presencia o no de comorbilidades específicas y de su número15.
Es previsible que, para elaborar una GPC de estas características, el GEG precise de un mayor esfuerzo y un plazo mayor de tiempo que el que requeriría la elaboración de una GPC convencional.
9.2.3. Preguntas clínicas de la GPC
Al elaborar las preguntas clínicas en formato PICO, la consideración de la comorbilidad obliga a refinar algunos aspectos específicos en sus tres elementos:
- Pacientes: en función del enfoque elegido (figura 9.1) en el desarrollo de la GPC se definirá el tipo de paciente con multimorbilidad. Para ello es necesario tener en cuenta que las enfermedades se asocian en un mismo paciente en función de que comparten factores de riesgo epidemiológicos, determinantes sociales, estilos de vida o vías fisiopatológicas. Son las denominadas interacciones de enfermedad a enfermedad16. La presencia de una enfermedad aumenta el riesgo de desarrollar otra o de empeorarla, o comparten los mismos síntomas o su presencia interfiere con las pruebas analíticas o funcionales usadas en su diagnóstico16. Por ejemplo, en el caso de los pacientes con EPOC, la coexistencia con insuficiencia cardiaca y dependencia afecta al proceso diagnóstico, a la evaluación funcional, al tratamiento y al pronóstico4. La presencia de la enfermedad renal crónica supone la mayoría de las interacciones relevantes con los fármacos utilizados en el tratamiento de la diabetes tipo 2, la insuficiencia cardíaca o la depresión17.
- Intervención: el pronóstico vital de muchos de estos pacientes o la carga de cuidado y la carga que suponen algunas intervenciones pueden llevar a desechar directamente alguna de ellas.
- En los pacientes con comorbilidad puede ser pertinente plantearse la inclusión de preguntas sobre intervenciones organizativas. En muchos casos, la mejora de la calidad de vida de los pacientes viene determinada, sobre todo, por la forma de proporcionarles una atención coordinada y de calidad. En tales casos, será imprescindible realizar recomendaciones sobre coordinación asistencial, que impliquen no solo intervenciones sobre los pacientes sino también sobre su entorno y sus cuidadores.
- Resultados (Outcomes): el enfoque de los desenlaces en las GPC en pluripatología tiene varias facetas y no solo las relacionadas con las preferencias de los pacientes, a saber:
- La competencia entre los desenlaces previsibles para las diferentes comorbilidades: un desenlace favorable para una de las enfermedades puede conllevar uno desfavorable para otra. Es especialmente necesario tener en cuenta esta competencia en las interacciones enfermedad-fármaco y fármaco-fármaco16:
- El tratamiento farmacológico de una enfermedad puede producir efectos adversos que simulan síntomas de otra enfermedad coexistente; por ejemplo, los edemas producidos por los antagonistas del calcio en el tratamiento de la HTA dificultan el diagnóstico de una insuficiencia cardíaca descompensada en un paciente con ambos procesos.
- El tratamiento farmacológico de una enfermedad empeora otra; por ejemplo, los AINES pueden descompensar una insuficiencia cardíaca18.
- Las interacciones por el uso de fármacos en diferentes enfermedades producen nuevos efectos adversos graves; por ejemplo, fracaso renal por la triple asociación AINE, IECA y diuréticos en un paciente con HTA y artrosis19.
- El marco temporal de presentación de los desenlaces. Este marco viene determinado por el pronóstico y las expectativas vitales, habitualmente cortas, de algunos grupos de morbilidad. El concepto de tiempo de rentabilidad o payoff time se refiere al tiempo en el que los beneficios de las recomendaciones de una GPC superan a los daños producidos por las mismas recomendaciones20. Este balance depende de la expectativa vital del paciente con comorbilidad; por ejemplo, el beneficio de la prevención secundaria de riesgo cardiovascular con estatinas en diabéticos mayores de 70 años se comienza a apreciar después de uno o dos años de tratamiento, por lo que aquellos sujetos con expectativa vital inferior a ese plazo estarían fuera del tiempo de rentabilidad21.
- La necesidad de priorizar la elección de variables orientadas al paciente (“variables duras”, como son los desenlaces en salud) en lugar de variables orientadas a la enfermedad (variables intermedias o “subrogadas”), ya que en casos de comorbilidad la fisiopatología puede indicar una significación distinta a la relación de dichas variables con los desenlaces en salud22; por ejemplo, el uso de los mismos criterios de buen control de la hemoglobina glicosilada en la población general se acompaña de más complicaciones por hipoglucemia, caídas, riesgo de institucionalización y peor pronóstico en la población anciana23.
- Dado que las reacciones adversas farmacológicas (RAF) aumentan con la edad y con el número de comorbilidades presentes en un paciente, en los apartados de la GPC sobre tratamiento deben incluirse preguntas específicas que enfoquen los potenciales RAF, y riesgos de su utilización, en el contexto de las comorbilidades asociadas a la patología índice y en personas de edad avanzada.
- Las reacciones adversas no se limitan solo a las intervenciones con fármacos sino también a las diagnósticas, en las que los daños deben ser explícitamente considerados como consecuencias no esperadas, dentro del conjunto de la carga del tratamiento; por ejemplo, un desenlace relevante en el manejo de la hipertensión arterial es evitar la progresión de la afectación renal y cardiovascular, pero su estudio mediante angiografía en un paciente con insuficiencia renal crónica puede resultar en daño renal inducido por contraste.
- También hay que considerar entre los desenlaces desfavorables (daño) la “carga de tratamiento” que supone para los pacientes con comorbilidad intentar acometer simultáneamente todos los aspectos del conjunto de patologías coexistentes en términos de polifarmacia, tiempo de autocuidados, estilo de vida y coste económico24.
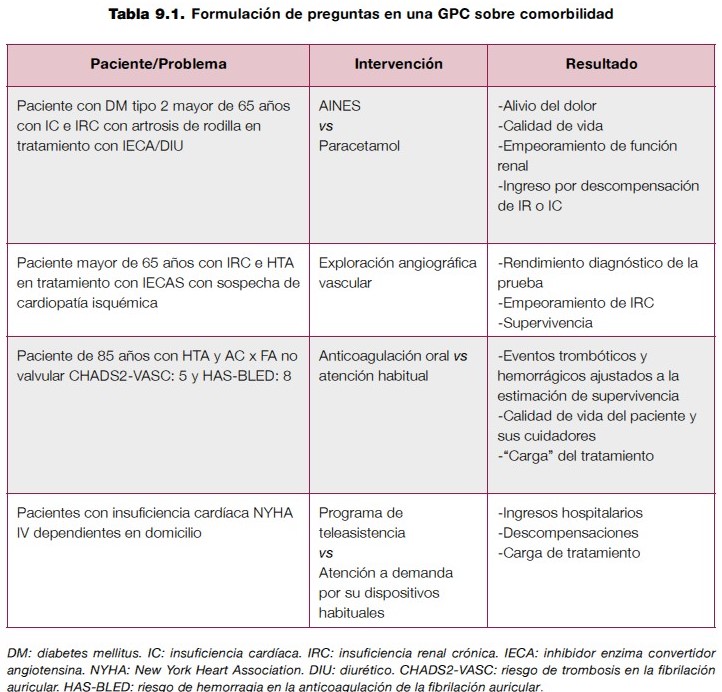
Este planteamiento supone un cambio en la estructura de las preguntas que pasarían de ser cuestiones PICO a ser PICCOT, donde la segunda C corresponde a comorbilidad y la T al marco temporal en el que considerar los desenlaces19. En la tabla 9.1 se presentan algunos ejemplos de preguntas siguiendo las consideraciones anteriores.
9.2.4. Búsqueda y selección de la evidencia
La consideración de la comorbilidad en una GPC determina las fuentes de información que es necesario consultar. Además de las bases de datos que figuran en el capítulo 5 del manual, si incluimos la polimedicación y las interacciones farmacológicas, es obligada la consulta de otras fuentes de información, como Micromedex (http://www.micromedexsolutions.com) o las webs de la Agencia Española del Medicamento y Productos sanitarios (AEMPS) (http://www.aemps.gob.es/), la Agencia Europea del Medicamento (EMA) (http://www.ema.europa.eu/ema/, etc. En estos recursos encontraremos la ficha técnica de los fármacos comercializados en nuestro país e información sobre efectos adversos, interacciones medicamentosas y alertas relacionadas con medicamentos.
De los términos utilizados con “multimorbilidad”, “comorbilidad”, ”pluripatología” solo se recoge, de momento, “comorbidity” en el tesauro de Medline y Embase*. Hasta ahora no está evaluada su capacidad para identificar artículos relevantes sobre este tema, por lo que es obligada la combinación de texto libre y tesauro. Existen algunos filtros sin validar de forma prospectiva; por ejemplo, el utilizado** en una reciente revisión sistemática sobre identificación de conjuntos de enfermedades en los pacientes ancianos25.
En muchas ocasiones, además de identificar ensayos clínicos, deberemos ampliar la selección a estudios observacionales para conocer el efecto de la intervención en determinados subgrupos de pacientes7. Por ejemplo, existe evidencia de estudios de cohortes que nos permiten cuantificar la influencia de la comorbilidad, valorada por el índice de Charlson26, sobre una variable de resultado relevante como los ingresos hospitalarios por reagudizaciones en la EPOC27 y en la insuficiencia cardíaca28.
También resultará obligada la selección y evaluación de los análisis de subgrupos con comorbilidad o por grupos de edad que proporcionan los ensayos clínicos. De esta forma podremos estimar el diferente efecto de las intervenciones diagnósticas o terapéuticas en tales pacientes.
La presencia de comorbilidad también tiene implicaciones en la selección de evidencias terapéuticas, ya que el tratamiento de la enfermedad puede empeorar una enfermedad concomitante de mayor entidad. Así, en una reciente guía nacional sobre la psoriasis elaborada con este enfoque se señalan las precauciones que deben tomarse con el uso de agentes biológicos cuando la psoriasis se acompaña de insuficiencia cardíaca29.
Un resumen de las implicaciones de la comorbilidad en el proceso de la revisión bibliográfica se presenta en la tabla 9.2.

9.2.5. Evaluación y síntesis de la evidencia
En cuanto a la calidad de la evidencia sobre comorbilidad, como se comentó en el capítulo 6, “Evaluación y síntesis de la evidencia científica”, el nivel máximo de calidad lo proporcionan los ECA, seguidos de los estudios observacionales. Pero se sabe que muchos de los pacientes con comorbilidad y pluripatología quedan excluidos de los ECA que investigan la efectividad de las intervenciones.
El GEG deberá evaluar la naturaleza (directa o indirecta) de la evidencia para cada resultado de interés, incluidos los efectos adversos. El uso de evidencia indirecta supone, según el sistema GRADE, una disminución en la calidad de la evidencia30.
En otras ocasiones los estudios realizados en poblaciones generales pueden incluir algún subgrupo con comorbilidad; por ejemplo, el análisis de la eficacia antihipertensiva de un determinado fármaco en los pacientes con insuficiencia renal e hipertensión.
En muchos ECA se observa heterogeneidad del efecto en un subgrupo de pacientes de mayor edad o con comorbilidad. Si una revisión sistemática de ECA realiza un análisis de subgrupos que incluye a estos pacientes, la evidencia puede ser más aplicable. Pero hay que ser especialmente cuidadoso en el manejo de tales análisis, ya que el efecto observado puede ser debido al azar. Tal como se ha expuesto en el capítulo 6 “Evaluación y síntesis de la evidencia científica”, GRADE propone una serie de factores que deben valorarse en el análisis de subgrupos31 y que permiten aumentar la confianza en los resultados observados (ver Tabla 6.4).
Hay que tener en cuenta que el análisis de subgrupos supone obtener estimaciones del efecto con un menor número de eventos y pacientes y, por lo tanto, mayor imprecisión, que se traduce en una evidencia de menor calidad. La clave consiste en valorar si la tendencia en el subgrupo sigue la misma dirección que en el resto de la muestra32.
En muchas ocasiones, los ECA disponibles, aunque incluyen pacientes con comorbilidad, utilizan variables subrogadas o seguimientos a muy corto plazo, por lo que habrá que buscar estudios de cohortes adicionales, con periodos de seguimiento mayores y resultados clasificados como resultados claves7. Por ejemplo, como se ha comentado, la GPC sobre diabetes en la población anciana de la American Geriatric Association recomienda niveles menos estrictos de hemoglobina glicosilada (HbA1c) según el gradiente de comorbilidad de los pacientes13. Dicha recomendación se fundamenta en la combinación de ECA en los que estos pacientes están subrepresentados, como el estudio UKPDS33, con estudios de cohortes realizados específicamente en pacientes con comorbilidades34.
Es importante recordar que, de acuerdo a GRADE, aunque los estudios observacionales se consideran de calidad baja pueden ser de alta calidad si se dan una serie de condiciones35 (ver tabla 6.1).
En definitiva, es muy probable que muchas de las recomendaciones en los pacientes con pluripatología y comorbilidad deban realizarse en base a una evidencia global de calidad baja o muy baja de acuerdo al sistema GRADE4.
9.2.6. Formulación de las recomendaciones
El GEG debe valorar la forma en que la presencia de comorbilidad puede afectar a la elaboración de las recomendaciones; es probable que implique modificar el sentido de una recomendación, su fuerza o su prioridad7.
A continuación se comentan las implicaciones que tiene la consideración de la comorbilidad y la pluripatología en los juicios secuenciales que propone GRADE para formular recomendaciones, además de lo señalado anteriormente sobre la priorización de las variables de resultado.
Calidad global de la evidencia: GRADE propone que se considere como la calidad global la inferior de todas las variables clave. Como se ha comentado previamente, esto supone que muchas de las recomendaciones deberán formularse en base a evidencia de baja o muy baja calidad.
Balance beneficio-riesgo: resulta indispensable tener en cuenta el tiempo de rentabilidad20 y las preferencias de pacientes y cuidadores a la hora de estimar el peso de las variables a favor y en contra de una intervención. La expectativa de vida y el pronóstico de los pacientes es determinante en este punto. Para ello resultan de mucha ayuda la utilización de escalas pronósticas36.
En la predicción de la expectativa vital se pueden usar modelos de predicción lo más específicos posible de patologías, cuando la GPC sea sobre un problema índice y sus comorbilidades (figura 1-A y 1-C). En otros casos (figura 1-B), además de los índices específicos por enfermedad serán necesarias escalas centradas en el paciente y su comorbilidades, como el índice de Charlson26, el PROFUND37-38 o el índice PALIAR26,37-39.
Es especialmente importante la evaluación del beneficio-riesgo de la polimedicación presente en este tipo de pacientes. Existen instrumentos, como el STOPP-START, Beers MAI, o MAI modificado)39 que pueden recomendarse para este propósito; aunque estos criterios por sí mismos no explican todas las posibles reacciones adversas40. Para la evaluación global de la adecuación del tratamiento farmacológico resulta muy útil el concepto de “deprescripción”, entendido como un proceso continuo (prescripción-deprescripción), adaptado a cada persona y a sus circunstancias, y que puede concluir con la modificación de dosis, sustitución o eliminación de unos fármacos y adición de otros infrautilizados41.
Al realizar el balance beneficio-riesgo es necesario incorporar la “carga de autocuidados” como efecto desfavorable. La acumulación de recomendaciones que determina la comorbilidad puede suponer una carga de trabajo inasumible para el paciente y su entorno. Se estima en más de dos horas diarias el tiempo necesario para cumplir las recomendaciones de muchos pacientes con comorbilidad, sobre todo cuando una de ellas es la diabetes24.
Costes sanitarios y sociales: la consideración de los costes es especialmente problemática en este grupo de pacientes. Hay que considerar los costes para el propio paciente y su entorno, que incluyen, además de los medicamentos, los desplazamientos para consultas o rehabilitación y los costes laborales de los cuidadores. Además, es necesario considerar el impacto de la atención a estos pacientes sobre la propia vida del cuidador, incluida su propia salud42.
Los costes para el sistema sanitario deben incorporar la evaluación sobre las nuevas formas de atención a tales colectivos. En este sentido, muchas de las estrategias propuestas, como la creación de enfermería para transferencia interniveles asistenciales, o el uso de las nuevas tecnologías de comunicación están pendientes de ser sometidas a evaluación en nuestro entorno.
Factibilidad: el GEG deberá valorar si el sistema de salud para el que se desarrolla la GPC es capaz de asumir la complejidad de las recomendaciones, su aplicación más allá del propio paciente y la necesaria intervención del personal de los servicios sanitarios y servicios sociales.
Valores y preferencias: el sistema GRADE de formulación de recomendaciones propone como paso inicial la clasificación de la importancia de las variables de resultado. La importancia de un resultado puede verse afectada por el riesgo competitivo de otro desenlace cuando se consideran todos en conjunto. Para un paciente diabético con insuficiencia renal crónica, la progresión a fracaso renal puede ser menos deseable que la muerte por evento cardiovascular. Del mismo modo, una persona con comorbilidad en alto riesgo inmediato de un desenlace negativo mayor (muerte, crisis cardiaca, ictus), puede preferir priorizar la reducción del riesgo de un desenlace de otra enfermedad a priori relativamente menos importante (fractura por osteoporosis).
Graduación de las recomendaciones: El GEG deberá elaborar recomendaciones para determinados grupos de pacientes, dado que una determinada intervención puede comportarse de forma distinta para un determinado subgrupo de pacientes. También la diferente calidad de la evidencia disponible puede obligar a realizar recomendaciones más o menos firmes para cada subgrupo.
Las distintas expectativas vitales y grupos de riesgo condicionan la elaboración de recomendaciones para cada etapa vital. Por ejemplo, la GPC de la International Diabetes Federation (IDF) sobre la diabetes en el anciano plantea la clasificación de los pacientes en un rango de fragilidad de cuatro niveles en función de su comorbilidad, estado funcional y dependencia23. La GPC se adapta para cada estadio, de forma que en el estadio final (expectativa de menos de un año de vida) se recomiendan intervenciones específicas, como valorar la deprescripción utilizando criterios Beers, realizar cambios con parsimonia o tener en cuenta a los cuidadores.
9.2.7. Claves para la implementación
Como se señala en el capítulo 10, “Implementabilidad de las Guías de Práctica Clínica”, la existencia de GPC de calidad no garantiza que sus recomendaciones sean trasladadas a las políticas sanitarias ni a la práctica asistencial diaria. En nuestro medio, las GPC con el diseño necesario esbozado en este capítulo son inexistentes, en un momento, además, en el que la mejor forma de adaptar los sistemas sanitarios para abordar el envejecimiento y la comorbilidad es objeto de debate43.
La mejora de la práctica clínica a través de la implementación de las GPC sobre una sola patología cuenta con extensa literatura44, aunque la mayor parte de esa literatura está desarrollada fuera de nuestro medio45. La implementación de GPC sobre un solo proceso se suele enmarcar dentro de las intervenciones educativas para profesionales; pero existe ya suficiente consenso sobre la idea de que los cambios en la práctica médica necesitan de intervenciones complejas multifactoriales, que engloben cambios organizativos e intervenciones educativas para profesionales y pacientes41.
La implementación de una GPC sobre comorbilidad es un proceso complejo que debe ser planificado cuidadosamente. En el capítulo 10, “Implementabilidad de las Guías de Práctica Clínica”, se explican los conceptos de implementación e implementabilidad de una GPC46, entendiendo el concepto de implementabilidad como las características del contenido, diseño y edición de una GPC que pueden facilitar la implementación. El concepto de implementación no es objeto de estudio en este manual, y en el caso de la comorbilidad puede requerir intervenciones destinadas a mejorar la coordinación entre niveles asistenciales o a capacitar a los profesionales en la toma de decisiones complejas con pacientes y cuidadores47. En este sentido resulta esencial asegurar que los pacientes con comorbilidad han sido adecuadamente informados de los beneficios, daños e inconvenientes de las diferentes opciones de tratamiento48.
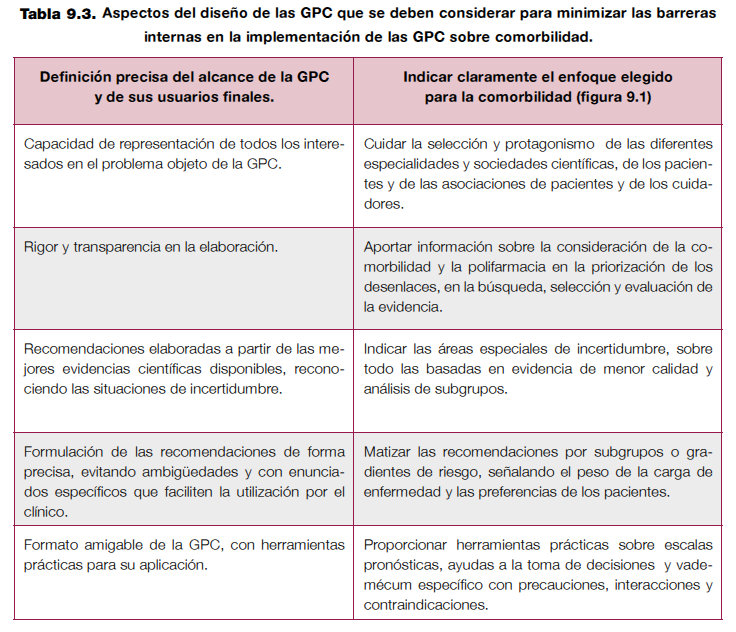
Existen numerosas herramientas a disposición del GEG para facilitar la implementabilidad de su GPC, entre ellas el instrumento AGREE-II. En la tabla 9.3 se resumen con sus propuestas adaptadas a las GPC sobre comorbilidad.
Por último, la evaluación de la implementación de una GPC requiere la monitorización mediante indicadores adecuados, dado que la aplicación de indicadores de las GPC generales a poblaciones con elevada comorbilidad puede llevar a situaciones de excesiva medicalización y carga, dañinas para el paciente y su entorno (cuidadores). Los indicadores deberían estar orientados a evaluar si la atención a los pacientes con pluripatología se realiza de forma continua y coordinada entre la atención primaria y especializada, o a la calidad de vida, más que estar orientados a valorar los procesos o resultados de acuerdo con variables biológicas.
Por ejemplo, en lugar de evaluar indicadores ligados a variables biológicas de una sola enfermedad como presión arterial, niveles de Hb A1c, etc., puede ser más adecuado considerar otro tipo de indicadores como los siguientes:
- Número de descompensaciones de las patologías consideradas en la GPC;
- Deterioro funcional;
- Utilización de recursos asistenciales (consultas, urgencias, hospitalizaciones…);
- Indicadores relacionados con el uso de la polimedicación (número de fármacos, de prescripción y fármacos considerados de riesgo para su situación determinados por criterios objetivos (Beers, Stopp-Start, etc.));
- Número de caídas, la calidad de vida, ausencia de dolor, disminución de la dependencia, evitación de institucionalización, etc.
Estos indicadores, más específicos y realistas, deben ser lo suficientemente flexibles para tener en cuenta las circunstancias únicas de cada paciente.
Resumen de los Aspectos Clave
Notas
(*) En Pubmed el término MesH “Aged” incluye a los mayores de 65 años y por debajo de él existen “Aged, 80 and over” y “Frailelderly”. Además de estar disponibles los grupos de edad en la opción “Limits”.
(**) 1-multimorbid*[tiab] OR multi-morbid*[tiab] OR multiple morbidit*[tiab] OR multiple diseas*[tiab] OR multiple illness*[tiab] OR multiple diagnos*[tiab] OR multiple chronic diseas*[tiab] OR multiple chronic illness*[tiab] OR multiple chronic diagnos*[tiab]OR multiple chronic condition*[tiab] 2-comorbidity[Mesh] OR comorbid*[ti] OR comorbid*[ti].3-chronicdisease”[Mesh].4-#2 AND #3.5-measure[tiab] OR measured[tiab] OR measurement[tiab] OR measurements[tiab] OR measures[tiab] OR index[tiab] OR indexes[tiab] OR indexed[tiab] OR indices[tiab] OR list[tiab] OR listed[tiab] OR lists[tiab] OR classification[tiab] OR classifications[tiab] OR classified[tiab] OR classifies[tiab] OR classify[tiab] OR classifying[tiab] OR instrument[tiab] OR instruments[tiab] OR definition[tiab] OR define[tiab] OR defined[tiab] OR scale[tiab]. 6-#1 AND #5. 7-#4 AND #5.8-#6 OR #7.
Bibliografía 9. Abordaje de la comorbilidad y la pluripatología
1. Dawes M. Co-morbidity: we need a guideline for each patient not a guideline for each disease. Fam Pract [Internet]. 2010 Feb;27(1):1-2 [consultado 03/03/2016]. Disponible en: http://fampra.oxfordjournals.org/content/27/1/1.long.
2. Zulman DM, Sussman JB, Chen X, Cigolle CT, Blaum CS, Hayward RA. Examining the evidence: a systematic review of the inclusion and analysis of older adults in randomized controlled trials. J Gen Intern Med [Internet]. 2011 Jul;26(7):783-90. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3138606/.
3. Bernabeu-Wittel M, Alonso-Coello P, Rico-Blázquez M, Rotaeche del Campo R, Sánchez Gómez S, Casariego Vales E. Desarrollo de guías de práctica clinica en pacientes con comorbilidad y pluripatologia. Aten primaria. 2014 Ago-Sep;46(7):385-392.
4. Fabbri LM, Boyd C, Boschetto P, Rabe KF, Buist AS, Yawn B, et al. How to integrate Multiple Comorbidities in Guideline Development: article 10 in Integrating and Coordinating Efforts in COPD Guideline Development. Proc Am Thorac Soc. 2012;9(5):274-81.
5. Orueta JF, Nuño-Solinís R, García-Álvarez A, Alonso-Morán E. Prevalence of multimorbidity according to the deprivation level among the elderly in the Basque Country. BMC Public Health [Internet]. 2013 Oct;13:918 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3852493/.
6. Barnett K, Mercer SW, Norbury M, Watt G, Wyke S, Guthrie B. Epidemiology of multimorbidity and implications for health care, research, and medical education: a cross-sectional study. Lancet [Internet]. 2012 Jul;380(9836):37-43 [consultado 03/03/2016]. Disponible en: http://www.sciencedirect.com/science/article/pii/S0140673612602402.
7. Uhlig K, Leff B, Kent D, Dy S, Brunnhuber K, Burgers JS, et al. A framework for crafting clinical practice guidelines that are relevant to the care and management of people with multimorbidity. J Gen Intern Med [Internet]. 2014 Apr;29(4):670-9 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3965742/.
8. Fitzgerald LS, Hanlon JT, Shelton PS, Landsman PB, Schmader KE, Pulliam CC, et al. Reliability of a modified medication appropriateness index in ambulatory older persons. Ann Pharmacother. 1997 May;31(5):543-8.
9. Gallagher P, Ryan C, Byrne S, Kennedy J, O’Mahony D. STOPP (Screening Tool of Older Person’s Prescriptions) and START (Screening Tool to Alert doctors to Right Treatment). Consensus validation. Int J Clin Pharmacol Ther. 2008 Feb;46(2):72-83.
10. Garfinkel D, Mangin D. Feasibility study of a systematic approach for discontinuation of multiple medications in older adults: addressing polypharmacy. Arch Intern Med [Internet]. 2010 Oct;170(18):1648-54 [consultado 03/03/2016]. Disponible en: http://archinte.jamanetwork.com/article.aspx?articleid=226051.
11. Hanlon JT, Schmader KE, Samsa GP, Weinberger M, Uttech KM, Lewis IK, et al. A method for assessing drug therapy appropriateness. J Clin Epidemiol. 1992 Oct;45(10):1045-51.
12. Samsa GP, Hanlon JT, Schmader KE, Weinberger M, Clipp EC, Uttech KM, et al. A summated score for the medication appropriateness index: development and assessment of clinimetric properties including content validity. J Clin Epidemiol. 1994 Aug;47(8):891-6.
13. Grupo de trabajo de implicación de pacientes en el desarrollo de GPC. Implicación de pacientes en el desarrollo de guías de práctica clínica: Manual Metodológico [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad. Instituto Aragonés de Ciencias de la Salud-IACS; 2013. (Guías de Práctica Clínica en el SNS: IACS Nº 2010/01) [consultado 03/03/2016]. Disponible en: https://portal.guiasalud.es/wp-content/uploads/2021/01/manual_metodologico_pacientes.pdf
14. Alonso-Coello P, Montori VM, Díaz MG, Devereaux PJ, Mas G, Diez AI, et al. Values and preferences for oral antithrombotic therapy in patients with atrial fibrillation: physician and patient perspectives. Health Expect. 2015 Dec;18(6):2318-27.
15. Putcha N, Puhan MA, Hansel NN, Drummond MB, Boyd CM. Impact of co-morbidities on self-rated health in self-reported COPD: an analysis of NHANES 2001-2008. COPD [Internet]. 2013 Jun;10(3):324-32 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4459792/.
16. Muth C, Kirchner H, van den Akker M, Scherer M, Glasziou PP. Current guidelines poorly address multimorbidity: pilot of the interaction matrix method. J Clin Epidemiol. 2014 Nov;67(11):1242-50.
17. Dumbreck S, Flynn A, Nairn M, Wilson M, Treweek S, Mercer SW, et al. Drug-disease and drug-drug interactions: systematic examination of recommendations in 12 UK national clinical guidelines. BMJ [Internet]. 2015 Mar;350:h949 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4356453/.
18. Scott PA, Kingsley GH, Scott DL. Non-steroidal anti-inflammatory drugs and cardiac failure: meta-analyses of observational studies and randomised controlled trials. Eur J Heart Fail [Internet]. 2008 Nov;10(11):1102-07 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0026354/.
19. Lapi F, Azoulay L, Yin H, Nessim SJ, Suissa S. Concurrent use of diuretics, angiotensin converting enzyme inhibitors, and angiotensin receptor blockers with non-steroidal anti-inflammatory drugs and risk of acute kidney injury: nested case-control study. BMJ [Internet]. 2013 Jan;346:e8525 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3541472/.
20. Braithwaite RS, Concato J, Chang CC, Roberts MS, Justice AC. A framework for tailoring clinical guidelines to comorbidity at the point of care. Arch Intern Med. 2007 Nov;167(21):2361-65 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3460384/.
21. Cigolle CT, Blaum CS, Halter JB. Diabetes and cardiovascular disease prevention in older adults. Clin Geriatr Med. 2009 Nov;25(4):607-41, vii-viii.
22. Guyatt GH, Oxman AD, Kunz R, Atkins D, Brozek J, Vist G, et al. GRADE guidelines: 2. Framing the question and deciding on important outcomes. J Clin Epidemiol. 2011 Apr;64(4): 395-400.
23. Internation Diabetes Federation (IDF) Working Group. IDF Managing Older People with Type 2 Diabetes. Global Guideline. Brussels: IDF; 2013.
24. Jowsey T, Yen L, W PM. Time spent on health related activities associated with chronic illness: a scoping literature review. BMC Public Health [Internet]. 2012 Dec;12:1044 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3533987/.
25. Sinnige J, Braspenning J, Schellevis F, Stirbu-Wagner I, Westert G, Korevaar J. The prevalence of disease clusters in older adults with multiple chronic diseases--a systematic literature review. PloS One [Internet]. 2013 Nov;8(11):e79641 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3823581/.
26. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373-83.
27. Arostegui I, Esteban C, García-Gutierrez S, Bare M, Fernández-de-Larrea N, Briones E, et al. Subtypes of patients experiencing exacerbations of COPD and associations with outcomes. PloS One [Internet]. 2014 Jun;9(6):e98580 [consultado 03/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4044022/.
28. Ruiz-Laiglesia FJ, Sánchez-Marteles M, Pérez-Calvo JI, Formiga F, Bartolomé-Satué JA, Armengou-Arxé A, et al. Comorbidity in heart failure. Results of the Spanish RICA Registry. QJM. 2014 Dec;107(12):989-94.
29. Daudén E, Castañeda S, Suárez C, García-Campayo J, Blasco AJ, Aguilar MD, et al. Abordaje integral de la comorbilidad del paciente con psoriasis. Actas Dermo-sifiliogr [Internet]. 2012 Jan.103 Suppl 1:1-64 [consultado 03/03/2016]. Disponible en: http://www.actasdermo.org/...
30. Daudén E, Castañeda S, Suárez C, García-Campayo J, Blasco AJ, Aguilar MD, et al. Abordaje integral de la comorbilidad del paciente con psoriasis. Actas Dermo-sifiliogr [Internet]. 2012 Jan.103 Suppl 1:1-64 [consultado 03/03/2016]. Disponible en: http://www.actasdermo.org/....
31. Guyatt GH, Oxman AD, Kunz R, Woodcock J, Brozek J, Helfand M, et al. GRADE guidelines: 7. Rating the quality of evidence--inconsistency. J Clin Epidemiol. 2011 Dec;64(12):1294-302.
32. Guyatt GH, Oxman AD, Kunz R, Brozek J, Alonso-Coello P, Rind D, et al. GRADE guidelines 6. Rating the quality of evidence--imprecision. J Clin Epidemiol. 2011 Dec;64(12):1283-93.
33. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998 Sep;352(9131):837-53.
34. Greenfield S, Billimek J, Pellegrini F, Franciosi M, De Berardis G, Nicolucci A, et al. Comorbidity affects the relationship between glycemic control and cardiovascular outcomes in diabetes: a cohort study. Ann Intern Med. 2009 Dec;151(12):854-860.
35. Guyatt GH, Oxman AD, Sultan S, Glasziou P, Akl EA, Alonso-Coello P, et al. GRADE guidelines: 9. Rating up the quality of evidence. J Clin Epidemiol. 2011 Dec;64(12):1311-6.
36. Thomas K, et al. The Gold Standards Framework (GSF) Prognostic Indicator Guidance (PIG) 4ª ed. The Gold Standards Framework Centre In End of Life Care CIC; 2011 [consultado 08/03/2016].
37. Bernabeu-Wittel M, Formiga F, Ollero-Baturone M, PROFUND Researchers. A new prognostic index centered on polypathological patients. The PROFUND index. J Gerontol A Biol Sci Med Sci [Internet]. 2011 Dec;66(12):1393-4; author reply 1395-6 [consultado 08/03/2016]. Disponible en: http://biomedgerontology.oxfordjournals.org/content/66A/12/1393.long.
38. Bernabeu-Wittel M, Murcia-Zaragoza J, Hernandez-Quiles C, Escolano-Fernández B, Jarava-Rol G, Oliver M, et al. Development of a six-month prognostic index in patients with advanced chronic medical conditions: the PALIAR score. J Pain Symptom Manage. 2014;47(3):551-65.
39. Colombo Bohórquez P, Nieto Martín MD, Pascual de la Pisa B, García Lozano MJ, Ortiz Camúñez MA, Bernabéu Wittel M. Validación de un modelo pronóstico para pacientes pluripatológicos en atención primaria: Estudio PROFUND en atención primaria. Aten Primaria [Internet]. 2014 Jun;46 Suppl 3:41-8 [consultado 08/03/2016]. Disponible en: http://www.sciencedirect.com/science/article/pii/S0212656714700642.
40. Kanaan AO, Donovan JL, Duchin NP, Field TS, Tjia J, Cutrona SL, et al. Adverse drug events after hospital discharge in older adults: types, severity, and involvement of Beers Criteria Medications. J Am Geriatr Soc [Internet]. 2013 Nov;61(11):1894-9 [consultado 08/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4446728/.
41. Gavilán-Moral E, Villafaina-Barroso A, Jiménez-de Gracia L, Gómez Santana MC. Ancianos frágiles polimedicados, ¿es la deprescripción de medicamentos la salida? Rev Esp Geriatr Gerontol. 2012 Jul-Aug;47(04):162-7.
42. Adelman RD, Tmanova LL, Delgado D, Dion S, Lachs MS. Caregiver burden: a clinical review. JAMA. 2014 Mar;311(10):1052-60.
43. Ministerio de Sanidad, Servicios Sociales e Igualdad. Estrategia para el Abordaje de la Cronicidad en el Sistema Nacional de Salud. Estrategia aprobada por el Consejo Interterritorial del Sistema Nacional de Salud el 27 de junio de 2012 [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2012 [consultado 08/03/2016]. Disponible en: https://www.mscbs.gob.es/organizacion/portada/home.htm....
44. Grimshaw JM, Thomas RE, MacLennan G, Fraser C, Ramsay CR, Vale L, et al. Effectiveness and efficiency of guideline dissemination and implementation strategies. Health Technol Assess [Internet]. 2004 Feb;8(6):iii-iv, 1-72 [consultado 08/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0021503/.
45. Brusamento S, Legido-Quigley H, Panteli D, Turk E, Knai C, Saliba V, et al. Assessing the effectiveness of strategies to implement clinical guidelines for the management of chronic diseases at primary care level in EU Member States: a systematic review. Health Policy. 2012 Oct;107(2-3):168-83.
46. Shiffman RN, Dixon J, Brandt C, Essaihi A, Hsiao A, Michel G, et al. The GuideLine Implementability Appraisal (GLIA): development of an instrument to identify obstacles to guideine implementation. BMC Med Inform Decis Mak [Internet]. 2005 Jul;5:23 [consultado 08/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1190181/.
47. Bernabeu-Wittel M, Ollero-Baturone M, Ruiz-Cantero A, Moreno-Gaviño L, Barón-Franco B, Fuertes A, et al. Functional Decline Over 1-year Follow-up in a Multicenter Cohort of Polypathological Patients: A New Approach to Functional Prognostication. Int J Gerontol [Internet]. 2012 Jun;6(2):68-74 [consultado 08/03/2016]. Disponible en: http://www.ijge-online.com/article/S1873-9598(11)00109-8/pdf.
48. Guiding principles for the care of older adults with multimorbidity: an approach for clinicians: American Geriatrics Society Expert Panel on the Care of Older Adults with Multimorbidity. J Am Geriatr Soc [Internet]. 2012 Oct;60(10):E1-E25 [consultado 08/03/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4450364/.
Lecturas recomendadas
• Bernabeu-Wittel M, Alonso-Coello P, Rico-Blázquez M, Rotaeche del Campo R, Sánchez Gómez S, Casariego Vales E. Desarrollo de guías de práctica clínica en pacientes con comorbilidad y pluripatología. Rev Clin Esp [Internet]. 2014 Ago-Sep;214(6) [consultado 08/03/2016]. Disponible en: http://www.revclinesp.es/es/desarrollo-guias-practica-clinica-pacientes/articulo/S0014256514002008/.
Revisión narrativa elaborada por tres sociedades científicas nacionales que efectúa una revisión sobre el estado de la cuestión del abordaje de la comorbilidad y la pluripatología en la elaboración de GPC destacando la necesidad de avance metodológico en este campo. Incluye una definición de términos relacionados con la comorbilidad y pluripatología.
• Working Groups. Multimorbidity En: Guidelines International Network [Internet]. Piltlochry (Scotland): The Guidelines International Network; 2015 [consultado 08/03/2016]. Disponible en: http://www.g-i-n.net/working-groups/multimorbidity.
Recopilación de recursos (websites, presentaciones, bibliografía, etc.) sobre mutimorbilidad y sobre las reuniones y presentaciones del grupo.
Tablas y figuras
Figura 9.1. Diferentes modelos de GPC en función del abordaje de la comorbilidad (modificado de Uhlig7)
Tabla 9.1. Formulación de preguntas en GPC sobre comorbilidad.






