Javier Gracia, Esther Martín, Mª del Mar Trujillo
4.1. Introducción
Una vez delimitado el alcance y objetivos de la GPC, el siguiente paso es concretar su contenido en un listado de preguntas clínicas que van a ser respondidas con evidencia científica en base a la cual se formularán las recomendaciones. Con este listado se consigue un “mapa de preguntas”, que constituye el esqueleto del contenido de la guía y que tiene doble finalidad. Por una parte, servirá para comprobar que se han cubierto todos los aspectos del alcance de la guía; por otra, servirá a los usuarios de la GPC para conocer si en ese documento encontrarán la respuesta a una determinada cuestión.
4.2. Definición y selección de las preguntas a responder
Las preguntas clínicas pueden dividirse, según se hayan formulado de una forma más o menos concreta, en genéricas y específicas.
4.2.1. Preguntas genéricas
En esta fase, y para asegurar que el listado de preguntas refleja todo el alcance propuesto para la guía, puede ser útil la elaboración de un algoritmo de decisiones que intente resumir los diversos aspectos de la atención al problema objeto de la GPC. Así, en cada paso de dicho algoritmo se pueden identificar y resumir en forma de preguntas genéricas las cuestiones que se deben contestar en la sucesiva toma de decisiones planteadas. Es conveniente que al principio de cada capítulo de una GPC aparezca una relación de las preguntas formuladas de forma general durante esta etapa.
4.2.2. Preguntas específicas
A medida que adquirimos experiencia en la búsqueda y selección de la evidencia científica (ver capítulo 5, “Búsqueda y selección de la evidencia científica”), nos damos cuenta de la importancia de que las preguntas genéricas sean más concretas. Habitualmente es necesario descomponer la lista de preguntas clínicas en varias preguntas más específicas. Para ello, es muy útil la realización de una búsqueda bibliográfica preliminar que permita reformular y generar nuevas preguntas, esta vez más específicas. A menudo se basarán en las cuestiones clave en el tema de estudio y, por lo general, contendrán más detalles que estas.
Las preguntas clínicas específicas deberían cubrir todas las áreas especificadas en el ámbito de la guía y no deberían introducir nuevas áreas. Pueden ser redefinidas y acordadas con personas con conocimiento y experiencia clínica en la disciplina. Cuando sea necesario redefinir estas preguntas después de que se haya identificado la evidencia, los cambios deberían ser acordados y consensuados con el grupo elaborador y documentados en la revisión de la evidencia.
4.2.3. Número de preguntas que deben incluirse en la guía
El número de preguntas clínicas para cada guía depende del tema y de la amplitud del alcance que se haya definido en las etapas iniciales y puede variar considerablemente en función del número de estudios que incluya cada pregunta y de la complejidad de su análisis. Por ejemplo, ciertas preguntas clínicas implican múltiples intervenciones que es necesario comparar (por ejemplo, elección del antihipertensivo inicial en la HTA sin comorbilidad), con muchos estudios primarios y revisiones, mientras que otras podrían plantear el efecto de una única intervención que disponga de pocos estudios primarios. No existe, por tanto, un número total ideal de preguntas; aunque sí es importante que sea un número abordable para el grupo elaborador de la guía y que se cubran los aspectos relevantes del alcance y objetivo de la GPC. En este sentido, como orientación puede ser de gran ayuda identificar y cuantificar el número de preguntas incluidas en otras GPC publicadas previamente sobre el tema. En los casos en los que el número resultante de preguntas sea amplio, puede ser útil dividir la guía en secciones sobre áreas más específicas.
4.3. Formulación de las preguntas: formato PICO y otros
Una vez elaborada la lista de preguntas clínicas que se van a responder, deben formularse con un formato estructurado1, de manera que definan los límites de la revisión de la evidencia, constituyan el esquema para el desarrollo de las búsquedas de literatura y actúen como guía para la formulación de recomendaciones.
4.3.1. Formato PICO
Para convertir una pregunta clínica en otra formulada de forma estructurada, una metodología aceptada a nivel internacional propone especificar e identificar cuatro componentes clave bien diferenciados:
- La población a la que va dirigida (Pacientes), especificando grupos de edad, sexo, estadio de la enfermedad, comorbilidad, nivel de riesgo, contexto, etc.
- La intervención que se va a evaluar (Intervención), que incluye dispositivo, procedimiento, prueba diagnóstica, exposición, factor pronóstico, factor de riesgo, agente etiológico, etc.
- La intervención con la que se quiere comparar (Comparador).
- Las variables de resultado o desenlaces de interés (Outcomes), considerando los clínicamente relevantes e importantes para el paciente en el caso de estudios sobre eficacia, pronóstico o etiología; y en el caso de los estudios de pruebas diagnósticas, estimadores de rendimiento o validez diagnóstica (sensibilidad, especificidad, coeficientes de probabilidad y valores predictivos).
Las iniciales de estas denominaciones de los cuatro elementos en inglés dan lugar al acrónimo PICO (Patient, Intervention, Comparison, Outcomes) por el que se conoce a este formato de pregunta estructurada2,3. El proceso de formulación de una pregunta en este formato se ilustra en el ejemplo de la tabla 4.1.
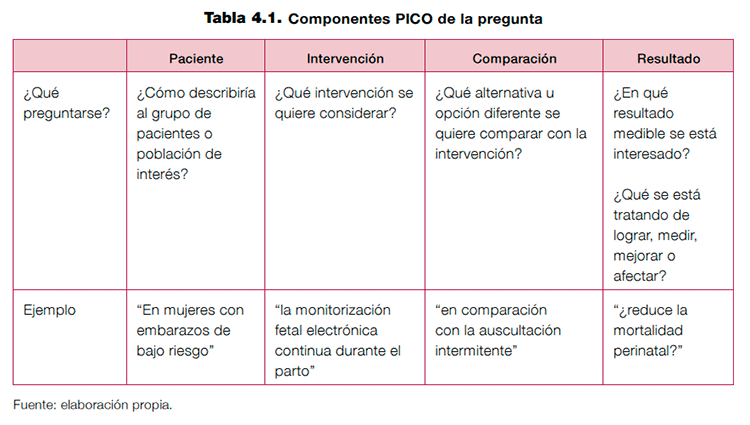
Ver en el anexo 4.1. la plantilla para la formulación de la pregunta en formato PICO.
Ventajas de formular las preguntas clínicas bien estructuradas en formato PICO:
- Favorece el desarrollo de la guía de forma ordenada y clara.
- Dirige hacia una respuesta pertinente y precisa de la pregunta.
- Facilita el diseño de la estrategia de búsqueda bibliográfica, ya que la subdivisión en componentes permite la elección y combinación de términos libres y descriptores, maximizando la recuperación de evidencia en las bases de datos.
- Permite conocer el tipo de pregunta que se ha formulado (intervención, diagnóstico, pronóstico o etiología y daño) y, por tanto, ayuda a identificar y seleccionar el tipo de diseño de investigación clínica más apropiado para responderla (ver la tabla 5.4. en el capítulo 5, «Búsqueda y selección de la evidencia científica»).
- Ayuda a determinar los criterios de selección (inclusión o exclusión) de los estudios objeto de la búsqueda bibliográfica. Estos criterios son una combinación de los cuatro componentes del formato PICO, además de la especificación de los diseños que mejor responden a la pregunta.
- Facilita la elaboración de recomendaciones de forma específica para cada cuestión clínica.
En el caso de preguntas sobre pronóstico y etiología, los componentes de PICO “Intervención” y “comparación” corresponden a factores pronósticos y etiológicos a evaluar. En estos casos en los que la pregunta busca responder interrogantes sobre factores causales, etiológicos y pronósticos, la intervención es reemplazada por “exposición” y la comparación por el “comparador”, que puede ser: no tener el factor de exposición. Para las preguntas sobre pruebas diagnósticas, habitualmente basta con sustituir la intervención por la nueva prueba diagnóstica a evaluar y la comparación por el “patrón oro” (gold standard) o prueba de referencia. No obstante, se han propuesto otros métodos útiles para la estructuración de las preguntas sobre pruebas diagnósticas, como el sistema PPIRT4 (Población, Pruebas previas, prueba Índice, prueba de Referencia y objetivo previsto (Target condition)).
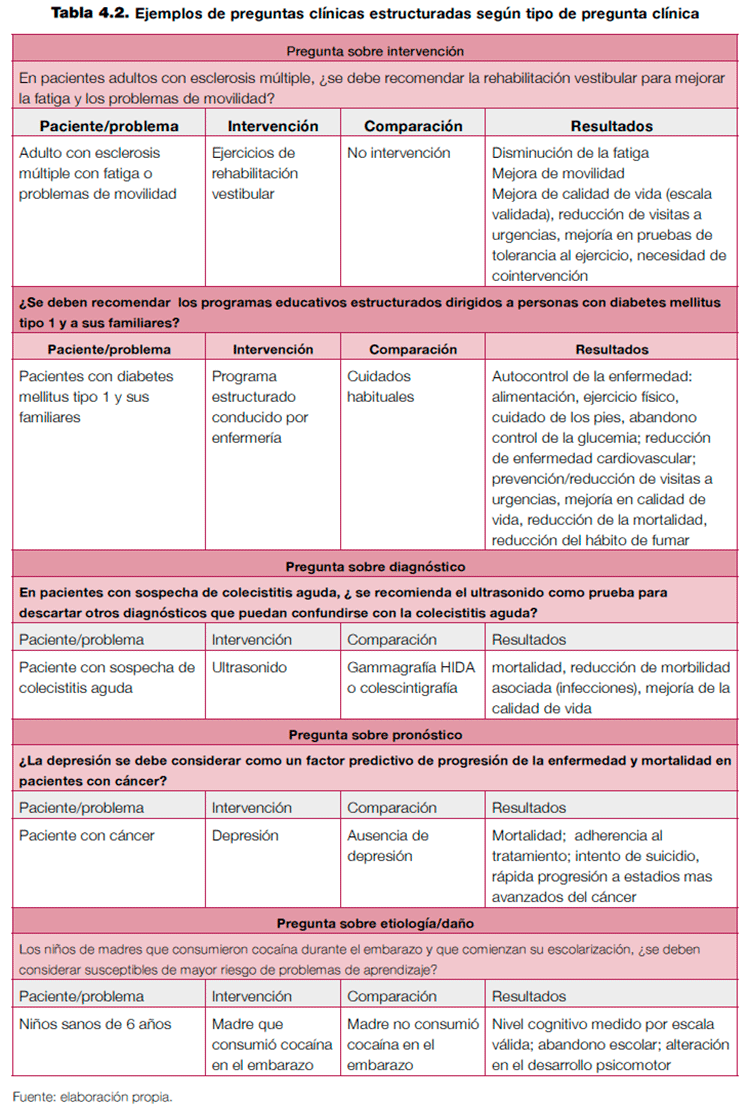
En la tabla 4.2 se muestran ejemplos de preguntas clínica estructuradas con formato PICO para diversos aspectos valorables en una GPC (tratamiento, diagnóstico, pronóstico, etiología).
4.3.1.1. Definición de los participantes de una pregunta clínica
Los pacientes o población de interés se definen en gran medida por la presencia de la condición particular que cubrirá la guía. Sin embargo, pueden ser tenidas en cuenta otras características como grupos de edad, género, estadio de la enfermedad, presencia de alguna comorbilidad, estatus socio-económico, etnicidad, área geográfica, etc., que potencialmente podrían influir en la condición clínica que aborda la GPC. El manual Expectativas metodológicas de las revisiones Cochrane de intervenciones (MECIR)5, establece como criterio metodológico obligatorio definir de forma anticipada los criterios de elegibilidad para los participantes en los estudios, especificando su contexto, diagnóstico o la definición de la enfermedad y los factores demográficos. Sin embargo, uno de los mayores desafíos a la hora de estructurar las preguntas es decidir el grado de precisión con el que se va a definir la población y la intervención.
A la hora de definir los participantes que se van a considerar en la pregunta clínica es muy importante tener en cuenta la posible presencia de comorbilidades. Por ello, para las preguntas clínicas en las que se decida incluir pacientes con comorbilidades se modificará la estructura PICO añadiendo un quinto elemento (PICCOT), con el que se delimitará qué tipo de comorbilidades se van a considerar (ver capítulo 9, “Abordaje de la comorbilidad y la pluripatología”).
4.3.1.2. Definición del tipo de intervenciones y comparadores
El segundo y tercer componente clave de una pregunta clínica formulada adecuadamente consisten en especificar la intervención de interés y aquellas con las que se va a comparar.
La naturaleza de la intervención se puede enmarcar en términos amplios (por ejemplo, intervenciones psicosociales) o precisos (por ejemplo, terapia cognitiva-conductual). A la hora de especificar la intervención conviene definir en qué consiste, con qué intensidad y frecuencia se realiza, quién la práctica y si las personas implicadas en la intervención necesitan formación previa. Los factores que especifican la naturaleza de la intervención suelen ser el método de administración (por ejemplo, grupal vs. individual), la persona que la utiliza (por ejemplo, enfermero vs. psicólogo) o el contexto (por ejemplo, pacientes ingresados vs. ambulatorios). Cuando la intervención consiste en medicamentos, se han de considerar factores como los principios activos afectados, la vía de administración, la dosis, la frecuencia de administración o la duración del tratamiento y su frecuencia. En el caso de intervenciones más complejas, como las terapias educacionales o de comportamiento, será necesario definir sus características.
El comparador hace referencia a las alternativas a la intervención a estudio disponibles. Por ejemplo, un tratamiento habitual, una variante de la misma intervención, otra intervención, no intervención o placebo, la ausencia de un factor de riesgo o etiológico, la prueba de referencia de una prueba diagnóstica, etc. En ocasiones ocurre que existen múltiples comparadores para una misma intervención. En estos casos, debería incluirse alguna pregunta clínica sobre si todos los posibles comparadores son equivalentes y sobre si algunas intervenciones son preferibles frente a otras.
4.3.1.3. Definición del tipo de variables de resultado
El cuarto componente clave de una pregunta clínica estructurada es la d definición de los desenlaces de interés que se van a considerar. La experiencia clínica y la opinión de los pacientes proporcionan las variables realmente importantes en las que debemos basar nuestras decisiones. Por ejemplo, clínicos y pacientes coincidirán en que es preciso evaluar la capacidad de un nuevo antidiabético oral de prevenir el desarrollo de micro y macroangiopatía, además de mejorar el control glucémico.
Se debe evitar incluir variables por el mero hecho de que se proporcionen en los estudios incluidos, si carecen de significado clínico. Por el contario, deberíamos incorporar todas las variables relevantes sobre resultados en salud y orientadas al paciente. De hecho, con frecuencia las variables realmente importantes no se encuentran en los estudios identificados. Tal es el caso de la diabetes tipo 2, para la cual no se ha conseguido responder de forma concluyente el impacto que tienen la mayoría de los fármacos en la prevención de las complicaciones micro y macrovasculares. La identificación de los desenlaces con significado clínico no abordados por los estudios individuales puede ser útil para poner de manifiesto lagunas de conocimiento para futuras investigaciones, que quedarán reflejadas en un apartado específico de la guía. Debe evitarse en lo posible la incorporación de variables de resultado subrogadas, intermedias o indirectas, como los resultados de laboratorio o radiológicos, ya que no pueden predecir los resultados clínicamente importantes con precisión y pueden conducir a una sobreestimación o subestimación de los verdaderos resultados clínicos9. La decisión sobre considerar o no medidas de resultado indirectas debe sustentarse en la evidencia disponible sobre la asociación entre la medida de resultado indirecta (por ejemplo, presión arterial) y la de interés (por ejemplo, accidente cerebrovascular).
Es especialmente necesario seleccionar tanto variables favorables (beneficio) como desfavorables (daño, seguridad, efectos adversos) para poder hacer un balance entre ellas y ayudar a los usuarios de las GPC a tomar la mejor decisión6,7. Por ejemplo, la pioglitazona disminuye la hemoglobina glicosilada, pero también produce edemas y toxicidad hepática.
Un caso especial es el de las variables de resultados para preguntas clínicas sobre pruebas diagnósticas, en las que con frecuencia se hace referencia a rendimiento diagnóstico (sensibilidad, especificidad), es decir, la capacidad que tiene la prueba diagnóstica para clasificar a los pacientes correctamente como enfermos y sanos. Sin embargo, la asunción correcta sería la de considerar aquellos resultados importantes para el paciente, como la morbilidad o mortalidad, que derivan de la realización del test. Por ejemplo, en pacientes afectados por un tumor supuestamente operable, un diagnóstico certero evitaría la morbilidad y la mortalidad precoz asociadas a la realización de una toracotomía inútil en los pacientes con un resultado falso positivo8 (ver capítulos 6 “Evaluación y síntesis de la evidencia científica” y 8 “Formulación de recomendaciones”).
4.3.1.3.1. Variables de resultado y metodología GRADE
Siguiendo las directrices propuestas por la metodología GRADE se seleccionarán los resultados importantes desde el punto de vista del paciente y, en caso de que estos resultados no estén disponibles, las variables intermedias que se están utilizando para reemplazar a esos desenlaces.
Consideremos, por ejemplo, una pregunta sobre el efecto de nuevos fármacos para tratar la hiperfosfatemia en pacientes con insuficiencia renal. Los efectos previstos más adecuados para medir el efecto de esta intervención, a pesar de que parece obvio que es la disminución de fosfato sérico, podrían ser la reducción de la mortalidad, el infarto de miocardio, las fracturas o el dolor debido a la calcificación de los tejidos blandos. Por ello, se debería incluir en la pregunta clínica todos los desenlaces importantes y excluir aquellos triviales, ya que su inclusión puede dar lugar a interpretaciones potencialmente engañosas, con datos que son de escasa o nula importancia.
El número de variables que se incluyan para la cuestión clínica no debería sobrepasar siete desenlaces por pregunta. Necesitamos, por tanto, establecer la importancia relativa de estas variables de resultado y elegir las que tienen mayor relevancia para nuestra pregunta clínica10. Esta priorización no debería llevarse a cabo en función de los datos observados sobre la magnitud del efecto o de que hayan sido consideradas en los estudios publicados. Por lo tanto, la priorización de los desenlaces debería realizarse antes de que se lleve a cabo la búsqueda oficial de evidencia científica.
Para establecer la importancia de las variables, el GEG (o un panel de profesionales expertos) debería puntuarlas mediante una escala del 1 al 9 (1 menos importante, 9 más importante) para clasificarlas en tres categorías:
- Críticas o clave para la toma de decisiones (entre 7 y 9 puntos).
- Importantes pero no clave para la toma de decisiones (entre 4 y 6 puntos).
- Poco importantes (entre 1 y 3 puntos).
La clasificación final de las variables de resultado seleccionadas debería establecerse en tres pasos:
- Clasificación preliminar de las variables, antes de revisar la evidencia sobre el tema.
- Revaluación de la importancia relativa de las variables una vez revisada la evidencia.
- Valoración del balance entre beneficios y riesgos de la intervención.
A modo de ejemplo, en la figura 4.1 se muestran las variables de resultado que se podrían seleccionar y su importancia relativa en una GPC sobre osteoporosis que aborde la eficacia del tratamiento con bifosfonatos.
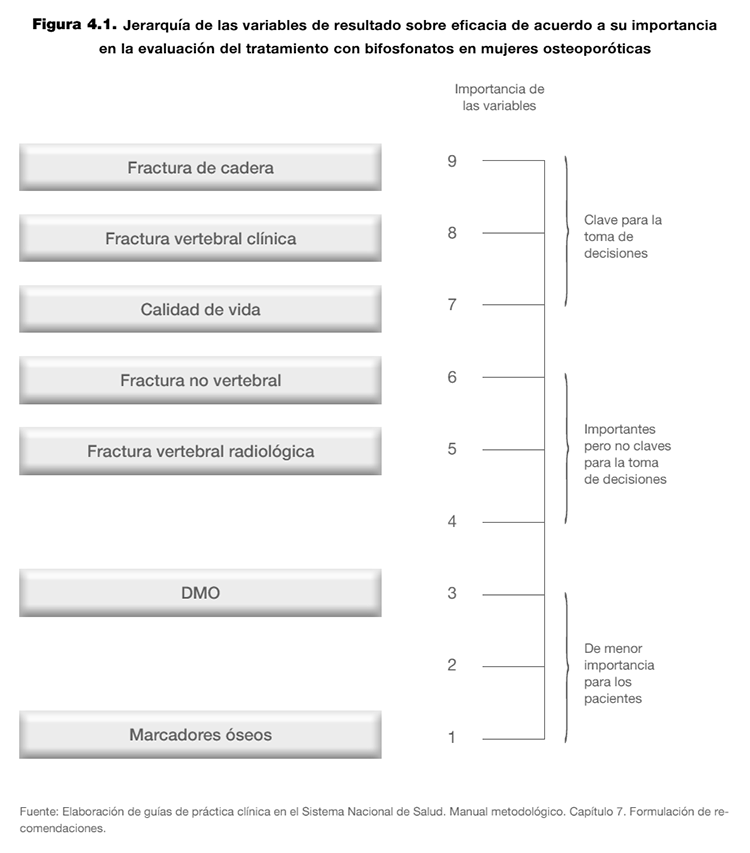
Las variables de las dos primeras categorías, sobre todo la primera, “variables clave”, son las que principalmente deberán tenerse en cuenta a la hora de formular las recomendaciones, mientras que las de menor importancia no deberían considerarse para tal fin. Las variables “importantes pero no clave” se deberían tener en cuenta si no hay estudios con variables clave, o complementando a variables cuando las variables clave no cubren todos los aspectos importantes para tomar una decisión. Todo ello, siempre con la premisa citada previamente, es decir, la certeza de que la variable importante está relacionada con el desenlace clave, como el caso de la HTA y las complicaciones cardiovasculares.
La calidad de la evidencia científica disponible para los resultados clave será la que determinará la calidad global de la evidencia científica para una pregunta concreta (ver capítulos 6 “Evaluación y síntesis de la evidencia científica”). Es recomendable que al menos una variable de resultado clave o importante se refiera a una variable sobre los efectos adversos de la intervención.
4.3.2. Otros formatos para estructurar preguntas
Aunque es habitual utilizar el formato PICO en la elaboración de preguntas clínicas, existen otras propuestas válidas para estructurarlas. Tal es el caso del formato SPICE, acrónimo de Setting, Perspective, Intervention, Comparison, Evaluation (Contexto, Perspectiva, Intervención, Comparación y Evaluación). También se puede encontrar el llamado formato PICCOT, en el que la segunda C se refiere a “comorbilidad” y el quinto elemento, “T”, describe el tiempo que se ha considerado para la recogida de los resultados a analizar (ver capítulo 9, “Abordaje de la comorbilidad y la pluripatología”).
4.4. Tipos de preguntas clínicas y diseños de estudios más adecuados
El listado de preguntas propuestas por el grupo elaborador puede contemplar aspectos de tratamiento, diagnóstico, pronóstico, prevención, organización de la asistencia sanitaria o incluso, en ocasiones, aspectos sobre las relaciones entre profesionales y pacientes, sus vivencias y expectativas. El grupo elaborador deberá considerar a priori qué diseño de estudio es más probable que responda a los objetivos de la pregunta clínica y, por tanto, será utilizado.
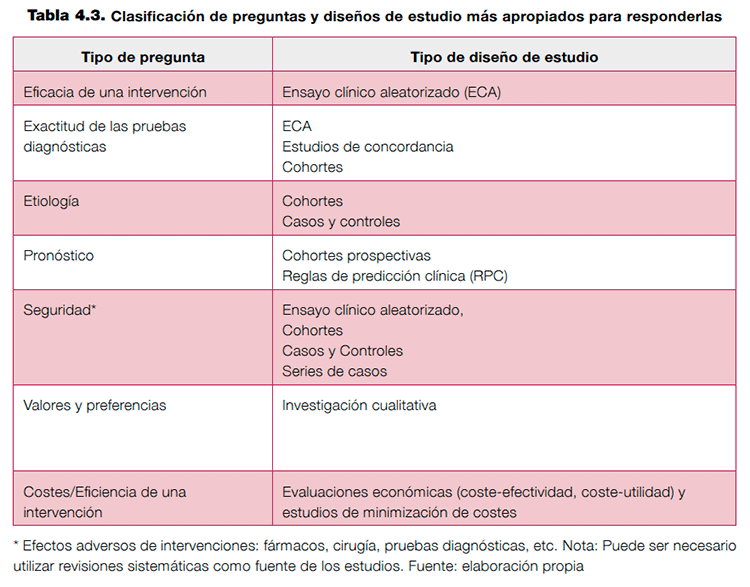
A continuación repasamos los tipos más frecuentes de preguntas clínicas junto a los diseños de estudios más adecuados para responderlas (tabla 4.3).
4.4.1. Preguntas clínicas sobre eficacia de una intervención
En términos generales, el diseño de estudio que mejor responde una pregunta clínica sobre la eficacia de una intervención es la revisión sistematica (metanálisis) de ECA y, en su defecto, los ECA (ensayo clínico aleatorizado), ya que este tipo de estudio, cuando está bien realizado, es el que tiene la mayor probabilidad de proporcionar una estimación del efecto no sesgada. La aleatorización es la única manera de prevenir la aparición de diferencias sistemáticas entre las características de los distintos grupos de participantes al inicio del estudio en cuanto a factores de confusión conocidos o no (o no medidos).
No obstante, por diversas razones, este tipo de evidencia no siempre está disponible. Además, para algunas intervenciones relacionadas con la salud puede ser técnicamente difícil o poco ético asignar poblaciones a los grupos control y de intervención. En esos casos pueden ser más apropiados otros diseños de estudios de intervención (cuasiexperimentales y observacionales). En el caso de los fármacos es habitual disponer de ECA para variables de eficacia y de seguridad a corto plazo, pero no para la seguridad a largo plazo, por lo que puede ser necesario buscar estudios observacionales para estas variables. Por ejemplo, la eficacia de los corticoides inhalados en el asma infantil sobre la evolución clínica de la enfermedad (capacidad funcional, reagudizaciones, etc.) o crecimiento a corto plazo nos la proporcionan los ensayos clínicos, mientras que su efecto sobre la talla final alcanzada precisa de la consulta de estudios de seguimiento a largo plazo (cohortes) de niños asmáticos. Para responder a otros aspectos de la pregunta, como cuando se revisa la evidencia para responder a aspectos como la perspectiva del paciente acerca del uso de servicios sanitarios o para complementar la información (por ejemplo, sobre efectos a largo plazo de la intervención), puede ser más adecuado utilizar otro tipo de diseños, como los estudios cualitativos, de farmacovigilancia, estudios de cohortes e incluso de series de casos.
4.4.2. Preguntas sobre exactitud de pruebas diagnósticas
Este tipo de preguntas se ocupan de la puesta en práctica de pruebas o estrategias diagnósticas y pueden incluir herramientas de identificación, examen físico, recogida de historial clínico, pruebas de laboratorio o anatomopatológicas y pruebas de imagen. En los estudios sobre validez de pruebas diagnósticas, los resultados de la prueba a evaluar (prueba índice) se comparan con los mostrados por la prueba de referencia o gold standard en la población de estudio11. Sin embargo, estos gold standards, que nos proporcionan certeza absoluta sobre el diagnóstico, son muy difíciles de encontrar, por lo que el principal reto es encontrar una prueba de referencia que esté tan cercana como sea posible al gold standard teórico. También es importante definir claramente qué uso exacto de la prueba queremos conocer (por ejemplo, si es como prueba de cribado o de triaje inicial o como prueba de confirmación diagnóstica o con otros fines).
Hay que tener en cuenta que la elaboración de las preguntas sobre diagnóstico admite un doble planteamiento a la hora de abordar su clasificación. En primer lugar, se puede considerar el abordaje de la capacidad de la prueba diagnóstica para clasificar a la población y separar a la población sana de la realmente enferma; por ejemplo, utilidad de la palpación del pulso para el diagnóstico de la fibrilación auricular. Pero también podemos plantearnos las consecuencias que tiene esta prueba sobre la población que se diagnostica con ella. Por ejemplo, podemos querer conocer si la realización de una campaña de toma del pulso a la población anciana produce beneficios en términos de disminución de la morbimortalidad cardiovascular y mejora de la calidad de vida. En este caso, se trata más de una pregunta sobre tratamiento en la que la intervención es la realización de una prueba diagnóstica y la comparación es la atención que se realiza de forma habitual a este tipo de población. El mismo planteamiento es el que se utiliza para justificar los programas de cribado. En el caso del cáncer de colon o de mama, lo que realmente se espera de un programa de cribado es que su aplicación en una determinada población pueda disminuir la mortalidad por dichas neoplasias.
Los diseños de estudio más adecuados para responder una pregunta clínica sobre la exactitud de las pruebas diagnósticas son, en ausencia de ECA, el estudio de concordancia y el estudio de cohortes. En estos tipos de estudios se practican a la misma población de estudio tanto la prueba índice como la prueba de referencia. No hay que olvidar que, aunque evaluar la precisión de la prueba es importante para establecer su utilidad, su verdadero valor reside en la forma en que la prueba diagnóstica guiará las decisiones terapéuticas o la provisión de servicios y, en última instancia, en su impacto sobre la mejora de los resultados clínicos.
4.4.3. Preguntas sobre pronóstico
La información de las preguntas sobre pronóstico puede ser útil en las GPC para clasificar la población dentro de categorías de riesgo que pueden ser sometidas a distintas intervenciones, para definir subgrupos de poblaciones que pueden responder de forma diferente a la intervención, para identificar factores que pueden usarse para combinar casos o para ayudar a determinar los desenlaces a largo plazo no abordados dentro del periodo de seguimiento del ensayo.
Las preguntas clínicas sobre pronóstico pueden estar relacionadas de forma estrecha con las cuestiones etiológicas en aquellos casos en los que el resultado se entiende como el desarrollo de la enfermedad en base a un número de factores de riesgo. Sin embargo, en los casos en los que uno de los factores pronósticos es el tratamiento, este tipo de preguntas están más relacionadas con preguntas sobre eficacia de la intervención.
El diseño de estudio que mejor responde las preguntas sobre pronóstico es el de cohortes prospectivas con análisis multivariante y de reglas de predicción clínica (RPC). Los estudios de casos y controles no suelen ser adecuados para responder este tipo de preguntas porque no estiman el riesgo inicial, sino que proporcionan solamente una estimación de la probabilidad del desenlace en personas con y sin el factor pronóstico.
4.4.4. Preguntas sobre etiología
En ocasiones será necesario estudiar la relación causal entre la exposición a determinados factores de riesgo y la aparición de enfermedades (por ejemplo, efectos adversos del uso de los teléfonos móviles) o los efectos adversos graves poco frecuentes de un nuevo fármaco. Puede que en el primer caso no dispongamos todavía de estudios de cohortes o ECA; en el segundo caso es probable que los ECA no incluyan un número suficiente de pacientes o un tiempo de seguimiento adecuado para detectar un efecto secundario poco frecuente o excepcional pero grave. En ambos casos pueden utilizarse estudios de casos y
controles.
4.4.5. Preguntas sobre la perspectiva de los pacientes
Las recomendaciones deben de tener en cuenta la perspectiva de los pacientes o aquellos afectados por las recomendaciones. La revisión de la literatura puede informar distintos aspectos de la elaboración de las recomendaciones, incluyendo entre otros la forma en que los pacientes valoran la importancia de los diferentes desenlaces o aspectos relacionados con la aceptabilidad de las intervenciones. Los diseños para evaluar estos temas pueden haber sido abordados mediante diseños cuantitativos (por ejemplo, valoración de la importancia de los desenlaces) como cualitativos (por ejemplo, actitudes o percepciones). Más información sobre este tema se puede obtener en el Manual Metodológico para la Implicación de Pacientes en el Desarrollo de Guías de Práctica Clínica12.
4.4.6. Preguntas clínicas sobre costes/eficiencia de una intervención
Para este tipo de preguntas el diseño más adecuado es la evaluación económica. Para más información sobre este tipo de preguntas, consultar el capítulo 7, “Consideración del uso de recursos y costes en la elaboración de recomendaciones”).
4.5. Listado de preguntas clínicas
Es importante que al final de este proceso de formulación de preguntas clínicas se disponga de un listado de todas las preguntas clínicas y en formato estructurado (PICO), clasificadas en los diferentes apartados en que se ha organizado la atención al tema objeto de la guía. Este listado se debe incorporar al anexo metodológico de la GPC.
Resumen de los Aspectos Clave
Bibliografía 4. Formulación de las preguntas clínicas de la GPC
1. Richardson WS, Wilson MC, Nishikawa J, Hayward RS. The well-built clinical question: a key to evidence-based decisions. ACP J Club. 1995 Nov-Dec;123(3):A12-A13.
2. Nobre MR, Bernardo WM, Jatene FB. A prática clínica baseada em evidências. Parte I - questões clínicas bem construídas [Internet]. Rev Assoc Med Bras. 2003 Oct-Dec; 49(4):445-9 [consultado 29/02/2016]. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-42302003000400039&lng=en&nrm=iso&tlng=en.
3. Stone PW. Popping the (PICO) question in research and evidence-based practice. Appl Nurs Res. 2002 Aug;15(3):197-8.
4. National Institute for Health and Care Excellence (NICE). Developing NICE guidelines: the manual. Manchester: NICE; 2014.
5. Higgins J, Churchill R, Lasserson T, Chandler J, Tovey D. Expectativas metodológicas de las revisiones cochrane de intervenciones (MECIR). Traducción a cargo del Centro Cochrane Iberoamericano. London: The Cochrane Collaboration; [2012].
6. Brozek JL, Akl EA, Jaeschke R, Lang DM, Bossuyt P, Glasziou P, et al. Grading quality of evidence and strength of recommendations in clinical practice guidelines: Part 2 of 3. The GRADE approach to grading quality of evidence about diagnostic tests and strategies. Allergy 2009 Aug;64(8):1109-16.
7. Brozek JL, Akl EA, Compalati E, Kreis J, Terracciano L, Fiocchi A, et al. Grading quality of evidence and strength of recommendations in clinical practice guidelines part 3 of 3. The GRADE approach to developing recommendations. Allergy. 2011 May;66(5):588-95.
8. Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ [Internet] 2008 May 17;336(7653):1106-10 [consultado 29/02/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2386626/.
9. Gøtzsche PC, Liberati A, Torri V, Rossetti L. Beware of surrogate outcome measures. Int J Technol Assess Health Care 1996 Spring;12(2):238-46.
10. Guyatt GH, Oxman AD, Kunz R, Atkins D, Brozek J, Vist G, et al. GRADE guidelines: 2. Framing the question and deciding on important outcomes. J Clin Epidemiol 2011 Apr;64(4): 395-400.
11. Knottnerus JA, van Weel C, Muris JW. Evaluation of diagnostic procedures. BMJ [Internet] 2002 Feb 23;324(7335):477-80 [consultado: 29/02/2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1122397/.
12. Grupo de trabajo de implicación de pacientes en el desarrollo de GPC. Implicación de pacientes en el desarrollo de guías de práctica clínica: Manual Metodológico [Internet]. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad. Instituto Aragonés de Ciencias de la Salud-IACS; 2013. (Guías de Práctica Clínica en el SNS: IACS Nº 2010/01) [consultado 26/02/2016].
Disponible en: https://portal.guiasalud.es/wp-content/uploads/2021/01/manual_metodologico_pacientes.pdf.
Lecturas recomendadas
• Rotaeche del Campo R, Gorroñogotia Iturbe A, Etxeberria Agirre A, Balagué Gea L. ¿Cómo formular preguntas clínicas contestables? En: Fisterra.com. Atención Primaria en la Red. Elsevier España, 2015.
Recurso de Fisterra que sirve de apoyo al servicio de preguntas clínicas de dicho portal, en el que se describe la formulación de preguntas clínicas como el paso inicial en la práctica de la medicina basada en la evidencia. Incluye una descripción de los principales tipos de estudio.
Anexos
Anexo 4.1. Plantilla para la formulación de la pregunta en formato PICO.
Tablas y figuras
Tabla 4.1. Componentes PICO de la pregunta.
Tabla 4.2. Ejemplos de preguntas clínicas estructuradas según tipo de pregunta clínica.
Tabla 4.3. Clasificación de preguntas y diseños de estudio más apropiados para responderlas.






