6.1. Perfil bacteriano y patrón de sensibilidades de la ITU en nuestro medio
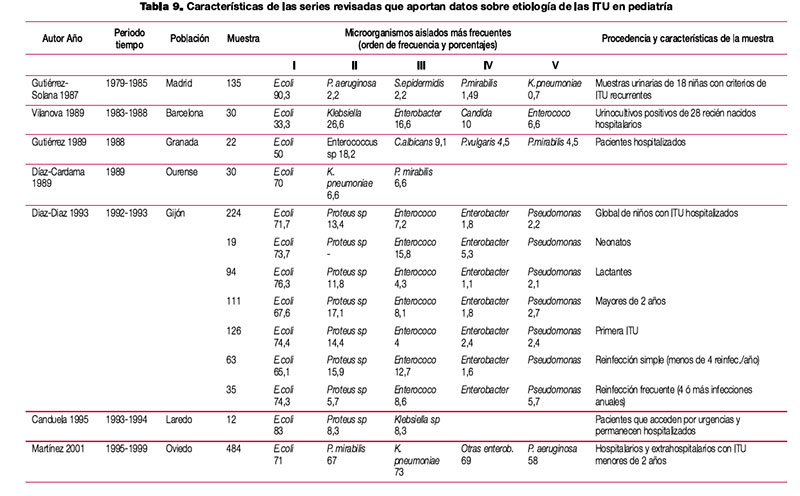
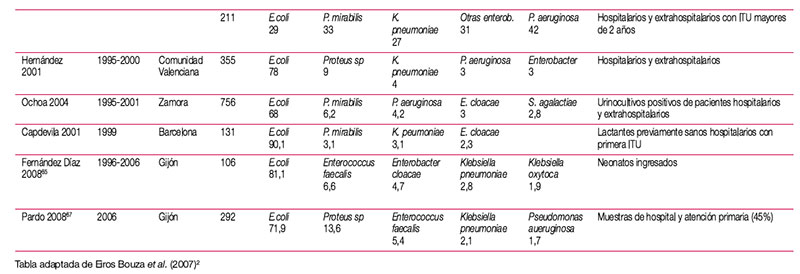
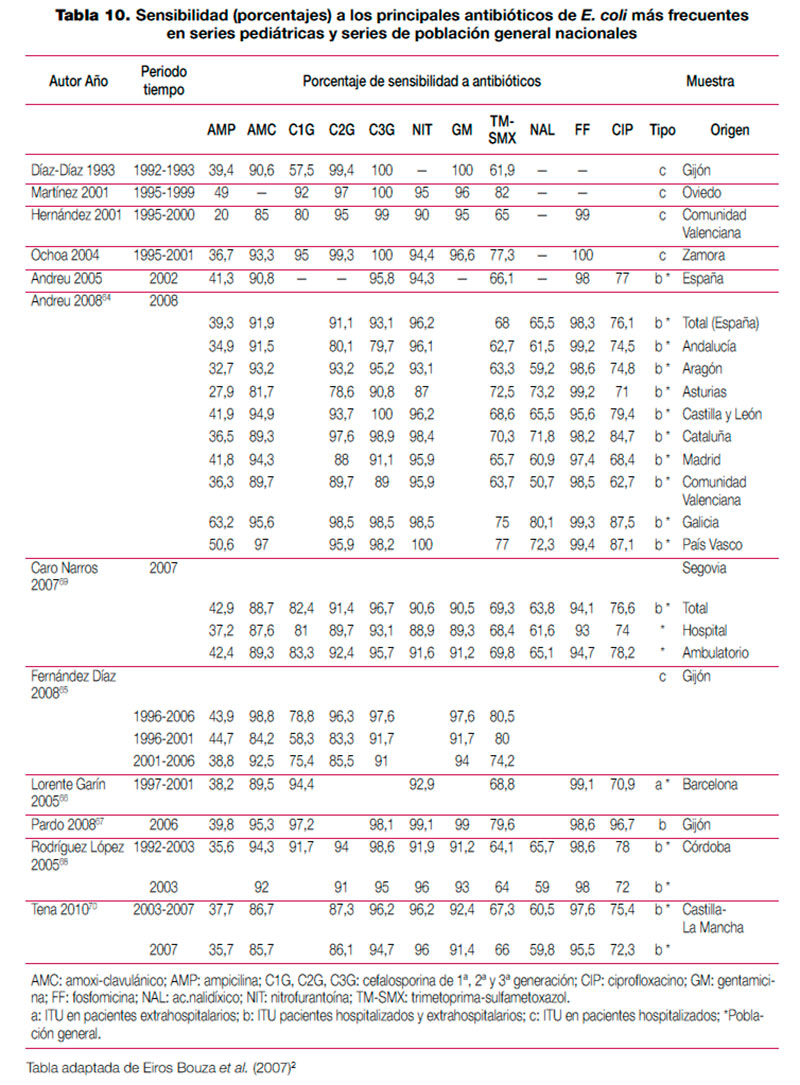
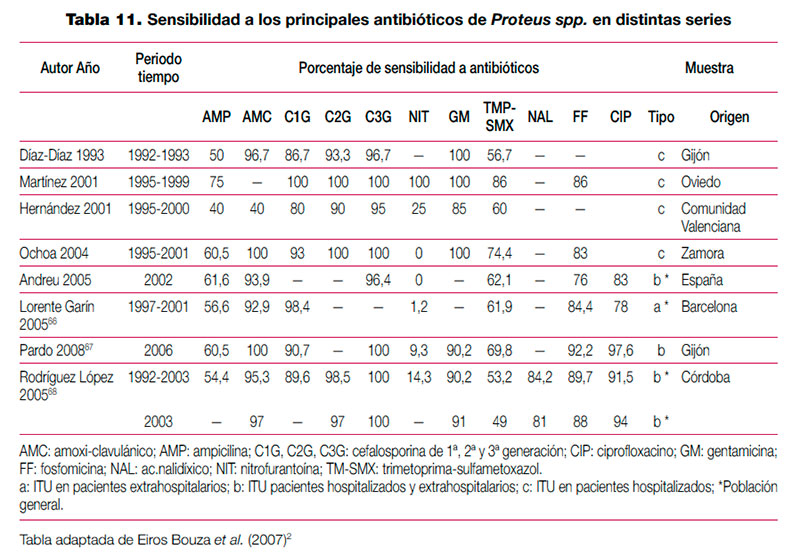
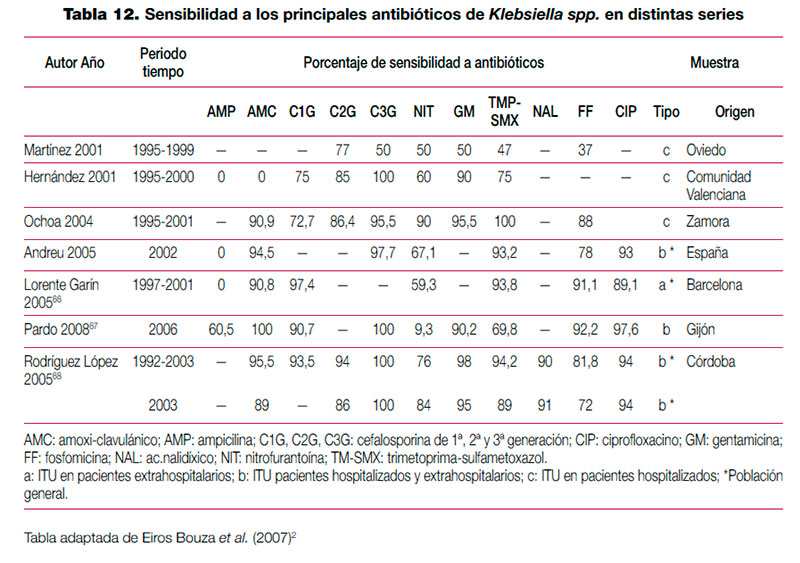
El tratamiento de la infección del tracto urinario (ITU) debe ser instaurado con frecuencia de forma empírica, en ausencia de información sobre el agente etiológico implicado y su sensibilidad a los distintos antimicrobianos habitualmente empleados. Aunque en el manejo de la ITU en la infancia, a diferencia de la edad adulta, es común la realización de urocultivo, en ocasiones el alto grado de sospecha clínica o el estado del paciente requiere la instauración de antibioterapia empírica. En la elección de antibiótico debe tenerse en cuenta la etiología más probable y su perfil teórico de sensibilidad a antimicrobianos, adaptando posteriormente el tratamiento a la evolución y el resultado de los estudios microbiológicos. Para que la información epidemiológica sea útil debe proceder de estudios realizados en el entorno asistencial en que trabajamos, ya que existen importantes diferencias locales o regionales en la sensibilidad de los microorganismos implicados. En una reciente revisión realizada en nuestro país sobre el manejo de la ITU en la infancia se revisó la etiología de distintas series de pacientes pediátricos con ITU, así como la sensibilidad que los uropatógenos aislados en esas series presentaban a los principales antimicrobianos (tabla 9, tabla 10, tabla 11 y tabla 12). Para el establecimiento del perfil de sensibilidad de los uropatógenos menos frecuentes, se revisaron también series de ITU de población general (incluidos adultos y niños)2. Esta revisión concluye lo siguiente: — Escherichia coli es el principal agente etiológico de ITU en la infancia (70-90% de los casos), por lo que su patrón de sensibilidad va a determinar habitualmente la elección terapéutica empírica. — El predominio de E. coli se ve reducido en ciertas circunstancias, en las que otros microorganismos incrementan su presencia. La exposición previa a antibióticos, el antecedente de hospitalización o la existencia de anomalías urinarias incrementan la probabilidad de que otros microorganismos, como Proteus mirabilis, Klebsiella spp. o Pseudomonas aeruginosa, sean los agentes responsables de la ITU. Debemos considerar también, especialmente en el niño pequeño, Enterococcus faecalis. Otros microorganismos poco frecuentes son los siguientes: Enterobacter cloacae, Streptococcus agalactiae, Staphylococcus spp., Serratia marcescens, Morganella morganii, Citrobacterspp. y Acinetobacter spp. La información clínica disponible en el momento del diagnóstico no permite predecir con seguridad la etiología; tan solo la tinción y examen microscópico de la orina pueden ayudar a seleccionar un determinado tratamiento. Esta exploración complementaria, habitualmente no disponible, debería considerarse en pacientes con ITU de alto riesgo. — E. coli presenta en nuestro medio un alto porcentaje de resistencia a ampicilina y a TM-SMX, por lo que estos antibióticos no resultan adecuados como tratamientos empíricos, a pesar de que la resistencia a TM-SMX se ha reducido algo en los últimos años. Entre los antibióticos que en España mantienen una alta actividad frente a E. coli se encuentran las cefalosporinas de segunda y tercera generación, fosfomicina, aminoglucósidos y amoxi-clavulánico. No obstante, la combinación amoxi-clavulánico presenta en algunas áreas porcentajes de resistencia crecientes. Igualmente, la resistencia a las cefalosporinas de primera generación es muy variable, y ha ascendido en algunas áreas hasta niveles que pueden comprometer su uso empírico. — Los datos disponibles sobre fluoroquinolonas, procedentes de series de aislamientos de población general, sugieren que se ha producido un importante aumento de la resistencia de E. coli a ciprofloxacino y otras fluoroquinolonas. Las escasas series pediátricas que analizan estos antibióticos muestran mínimos porcentajes de resistencia. No obstante, a pesar de que se está extendiendo el uso de estos antimicrobianos en la infancia, por el momento se limita al tratamiento de ITU complicadas, dirigido por cultivo y antibiograma. — Proteus mirabilis tiene un perfil de sensibilidad similar al de E. coli, aunque en algunas series de urocultivos de población general y pediátrica ha mostrado una menor sensibilidad a fosfomicina. Klebsiella pneumoniae presenta resistencia natural a la ampicilina, y mantiene una alta sensibilidad a otros antibióticos habitualmente activos frente a ella. La aparición de cepas de Klebsiella productoras de betalactamasas de espectro ampliado puede explicar que algunas series, fundamentalmente con casuística hospitalaria, muestren un descenso importante de la sensibilidad a cefalosporinas. Pseudomonas aeruginosa mantiene una buena sensibilidad a carbapenémicos (imipenem y meropenem), piperacilina-tazobactam, ceftazidima, tobramicina y amikacina; ha descendido algo para ciprofloxacino y gentamicina. — En la elección de tratamiento empírico debemos considerar que aunque las cefalosporinas de segunda y tercera generación presentan un perfil discretamente mejor que amoxi-clavulánico para enterobacterias, solo amoxi-clavulánico permite cubrir un eventual, aunque poco frecuente, Enterococcus faecalis. Asimismo, tenemos que valorar que el antecedente de antibioterapia, hospitalización o anomalías urinarias incrementa el riesgo de que el agente etiológico sea resistente a antibióticos de uso habitual. — Por último, teniendo en cuenta que ningún antibiótico garantiza una cobertura al 100% de todos los posibles microorganismos, en casos de ITU de alto riesgo podemos necesitar asociaciones de antibióticos. Para cubrir un posible enterococo, tendremos que incluir ampicilina en la asociación. Por otra parte, si queremos cubrir Pseudomonas aeruginosa, conviene que asociemos antibióticos específicos, ya que combinaciones clásicas, que incluyan gentamicina, pueden resultar insuficientes. Finalmente, resulta excepcional en la infancia tener que recurrir a carbapenémicos para cubrir posibles microorganismos multirresistentes (cepas de Klebsiella con betalactamasas de espectro ampliado, Acinetobacter o Pseudomonas). Adicionalmente, se han completado los datos de perfil etiológico y sensibilidades de esta revisión con los datos de nueve estudios nacionales posteriores64–72. Se han tabulado los resultados de las series que incluían muestras de población pediátrica de forma exclusiva (para el perfil etiológico y de resistencias) o que incluían población general (para el perfil de resistencias). De los nueve estudios analizados, solo 265,67 presentan información detallada de población pediátrica. Ni las series pediátricas ni las de población general muestran cambios relevantes en el perfil etiológico o en el patrón de sensibilidad, con respecto a los resultados mostrados en la revisión mencionada. Los resultados de los estudios, que no se incluyen en las tablas, se resumen a continuación: Lerma et al. determinaron la susceptibilidad a betalactámicos de una selección de oportunidad de 203 aislamientos de E. coli procedentes de ITU de población general española, con varios fenotipos de resistencia. Frente a los E. coli con fenotipos susceptible y productor de penicilinasa, todos los betalactámicos ensayados exhibieron gran actividad, con una sensibilidad cercana al 100%. Las cepas con hiperproducción de penicilinasa mostraron un 100% de resistencia a cefuroxima y amoxi-clavulánico y un 100% de sensibilidad a cefotaxima, piperacilina/tazobactam y meropenem. Todos los antibióticos, excepto amoxi-clavulánico, presentaron gran actividad frente a las cepas con resistencia a inhibidores de betalactamasas tipo TEM. Meropenem, cefminox y piperacilina/tazobactam presentaron la mayor actividad frente a cepas con betalactamasas de espectro ampliado, seguidas de amoxi-clavulánico71. Tamayo et al. encontraron, en muestras de población general de varios centros de Madrid, una prevalencia global de enterobacterias productoras de betalactamasas de espectro ampliado del 3,6% (293/8139)72. Para E. coli, la prevalencia fue del 4,15% (279/6721). Tena et al. encontraron un aumento significativo de la prevalencia en cepas de E. coli de ITU de población general en Castilla-La Mancha entre 2003 y 2007, de un 1,9% a un 4,9%70.
6.2. Mecanismo de acción de las bacterias sobre el tracto urinario
6.2.1. Datos bacteriológicos
Salvo en el periodo neonatal, durante el cual la ITU puede producirse por vía hematógena46, en la mayoría de los casos se produce por vía ascendente a partir de gérmenes gram negativos presentes en el intestino (enterobacterias) y que contaminan la zona perineal2,64,73. De ellos, el Escherichia coli es, con mucho, el microorganismo que se aísla con mayor frecuencia: origina alrededor del 80-90% de todas las ITU en el niño. El resto de las infecciones las originan otras enterobacterias, como Proteus mirabilis, Klebsiella pneumoniae, Citrobacter, Enterobacter, etc. La infección por Proteus mirabilis ocurre con mayor frecuencia en los varones, probablemente por la presencia de este germen en el saco balanoprepucial2,64,73. Un pequeño número de infecciones son producidas por cocos gram positivos. Entre ellos, el más frecuente es el Enterococcus y en menor medida el Streptococcus del grupo B u otros cocos gram positivos. Estos gérmenes aparecen sobre todo en el recién nacido, aunque en los recién nacidos también predominan las ITU producidas por gram negativos. El Staphyloccocus aureus, el Staphylococcus epidermidis y el Staphylococcus saprophyticus también pueden producir una ITU, pero muy raramente2,64,73. En los pacientes hospitalizados con antecedentes de instrumentalización del tracto urinario, las infecciones urinarias suelen ser originadas por gérmenes típicamente hospitalarios como la Pseudomonas aeruginosa, la Serratia y el Staphylococcus. La Candida albicans suele aparecer preferentemente en los pacientes con uso prolongado de antibióticos de amplio espectro, en pacientes inmunodeprimidos o en aquellos a los que se les han colocado sondas vesicales durante periodos prolongados de tiempo2,64,73. Los virus tienen un escaso papel como causa de infecciones, aunque el adenovirus y el virus BK son causa frecuente de cuadros de cistitis hemorrágica, sobre todo en pacientes inmunodeprimidos74,75. La flora fecal anaerobia rara vez produce ITU, a pesar de ser muchísimo más abundante que el E. coli en las heces.
6.2.2. Patogenia
La patogenia de la ITU es compleja y existen múltiples factores (bacterianos, inmunológicos, anatómicos, urodinámicos, genéticos, etc.) que pueden influir en la localización, curso y pronóstico de la misma. Actualmente se acepta la existencia de una predisposición individual y genética a padecer una ITU. Los niños predispuestos se defenderían de forma deficiente de las bacterias gram negativas, especialmente Escherichia coli, que es el germen que produce la mayoría de las ITU y el que está mejor caracterizado. Según la capacidad defensiva del huésped y la virulencia bacteriana, la ITU se manifestará de forma más o menos grave: PNA, cistitis o bacteriuria asintomática76. Existen pruebas, tanto clínicas como experimentales, de que en la ITU la entrada de los gérmenes procedentes del intestino (enterobacterias) se produce a través de la uretra, de forma ascendente77,78. Después de la colonización de la zona periuretral, los gérmenes alcanzan la vejiga y desde aquí llegan a los riñones a través de los uréteres.
6.2.3. Factores bacterianos
La capacidad de los microorganismos de adherirse a las células uroepiteliales es el principal factor condicionante de la colonización inicial de la mucosa vesical y del ascenso posterior de los gérmenes hasta el tracto urinario superior. Esto puede ocurrir incluso en ausencia de anomalías estructurales, como por ejemplo el RVU. La adhesión a las células uroepiteliales se consigue gracias a unas estructuras filamentosas especializadas que se localizan en la cápsula de las bacterias y que se denominan pili o fimbrias79. Existen varios tipos de fimbrias. Las fimbrias tipo 1 se encuentran en las cepas bacterianas que están más presentes en los cuadros de cistitis y de bacteriuria asintomática (34%), y apenas se encuentran en la PNA (5%)80,81. Recientemente se ha referido que este tipo de fimbrias no contribuyen a la respuesta inflamatoria de la mucosa uroepitelial en la ITU82. Las cepas de E. coli que poseen fimbrias tipo 2 o P están más presentes en los pacientes con cuadros de PNA (76-94%) que en los pacientes con cistitis (19-23%), en aquellos con bacteriuria asintomática (14-18%) o en las heces de los individuos sanos (7-16%)83,84. Recientemente se ha demostrado que las fimbrias P son codificadas por un grupo de 11 genes (pap gene cluster) y son portadoras de una adhesina específica, la Gal( 1-4)Galespecific PapG adhesin85. Dicha adhesina es esencial en la patogenia de la infección renal y se adhiere a unos receptores específicos, los glucoesfingolípidos, de las células epiteliales de la mucosa del tracto urinario86. Se han descrito mutaciones en algunos de estos genes que imposibilitan la expresión de algunas fimbrias P, condicionando que algunas cepas bacterianas no puedan adherirse al uroepitelio87.
6.2.4. Factores del huésped
Cuando los gérmenes uropatógenos invaden el tracto urinario se produce una respuesta inmune a nivel de las células uroepiteliales que desempeña un papel vital en la susceptibilidad de un paciente a la ITU. En los últimos años se han descubierto una familia de receptores denominados Tolllike receptors (TRL) que se expresan en las células uroepiteliales y que, actuando como centinelas, tienen la capacidad de reconocer ciertas moléculas asociadas a los gérmenes uropatógenos88. Hasta la fecha se han identificado 11 TRL, de los cuales los TRL 2, 4 y 11 son los que tienen mayor importancia dentro de la patogenia de la ITU. El TRL2 identifica las lipoproteínas de las bacterias gram positivas y el TRL4 las endotoxinas lipopolisacáridas de las bacterias uropatógenas, como el E. coli. El TRL11 también reconoce los gérmenes uropatógenos y protege el riñón de infecciones ascendentes, pero hasta el momento no se ha establecido cuál es el papel de este receptor en las ITU del ser humano88–91. En condiciones normales, las fimbrias del E. coli se unen a los receptores específicos ya mencionados, reclutando los TRL4 y liberándose una señalización transmembrana que desencadena la producción de diferentes mediadores inflamatorios, como citoquinas, quimioquinas, defensinas, proteínas del sistema del complemento y otros péptidos adhesivos, dando lugar a una respuesta inflamatoria a nivel del tejido renal y a la llegada desde los capilares de células inmunes, como los neutrófilos. Los efectos del proceso inflamatorio, además de conseguir la erradicación de las bacterias, pueden dar lugar a un proceso destructivo para el propio huésped, con la formación de un tejido cicatricial en el lugar de la inflamación; es decir, la formación de una cicatriz es más una consecuencia del proceso inflamatorio que de algún efecto directo de la propia bacteria88. En la BA los gérmenes uropatógenos han perdido la expresión de muchos factores de virulencia y tienen poca capacidad para provocar la defensa inmune de la mucosa uroepitelial. Así, en estudios experimentales y clínicos realizados en niños con BA, se ha observado una expresión reducida de los TRL4, en relación con sujetos control. Como resultado, estos pacientes pueden ser portadores asintomáticos durante periodos prolongados de tiempo, sin provocar una respuesta destructiva del huésped; es decir, la falta de respuesta de la mucosa uroepitelial puede ser un mecanismo protector contra el daño renal92. La producción local de quimioquinas, entre las que el principal representante es la IL-8, es fundamental en el proceso migratorio de los neutrófilos desde la pared capilar hasta la luz tubular, en donde interactúan con los microorganismos patógenos, destruyéndolos. Son precisamente los gérmenes uropatógenos con fimbrias P los que estimulan su liberación en las células del epitelio renal88,93,94. En estudios experimentales se ha comprobado que en los ratones en los que no se expresa el receptor de la IL-8 no se produce la adecuada emigración de los neutrófilos y que los ratones KO para el receptor de la citoquina IL-8 (CXCR1) tienen una mayor predisposición a desarrollar PNA y cicatrices renales, debido a una disfunción en la respuesta de dichos neutrófilos. En estudios clínicos se ha descrito que en los niños propensos a padecer PNA existe una expresión reducida del receptor de la citoquina IL-8, con respecto a los controles95. La proteína de Tamm-Horsfall es la proteína más abundante en la orina y se expresa exclusivamente en la rama ascendente del asa de Henle. Existe evidencia reciente de que esta proteína juega un papel importante en la respuesta inmunológica de defensa antibacteriana del tracto urinario. Sirve como modulador endógeno de la activación de los granulocitos, monocitos, etc.; previene la colonización de los gérmenes uropatógenos y, al unirse con las fimbrias tipo 1, interfiere con el ataque de las bacterias al tracto urinario. Puede también tener un papel proinflamatorio, al inducir la maduración de las células dendríticas a través de un mecanismo complejo en el que participa la activación del TRL4 y el factor de transcripción NF-kB88. Las bacterias son capaces de activar el sistema del complemento, induciendo a la opsonización de las mismas. Sin embargo además del aclaramiento bacteriano, la activación del complemento puede dar lugar a un daño tisular en el huésped. En estudios experimentales se ha comprobado que la inhibición del sistema de complemento disminuye la respuesta inflamatoria y potencialmente reduce el grado de daño tisular88. Dentro de la respuesta inmunológica del organismo durante la ITU se incluye la liberación local de β-defensinas por el epitelio renal y α-defensinas por los neutrófilos infiltrados, que, entre otras misiones, producen la muerte de los microorganismos patógenos88,96. Existen además moléculas de adhesión a las células del endotelio vascular que son fundamentales para que las células inflamatorias salgan de la circulación e infiltren el tejido circundante al proceso de inflamación88 En resumen, los acontecimientos moleculares locales referidos como resultado de la interacción entre las células del tracto urinario y los gérmenes patógenos parecen ser un factor determinante en las consecuencias clínicas de la ITU. La variabilidad interindividual de la respuesta celular, probablemente en relación con algunos polimorfismos de genes candidatos, puede ser la responsable de la mayor susceptibilidad de algunos individuos a presentar ITU recurrentes y a desarrollar un daño renal progresivo. Cuando se comprenda más profundamente cuál es la base molecular de los mecanismos patogénicos de la ITU se podrá identificar mejor a los individuos susceptibles, lo que a su vez nos permitirá emprender estrategias de tratamiento más específicas y conseguir mayor eficacia a la hora de evitar las complicaciones88.
6.2.5. Otros mecanismos de defensa
La orina es un excelente medio de cultivo para el crecimiento bacteriano, y cuando las bacterias alcanzan la vejiga se multiplican fácilmente. Uno de los mecanismos de defensa para evitar el crecimiento bacteriano en el tracto urinario se fundamenta en la propia micción, la cual conduce a una descamación continua de las células epiteliales superficiales a las que están adheridas las bacterias. Es decir, las bacterias son lavadas de la vejiga mediante micciones repetidas y la esterilidad de la orina depende en gran medida de que no exista interrupción del flujo urinario97,98. La obstrucción del tracto urinario con estasis de la orina, ya sea debido a un proceso mecánico en relación con alguna anomalía congénita (hidronefrosis, ureterohidronefrosis, duplicidades, ureteroceles, válvulas, etc.), o a un problema funcional en relación por ejemplo con una disfunción vesical, es uno de los factores más importantes que predispone a la ITU y al daño renal. El volumen residual aumentado y la distensión vesical como consecuencia de una obstrucción favorecen la multiplicación bacteriana99,100. Las disfunciones vesicales (síndrome de urgencia miccional, micción disfuncional con disinergia detrusor-esfinteriana, síndrome de la vejiga perezosa, etc.), como ya se ha mencionado, son un factor de predisposición a la ITU recurrente, sobre todo en las mujeres, ya que dan lugar a un volumen de orina residual aumentado, a una dilatación vesical con elevación de la presión intravesical, etc.101,102. Del mismo modo, hay una correlación entre el estreñimiento y la ITU recurrente. Aunque ello pueda ser el resultado de factores mecánicos relacionados con la compresión de la vejiga y del cuello de la misma por las heces, es más probable que dependa de la coexistencia con una micción disfuncional y un vaciamiento incompleto de la vejiga (síndrome de eliminación disfuncional). La mejora de los hábitos de defecación por lo general disminuye la incidencia de la ITU recurrente, sobre todo si va asociada a un patrón miccional normal. La actividad sexual es uno de los factores de riesgo de desarrollar una cistitis aguda, sobre todo en las adolescentes sexualmente activas; en los varones son mucho menos frecuentes103,104.
6.2.6. Reflujo vesicoureteral
El RVU favorece que la orina infectada de la vejiga ascienda hacia el tracto urinario superior sin necesidad de que las bacterias posean propiedades de virulencia especiales. En un estudio de niños con PNA recurrente, las infecciones se originaron por E. coli con fimbrias P tan solo en el 36% de los niños que presentaban RVU105. El 25-50% de los niños que presentan su primera manifestación de una ITU tienen RVU106, porcentaje mucho mayor al referido en los niños que no han tenido una ITU, 0,4-1,8%107,108. En presencia de RVU aproximadamente el 80-90% de los pacientes con ITU con fiebre tienen DMSA anormal44,109,110 y esto es particularmente cierto cuando el reflujo es moderado-grave (grado IV-V). La probabilidad de estos pacientes de tener una PNA es 2 veces superior (67%) a la de los que tienen un reflujo leve (32%) y a la de los que no tienen reflujo (34%)106,111. Sin embargo, la mayoría de los pacientes con DMSA alterada no tienen RVU (60- 68%) en el momento en que se realiza la investigación106,111–113. Este dato subraya la importancia de los factores de defensa del huésped y de la virulencia bacteriana en la patogenia de la PNA en niños, y apoya la tesis de que aunque el reflujo, sobre todo si es grave, es un factor favorecedor de la PNA, no es imprescindible para que la PNA se produzca.
Bibliografía 6. Etiología y etiopatogenia de la ITU
- 2. Eiros Bouza JM, Ochoa Sangrador C. Perfil etiológico de las infecciones urinarias y patrón de sensibilidad de los uropatógenos. An Pediatr (Barc). 2007;67(5):461-8.
- 44. Verboven M, Ingels M, Delree M, Piepsz A. 99mTc-DMSA scintigraphy in acute urinary tract infection in children. Pediatr Radiol. 1990;20(7):540-2.
- 46. Ginsburg CM, McCracken GH, Jr. Urinary tract infections in young infants. Pediatrics. 1982;69(4):409-12.
- 64. Andreu A, Planells I, Grupo español para el estudio de la sensibilidad antimicrobiana de los patógenos urinarios. Etiología de la infección urinaria baja adquirida en la comunidad y resistencia del Escherichia Coli a los microbianos de primera línea. Estudio nacional multicéntrico. Med Clin (Barc). 2008;130(13):481-6.
- 65. Fernández Díaz M, Solís Sánchez G, Málaga Guerrero S, Fernández Fernández EM, Menéndez Arias C, Fernández Menéndez JM, et al. Comparación temporal y bacteriológica de la infección urinaria neonatal. An Pediatr (Barc). 2008;69(6):526-32.
- 66. Lorente Garín JA, Placer Santosa J, Salvadó Costa M, Segura Álvarez C, Gelabert-Mas A. Evolución de la resistencia antibiótica en las infecciones urinarias adquiridas en la comunidad. Rev Clin Esp. 2005;205(6):259-64.
- 67. Pardo R, Morn M, Fernádez E, Díaz E, Villar M, Otero L. Estudio comparativo de las infecciones urinarias en un red sanitaria (1992-2006). Bol Pediatr. 2008;48(205):271-5.
- 68. Rodríguez López FC, Franco-Álvarez de Luna F, Gordillo Urbano RM, Ibarra González A, Casal Román M. Microorganismos aislados de muestras de orina procedentes de la comunidad y patrón de sensibilidad en un periodo de 12 años. Rev Esp Quimioter. 2005;18(2):159-67.
- 69. Caro Narros M, Hernando Real S, Carrero González P, García Carbajosa S. Estudio de multirresistencia antibiótica de Escherichia coli en urocultivos. Med Clin (Barc). 2007;129(11): 409-11.
- 70. Tena D, González-Praetorius A, González JC, Heredero E, Illescas S, Sáinz de Baranda C, et al. Evolución del patrón de sensibilidad de Escherichia coli en infecciones del tracto urinario diagnosticadas en la comunidad durante el periodo 2003-2007. Estudio multicéntrico en Castilla la Mancha. Rev Esp Quimioter. 2010;23(1):36-42.
- 71. Lerma M, Cebrián L, Giménez MJ, Coronel P, Gimeno M, Aguilar L, et al. Sensibilidad a betalactámicos de aislados clínicos de Escherichia coli con diferentes fenotipos de resistencia procedentes de infecciones urinarias. Rev Esp Quimioter. 2008;21(3):149-52.
- 72. Tamayo J, Orden B, Cacho J, Cuadros J, Gómez-Garcís JL, Als JI. Actividad de ertapenem y otros antimicrobianos frente a enterobacterias productoras de BLEE aisladas. Rev Esp Quimioter. 2007;20(3):334-8.
- 73. Practice parameter: the diagnosis, treatment, and evaluation of the initial urinary tract infection in febrile infants and young children. American Academy of Pediatrics. Committee on Quality Improvement. Subcommittee on Urinary Tract Infection. Pediatrics. 1999;103(4 Pt 1): 843-52.
- 74. Arthur RR, Shah KV, Charache P, Saral R. BK and JC virus infections in recipients of bone marrow transplants. J Infect Dis. 1988;158(3):563-9.
- 75. Runde V, Ross S, Trenschel R, Lagemann E, Basu O, Renzing-Kohler K, et al. Adenoviral infection after allogeneic stem cell transplantation (SCT): report on 130 patients from a single SCT unit involved in a prospective multi center surveillance study. Bone Marrow Transplant. 2001;28(1):51-7.
- 76. Cistitis no complicada en la niña: guía multidisciplinar de la práctica clínica avalada científicamente por la Sociedad Española de Infectología Pediátrica. Barcelona: Zambon; 2008.
- 77. Stamey TA. The role of introital enterobacteria in recurrent urinary infections. J Urol. 1973;109(3):467-72.
- 78. Bollgren I, Winberg J. The periurethral aerobic bacterial flora in healthy boys and girls. Acta Paediatr Scand. 1976;65(1):74-80.
- 79. Eden CS, Hansson HA. Escherichia coli pili as possible mediators of attachment to human urinary tract epithelial cells. Infect Immun. 1978;21(1):229-37.
- 80. Zhou G, Mo WJ, Sebbel P, Min G, Neubert TA, Glockshuber R, et al. Uroplakin Ia is the urothelial receptor for uropathogenic Escherichia coli: evidence from in vitro FimH binding. J Cell Sci. 2001;114(Pt 22):4095-103.
- 81. Hagberg L, Jodal U, Korhonen TK, Lidin-Janson G, Lindberg U, Eden CS. Adhesion, hemagglutination, and virulence of Escherichia coli causing urinary tract infections. Infect Immun. 1981;31(2):564-70.
- 82. Bergsten G, Wullt B, Schembri MA, Leijonhufvud I, Svanborg C. Do type 1 fimbriae promote inflammation in the human urinary tract? Cell Microbiol. 2007;9(7):1766-81.
- 83. Kallenius G, Mollby R, Svenson SB, Helin I, Hultberg H, Cedergren B, et al. Occurrence of P-fimbriated Escherichia coli in urinary tract infections. Lancet. 1981;2(8260-61):1369-72.
- 84. Vaisanen-Rhen V, Elo J, Vaisanen E, Siitonen A, Orskov I, Orskov F, et al. P-fimbriated clones among uropathogenic Escherichia coli strains. Infect Immun. 1984;43(1):149-55.
- 85. Roberts JA, Marklund BI, Ilver D, Haslam D, Kaack MB, Baskin G, et al. The Gal(alpha 1-4)Gal-specific tip adhesin of Escherichia coli P-fimbriae is needed for pyelonephritis to occur in the normal urinary tract. Proc Natl Acad Sci U S A. 1994;91(25):11889-93.
- 86. Eden CS, Leffler H. Glycosphingolipids of human urinary tract epithelial cells as possible receptors for adhering Escherichia coli bacteria. Scand J Infect Dis Suppl. 1980;Suppl 24:144-7.
- 87. Roos V, Schembri MA, Ulett GC, Klemm P. Asymptomatic bacteriuria Escherichia coli strain 83972 carries mutations in the foc locus and is unable to express F1C fimbriae. Microbiology. 2006;152(Pt 6):1799-806.
- 88. Mak RH, Kuo HJ. Pathogenesis of urinary tract infection: an update. Curr Opin Pediatr. 2006;18(2):148-52.
- 89. Anders HJ, Banas B, Schlondorff D. Signaling danger: toll-like receptors and their potential roles in kidney disease. J Am Soc Nephrol. 2004;15(4):854-67.
- 90. Eden CS, Briles D, Hagberg L, McGhee J, Michalec S. Genetic factors in host resistance to urinary tract infection. Infection. 1985;13 Suppl 2:S171-S176.
- 91. Zhang D, Zhang G, Hayden MS, Greenblatt MB, Bussey C, Flavell RA, et al. A toll-like receptor that prevents infection by uropathogenic bacteria. Science. 2004;303(5663):1522-6.
- 92. Ragnarsdóttir B, Fischer H, Godaly G, Grönberg-Hernandez J, Gustafsson M, Karpman D, et al. TLR- and CXCR1-dependent innate immunity: insights into the genetics of urinary tract infections. Eur J Clin Invest. 2008;38 Suppl 2:12-20.
- 93. Frendeus B, Wachtler C, Hedlund M, Fischer H, Samuelsson P, Svensson M, et al. Escherichia coli P fimbriae utilize the Toll-like receptor 4 pathway for cell activation. Mol Microbiol. 2001;40(1):37-51.
- 94. Bergsten G, Samuelsson M, Wullt B, Leijonhufvud I, Fischer H, Svanborg C. PapG-dependent adherence breaks mucosal inertia and triggers the innate host response. J Infect Dis. 2004;189(9):1734-42.
- 95. Lundstedt AC, Leijonhufvud I, Ragnarsdottir B, Karpman D, Andersson B, Svanborg C. Inherited susceptibility to acute pyelonephritis: a family study of urinary tract infection. J Infect Dis. 2007;195(8):1227-34.
- 96. Ganz T. Defensins: antimicrobial peptides of innate immunity. Nat Rev Immunol. 2003;3(9): 710-20.
- 97. Norden CW, Green GM, Kass EH. Antibacterial mechanisms of the urinary bladder. J Clin Invest. 1968;47(12):2689-700.
- 98. Schulte-Wissermann H, Mannhardt W, Schwarz J, Zepp F, Bitter-Suermann D. Comparison of the antibacterial effect of uroepithelial cells from healthy donors and children with asymptomatic bacteriuria. Eur J Pediatr. 1985;144(3):230-3.
- 99. Nuutinen M, Uhari M. Recurrence and follow-up after urinary tract infection under the age of 1 year. Pediatr Nephrol. 2001;16(1):69-72.
- 100. Panaretto KS, Craig JC, Knight JF, Howman-Giles R, Sureshkumar P, Roy LP. Risk factors for recurrent urinary tract infection in preschool children. J Paediatr Child Health. 1999;35(5): 454-9.
- 101. Snodgrass W. Relationship of voiding dysfunction to urinary tract infection and vesicoureteral reflux in children. Urology. 1991;38(4):341-4.
- 102. Naseer SR, Steinhardt GF. New renal scars in children with urinary tract infections, vesicoureteral reflux and voiding dysfunction: a prospective evaluation. J Urol. 1997;158(2):566-8.
- 103. Johnson JR, Stamm WE. Diagnosis and treatment of acute urinary tract infections. Infect Dis Clin North Am. 1987;1(4):773-91.
- 104. Hooton TM, Stamm WE. Diagnosis and treatment of uncomplicated urinary tract infection. Infect Dis Clin North Am. 1997;11(3):551-81.
- 105. Lomberg H, Hellström M, Jodal U, Leffler H, Lincoln K, Eden CS. Virulence-associated traits in Escherichia colicausing first and recurrent episodes of urinary tract infection in children with or without vesicoureteral reflux. J Infect Dis. 1984;150(4):561-9.
- 106. Jakobsson B, Nolstedt L, Svensson L, Söderlundh S, Berg U. 99mTechnetium-dimercaptosuccinic acid scan in the diagnosis of acute pyelonephritis in children: relation to clinical and radiological findings. Pediatr Nephrol. 1992;6(4):328-34.
- 107. Bailey RR. Vesicoureteral reflux in healthy infants and children. En: Hodson J, Kincaid-Smith P, editors. Reflux nephropathy. New York: Masson; 1979. p. 56-61.
- 108. Ransley PG. Vesicoureteric reflux: continuing surgical dilemma. Urology. 1978;12(3):246-55.
- 109. Majd M, Rushton HG, Jantausch B, Wiedermann BL. Relationship among vesicoureteral reflux, P-fimbriated Escherichia coli, and acute pyelonephritis in children with febrile urinary tract infection. J Pediatr. 1991;119(4):578-85.
- 110. Jakobsson B, Soderlundh S, Berg U. Diagnostic significance of 99mTc-dimercaptosuccinic acid (DMSA) scintigraphy in urinary tract infection. Arch Dis Child. 1992;67(11):1338-42.
- 111. Majd M, Rushton HG. Renal cortical scintigraphy in the diagnosis of acute pyelonephritis. Semin Nucl Med. 1992;22(2):98-111.
- 112. Benador D, Benador N, Slosman DO, Nussle D, Mermillod B, Girardin E. Cortical scintigraphy in the evaluation of renal parenchymal changes in children with pyelonephritis. J Pediatr. 1994;124(1):17-20.
- 113. Sreenarasimhaiah V, Alon US. Uroradiologic evaluation of children with urinary tract infection: are both ultrasonograpy and renal cortical scintigraphy necessary? J Pediatr. 1995;127(3): 373-7.
Figuras y Tablas
Tabla 9. Características de las series revisadas que aportan datos sobre etiología de las ITU en pediatría (pdf, 41 Kb.)
(pdf, 41 Kb.)
Tabla 10. Sensibilidad (porcentajes) a los principales antibióticos de E. coli más frecuentes en series pediátricas y series de población general nacionales (pdf, 37 Kb.)
(pdf, 37 Kb.)
Tabla 11. Sensibilidad a los principales antibióticos de Proteus spp. en distintas series (pdf, 37 Kb.)
(pdf, 37 Kb.)
Tabla 12. Sensibilidad a los principales antibióticos de Klebsiella spp. en distintas series (pdf, 37 Kb.)
(pdf, 37 Kb.)






