Pablo Alonso, Itziar Etxeandia, David Rigau, Javier Gracia
8.1. Introducción
Una vez completada la evaluación y síntesis de la evidencia, el grupo elaborador de la guía (GEG) debería disponer de la suficiente información sobre los distintos aspectos que intervienen en la formulación de las recomendaciones.
Para estructurar la información y dotar las decisiones del GEG de una máxima transparencia, el grupo GRADE ha elaborado una propuesta sobre marcos de trabajo EtD (Evidence to Decision frameworks; en adelante, tablas EtD)1-3. También ha desarrollado un software para facilitar la preparación, presentación y difusión de resúmenes de evidencia, GPC e informes de evaluación de tecnologías. Se trata de la plataforma en línea denominada Guideline Development Tool (GDT) (http://gradepro.org/), que facilita la elaboración de las tablas resumen de los hallazgos y las tablas EtD y permite presentarlas en diferentes formatos. Existe, asimismo, una herramienta interactiva para crear tablas EtD, denominada iEtD, disponible en la plataforma de epistemonikos (http://ietd.epistemonikos.org) junto a un manual de ayuda (http://ietd.epistemonikos.org/#/help/guidance). La herramienta iEtD será integrada próximamente en la herramienta GDT.
Los diferentes factores, criterios y consideraciones que forman parte de este marco de trabajo se detallan a lo largo de este capítulo.
8.2. De la evidencia a la recomendación
8.2.1. La tabla de la evidencia a las decisiones (tabla EtD)
GRADE ha desarrollado las tablas EtD para ayudar a grupos de individuos que formulan recomendaciones o toman decisiones sanitarias (por ejemplo, GEG o responsables de políticas sanitarias) a pasar de la evidencia a las recomendaciones. Esta propuesta refleja la evolución de la tabla de la evidencia a la recomendación desa rollada y publicada previamente por GRADE, e incluida en la versión anterior de este manual. La tabla inicial incluía cuatro componentes básicos (calidad de la evidencia, valores y preferencias, balance entre beneficios y riesgos, y costes) y ha evolucionado hacia un formato que incluye, entre otros, factores (o criterios) como aceptabilidad, equidad, o factibilidad.
Las tablas EtD se estructuran en tres partes fundamentales (anexo 8.1); a saber:
- Formulación de la pregunta.
- Evaluación de los criterios.
- Conclusiones.
La preparación de estos marcos requiere la revisión sistemática de la evidencia disponible para los diferentes aspectos que abordan tanto sobre efectividad y diagnóstico como sobre aspectos de valoración de los desenlaces por parte de los pacientes (y aquellos afectados por la recomendación), uso de recursos y costes, aceptabilidad o factibilidad, entre otros.
8.2.2. Formulación de la pregunta
Esta sección es la puerta de entrada a la tabla EtD (anexo 8.1). En ella se debe incluir información sobre los siguientes aspectos:
Pregunta: inicialmente incluye tanto la pregunta narrativa como la estructurada (ver capítulo 4).
Entorno: es necesario especificar el ámbito al cual va dirigida la recomendación; por ejemplo, si se aplica a la atención primaria o especializada, o si está circunscrita a centros especializados o a centros ambulatorios pero atendidos por especialistas habitualmente hospitalarios, etc.
Perspectiva: se debe concretar la perspectiva que toma el GEG, ya que determinará la influencia de los diversos criterios que se tienen en cuenta para formular las recomendaciones. Por ejemplo, la perspectiva determinará las consecuencias económicas analizadas, los desenlaces o los aspectos como equidad, aceptabilidad o factibilidad. En el caso del Programa de GPC, la perspectiva es poblacional (desde el punto de vista del Sistema Nacional de Salud (SNS). Otras perspectivas poblacionales posibles que no aplican al Programa de GPC son la perspectiva hospitalaria y la de un área de salud o de un asegurador, entre otras.
Subgrupos: se deben concretar los potenciales subgrupos que el GEG ha tenido en cuenta a la hora de contestar la pregunta. En algunas ocasiones, estas consideraciones pueden llevar a completar un marco diferente o a formular recomendaciones distintas utilizando el mismo marco; en otras, esta información sobre los potenciales subgrupos no conlleva recomendaciones adicionales, pero aporta una nueva dimensión al análisis que lleva a cabo el GEG.
Antecedentes: se deben incluir antecedentes breves y concisos, que permitan a los miembros del GEG y a los futuros usuarios de la tabla EtD poner en contexto el tema en cuestión.
8.2.3. Evaluación de los criterios
La tabla EtD destinada a las recomendaciones clínicas incluye varios criterios (anexo 8.1). Para cada criterio es necesario considerar la evidencia científica disponible y las potenciales consideraciones adicionales, así como realizar juicios (cada uno de estos aspectos está plasmado en una columna de la tabla EtD; para más información, consultar el manual: http://ietd.epistemonikos.org). A continuación se detalla cada criterio.
8.2.3.1. ¿El problema constituye una prioridad?
Cuanto más severo es un problema, más probable es que sea una prioridad y, por tanto, que deba ser recomendado. Por ejemplo, las intervenciones para el tratamiento de enfermedades con altas tasas de mortalidad o discapacidad probablemente tengan una prioridad más alta que las de las enfermedades que solo causan problemas de menor importancia. En caso de que el GEG considere que todas las preguntas tienen una prioridad similar, podría optar por no completar este criterio.
8.2.3.2. ¿Cuál es la magnitud de los efectos deseables?
Cuanto más sustanciales son los efectos deseables (beneficios) de una intervención respecto a un comparador, más probable es que se deba recomendarla. Este juicio debe tener en cuenta tanto el efecto en términos absolutos como la importancia de los desenlaces (la valoración que asigna a cada desenlace la población afectada). Si la calidad de la evidencia es muy baja o si no hay estudios, es improbable poder juzgar hasta qué punto un efecto es sustancial. Si la calidad es moderada o alta, el GEG debe utilizar un comparador explícito o implícito para realizar este juicio.
8.2.3.3. ¿Cuál es la magnitud de los efectos indeseables?
Cuanto más sustanciales son los efectos indeseables (daños y carga de la enfermedad) en relación con el comparador, menos probabilidades habrá de recomendar una intervención. Los juicios sobre este criterio son similares a los empleados con los efectos deseables, y la misma mecánica se aplica a ambos tipos de efecto.
8.2.3.4. ¿cuál es la certeza (calidad o confianza) del cuerpo de evidencia disponible sobre los efectos de las intervenciones?
Cuanto menor es la confianza en los resultados principales provenientes de la evidencia científica, menos probable es que se deba realizar una recomendación a favor o en contra de la intervención. La calidad se clasifica en cuatro categorías (alta, moderada, baja y muy baja). La calidad global es la menor de cualquiera de las correspondientes a los desenlaces críticos (ver apartado 6.2.1, «Definición de la calidad de la evidencia»).
8.2.3.5. ¿Existe incertidumbre o variabilidad en cómo los pacientes valoran los desenlaces de interés?
La incertidumbre sobre cómo valoran los principales desenlaces los pacientes o aquellos afectados por la recomendación puede ser una razón para no realizar una recomendación fuerte. Lo mismo ocurre si existe una variabilidad importante respecto a esta valoración (por ejemplo, si los individuos tomarían diferentes decisiones ante una variabilidad).
Por ejemplo, la warfarina reduce el riesgo de ictus, pero aumenta el de sangrado gastrointestinal grave en pacientes con fibrilación auricular. Si un GEG no confía en la valoración que los pacientes asignarían a estos desenlaces y, por tanto, no sabe con certeza qué decisión tomarían pacientes debidamente informados con riesgo basal de ictus bajo a moderado, no estaría justificada una recomendación fuerte (ya fuera a favor o en contra).
La información sobre la valoración que atribuyen los pacientes a los desenlaces se puede obtener a partir de diferente aproximaciones y a partir de diferentes diseños. Por ejemplo, el GEG puede informarse a partir de estudios que determinen las utilidades de los diferentes desenlaces. Estas pueden evaluarse en estudios transversales que utilicen herramientas como escalas analógicas visuales, standard gamble o time-trade-off. La información también puede provenir de estudios que miden directamente la elección que realizan los participantes cuando se les presentan las probabilidades de los desenlaces, tanto favorables como desfavorables, y se les describen. Otras fuentes de información son la opinión de los pacientes incluidos en el grupo elaborador, los estudios ad hoc realizados con pacientes durante la preparación de la guía, y la experiencia de los clínicos miembros del GEG en la toma de decisiones compartida con los pacientes. Todas estas fuentes tienen limitaciones y fortalezas que deben ser cuidadosamente ponderadas. Finalmente, independientemente de la evidencia localizada o producida, el GEG debe ser explícito en cuanto a la valoración asignada a los desenlaces en cuestión.
8.2.3.6. El balance entre los efectos deseados o indeseados, ¿favorece a la intervención o a la comparación?
Los juicios sobre el balance de los efectos deseados e indeseados deben tener en cuenta lo siguiente:
- La magnitud de los efectos deseables e indeseables, así como la certeza que generan.
- La valoración que los pacientes o los afectados por la recomendación atribuyen a los principales desenlaces, así como la certeza y la variabilidad de la evidencia disponible al respecto.
Este juicio requiere considerar los cuatro últimos criterios detallados hasta el momento. En algunas ocasiones, uno de ellos puede tener un mayor peso, y el GEG debería explicitarlo. En otras, corresponde plantearse cuánto valoran los afectados por la recomendación los efectos en el futuro respecto a los inmediatos (tasas de descuento), y la incertidumbre o variabilidad en torno a estas tasas. Por otro lado, a veces conviene preguntarse en qué medida las personas afectadas están dispuestas a optar por la oportunidad (o incertidumbre) de experimentar un desenlace favorable sabiendo que corren el riesgo de experimentar un desenlace desfavorable (aversión al riesgo o búsqueda de riesgo), y tener en cuenta la incertidumbre o variabilidad de estas actitudes.
8.2.3.7. ¿Cuál es la magnitud de los requerimientos de recursos (costes)?
Cuanto mayor es el coste, menos probable es que una intervención se recomiende. Si el uso de recursos se considera fundamental para una decisión acerca de una recomendación, lo más probable es que deba ser evaluado formalmente. Los costes y beneficios que se incluyan dependen de la perspectiva que se tome. Como ya se ha señalado, para las GPC del Programa la perspectiva es la del Sistema Nacional de Salud. La información que se presente (por ejemplo, por coste/persona o por población, costes anuales o totales, etc.) puede depender de la naturaleza de la decisión. Suele ser útil presentar la información de más de una forma (por ejemplo, coste anual y coste de por vida). Para más información sobre este criterio y los aspectos relacionados, consultar el capítulo 7, “Consideración del uso de recursos y costes en la elaboración de recomendaciones”.
8.2.3.8. ¿Cuál es la calidad de la evidencia sobre los requerimientos de recursos (costes)?
Cuanto menor es la certeza sobre las necesidades de recursos, más probable es que el GEG necesite buscar información para disminuir esta incertidumbre. Una vez que el GEG ha establecido la necesidad de buscar más información, se requiere localizar evidencia de las diferencias en el uso de los recursos, hacer juicios respecto a la confianza en las estimaciones del efecto utilizando los mismos criterios que se utilizan para los resultados de salud y valorar el uso de los recursos en términos de costes específicos para el entorno de interés. Cuanta más incertidumbre genere la información obtenida, menos probable es que un GEG realice una recomendación fuerte a favor o en contra de una intervención.
La valoración monetaria de los recursos debe hacerse aplicando los costes unitarios disponibles actualizados de cada elemento, así como la cantidad medida (es decir, el número de unidades) de cada uno. Para más información sobre este criterio y los aspectos relacionados, consultar el capítulo 7, “Consideración del uso de recursos y costes en la elaboración de recomendaciones”.
8.2.3.9. La relación coste-efectividad, ¿favorece a la intervención o a la comparación?*
Cuanto mayor es el coste en relación con el beneficio neto, menos probable es que una intervención deba recomendarse. Los juicios sobre la rentabilidad de una intervención deben de tener en cuenta lo siguiente:
- El balance entre los efectos deseables y no deseables (el beneficio neto), así como la incertidumbre en torno a la variabilidad o el beneficio neto estimado (incluidas la incertidumbre acerca de cuánto valora la gente los principales desenlaces y la incertidumbre acerca de la efectividad).
- Recursos necesarios (costes) y la incertidumbre en torno a su variabilidad.
La evidencia y las consideraciones adicionales que informan los juicios sobre el costeefectividad de las intervenciones incluyen la evidencia científica y las consideraciones adicionales de los seis criterios anteriores. Aunque este factor sea una síntesis de esos criterios, algunos pueden tener un efecto independiente sobre una recomendación. Por ejemplo, un GEG podría inclinarse por recomendar algunas intervenciones con una relación coste-efectividad relativamente alta y no otras con una relación coste-efectividad similar pero efectos deseables menos sustanciales, un beneficio neto sustancialmente menor o más incertidumbre sobre sus efectos.
Al igual que en los juicios sobre la magnitud de las necesidades de recursos, un juicio que busque determinar si una relación de coste-efectividad favorece la intervención o la comparación requiere una comparación implícita o explícita. A menudo los GEG utilizan comparaciones implícitas y pueden considerar las comparaciones explícitas únicamente cuando no están de acuerdo o cuando consideran necesario justificar su juicio. Alternativamente, un GEG podría utilizar la relación coste-efectividad de una serie de intervenciones que estén en uso o hayan recibido financiamiento, y compararlas con las intervenciones que esté evaluando.
Del mismo modo, al igual que en los juicios sobre la magnitud de las necesidades de recursos, un juicio que busque determinar si una relación de coste-efectividad favorece una de las intervenciones evaluadas requiere una comparación implícita o explícita. A menudo los GEG utilizan comparaciones implícitas y, cuando no alcanzan consenso o cuando consideran que existe una necesidad mayor de justificar su juicio, pueden plantearse la utilización de comparaciones explícitas.
Para más información sobre este criterio y los aspectos relacionados consultar el capítulo 7, “Consideración del uso de recursos y costes en la elaboración de recomendaciones”.
8.2.3.10. ¿Cuál sería el impacto sobre la equidad?
En ocasiones, las intervenciones recomendadas pueden generar inequidades en determinados subgrupos de la población. Estas inequidades son consecuencia del impacto de la intervención en una población con individuos que presentan características asociadas a una desventaja (por ejemplo, la situación económica, el tipo de empleo u ocupación, la educación, el lugar de residencia, el sexo o la raza).
Los equipos técnicos y el GEG pueden analizar los posibles impactos sobre la equidad, mediante la evaluación de las consecuencias de una intervención y sus posibles efectos diferenciales en las poblaciones desfavorecidas.
Por ejemplo, la recomendación de utilizar dabigatrán en lugar de acenocumarol (que necesita controles periódicos del nivel de anticoagulación) como tratamiento anticoagulante en los pacientes con fibrilación auricular podría disminuir la inequidad, ya que el acceso a este fármaco podría facilitar el acceso a un tratamiento anticoagulante en los pacientes que, por su lugar de residencia, tengan dificultades para poder realizar los controles correspondientes. En cambio, teniendo en cuenta que los pacientes menores de 65 años deben hacerse cargo de un porcentaje del coste del fármaco, a pesar de tratarse de un medicamento de aportación reducida en España, la recomendación de este fármaco podría generar inequidad en poblaciones de personas activas con menos recursos, ya que los pensionistas tienen un tope máximo mensual de gasto, a diferencia de los trabajadores activos. Otro ejemplo sería una asociación de antihipertensivos o ciertos hipolipemiantes (que no tienen aportación reducida), que podría generar inequidad en pacientes no pensionistas (sin tope de aportación mensual por copago) frente a pacientes pensionistas (con tope de aportación mensual por copago).
8.2.3.11. ¿Es aceptable la intervención para los grupos de interés clave?
Una intervención puede ser considerada más o menos aceptable para las distintas partes implicadas (como administradores de servicios de salud, proveedores de salud, o usuarios) según cuáles sean sus opiniones y experiencias en relación con la intervención y la importancia relativa que atribuyen a sus consecuencias. Esto puede conllevar la necesidad de que el grupo proponga acciones concretas para asegurar su correcta implementación. Cuanto menos aceptable es una intervención para los grupos de interés clave, menos probable es que corresponda recomendarla. Si se recomienda, probablemente sea necesario considerar una estrategia de implementación que aborde estos problemas de aceptabilidad detectados o previstos por el GEG.
8.2.3.12. ¿Es factible implementar la intervención?
Cuanto menos factible es una intervención, menos probable es que corresponda recomendarla. Las barreras para implementar una intervención pueden modificar la fuerza de una recomendación. El GEG puede incluir estas consideraciones en la misma recomendación o comentar en el apartado “Consideraciones de implementación” de la tabla EtD las barreras que deberían tenerse en cuenta y las estrategias para abordarlas.
Por ejemplo, una guía de práctica clínica puede juzgar muy útil la terapia cognitiva para el tratamiento de la depresión leve o moderada. No obstante, la escasez de terapeutas hace a menudo imposible su aplicación en muchos entornos. En este caso es más probable que se formule una recomendación débil o condicional y que se incluyan consideraciones para posibilitar la implementación de esta intervención. La decisión de aumentar el número de terapeutas sería en todo caso una decisión de política sanitaria propia de otro contexto y requeriría otro tipo de tabla EtD.
8.2.4. Conclusiones
8.2.4.1. Recomendación y tipo
Las recomendaciones deben ser concisas, fáciles de comprender y contener una acción concreta (anexo 8.1). Asimismo, deben estar estructuradas y especificar la población, intervención y comparación. Para más detalles, ver apartado 8.5, “Redacción de las recomendaciones”. Los tipos de recomendación se describen en el apartado 8.3, “Fuerza y dirección de las recomendaciones”.
8.2.4.2. Justificación
El GEG debe proporcionar una breve justificación de la recomendación y destacar los juicios del panel en cuanto a los criterios clave que motivaron la recomendación final. Por ejemplo, en el caso de una recomendación débil en contra de cambiar a dabigatrán a pacientes con fibrilación auricular y riesgo moderado de ictus (CHADS2=2) que estén bien controlados con warfarina, el GEG podría formular la siguiente justificación: “El grupo elaborador, dada la escasa o nula reducción del riesgo de ictus y el coste sustancialmente mayor del dabigatrán, a pesar de unos inconvenientes algo menores para los pacientes, ha formulado una recomendación débil en contra”.
8.2.4.3. Justificación detallada
Asimismo, el GEG debería formular una justificación más detallada de sus juicios sobre cada uno de los criterios más importantes para la recomendación formulada.
8.2.4.4. Consideraciones de subgrupos
El GEG debe resumir los subgrupos que fueron considerados y toda modificación específica de la recomendación general. Si se decide formular recomendaciones diferentes para los distintos subgrupos, quizá convenga preparar tablas EtD independientes.
8.2.4.5. Consideraciones de implementación
Habiendo analizado los efectos deseables e indeseables de las intervenciones, así como su aceptabilidad y factibilidad e impacto sobre la equidad, el GEG está en una posición privilegiada para alertar de las potenciales barreras a la implementación. Por tanto, puede incluir en este apartado estrategias para abordar barreras o aspectos relevantes que puedan dificultar la aceptabilidad y factibilidad de la intervención.
8.2.4.6. Monitorización y evaluación
El GEG puede incluir en este apartado sugerencias de monitorización y evaluación si se implementa la intervención. Asimismo, puede sugerir indicadores para la monitorización y las potenciales necesidades de evaluaciones en el futuro.
8.2.4.7. Prioridades de investigación
El GEG puede incluir en este apartado las necesidades de investigación que se hayan podido detectar durante el proceso de formulación de las recomendaciones. Estas necesidades deben ser lo más concretas y estructuradas que sea posible (ver apartado 8.4.2, “Recomendaciones en el contexto de investigación”).
8.2.5. Recomendaciones diagnósticas
La designación de prueba diagnóstica es genérica e incluye diferentes propósitos, como la detección de alteraciones fisiológicas (determinación de los parámetros bioquímicos en un análisis de sangre), el establecimiento del pronóstico (pruebas de imagen para determinar la extensión de un tumor), el seguimiento del curso clínico o la respuesta a un tratamiento (determinación de la carga viral), la información del manejo clínico (identificación de un microorganismo por cultivo y determinación de la sensibilidad antibiótica), así como el diagnóstico propiamente dicho, que pretende establecer si una determinada persona sufre o no una patología. Asimismo, la evaluación de las pruebas diagnósticas puede sustituir una prueba existente, o servir como prueba complementaria o como prueba de cribado. Para los efectos de este capítulo, nos hemos basado en el uso de pruebas con un propósito diagnóstico que aporten un resultado dicotómico (por ejemplo, presentar o no presentar un cáncer), a diferencia de los resultados continuos (por ejemplo, niveles en sangre de troponinas).
Las pruebas diagnósticas solo se deben aplicar tras un análisis detallado de las consecuencias que implican sus resultados; es decir, el impacto que va a tener el manejo clínico sobre desenlaces importantes para los pacientes tras conocer el resultado. Las recomendaciones sobre pruebas diagnósticas, por tanto, requieren la evaluación no solo de la evidencia de los estudios de rendimiento sino también del abordaje posterior, así como de la historia natural de la enfermedad.
La tabla EtD de la evidencia a la toma de decisiones comparte el mismo razonamiento que las preguntas de intervención, aunque presenta algunas particularidades, principalmente la necesidad de relacionar la evidencia sobre la precisión diagnóstica y las consecuencias últimas de actuar clínicamente a partir de estos resultados. La tabla EtD para pruebas diagnósticas presenta, por tanto, algunos criterios adicionales para una evaluación detallada y explícita de estos aspectos.
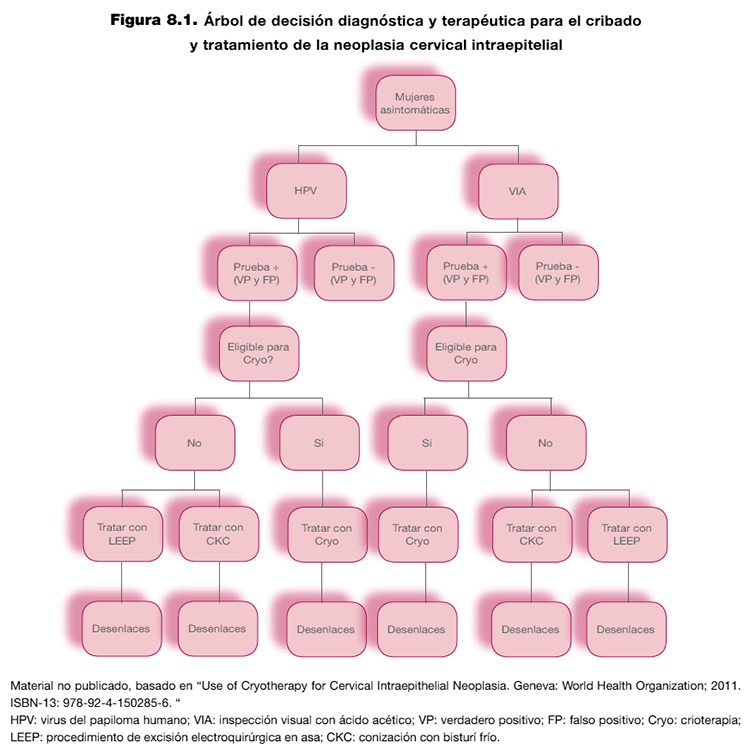
Formulación de la pregunta: debe incluir información sobre la población, las intervenciones (pruebas índice y de referencia) y los desenlaces relevantes para el paciente. Además, se debe proporcionar información sobre el propósito, el rol de la prueba y las estrategias de manejo clínico tras el resultado. Este último aspecto se puede reflejar de forma esquemática elaborando un árbol de decisión diagnóstica y terapéutica. En el ejemplo de la figura 8.1 se presenta un árbol de decisión elaborado en el contexto de una pregunta sobre cribado y tratamiento de la neoplasia cervical intraepitelial.
Evaluación de los factores: la tabla EtD para pruebas diagnósticas incluye factores muy similares (ver tabla 8.1, “Factores para la elaboración de recomendaciones sobre pruebas diagnósticas”). Por ese motivo, este apartado solo destacará los criterios más específicos para las recomendaciones sobre pruebas diagnósticas.

¿Cuál es la precisión de la prueba diagnóstica?
La base ideal es una revisión sistemática de estudios de precisión diagnóstica o, en su ausencia, estudios individuales. Si la prueba que se evalúa es muy imprecisa, podría justificarse sin más una recomendación en contra de su uso.
¿Favorece el balance entre los beneficios y los riesgos a la prueba índice o a la comparación?
El juicio debe incorporar información sobre los beneficios potenciales (rapidez, facilidad de uso) y riesgos (prueba invasiva) directos de la prueba. También debe incorporar información sobre las consecuencias de actuar clínicamente a partir de los resultados de las pruebas. Esta información debe estar basada en evidencia de ensayos clínicos (tratamiento de los casos con la enfermedad o condición) o de estudios de historia natural (evolución de la enfermedad o condición sin tratamiento). Para un juicio más detallado y transparente, se sugiere valorar la elaboración de un modelo de predicción. En la tabla 8.2 se presenta un modelo de predicción elaborado en el contexto de la pregunta anterior sobre el cribado y tratamiento de la neoplasia cervical intraepitelial (ver figura 8.1).

A menudo, el grupo elaborador no dispone de tiempo para preparar este tipo de modelo, o la tarea puede resultar muy compleja. En estos casos, se debe explicitar el número estimado de casos correcta e incorrectamente diagnosticados, así como los efectos estimados de la actuación clínica posterior, basándose en la mejor evidencia disponible. Estos aspectos se pueden presentar de forma narrativa.
¿Cuál es la certeza/confianza global respecto a la evidencia disponible?
En el caso de las pruebas diagnósticas, este juicio debe tener en cuenta todos los cuerpos de evidencia relevantes para poder formular la recomendación; a saber:
- Certeza respecto a la evidencia de estudios de precisión diagnóstica: en el capítulo 6 ya se destacó que los estudios de rendimiento diagnóstico con un diseño apropiado aportan una confianza alta en cuanto a la capacidad de la prueba diagnóstica para clasificar a los pacientes en sanos y enfermos. Sin embargo, sus estimadores de resultados (sensibilidad, especificidad, etc.) se consideran resultados indirectos de los efectos en salud de los pacientes.
- Certeza respecto a la evidencia sobre los potenciales beneficios y riesgos directos de la prueba.
- Certeza respecto a la evidencia sobre el curso natural de la enfermedad y el manejo clínico a partir de los resultados: el grupo GRADE ofrece marcos para la evaluación de la confianza en los resultados sobre la historia natural de una enfermedad provenientes de estudios de tipo observacional, así como para la evaluación de la confianza en los resultados sobre los efectos de una intervención provenientes de ensayos clínicos.
- Certeza respecto a la relación entre el resultado de la prueba y las decisiones de manejo clínico: se debe realizar un juicio sobre la certeza de que, tras un resultado determinado de una prueba, el paciente recibirá el manejo clínico adecuado (por ejemplo, tal y como se detalla en el árbol de decisión diagnóstica y terapéutica, que el grupo deberá elaborar al formular la pregunta clínica). Hay situaciones en las que existe poca confianza en esta relación; por ejemplo, no hay certeza de que las intervenciones estén disponibles para todos los pacientes afectados ni de que se puedan implementar de forma eficiente u oportuna.
La confianza global respecto a los efectos de la prueba y el posterior manejo clínico será la más baja de los cuerpos de evidencia mencionados anteriormente. En un escenario en el que existe una confianza alta en los resultados de una prueba, pero los estudios de historia natural o de tratamiento brindan una baja confianza en sus resultados, la confianza global en las consecuencias últimas sobre los desenlaces de interés para el paciente será en conjunto baja.
Conclusiones: se debe incluir el mismo tipo de información que se recoge en el apartado 8.2.5 de este capítulo.
8.3. Fuerza y dirección de las recomendaciones
La fuerza de las recomendaciones refleja el grado de certeza de que los efectos deseables de una intervención recomendada superan sus efectos no deseables, o viceversa, en la población de interés.
Las recomendaciones pueden ser clasificadas por su dirección y su fuerza. Según GRADE, la dirección de una recomendación puede ser a favor o en contra del uso de una intervención, y, en términos de fuerza, una recomendación puede ser fuerte o débil. GRADE sugiere la utilización de los términos “fuerte” y “débil” para la identificación explicita de la fuerza de las recomendaciones, pero deja abierta la posibilidad de optar por una redacción diferenciada que caracterice cada categoría de fuerza (ver el apartado 8.5, “Redacción de las recomendaciones”).
Recomendación fuerte: se refiere a una recomendación con confianza en que los efectos deseados de la intervención superan a los indeseables (recomendación fuerte a favor), o en que los efectos indeseados de la intervención superan los deseados recomendación fuerte en contra). Para poder realizar una recomendación fuerte, el GEG debe estar seguro de los diferentes factores que están implicados en la fuerza de la recomendación, además de contar con la información pertinente que respalde dicha confianza a favor o en contra del uso de una intervención (por ejemplo, conocer claramente la relación entre los riesgos y los beneficios).
Estos son algunos ejemplos de recomendaciones fuertes:
- Se recomienda utilizar metformina como primera opción de tratamiento oral para pacientes con DM2 obesos y no obesos.
- En pacientes con DM2 que precisan insulinización intensiva, no se recomienda el uso de análogos de acción rápida.
- En niños menores de 4 años de edad no controlados con dosis bajas o medias de glucocorticoide inhalado, se recomienda doblar la dosis de glucocorticoide.
Recomendación débil: se refiere a una recomendación según la cual los efectos deseables probablemente superan los efectos no deseables (recomendación débil a favor de una intervención) o los efectos no deseables probablemente son mayores que los efectos deseables (recomendación débil en contra de una intervención), pero con una incertidumbre apreciable.
Una recomendación débil implica que no todos los pacientes se beneficiarán de la acción recomendada. Por ello, será necesario considerar de manera más rigurosa las preferencias y valores de los pacientes individuales. Esto supondrá generalmente una necesidad mayor de tiempo durante la toma de decisiones compartidas, para poder garantizar una trasmisión clara y completa de los beneficios y daños potenciales a cada paciente individual.
Debido a que el término “recomendación débil” puede haber tenido una connotación negativa entre los usuarios de las recomendaciones, e incluso haber generado confusión con el concepto de “evidencia débil”, GRADE sugiere la posibilidad de utilizar términos alternativos para describir dicho concepto:
- Recomendación condicional (en función de los valores del paciente, los recursos disponibles o el contexto de aplicación).
- Recomendación discrecional (basada en la opinión de pacientes o profesionales médicos).
- Recomendación restringida/restrictiva (por una explicación sobre aspetos que puedan conducir a diferentes decisiones).
Ejemplos de recomendaciones débiles:
- En pacientes hipertensos de alto riesgo cardiovascular, se sugiere utilizar la combinación de IECA y CA dihidropiridínico en lugar de la asociación de IECA con diurético tiazídico.
- En preescolares con sibilancias o asma leve intermitente, se sugiere no comenzar tratamiento con glucocorticoides inhalados o montelukast.
- Cuando el control con metformina sea insuficiente, se sugiere añadir una sulfonilurea como doble terapia.
8.3.1. Significado de las recomendaciones
Las GPC se pueden elaborar desde diferentes perspectivas para apoyar la toma de decisiones en diferentes escenarios. En este contexto, a pesar de que las recomendaciones fuertes representan habitualmente acciones que inspiran alta confianza en los beneficios, no tienen por qué revestir igual importancia desde las diferentes perspectivas de pacientes, sistemas de salud y salud pública. Por ejemplo, en el contexto de una recomendación clínica, los responsables políticos o los gestores de la salud pública pueden decidir que algunas recomendaciones fuertes, a pesar de ser importantes para los pacientes individuales, tienen baja prioridad desde la perspectiva del sistema sanitario.
Una de las ventajas de esta clasificación binaria de la fuerza de la recomendación propuesta por GRADE es que permite brindar una dirección o interpretación clara de las recomendaciones en función de la perspectiva (de pacientes, profesionales médicos y responsables políticos) adoptada durante la preparación de la guía. En la tabla 8.3 se presentan las implicaciones que tendrían las recomendaciones fuertes y débiles para cada usuario al que se destinan las GPC.

8.4. Situaciones especiales de determinación de la dirección y fuerza de las recomendaciones
8.4.1. Recomendaciones fuertes con calidad de evidencia baja
En general, se desaconseja que se formulen recomendaciones fuertes cuando la calidad de las estimaciones del efecto para desenlaces críticos es baja o muy baja. No obstante, se han identificado ciertas circunstancias o situaciones paradigmáticas en las cuales, a pesar de la existencia de evidencia de baja calidad, las recomendaciones fuertes podrían estar justificadas; a saber:
- Recomendación fuerte a favor de una intervención para situaciones clínicas de vida o muerte, sobre las que existe evidencia de baja calidad en cuanto a los beneficios de la intervención y evidencia de alta o incluso baja calidad en cuanto a la toxicidad. El GEG podría decidir que, debido a su situación de alto riesgo de muerte, la mayoría de los pacientes escogerían la intervención aun siendo tóxica, y podría formular por ello una recomendación fuerte a favor del uso de dicha intervención.
- Recomendación fuerte en contra de una intervención cuando existe evidencia de baja calidad que sugiere beneficios, y evidencia de alta calidad sobre los efectos adversos observados o sobre un uso importante de recursos. El GEG podría decidir que los efectos indeseados sobrepasan sustancialmente los deseados y formular en consecuencia una recomendación fuerte en contra de su utilización.
- Recomendación fuerte a favor cuando existe evidencia de calidad baja sobre un beneficio similar de dos alternativas comparadas, y evidencia de alta calidad de un riesgo menor con una de ellas. Las razones para evitar los riesgos asociados al uso de una de las alternativas podrían llevar a formular una recomendación fuerte a favor de la intervención con menor riesgo.
- Recomendación fuerte a favor de la intervención cuando existe evidencia de calidad alta sobre un beneficio similar de las alternativas comparadas, y evidencia de baja o muy baja calidad sobre un mayor riesgo con una de ellas. La determinación de que con una de las alternativas se evitarían posibles riesgos importantes podría justificar una recomendación fuerte a favor de la intervención con un aparente riesgo menor.
- Recomendación fuerte en contra de una intervención cuando existe evidencia de alta calidad sobre los modestos beneficios de una intervención, y evidencia de baja o muy baja calidad sobre la probabilidad de que cause daños catastróficos. La prudencia de evitar riesgos muy serios podría justificar en estos casos la recomendación fuerte en contra de una intervención, a pesar de la confianza en sus beneficios.
Cabe destacar que estas situaciones reflejan escenarios en los cuales la dirección o fuerza de la recomendación podría cambiar ante nueva evidencia de mayor calidad.
8.4.2. Recomendaciones en el contexto de investigación
El GEG puede enfrentarse a situaciones en las que se deben tomar decisiones sobre intervenciones prometedoras asociadas a daños y riesgos, o costes apreciables, con evidencia insuficiente de los beneficios para respaldar su uso. Por un lado, el GEG puede ser reacio a pronunciarse en contra de este tipo de intervenciones por temor a frenar una investigación adicional sobre el tema en cuestión. Por otro lado, si formula recomendaciones favorables al uso prematuro de dichas intervenciones, podría estar fomentando una rápida difusión de intervenciones potencialmente ineficaces o dañinas e impidiendo el reclutamiento para la investigación o para estudios afines ya en curso. La formulación de recomendaciones para el uso de una intervención solo en el contexto de la investigación puede despejar estos problemas y temores.
Una recomendación adecuada para el contexto de investigación deberá cumplir las siguientes condiciones:
- Existe una importante incertidumbre sobre los efectos de la intervención, así como una calidad de evidencia muy baja o baja en torno a las consecuencias deseadas y no deseadas
- La investigación futura ofrece la posibilidad de reducir la incertidumbre existente a un coste razonable.
- El beneficio y ahorro potencial de reducir la incertidumbre sobrepasa los daños y costes potenciales de utilizar o no utilizar la intervención sobre la base de la evidencia actual disponible.
La recomendación para el contexto de investigación debe especificar particularmente los desenlaces importantes para el paciente y su modalidad de medición, así como otros aspectos relevantes con respecto a la pregunta específica de investigación (características del paciente, intervención y comparación específica, tipo de estudio, etc.). De igual modo, es aconsejable que las recomendaciones de utilización de una intervención exclusivamente en el ámbito de la investigación vayan acompañadas de una recomendación explícita fuerte de no utilizar la intervención estudiada fuera de ese contexto (es decir, en la práctica clínica habitual).
Ejemplos de recomendaciones para la investigación:
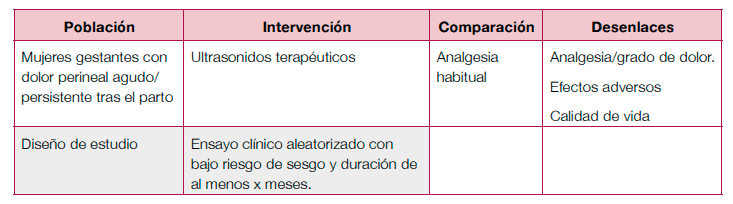
Terapéutico
- Se necesitan ECA, doble ciego, con un seguimiento de mayor duración para investigar la eficacia y seguridad del ultrasonido terapéutico para el dolor perineal agudo o persistente después del parto.
Investigación cualitativa
- Se necesitan estudios cualitativos sobre la percepción de las gestantes sobre quién presta los cuidados prenatales.

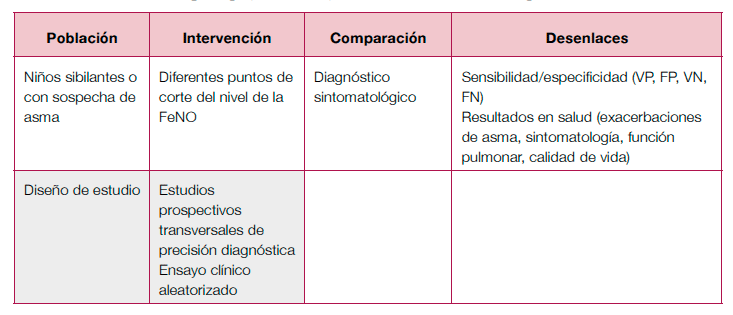
Diagnóstico
- Se necesitan estudios en niños para poder establecer los puntos de corte del nivel de la FeNO que apoyen el diagnóstico de asma en esta población.
8.4.3. No realizar recomendaciones
Un GEG puede ser reacio a formular recomendaciones a favor o en contra de una estrategia de manejo por diferentes razones. Por ejemplo, cuando la confianza en la estimación del efecto es tan baja que se considera que sería demasiado especulativo formular una recomendación. Otro ejemplo se podría dar en los casos en que, a pesar de tener una confianza moderada o incluso alta en la estimación del efecto, el balance entre los beneficios y los daños está estrechamente equilibrado o es incierto y, además, los valores y preferencias de los pacientes y los recursos requeridos son desconocidos o muy variables. Una tercera posibilidad es que las diferentes opciones de intervención tengan consecuencias no deseadas muy diferentes y que sea muy probable que las preferencias de pacientes individuales sean tan dispares que resulta difícil definir valores y preferencias típicas dentro de una población.
Ante estas situaciones, y a pesar de la disconformidad que puedan generar, debería tratarse de consensuar recomendaciones para poder dar respuesta a la necesidad del profesional clínico de proporcionar consejos y soluciones, a la necesidad del paciente de tomar decisiones, y a la necesidad del profesional de la gestión de establecer políticas de salud. No obstante, cabe pensar que dichas recomendaciones serán inevitablemente débiles.
Cuando nos enfrentamos a la tarea de elaborar una recomendación con evidencia de baja o muy baja calidad debido a la incertidumbre sobre las estimaciones o a un equilibrio entre riesgos y beneficios, se debería usar el mejor juicio posible para formular recomendaciones específicas y claras, exponiendo de forma transparente los juicios realizados. Por otro lado, el GEG no debería renunciar a realizar una recomendación por el solo hecho de que distintos pacientes tomarían decisiones diferentes, ya que esto puede quedar reflejado con una calificación “débil”. En dichas circunstancias, sería aconsejable formular al menos una recomendación de la necesidad de diálogo entre el profesional clínico y los distintos pacientes para determinar y verificar sus preferencias respecto a las opciones de intervención.
8.5. Redacción de las recomendaciones
La redacción de una recomendación debe de ser concisa, clara (evitando ambigüedades) y fácil de trasladar a la práctica clínica. Las acciones recomendadas deben establecerse con precisión y la fuerza de la recomendación debe quedar reflejada mediante etiquetas, números, letras, símbolos, etc.
Hasta la fecha, la poca evidencia empírica acerca de la redacción expresiva de la fuerza de las recomendaciones muestra que ninguno de los enfoques estudiados es claramente superior a los demás. El grupo de trabajo GRADE para la redacción de las recomendaciones sugiere, además del uso etiquetas específicas como “recomendación fuerte/débil”, la adopción de una terminología específica para reflejar la fuerza, utilizando para ello expresiones como “se recomienda/no se recomienda” o “se debe/no se debe” cuando se habla de recomendaciones fuertes, y “se sugiere/no se sugiere” o “se podría” para recomendaciones débiles. Además, las recomendaciones deben describir siempre la población a la que aplica (definida por la enfermedad o por otros factores), así como la intervención y comparación con un máximo de detalle, para lograr que sean lo más específicas posible.
La redacción de las recomendaciones debe ser acordada por el GEG y debe ceñirse a las siguientes características:
- Centrarse en la acción que debe tomarse y contener una sola acción principal.
- Incluir lo que los usuarios necesitan saber.
- Utilizar un lenguaje lo más llano posible, evitando la ambigüedad.
- Reflejar la fuerza de la recomendación.
- Destacar la participación del paciente (o sus cuidadores) en las decisiones sobre el tratamiento y el cuidado.
Resumen de los Aspectos Clave
Notas
* Algunas organizaciones como NICE (NICE 2015) tienen umbrales de coste-efectividad. No obstante, este es un tema muy controvertido4. En nuestro país ha habido recientes trabajos en este tema, pero no existe un umbral de coste-efectividad oficial o ampliamente reconocido para la toma de decisiones5-6. Estos estudios recomiendan continuar con el debate y fomentar proyectos de investigación que permitan definir un umbral que pueda ser aplicado en nuestro contexto. Por tanto, se podría adoptar de manera orientativa el umbral utilizado por NICE actualmente (NICE 2014): 1) intervenciones por debajo de 20.000 euros/AVAC: estas intervenciones son en general consideradas coste-efectivas. Si un GEG considera que una intervención con un RCEI por debajo de 20.000 euros/AVAC no debe ser recomendada, debería explicitar las razones de esta decisión; 2) intervenciones por encima de 20.000 euros/AVAC: su recomendación debe ir acompañada de un juicio explícito acerca del porqué de su adopción. Este juicio debe considerar factores como la certeza en torno al RCEI, cambios en la calidad de vida que no fueron bien capturados en los análisis y por tanto llevaron a una subestimación de los beneficios en salud, y casos en que no se capturaron adecuadamente los beneficios en salud (importantes y demostrables) de intervenciones innovadoras; y 3) intervenciones entre 20.000 y 30.000 euros/AVAC: se deben explicitar los factores anteriormente expuestos, y por encima de 30.000 euros/AVAC esta justificación debe ser aún mayor.
** Nota importante: Los profesionales médicos, pacientes, terceros pagadores, comités de vigilancia institucionales, otros grupos de interés, o tribunales no deben considerar que las recomendaciones son obligatorias. Incluso las recomendaciones fuertes basadas en evidencia de alta calidad no son obligatoriamente aplicables en todas las circunstancias y a todos los pacientes. Los usuarios de las recomendaciones podrían concluir razonablemente que la adhesión a algunas recomendaciones fuertes basadas en evidencia de alta calidad pueda ser un error para determinados pacientes. Es posible que las GPC o las recomendaciones no tengan en cuenta todas y cada una de las circunstancias apremiantes de cada paciente y las circunstancias clínicas. Por tanto, ningún responsable de evaluar las acciones del profesional clínico debería tratar de aplicar las recomendaciones de forma rutinaria y sin justificación.
Bibliografía 8. Formulación de las recomendaciones
1. Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl E, Davoli M, et al.: GRADE working Group. GRADE Evidence to Decision (EtD) frameworks: 2. Clinical practice guidelines. BMJ 2016 (aceptado).
2. Alonso-Coello P, Schünemann H, Moberg J, Brignardello-Petersen R, Akl E, Davoli M, et al.: GRADE working Group. GRADE Evidence to Decision (EtD) frameworks: A systematic and transparent approach to making well-informed healthcare choices: 1. Introduction. BMJ 2016 (aceptado).
3. Schünemann H, Reem M, Brozek J, Santesso N, Alonso-Coello P, Guyatt G, et al.: GRADE working group. GRADE Evidence to Decision (EtD) frameworks: Diagnostic, screening and other tests in clinical practice and public health. J Clin Epidem 2016 (aceptado).
4. Claxton K, Martin S, Soares M, Rice N, Spackman E, Hinde S, et al. Methods for the estimation of the NICE cost effectiveness threshold. Health Technol Assess . 2015;19(14).
5. Vallejo-Torres L, García-Lorenzo B, García-Pérez L, Castilla I, Valcárcel Nazco C, Linertová R, et al. Valor Monetario de un Año de Vida Ajustado por Calidad: Revisión y Valoración Crítica de la Literatura. Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; El Rosario (Tenerife): Servicio de Evaluación del Servicio Canario de la Salud; 2014. Informes de Evaluación de Tecnologías Sanitarias.
6. García-Lorenzo B, Vallejo-Torres L, Trujillo-Martín MM, Perestelo-Pérez L, Valcárcel-Nazco C, Serrano Aguilar P. Evaluación económica busca umbral para apoyar la toma de decisiones. Rev Esp Salud Pública [Internet]. 2015 Dic;89(6):537-544 [consultado 03/03/2016]. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1135-57272015000600002.
Lecturas recomendadas
Las lecturas recomendadas a continuación describen con diferente grado de detalle la tabla EtD para la formulación de las recomendaciones propuesta por el grupo GRADE. Los manuales y publicaciones referentes a este tema, presentan el desarrollo y la evolución a lo largo de los años de dicho Marco, incluyendo ejemplos de su utilización.
• Manual EtD Evidence to Decision (EtD) Frameworks [Internet]. [Consultado: 03/03/2016]. Disponible en: http://ietd.epistemonikos.org/#/help/guidance. Dirigido a elaboradores de guías. El manual aborda la utilización de las tablas EtD (Evidence to Decisions), incluidos los marcos dirigidos a las recomendaciones clínicas y el marco para las preguntas sobre pruebas diagnósticas.
• Capítulo de la evidencia a la recomendación (GDT)
6. Going from evidence to recommendations. En: Schünemann H, Brozek J, Guyatt G, Oxman A, editores. GRADE handbook for grading quality of evidence and strength of recommendations. The GRADE Working Group, 2013.
Dentro del manual de la herramienta Guideline Development Tool el capítulo (Going from evidence to recommendations) aborda la etapa de la evidencia a la recomendación. Este capítulo será en el futuro remplazado por el contenido, más exhaustivo, del manual EtD.
• Serie de artículos sobre los marcos EtD
Se han aceptado tres artículos hasta el momento. Están pendientes dos más sobre el marco para las decisiones de financiación así como sobre el marco para las recomendaciones/decisiones de sistemas sanitarios/salud pública.
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl E, Davoli M, et al.: GRADE working Group. GRADE Evidence to Decision (EtD) frameworks: 2. Clinical practice guidelines. BMJ 2016 (aceptado).
- Alonso-Coello P, Schunemann H, Moberg J, Brignardello-Petersen R, Akl E, Davoli M, et al.: GRADE working Group. GRADE Evidence to Decision (EtD) frameworks: A systematic and transparent approach to making well-informed healthcare choices: 1. Introduction. BMJ 2016 (aceptado).
- Schunemann H, Reem M, Brozek J, Santesso N, Alonso-Coello P, Guyatt G, et al.: GRADE working group. GRADE Evidence to Decision (EtD) frameworks: Diagnostic, screening and other tests in clinical practice and public health. J Clin Epidem 2016 (aceptado).
• Tres artículos sobre el paso de la evidencia a la recomendación (Serie BMJ 2008).
Artículos previos al desarrollo de la tabla EtD por el grupo GRADE. El publicado en el British Medical Journal está más dirigido a los elaboradores. Los otros dos de la serie publicada en el Journal of Clicinal Epidemiology están dirigidos a elaboradores de GPC.
- Guyatt GH, Oxman AD, Kunz R, Falck-Ytter Y, Vist GE, Liberati A, et al: Going from evidence to recommendations. BMJ [Internet] 2008 May;336:1049-51 [consultado 03/03/ 2016]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2376019/.
- Andrews JC, Guyatt GH, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol 2013 Jul;66(7):719-25.
- Andrews JC, Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Alonso-Coello, P, et al. GRADE guidelines: 15. Going from evidence to recommendations: determinants of a recommendation’s direction and strength. J Clin Epidemiol 2013 Jul;66(7):726-35.
Anexos
Anexo 8.1. Tablas/Marcos de la evidencia a las decisiones (EtD).
Tablas y figuras
Tabla 8.1. Factores para la elaboración de recomendaciones sobre pruebas diagnósticas.
Tabla 8.3. Implicaciones de cada tipo de recomendación en función del grupo de interés.






