Preguntas a responder:
- En personas con enfermedad renal crónica ¿el tratamiento con fármacos inhibidores del enzima conversor de la angiotensina o antagonistas de los receptores de la angiotensina reducen la progresión de la enfermedad y el daño vascular?
- En personas con enfermedad renal crónica que requieren tratamiento antihipertensivo, ¿se deben establecer cifras objetivo de presión arterial?
- En personas con enfermedad renal crónica, ¿el tratamiento con estatinas, reducen la progresión de la enfermedad y el daño vascular?
- En personas con enfermedad renal crónica, ¿el tratamiento con fármacos antiagregantes plaquetarios, reducen la progresión de la enfermedad y el daño vascular?
7.1. Tratamiento con inhibidores de la enzima convertidora de la angiotensina (IECA) y antagonistas de los receptores de la angiotensina II (ARA II)
IECA o ARA II frente a placebo
Los fármacos activos sobre el sistema renina-angiotensina-aldosterona son principalmente los inhibidores de la enzima conversora de la angiotensina (IECA), los bloqueadores de los receptores de la angiotensina II (ARA II) y los inhibidores directos de la renina (como aliskireno y remikireno –sólo el primero se encuentra comercializado en España).
La primera decisión al plantear un tratamiento antihipertensivo es establecer a partir de qué cifra de presión arterial se debe iniciar un tratamiento. Es conocido que la presión arterial elevada es un factor de riesgo vascular y que las cifras de presión arterial tienen una relación continúa con el desarrollo de complicaciones vasculares96. En personas mayores de 18 años que no reciben tratamiento farmacológico se considera hipertensión arterial la elevación permanente de las cifras de presión arterial por encima de 139 mm Hg para la PA sistólica (PAS) y 89 mm Hg para la PA diastólica (PAD).
En los pacientes con ERC, los valores de albuminuria tienen un valor pronóstico en la evolución del daño renal y en la morbi-mortalidad vascular14,15,97,98. La consideración de la presencia de albúmina en orina como marcador subrogado de progresión del daño vascular y renal es la base del tratamiento antihipertensivo basado en el sistema reninaangiotensina- aldosterona, básicamente IECA y ARA II. Aunque otros agentes antihipertensivos son eficaces para reducir las cifras de presión arterial, no hay evidencia suficiente en personas con ERC para justificar su uso como primera opción con el objetivo de reducir el riesgo de progresión del daño renal y la albuminuria. Así los antagonistas de la aldosterona, diuréticos, los beta-bloqueantes, los antagonistas de los canales del calcio, los agonistas alfa2-adrenérgicos o los bloqueadores alfa1-adrenérgicos, se usan principalmente en combinación con IECA o ARA II con el objetivo de mejorar el control de las cifras de tensión arterial y según las co-morbilidades de cada paciente2.
El principal estudio que evaluó los beneficios sobre la evolución del daño vascular y renal del aliskireno (inhibidor directo de la renina) en combinación con IECAs o ARAII, en pacientes con nefropatía diabética tuvo que ser interrumpido prematuramente por un desfavorable balance beneficio riesgo. La Agencia Española de Medicamentos y Productos Sanitarios recomienda no iniciar nuevos tratamientos con aliskireno en pacientes diabéticos o con enfermedad renal moderada o grave, que ya utilizan IECA o ARAII.
Los antagonistas de la aldosterona (espironolactona) en pacientes con ERC se han evaluado junto con un tratamiento con IECA en estudios de pequeño tamaño que no han evaluado desenlaces de interés de progresión de daño vascular o renal. Debido a la tendencia a producir hiperkaliemia, deberían usarse con precaución2.
Los diuréticos de tipo tiazídico, su mecanismo de acción se encuentra afectado en personas con ERC y TFG <30-50 mL/min/1,73 m2. La evidencia de estos fármacos frente a placebo es escasa y en los estudios que han sido comparados con IECA la eficacia ha sido similar2,88,95.
Los diferentes estudios en personas con ERC e insuficiencia cardiaca han mostrado beneficios de los fármacos beta-bloqueantes sobre el daño vascular frente a placebo mientras que en relación a IECA los beneficios sobre el daño vascular y renal son similares. El uso de fármacos beta-bloqueantes en pacientes con ERC debe realizarse con precaución debido a la posibilidad de acumulación por reducción de su eliminación y por tanto potenciación de sus efectos sobre la conducción cardiaca88,99.
Los bloqueadores de los canales del calcio, sobretodo dihidropiridinas, pueden aumentar la eliminación de albúmina en orina y causar retención de líquidos y edema por lo que su uso en personas con ERC puede ser problemático. Los bloqueadores de los canales del calcio de tipo no-dihidropiridinas (diltiazem, verapamilo) no presentan este tipo de efecto con tanta frecuencia aunque tienen efectos sobre la conducción cardiaca y reducen la contractilidad miocárdica, además de interaccionar con algunos inmunosupresores comunes en pacientes con trasplante renal2.
La evidencia para los agonistas alfa2-adrenérgicos de acción central y los bloqueadores alfa1-adrenérgicos en pacientes con ERC es limitada a tratamiento conjunto con otros anti-hipertensivos y no ha evaluado desenlaces de interés de progresión de daño vascular o renal. El uso se ve limitado por sus efectos indeseables2.
Resumen de la evidencia
Se identificaron seis revisiones sistemáticas (RS) que han evaluado el efecto de los inhibidores de la enzima convertidora de la angiotensina (IECA) y los antagonistas de los receptores de la angiotensina II (ARA II) sobre la mortalidad, los eventos vasculares y renales en comparación a placebo, no tratamiento o en combinación, en pacientes con ERC87-92. Se excluyeron las RS que en los criterios de selección no se especificó que los estudios incluyeran pacientes con ERC o que incluyeron nefropatías por causas específicas (como debidas a IgA) o que no evaluaran desenlaces de interés para la guía.
Los resultados que se presentan provienen de la RS realizada por Agency for Healthcare Research and Quality de los EEUU88. Esta RS, actualizada hasta enero de 2011, evaluó IECAs frente a ARA II con un seguimiento superior a 6 meses y que incluyeran un mínimo de 50 pacientes. Los resultados de esta RS, que muestra resultados sobre los principales desenlaces considerados, se centran en pacientes con ERC en estadios 1 a 3.
Las otras RS presentaron diversas limitaciones. La RS de Susantitaphong 2013 proporcionó resultados de variables analíticas y para los desenlaces de interés de la GPC sólo aporta resultados sobre mortalidad, aunque no especifica los estudios que incluyeron en el análisis87. La RS de Sharma 2011 realizó una búsqueda hasta marzo de 2010 y excluyó numerosos estudios por no presentar los resultados estratificados por estadio de ERC89. La RS de Balamuthusamy 2008 presentó los resultados de los estudios con IECA y ARA II combinados en un mismo análisis91. Otras RS90,92 realizaron búsquedas hasta 2007 y 2005 respectivamente.
Las intervenciones evaluadas fueron:
- Tratamiento con IECA frente a placebo.
- Tratamiento con IECA frente a placebo (en pacientes con albuminuria sin hipertensión arterial).
- Tratamiento con ARA II frente a placebo.
- Tratamiento con ARA II frente a placebo (en pacientes con albuminuria sin hipertensión arterial).
1. Tratamiento con IECA frente a placebo
La RS de Fink 2012 incluye 17 ECA para un total de 11.661 pacientes que evaluaron el tratamiento con IECA frente placebo o no tratamiento. Dos estudios hicieron por análisis post-hoc de subgrupos de pacientes con ERC con una TFG <60 mL/min/1,73 m2 (estadio 3, 4 ó 5). Sin embargo, en 15 de los 17 ensayos los pacientes debían presentar diferentes niveles de albuminuria, proteinuria o función renal (TFG, creatinina sérica o aclaramiento de creatinina).
La mayoría de los pacientes incluidos en estos ensayos presentaban diabetes (65%); la mitad de ellos hipertensión arterial (50%) y hasta un 38% antecedentes vasculares. La mayoría de la población incluida fue caucásica-blanca (77%). Los IECAs evaluados fueron: ramipril (7 ECA), perindopril (1 ECA), fosinopril (1 ECA), captopril (4 ECA), benazepril (1 ECA), enalapril (2 ECA) y lisinopril (1 ECA). El seguimiento promedio de los estudios varió de 6 meses a 5 años, la mayoría con una duración superior a 2 años.
Mortalidad por cualquier causa
Un total de 16 ECA (11.536 pacientes) que evaluaron el tratamiento con IECA frente placebo, no mostraron una reducción significativa de la mortalidad en pacientes con o sin diabetes (16 ECA, 1.353 eventos, RR: 0,94 IC95% de 0,80 a 1,12)88.
alta
Los ensayos en los que se evaluó este desenlace en el subgrupo de pacientes con alteraciones renales, en el momento de la inclusión, no mostraron diferencias significativas entre IECA o placebo en mortalidad en pacientes con proteinuria o con disminución de la TFG, sin embargo en los ensayos en pacientes con albuminuria (30 – 300 mg/24 h) los IECA se asociaron a una reducción significativa de la mortalidad por cualquier causa. (9 ECA, 369 eventos, RR: 0,79 IC95% de 0,66 a 0,96)88.
alta
Mortalidad cardiovascular
Un total de 3 ECA (7.533 pacientes) no mostraron diferencias entre un tratamiento con IECA o placebo en la mortalidad de tipo cardiovascular en pacientes con o sin diabetes (3 ECA, 453 eventos, RR: 1,03 IC95% de 0,86 a 1,23)88.
alta
Infarto de miocardio
Un total de 3 ECA (5.100 pacientes) no mostraron diferencias entre un tratamiento con IECA o placebo en la incidencia de infarto de miocardio (2,4 % para los IECA, 3,1% para el placebo) (3 ECA, 142 eventos, RR: 0,79 IC95% de 0,57 a 1,09)88.
moderada
Ictus
Un total de 4 ECA (7.719 pacientes) no mostraron diferencias entre un tratamiento con IECA o placebo en la incidencia de ictus (6,0 % para los IECA, 7,2% para el placebo) (4 ECA, 510 eventos, RR: 0,80 IC95% de 0,52 a 1,23)88. Los resultados fueron variables entre los estudios, probablemente por incluir pacientes con y sin antecedentes de ictus previos.
moderada
Un estudio que incluyó pacientes con antecedentes de ictus previos mostró una reducción significativas de los ictus posteriores (1 ECA, 264 eventos, RR 0,71 IC95% de 0,57 a 0,89)88 aunque no mostró diferencias en el subgrupo de pacientes con TFG superiores o inferiores a <60 mL/min/1,73 m2.
alta
Eventos vasculares
La RS de Fink 2012 identificó un total de 7 ECA, que evaluaron el beneficio de un tratamiento con IECA o placebo sobre los eventos vasculares. Las definiciones de estos desenlaces fueron muy variables y no se analizaron conjuntamente los resultados. En dos de los 7 ECA, el tratamiento con IECA mostró una reducción significativa de los eventos vasculares respecto a placebo88.
Progresión de la enfermedad renal (evolución a fallo renal)
moderada
moderada
Progresión de la enfermedad renal (parámetros analíticos)
Un total de 7 ECA presentaron los resultados de progresión del daño renal, definido como duplicación de creatinina sérica o progresión a albuminuria (>300 mg/24 h)88.
Los IECA se asociaron a una reducción significativa de duplicación de creatinina sérica, en comparación con placebo (7 ECA, 331 eventos, RR: 0,60 IC95% de 0,40 a 0,89)88.
moderada
Los IECA se asociaron a un reducción significativa de progresión a albuminuria (>300 mg/24 h), en comparación con placebo (7 ECA, 297 eventos, RR: 0,48 IC95% de 0,27 a 0,85)88.
baja
Efectos indeseados
La mayoría de los ensayos mostró resultados respecto a los efectos indeseados asociados al tratamiento. Los IECA se asociaron a un mayor abandono del tratamiento relacionado con efectos indeseados graves (20,7 %) en relación al tratamiento con placebo, al margen de la significación (14 ECA, 1.459 eventos, RR: 1,08 IC95% de 0,99 a 1,19)88.
alta
El efecto indeseable más común fue la tos, que se reportó en un 4,7% de los pacientes en tratamiento con IECA frente al 1,8% de los pacientes con placebo (9 ECA, 184 eventos, RR: 2,18 IC95% de 1,23 a 3,86)88.
alta
Un total de 8 ECA no mostraron diferencias significativas en la incidencia de hiperkalemia (6 ECA, 14 eventos, RR: 1,50 IC95% de 0,50 a 4,46)88.
muy baja
2. Tratamiento con IECA frente a placebo (en pacientes con albuminuria sin hipertensión arterial).
La RS de Fink, identificó 7 ECA que evaluaron el tratamiento con IECA frente a placebo en pacientes con albuminuria sin hipertensión arterial100-106.
Mortalidad por cualquier causa
Un total de 7 ECA (1.454 pacientes) que evaluaron el tratamiento con IECA frente placebo no mostraron una reducción significativa de la mortalidad (7 ECA, 16 eventos, RR: 1,87 IC95% de 0,65 a 5,37)100-106.
baja
Mortalidad cardiovascular
Un solo ECA que incluyó 864 pacientes sin diabetes no mostró diferencias entre un tratamiento con IECA o placebo en la mortalidad de tipo cardiovascular (1 ECA, 8 eventos, RR: 1,67 IC95% de 0,40 a 6,96)100.
baja
Infarto de miocardio (no mortal)
Un total de 3 ECA (1.070 pacientes) no mostraron diferencias entre un tratamiento con IECA o placebo en la incidencia de infarto de miocardio (3 ECA, 28 eventos, RR: 1,06 IC95% de 0,51 a 2,20)100-102.
baja
Ictus
Un único ECA (864 pacientes) evaluó este desenlace mostrando un menor riesgo de presentación de ictus con el IECA en relación al placebo. (1 ECA, 11 eventos, RR: 0,10 IC95% de 0,01 a 0,78)100.
baja
Eventos vasculares
Se identificaron 2 ECA que evaluaron los eventos vasculares como desenlace combinado. Un estudio definió los eventos vasculares como la mortalidad cardiovascular u hospitalización por morbilidad cardiovascular (infarto de miocardio no mortal, isquemia de miocardio, insuficiencia cardiaca, enfermedad vascular periférica, y/o accidente cerebrovascular)100, sin embargo un segundo estudio no dio una definición para este desenlace101. El análisis conjunto de estos dos ECA (1002 pacientes), no mostró diferencias entre los IECA frente al placebo en la incidencia de los eventos vasculares. (2 ECA, 69 eventos, RR: 0,73 IC95% de 0,46 a 1,17)100,101.
baja
Progresión de la enfermedad renal (parámetros analíticos)
Un total de 5 ECA evaluaron el riesgo de progresión de la enfermedad renal como progresión albuminuria (>300 mg/24h). En comparación con placebo, los IECAs se asociaron a una reducción significativa del riesgo de evolución a albuminuria (5 ECA, 61 eventos, RR: 0,25 IC95% de 0,12 a 0,45)101-103,105,106
muy baja
Efectos indeseados
Un total de 6 ECA mostraron los abandonos del tratamiento asociados a algún tipo de efecto indeseado grave. El tratamiento con IECA no se asoció a un mayor abandono del tratamiento relacionado con efectos indeseados graves en relación al tratamiento con placebo (6 ECA, 46 eventos, RR: 1,03 IC95% de 0,55 a 1,92)101-106.
baja
3. Tratamiento ARA II frente a placebo
Esta misma revisión incluye 5 ECA para un total de 5.769 pacientes que evaluaron el tratamiento con ARA II frente placebo o no tratamiento. Un estudio hizo análisis post-hoc de subgrupos de pacientes con ERC (estadios 1-2 ó 3-4). En 4 de los 5 ensayos los pacientes debían presentar diferentes niveles de albuminuria o proteinuria.
La mayoría de los pacientes incluidos en estos ensayos presentaban hipertensión (91%), diabetes (81%) o enfermedad coronaria (57%); cerca de un tercio presentó otros antecedentes vasculares (28%). La mayoría de la población incluida fue caucásica-blanca (64%). Los IECAs evaluados fueron: irbesartan (2 ECA), losartan (1 ECA) y telmisartan (2 ECA). El seguimiento promedio de los estudios varió de 6 meses a 5 años.
Mortalidad por cualquier causa
Un total de 4 ECA (5.242 pacientes) que evaluaron el tratamiento con ARA II frente placebo, no mostraron una reducción significativa de la mortalidad en pacientes con o sin diabetes (4 ECA, 847 eventos, RR: 1,04 IC95% de 0,92 a 1,18)88.
Los ensayos en los que se evaluó este desenlace en subgrupos de pacientes con alteraciones renales en el momento de la inclusión no mostraron diferencias significativas entre ARA II o placebo en mortalidad en pacientes con albuminuria o con disminución de la TFG88.
alta
Mortalidad cardiovascular
Un único ECA (1.991 pacientes) no mostró diferencias entre un tratamiento con ARA II o placebo en la mortalidad de tipo cardiovascular (1 ECA, 226 eventos, RR: 1,03 IC95% de 0,80 a 1,31)88.
alta
Infarto de miocardio
Un único ECA (1.513 pacientes) no mostró diferencias entre un tratamiento con ARA II o placebo en la incidencia de infarto de miocardio en pacientes (6,7 % para los ARA II, 8,9% para el placebo) (1 ECA, 118 eventos, RR: 0,75 IC95% de 0,53 a 1,06)88.
moderada
Ictus
Ninguno de los estudios identificados evaluó este desenlace.
Eventos vasculares
La RS de Fink 2012 identificó un total 3 ECA que evaluaron el beneficio de un tratamiento con ARA II o placebo sobre los eventos vasculares. Las definiciones de estos desenlaces fueron variables y no se analizaron conjuntamente los resultados. De todos modos, ninguno de los tres ensayos mostró diferencias significativas respecto a placebo.
Progresión de la enfermedad renal (evolución a fallo renal)
En un total de 3 ECA (4.652 pacientes), el tratamiento con ARA II redujo el riesgo de progresión a fallo renal de forma significativa (10% para los ARA II, 12,9% para el placebo) (3 ECA, 533 eventos, RR: 0,77 IC95% de 0,66 a 0,90)88.
alta
Progresión de la enfermedad renal (parámetros analíticos)
Un total de 3 ECA presentaron los resultados de progresión renal, definido como duplicación de creatinina sérica. Los ARA II se asociaron a una reducción significativa de este desenlace en comparación con placebo (3 ECA, 629 eventos, RR: 0,78 IC95% de 0,68 a 0,90)88.
alta
Dos ECA definieron la progresión renal como la progresión a albuminuria (>300 mg/24 h). Los ARA II se asociaron a una reducción significativa de este desenlace en comparación con el placebo (2 ECA, 213 eventos, RR: 0,42 IC95% de 0,33 a 0,52)88.
baja
Efectos indeseados
La mayoría de los ensayos mostró resultados respecto a los efectos indeseados asociados al tratamiento, aunque no permitió evaluar conjuntamente el número de pacientes con efectos indeseados graves o abandonos del tratamiento por efectos indeseados. Los resultados fueron variables y el tratamiento con ARA II se asoció a una menor tasa de efectos indeseados respecto a placebo (1 ECA) pero a un mayor número de abandonos debido a efectos indeseados (1 ECA). Respecto a los efectos indeseados graves 1 ECA no mostró diferencias mientras que otro ECA mostró un menor número de pacientes con efectos indeseados graves con el tratamiento con ARA II.
baja
4. Tratamiento con ARA II frente a placebo (en pacientes con albuminuria sin hipertensión arterial)
Para este tipo de pacientes específico, no se encontraron ECA que evaluaran estas dos intervenciones.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento anti-hipertensivo. De todos modos el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Sin embargo, se encontró evidencia donde se evaluaron las utilidades en pacientes con ERC en diferentes estadios de la enfermedad, pero sin tratamiento renal sustitutivo. Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad. Aunque las diferencias entre estadio 1, 2, 3 y 4 podrían ser clínicamente relevantes, las diferencias entre estadio 4, 5 y fallo renal con hemodiálisis son muy importantes. Los pacientes que han recibido un trasplante renal otorgan valores de utilidad más elevados a su estado de salud que los pacientes con hemodiálisis. En pacientes sin tratamiento renal sustitutivo, la diabetes, la presencia de anemia y el requerimiento de transfusiones sanguíneas son percibidos como un peor estado de salud (utilidades más bajas). Aunque el método de media de los valores de utilidad afecta de forma importante a los resultados, no parece que los valores sean muy variables según la edad, sexo o procedencia geográfica.
Información más detallada en el capitulo 6.1, apartado de valores y preferencias de los pacientes.
Uso de recursos y costes
Se localizó un estudio realizado en el año 2007, cuyo objetivo era evaluar el coste-efectividad de los bloqueadores del sistema renina-angiotensina-aldosterona en la prevención del fallo renal en pacientes con nefropatía diabética107. Se compararon los inhibidores de la enzima convertidora de angiotensina (IECA), los análogos de los receptores de angiotensina II (ARA II) y el no tratamiento. El estudio fue realizo en Grecia, en un segundo nivel de atención, se tomó la perspectiva del tercer pagador y el horizonte temporal fue a vida. Los datos de efectividad se obtuvieron de una revisión sistemática de la literatura realizada por los propios autores, en la cual no encontraron estudios que compararan de forma directa las dos intervenciones. La medida de efectividad fue el riesgo de desarrollo de fallo renal y la medida de beneficio fue el número necesario a tratar (NNT) para prevenir que un paciente desarrolle un fallo renal. La mortalidad y la morbilidad cardiovascular, así como los eventos adversos no fueron incluidos al no encontrarse diferencias entre las intervenciones evaluadas. Los costes (dólares americanos, 2006) incluyeron el coste farmacéutico así como el tratamiento a vida del fallo renal.
Los resultados mostraron que el NNT para prevenir que un paciente desarrolle fallo renal es de 21 para los ARA II, 333 para los IECA, y 65 para cualquiera de las dos intervenciones. El coste a vida del tratamiento del fallo renal fue de $ 195.692 (146.039 €), y el coste medio anual de tratamiento fue de $ 763,50 para los ARA II, $ 144,92 para los IECA y de $ 291,39 para cualquiera de los dos.
En pacientes que recibían ARA II, el coste para prevenir que un paciente desarrolle fallo renal fue de $ 31.729 (IC95% 19.443 a 85.442) y dado el coste a vida del fallo renal, supondría con ahorro neto por paciente a tres años de $ 7.770 (IC95% 1.940 a 13.631). Para los IECA, el coste para prevenir que un paciente desarrolle fallo renal fue de $ 189.190, similar al coste a vida del fallo renal. Para los pacientes que recibían alguno de los dos tratamientos, el ahorro neto en costes fue mayor a $ 2.000, pero lo resultados no fueron significativos.
Este estudio también fue realizado tomando datos de Estados Unidos y los resultados fueron similares, mostrando la superioridad de los ARA II respecto a los IECA. De la misma forma, los análisis de sensibilidad mostraron que los resultados fueron robustos y, los cambios en los costes, no alteraron las conclusiones realizadas por los autores.
Los resultados de este análisis de coste efectividad muestran que el tratamiento de los pacientes con nefropatía diabética con fármacos que actúen sobre el sistema renina-angiotensina- aldosterona como parte de su tratamiento habitual es coste-efectivo en relación a no realizar tratamiento, resultando en una reducción del 23% de desarrollo de fallo renal y un ahorro neto en costes para el sistema de seguridad social griego. Los resultados parecen favorecen los ARA II respecto a los IECA, sin embargo los autores señalan que los resultados deben ser interpretados con cautela dado que no se encontraron estudios que comparan de forma directa estas dos intervenciones y a su vez incluyeran los desenlaces evaluados. Además, resultados más recientes sobre la eficacia comparativa entre IECA y ARA II sugieren que esta podría ser similar y que por tanto el NNT para evitar un fallo renal sería parecido entre las dos opciones, modificando substancialmente las estimaciones de coste-efectividad.
Se han localizado otros dos estudios de coste-utilidad de los inhibidores de la enzima convertidora de la angiotensina (IECA) para el tratamiento de los pacientes no diabéticos en estadios avanzados de enfermedad renal definidos como pacientes con una creatinina sérica >3,0 mg/dL, tasa de filtrado glomerular glomerular de 15-26 mL/min/1,73 m2, proteinuria e hipertensión [>150/85 mm Hg], sin insuficiencia cardiaca severa. Los dos estudios son metodológicamente similares pero realizados en dos países distintos: Holanda113 y Alemania110. Para los dos estudios, la intervención fue el uso de benazepril 10 mg dos veces al día y el comparador fue el no tratamiento con IECA. El ámbito de los dos estudios fue el segundo nivel de atención, se tomó la perspectiva del sistema nacional de salud de los respectivos países y el horizonte temporal fue a vida. Los desenlaces de efectividad fueron extraídos de una revisión sistemática de la literatura llevada a cabo por los autores, los valores de utilidad fueron sacados de estudios publicados realizados en pacientes estadunidenses y la medida de beneficio fue los años de vida ajustados por calidad (QALY). Los autores remarcan que los pacientes en ambos grupos recibían otros tratamientos antihipertensivos, pero no otros IECA. El análisis económico incluyó costes (Euros, 2009110 y 2010113) del tratamiento farmacológico, analíticas y costes relacionados con el fallo renal (trasplante y diálisis) y otros costes relacionados con el tratamiento de ERC. Se realizaron los descuentos y análisis de sensibilidad correspondientes.
El coste del tratamiento en Alemania sin IECA fue estimado en 205.200 € y de 172.676 € con IECA. En Holanda fue de 220.942 € sin IECA y de 183.535 € con IECA. El análisis del coste incremental en los dos estudios mostró que los IECA fueron dominantes al ser menos costoso y más efectivos que el no tratamiento. Las variables que más influenciaron el coste incremental y la efectividad en el análisis de sensibilidad fueron la eficacia del IECA, el coste del fallo renal, así como las tasas de descuento en los costes y los beneficios.
De la evidencia a la recomendación
Para la comparación IECA frente a placebo la calidad global de la evidencia fue moderada para los desenlaces vasculares y para la progresión renal, principalmente por imprecisión en algunos de los desenlaces de interés. Para los eventos adversos la calidad global fue alta.
Para la comparación IECA frente a placebo realizada únicamente en población con albuminuria sin hipertensión arterial, la calidad global de la evidencia fue baja, principalmente por imprecisión de los resultados.
Para la comparación ARA II frente a placebo, la calidad global de la evidencia fue alta para los desenlaces vasculares y de progresión renal. Para los eventos adversos el número de eventos evaluados fue escaso y se consideraron solo desenlaces analíticos.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento anti-hipertensivo. De todos modos, el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Beneficios y riesgos/carga de las intervenciones
IECA frente a placebo
Los diferentes ensayos señalan que en pacientes con ERC, el tratamiento con un IECA no reduce de forma significativa la progresión del daño vascular frente a un tratamiento con placebo (mortalidad por cualquier causa, mortalidad cardiovascular, infarto de miocardio o ictus). En pacientes con mayor riesgo vascular (antecedentes de ictus o albuminuria) un tratamiento con IECA podría reducir la mortalidad por cualquier causa y los ictus. El tratamiento con IECA reduce, sin embargo, la progresión del daño renal en comparación a un placebo, por cada 1000 pacientes tratados con IECA, 9 pacientes menos presentarían progresión a estadios finales de la enfermedad renal, 22 menos duplicación de la creatinina sérica, 11 menos evolucionarían a albuminuria (>300 mg/24 h). Los IECA parecen presentan mayor incidencia de tos que en relación al placebo, de cada 1.000 pacientes tratados con IECA, 20 pacientes más presentarían tos en relación al placebo.
IECA frente a placebo (en población con albuminuria sin hipertensión arterial)
El análisis conjunto realizado sólo en población con albuminuria sin hipertensión arterial, los IECA no parecen reducir la progresión del daño vascular frente a un tratamiento con placebo (mortalidad por cualquier causa, mortalidad cardiovascular, infarto de miocardio) con excepción del riesgo de ictus (reducción de 21 eventos por cada 1.000 pacientes tratados en comparación con placebo); de todos modos la confianza con estos resultados se vio muy limitada por el escaso número de eventos evaluados. El tratamiento con IECA se asoció, sin embargo, a una reducción significativa del riesgo de progresión del daño renal (evaluado como progresión a albuminuria) (165 pacientes menos por cada 1.000 tratados en comparación con placebo). No hubo diferencias en el riesgo de abandonos por efectos indeseables graves entre las dos opciones.
ARA II frente a placebo
Los diferentes ensayos señalan que en pacientes con ERC, el tratamiento con un ARA II no reduce de forma significativa la progresión del daño vascular frente a un tratamiento con placebo (mortalidad por cualquier causa, mortalidad cardiovascular, infarto de miocardio o ictus). El tratamiento con ARA II reduce, sin embargo, la progresión del daño renal en comparación a un placebo, por cada 1.000 pacientes tratados con ARA II, 30 pacientes menos presentarían progresión al estadio final de la enfermedad renal, así como duplicación de creatinina sérica y 181 pacientes menos progresarían a albuminuria (>300 mg/24 h), en comparación con el placebo. Los ARA II presentan una mayor incidencia de elevación del potasio en sangre respecto a placebo, de cada 1.000 pacientes tratados con ARA II, 20 pacientes más presentarían hiperkalemia en relación al placebo, así como probablemente una mayor incidencia de otros efectos indeseables, aunque la evidencia no es consistente en este punto.
Balance beneficio-riesgo
Los beneficios de un tratamiento con IECA o ARA II superan los riesgos en relación al no tratamiento. Respecto a pacientes con albuminuria, sin hipertensión, los beneficios respecto a una potencial reducción de la progresión del daño renal mediante un tratamiento con IECA podría superar los riesgos, en comparación a no tratamiento.
Uso de recursos y costes
Los resultados disponibles señalan que el tratamiento con IECA o ARA II en pacientes con nefropatía diabética resulta ser coste-efectivo en relación a no tratamiento para la prevención del fallo renal.
Recomendaciones
| FUERTE | En pacientes con ERC que requieren un tratamiento anti-hipertensivo, tanto los inhibidores del enzima conversor de la angiotensina como los antagonistas del receptor de la angiotensina son fármacos de primera elección. |
| DÉBIL | En pacientes con ERC y proteinuria (>300 mg/24 h), se sugiere un tratamiento anti-hipertensivo basado en la inhibición del eje renina- angiotensina-aldosterona. |
| FUERTE | En los pacientes que presenten tos persistente no tolerada debido al tratamiento con inhibidores del enzima conversor de la angiotensina, se recomienda el uso de antagonistas del receptor de la angiotensina. |
IECA frente ARA II
Los resultados que se presentan provienen de la RS realizada por Agency for Healthcare Research and Quality de los EEUU88. Esta RS, actualizada en enero de 2011, incluyó estudios que evaluaban un tratamiento con IECAs frente a un tratamiento con ARA II, con un seguimiento superior a 6 meses y que incluyeran un mínimo de 50 pacientes. Los resultados de esta RS, que muestra resultados sobre los principales desenlaces considerados, se centran en pacientes con ERC en estadios 1 a 3.
Se ha localizado adicionalmente una RS que ha evaluado los efectos indeseables de los IECA y los ARA II en pacientes con hipertensión y realizaron un metanálisis de los resultados. Esta RS incluyó 97 ECA con al menos 20 pacientes y una duración superior a las 12 semanas y mostraran los resultados de comparaciones directas de un tratamiento con IECAs y ARA II en personas con hipertensión114.
Los ECA de Imai 201193 y Mann 201394 no se incluyeron por ser publicaciones de análisis post-hoc de dos estudios ya incluidos en la RS de Fink 201288. Y un tercer ECA de Fernández 2013, que si fue incluido115. Este ECA incluyó 133 pacientes con diabetes mellitus tipo 2 y diagnóstico clínico de nefropatía diabética, con ERC en estadio 2 y 3. Este estudio tuvo un seguimiento medio de 32 meses y evaluó a los IECA (lisinopril 40 mg), frente a los ARA II (irbesartan 600 mg). La publicación mostró como desenlace principal a una variable combinada de progresión renal, aumento del 50% de creatinina sérica basal, progresión a estadio final de la enfermedad renal o muerte.
Tratamiento con IECA frente a ARA II
La RS de Fink 2012 incluye 6 ECA con un total de 4.799 pacientes que evaluaron el tratamiento monoterapia IECA frente a la monoterapia ARA II. Por lo que se refiere a la función renal, un estudio presentó un análisis post-hoc que evaluó los resultados en pacientes con una TFG <60 mL/min/1,73 m2 (estadios 3, 4 ó 5) mientras que otro ensayo incluyó pacientes con TFG >60 mL/min/1,73 m2 con albuminuria (30 – 300 mg/24 h). Los demás ensayos no presentaron en los criterios de inclusión o en las características basales de los participantes la condición de ERC, sin embargo en 5 de los 6 ensayos los pacientes debían presentar diferentes grados de albuminuria.
En 5 de los 6 estudios, todos los pacientes incluidos fueron diabéticos, sin embargo el estudio de mayor tamaño incluyó aproximadamente un 40% de pacientes con diabetes. Este estudio no presentó los resultados numéricos en el subgrupo de pacientes con enfermedad renal en consecuencia, los resultados que se presentan a continuación se refieren exclusivamente a pacientes con diabetes.
Los IECAs y ARA II evaluados fueron: Ramipril (2 ECA), Enalapril (2 ECA), Lisinopril (2 ECA), Captopril (1 ECA), Telmisartán (3 ECA), Valsartán (2 ECA) y Losartán (1 ECA). La media o mediana de seguimiento fue de 1 año en 3 ECA, 2,5 años en 1 ECA y 5 años en 2 ECA.
Mortalidad por cualquier causa
Un total de 4 ECA (534 pacientes) que evaluaron el tratamiento con IECA frente a ARA II, no muestran una reducción significativa de la mortalidad entre ambos tratamientos farmacológicos (2,7 % para los IECA, 2,2% para el tratamiento con ARA II) (4 ECA, 13 eventos, RR: 1,04 IC95% de 0,37 a 2,95)88.
baja
Mortalidad cardiovascular
Un total de 4 ECA (534 pacientes) que evaluaron el tratamiento con IECA frente a ARA II no muestran una reducción significativa de la mortalidad cardiovascular (1,2 % para los IECA, 1,0% para el tratamiento con ARA II) (4 ECA, 6 eventos, RR: 0,88 IC95% de 0,19 a 4,13)88.
baja
Infarto de miocardio
Un total de 2 ECA (353 pacientes) que evaluaron el tratamiento con IECA frente a ARA II no muestran una reducción significativa de los infartos de miocardio (no mortales) del 38% (2 ECA, 15 eventos, RR: 0,62 IC95% de 0,23 a 1,68)88.
baja
Insuficiencia cardiaca congestiva
Un total de 2 ECA (353 pacientes) que evaluaron el tratamiento con IECA frente a ARA II no muestran una reducción significativa de insuficiencia cardíaca congestiva del 28% (2 ECA, 16 eventos, RR: 0,72 IC95% de 0,28 a 1,87)88.
baja
Progresión de la enfermedad renal
Una RS identificó un solo ECA que evaluó los resultados de un desenlace combinado de, progresión de la enfermedad renal como inicio de diálisis, trasplante renal, duplicación de creatinina sérica, o muerte. Este estudio mostró los resultados conjuntos y para el subgrupo de pacientes con ERC aunque en estos últimos se muestran solo los resultados en forma de gráfico. En el conjunto de pacientes con enfermedad vascular o diabetes con afectación del órgano diana (con o sin nefropatía), el ensayo no mostró diferencias entre IECA o ARA II para este desenlace (1 ECA, 1.297 eventos, HR: 1,00 IC95% de 0,92 a 1,09)88
Un ECA posterior presentó los resultados de un desenlace compuesto de progresión renal, definida como aumento del 50% de creatinina sérica basal, progresión a estadio final de la enfermedad renal o muerte, en pacientes con nefropatía diabética115. Los resultados tampoco mostraron diferencias significativas entre los IECA (29%) y los ARA II (29%) en la progresión de la enfermedad renal. (1 ECA, 18 eventos, RR: 1,00 IC95% de 0,46 a 2,19)115.
El análisis conjunto de ambos ensayos (17.182 pacientes) no mostró diferencias significativas en la progresión de la enfermedad renal entre los IECA y ARA II (2 ECA, 2.315 eventos, RR: 1,00, IC95% de 0,93 a 1,08).
moderada
Efectos indeseados
Un total de 4 ECA (534 pacientes) evaluaron el tratamiento con IECA frente a ARA II, y no muestran una diferencia significativa en las tasas de suspensión del tratamiento debido a efectos adversos (4 ECA, 64 eventos, RR: 1,35 IC95% de 0,86 a 2,13)88.
baja
Sin embargo, una RS que identificó 36 ECA (con aproximadamente 12.000 pacientes) que evaluaron el tratamiento con IECA frente a ARA II en pacientes con hipertensión u otras indicaciones para recibir un tratamiento enfocado a la inhibición del eje renina-angiotensina-aldosterona (la mayoría de ellos sin ERC) mostró que los IECA se asociaron a un riesgo significativamente superior de abandonos del tratamiento debido a efectos indeseables (36 ECA, RR: 1,77 IC95% de 1,42 a 2,21). Los abandonos por efectos indeseados sucedieron en un 3% y en un 5,4% de los pacientes en tratamiento con ARA II e IECAs, respectivamente114.
baja
La tos fue el evento adversos específico más comúnmente reportado, y fue significativamente más frecuente con el tratamiento con IECA en relación a los ARA II. (3 ECA, 284 pacientes, 19 eventos, RR: 4,10 IC95% de 1,47 a 11,48)88.
moderada
Adicionalmente, una RS que identificó 40 ECA (en aproximadamente 18.000 pacientes) que evaluaron el tratamiento con IECA frente a ARA II en pacientes con hipertensión u otras indicaciones para recibir un tratamiento enfocado a la inhibición del eje renina-angiotensina-aldosterona (la mayoría de ellos sin ERC) mostró que los IECA se asociaron a un riesgo significativamente superior de tos (40 ECA, RR: 4,74 IC95% de 3,56 a 6,31). El porcentaje de tos en los pacientes en tratamiento con ARAII fue del 2,2% de promedio y con IECAs del 8,7% de promedio114.
moderada
Valores y preferencias de los pacientes
Ver apartado de IECA o ARA II frente a placebo.
Uso de recursos y costes
Ver apartado de IECA o ARA II frente a placebo.
De la evidencia a la recomendación
La calidad global de la evidencia fue baja, debido principalmente al escaso número de eventos que aportaron resultados imprecisos.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento anti-hipertensivo. De todos modos el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Beneficios y riesgos/carga de las intervenciones
La probabilidad de presentar un evento vascular (infarto de miocardio o insuficiencia cardiaca congestiva) así como la mortalidad de tipo vascular o por cualquier causa en pacientes con ERC, no parece diferir entre un tratamiento con IECA o un tratamiento con ARA II, aunque se dispone de una escasa confianza con estos resultados. Tampoco parece diferir el riesgo de progresión de la enfermedad renal aunque la mayoría de pacientes incluidos en el análisis no presentaron nefropatía. Sin embargo, los IECAs se asocian a un mayor riesgo de presentar tos en relación a un tratamiento con ARA II (entre 79 y 325 eventos más por cada 1.000 tratamientos) y parecen asociarse a un aumento de los abandonos de tratamiento debido a efectos indeseables (entre 34 y 42 abandonos más por cada 1.000 tratamientos).
Respecto a los ARA II surgió una alerta asociándolos a un incremento del riesgo de cáncer a partir de una RS que evaluó la incidencia de distintos tipos de cáncer entre un tratamiento con ARA II (sólo o en combinación) y un control (placebo u otro tratamiento anti-hipertensivo). Los resultados mostraron un ligero incremento, aunque significativo, del riesgo de cáncer asociado al tratamiento con ARA II (5 ECA, 4.112 eventos, RR: 1,08; IC95% de 1,01 a 1,15)117. Sin embargo dos RS118,119 y un estudio de cohortes120 posteriores no encontraron asociación entre un tratamiento con ARA II y las muertes por cáncer o la incidencia de distintos tipos de cáncer como el de pulmón, mama o próstata.
Balance beneficio-riesgo
Los beneficios del tratamiento con IECA probablemente sean similares a un tratamiento con ARA II. Aunque los primeros se asocian con más frecuencia a tos y a abandonos por efectos indeseables, los ARA II podrían relacionarse con un aumento del riesgo de cáncer. El grupo elaborador ha dado más importancia al coste más elevado del tratamiento con ARA II en comparación al tratamiento con IECA sin un beneficio significativo en pacientes con nefropatía, además de la mayor experiencia en el uso de los IECA107,108,121.
Uso de recursos y costes
Los resultados disponibles señalan que el tratamiento con ARA II sería coste-efectivo en relación al tratamiento con IECA para la prevención del fallo renal en pacientes con nefropatía diabética, de todos modos, el beneficio del tratamiento con IECA podría estar infraestimado y los resultados no ser directamente aplicables a nuestro medio. El coste unitario del tratamiento con ARA II es muy superior al de un tratamiento con IECAs.
Recomendaciones
| DÉBIL | En pacientes con ERC, con o sin diabetes, que requieren un tratamiento anti-hipertensivo basado en la inhibición del eje renina-angiotensina-aldosterona, se sugiere iniciar tratamiento con IECA frente a los ARA II. |
| Fuerte | En los pacientes que presenten intolerancia al tratamiento con inhibidores del enzima conversor de la angiotensina, se recomienda el uso de antagonistas del receptor de la angiotensina. |
Diferentes combinaciones de IECA y ARA II
La RS de Fink 2012 localizó 6 ECA que evaluaron el tratamiento combinado de IECA asociado a los ARA II frente a la monoterapia con IECA y 3 ECA que evaluaron el tratamiento combinado de IECAs asociados a los ARA II frente a la monoterapia ARA II. La mayoría de los pacientes tenía algún tipo de comorbilidad como diabetes tipo 2, hipertensión arterial o enfermedad vascular establecida. El seguimiento promedio osciló entre las 30 semanas y los 4,7 años.
La mayoría de los estudios, excepto dos123,124, fueron de pequeño tamaño. De estos dos grandes ensayos, el primero incluyó pacientes con insuficiencia cardiaca y los resultados provienen de un análisis de subgrupo de pacientes con ERC. Este estudio mostró resultados para los desenlaces de mortalidad, eventos vasculares y efectos indeseables entre un tratamiento combinado de IECA asociado a los ARA II frente a la monoterapia con IECA123. El otro gran ensayo presentó los resultados de un tratamiento combinado de IECA asociado a los ARA II en comparación a un tratamiento en monoterapia, sin distinguir el grupo terapéutico. El estudio incluyó pacientes con diabetes, afectación de órgano diana y enfermedad vascular previa; los resultados analizados provinieron de un subgrupo de pacientes con TFG <60mg/mL/1,72 m2.124
Posterior a la RS de Fink 2012 se localizaron dos estudios adicionales. El primer ECA115 incluyó 133 pacientes con nefropatía diabética en estadios 2 y 3. Este estudio evaluó la eficacia y tolerabilidad de intervención combinada de IECA más ARA II (lisinopril 20 mg + irbesartan 300 mg) frente a estos tratamientos en monoterapia, con un seguimiento medio de 32 meses.
El segundo ECA122 incluyó 1.448 pacientes con diabetes tipo 2 con nefropatía diabética (TFG entre 30 a 89,9 mL/minuto por 1,73 m2 de área de superficie corporal), la gran mayoría hombres veteranos de guerra. Se evaluó a través de este estudio la eficacia y seguridad de la terapia combinada con IECA más ARA II frente a la monoterapia con ARA II (losartán (de 50 mg a 100 mg/día) más lisinopril (a partir de 10 mg a 20 mg a 40 mg por día) frente a lisinopril (a partir de 10 mg a 20 mg a 40 mg por día) más placebo) con un seguimiento medio de 2,2 años, las intervenciones fueron suspendidas antes de tiempo principalmente por cuestiones de seguridad debido al aumento de las tasas de eventos adversos graves, como la hiperkalemia y daño renal agudo, en los pacientes que recibieron la terapia combinada.
Las intervenciones evaluadas son:
- Tratamiento con IECA asociado a ARA II frente a monoterapia IECA.
- Tratamiento con IECA asociado a ARA II frente a monoterapia ARA II.
- Tratamiento con IECA asociado a ARA II frente a monoterapia.
Tratamiento con IECA asociado a ARA II frente a monoterapia IECA
Mortalidad por cualquier causa
Un total de 3 ECA (3.059 pacientes) evaluaron el tratamiento con IECA asociado a los ARA II frente a la monoterapia IECA, sin mostrar una reducción significativa de la mortalidad entre ambos tratamientos. Un estudio, con un seguimiento de 2 años, aportó la mayoría de los eventos a este análisis. (3 ECA, 705 eventos, RR: 1,03; IC95% de 0,91 a 1,18)88.
alta
Ictus no mortal
Un estudio que incluyó 53 pacientes con nefropatía diabética evaluó el riesgo de ictus no mortal y presentó un evento en cada grupo de tratamiento (1 ECA, 2 eventos, RR: 1,04; IC95% de 0,07 a 15,75)88.
baja
Insuficiencia cardiaca congestiva
Un estudio que incluyó 53 pacientes con nefropatía diabética evaluó el riesgo de insuficiencia cardíaca congestiva y presentó dos eventos en el grupo que recibió el tratamiento combinado y ninguno para el grupo de IECA solos (1 ECA, 2 eventos, RR: 5,19; IC95% de 0,26 a 103,11)88.
baja
Eventos vasculares
Un estudio, con un seguimiento de 2 años, evaluó una variable combinada de eventos vasculares definida como muerte, muerte súbita con reanimación, hospitalización por insuficiencia cardíaca, o la administración de inotrópicos o drogas vasolilatoras por vía intravenosa durante 4 horas o más sin hospitalización. Los IECA asociados a los ARA II estuvieron asociados con una disminución estadísticamente significativa de 11% del riesgo relativo de eventos vasculares en relación a la monoterapia IECA (1 ECA, 1.048 eventos, RR: 0,89; IC95% de 0,80 a 0,98)88.
moderada
Progresión de la enfermedad renal
Un estudio que incluyó 90 pacientes con ERC e hipertensión evaluó la progresión de la enfermedad como el número de pacientes con progresión a fallo renal y presentó dos eventos para el tratamiento combinado y dos para el tratamiento con IECA solos (1 ECA, 4 eventos, HR: 1,00; IC95% de 0,15 a 6,79)88.
baja
Este mismo estudio evaluó la progresión de la enfermedad como aumento de dos veces los valores de creatinina sérica, sin mostrar diferencias significativas entre el tratamiento combinado y los IECA solos (1 ECA, 4 eventos, HR: 0,07; IC95% de 0,0 a 1,13)88.
baja
Un ECA115 evaluó la progresión de la enfermedad con un desenlace compuesto de progresión renal, definida como aumento del 50% de creatinina sérica basal, progresión a estadio final de la enfermedad renal o muerte. Los resultados no mostraron diferencias significativas entre la asociación de IECA con ARA II (30%) frente a los IECA (29%) en la progresión de la enfermedad renal. (1 ECA, 31 eventos, RR: 1,05; IC95% de 0,56 a 1,98)115.
baja
Efectos indeseados
El número de pacientes que abandonaron el tratamiento se evaluó en 4 ECA mostrando un rango de resultados que varió entre el 6% y el 24%. Un solo estudio evaluó el número de abandonos del tratamiento asociado a efectos adversos, sin diferencias entre tratamiento combinado y los IECA solos.
Dos estudios reportaron los eventos adversos en general, y fue similar entre ambos tratamientos. El evento adverso específico más común fue la hipotensión y la hiperkalemia.
La hiperkalemia fue más frecuente en el grupo de tratamiento combinado (2 ECA, 193 eventos, RR: 1,88; IC95% de 1,41 a 2,51)88.
moderada
Tratamiento con IECA asociado a ARA II frente a monoterapia ARA II
Mortalidad por cualquier causa
Se realizó un análisis conjunto de 2 ECA en 1.534 pacientes con nefropatía, donde se evaluó la mortalidad por cualquier causa entre el tratamiento con IECA asociado a los ARA II frente a la monoterapia ARA II. El resultado no mostró diferencias significativas entre ambas intervenciones. (2 ECA, 123 eventos, RR: 1,05; IC95% de 0,75 a 1,47)88,122.
baja
Ictus
Un ECA122 (1.448 pacientes) no mostró diferencias significativas entre la terapia de IECA asociada a ARA II (2,5%) frente a los ARA II (2,5%), en el riesgo de desarrollo de ictus. (1 ECA, 36 eventos, HR: 1,00; IC95% de 0,52 a 1,91)122.
muy baja
Infarto de miocardio
El ensayo de Fried 2013 (1.448 pacientes) no mostró diferencias significativas entre las intervenciones evaluadas en el riesgo de presentar infarto de miocardio. (1 ECA, 92 eventos, HR: 1,30; IC95% de 0,87 a 1,94)122.
baja
Insuficiencia cardiaca congestiva
El ECA de Fried 2013 (1.448 pacientes) tampoco mostró diferencias significativas entre las dos intervenciones evaluadas, en el riesgo de presentar insuficiencia cardiaca congestiva (1 ECA, 195 eventos, HR: 0,84; IC95% de 0,65 a 1,09)122.
baja
Progresión de la enfermedad renal
Un ECA115, presentó los resultados de un desenlace compuesto de progresión renal, definida como aumento del 50% de creatinina sérica basal, progresión a estadio final de la enfermedad renal o muerte. Los resultados no mostraron diferencias significativas entre la terapia asociada de ARA II a IECA (30%) y los ARA II (29%). (1 ECA, 29 eventos, RR: 1,05; IC95% de 0,56 a 1,98)115.
baja
En el ECA122 (1.448 pacientes), el tratamiento con IECA asociados a ARA II (3,7%) mostró una menor evolución a fallo renal (al borde de la significación) en relación a la monoterapia con ARA II (5,9%). (1 ECA, 70 eventos, HR: 0,63; IC95% de 0,39 a 1,00)122.
baja
Dos estudios evaluaron la progresión de la enfermedad renal como número de pacientes con progresión de la albuminuria (>300 mg/24h), sin diferencias entre un tratamiento combinado IECA con ARA II frente a la monoterapia ARA II. (2 ECA, 4 eventos, RR 0,33; IC95% de 0,04 a 3,08). Ambos estudios incluyeron pacientes con albuminuria (<30 mg / mmol) e hipertensión88.
muy baja
Efectos indeseados
Un estudio (1.448 pacientes) mostró que el número de pacientes que presentó algún tipo de efecto adverso serio, fue mayor con la terapia combinada de IECA más ARA II, en relación a la monoterapia con ARA II (al margen de la significación) (1 ECA, 796 eventos, RR: 1,09; IC95% de 1,00 a 1,20)122.
moderada
El riesgo de daño renal agudo también fue mayor con la terapia combinada de IECA y ARA II. (1 ECA, 210 eventos, RR: 1,63; IC95% de 1,25 a 2,10)122.
baja
El análisis conjunto de dos ECA (1.534 pacientes) mostró mayor riesgo de hiperkalemia con la terapia combinada con IECA y ARA II, en relación a la monoterpia ARA II (2 ECA, 106 eventos, RR: 2,21; IC95% de 1,48 a 3,30)88,122.
muy baja
Solo un estudio de pequeño tamaño mostró los resultados de efectos indeseados específicos, no mostrando diferencias un tratamiento combinado IECA con ARA II frente a la monoterapia ARA II para hipotensión, y tos (1 ECA, 9 eventos, RR 1,25 IC95% de 0,36 a 4,34) y (1 ECA, 2 eventos, RR 5,00; IC95% de 0,25 a 101,18) respectivamente88.
baja
Tratamiento con IECA asociado a ARA II frente a monoterapia
La RS de Fink 2012 localizó un gran ECA (23.422 pacientes) que evaluó la efectividad de un tratamiento antihipertensivo combinado (ramipril 10 mg/día más telmisartan 80 mg/ día) frente a cada uno de los tratamientos individuales. Un análisis post-hoc evaluó los resultados en un subgrupo de 8.933 pacientes con disminución del filtrado glomerular (TFG <60 mL/min/1,72 m2) o albuminuria; la mayoría con hipertensión arterial y enfermedad vascular establecida y la mitad de ellos con diabetes tipo 2. El ensayo mostró los resultados combinados de los dos grupos de pacientes que recibieron tratamiento con monoterapia, con una duración del seguimiento de 4,7 años124.
Mortalidad
Un ECA (8.933 pacientes) que evaluó el tratamiento con IECA asociado a los ARA II frente a la monoterapia, no mostró una reducción significativa de la mortalidad por cualquier causa entre ambos tratamientos (1 ECA, 1.553 eventos, RR 1,02; IC95% de 0,93 a 1,13). El ECA tampoco mostró diferencias para la mortalidad de causa vascular (1 ECA, 971 eventos, RR 0,99; IC95% de 0,87 a 1,12)88.
alta
Eventos vasculares
Este mismo ECA evaluó los eventos vasculares con un desenlace de tipo combinado que se definió como muerte de causa vascular, infarto de miocardio, ictus u hospitalización por insuficiencia cardiaca, sin encontrar diferencias entre ambas intervenciones (1 ECA, 2.025 eventos, RR 0,97; IC95% de 0,89 a 1,05)88.
alta
Progresión de la enfermedad renal
La progresión de la enfermedad renal fue definida en este ensayo como número de pacientes con fallo renal y necesidad de diálisis, sin diferencias entre ambas intervenciones (1 ECA, 84 eventos, RR 1,19; IC95% de 0,77 a 1,85)88.
moderada
Tampoco se mostraron diferencias al evaluar el número de pacientes en los que se doblan los valores de creatinina (1 ECA, 226 eventos, RR: 1,25; IC95% de 0,96 a 1,63)88.
baja
Efectos indeseados
Este mismo ECA mostró que el riesgo de presentar efectos indeseados fue superior en el tratamiento combinado que con monoterapia, incluyendo el riesgo de requerir diálisis urgente (1 ECA, RR: 1,95; IC95% de 1,09 a 3,49), hiperkalemia (1 ECA, RR: 1,65; IC95% de 1,40 a 1,95), hipotensión (1 ECA, RR: 1,66; IC95% de 1,29 a 2,12)88.
moderada
El mismo ECA mostró que el riesgo de presentar tos fue superior en el tratamiento combinado que con monoterapia (1 ECA, RR: 1,72; IC95% de 1,34 a 2,20)88.
alta
Valores y preferencias de los pacientes
Ver capítulo 7.1 sobre tratamiento antihipertensivo con IECA o ARA II frente a placebo.
Uso de recursos y costes
No se encontraron estudios de costes que compararan las intervenciones evaluadas, aunque el coste unitario del tratamiento combinado es superior.
De la evidencia a la recomendación
Calidad de la evidencia
Para la comparación del tratamiento combinado (IECA más ARA II) frente a IECA, hay evidencia de alta calidad para el desenlace de mortalidad. Otros desenlaces presentaron limitaciones importantes como la definición de la variable combinada de eventos vasculares, limitaciones en el diseño y ejecución o escaso número de eventos.
Para la comparación del tratamiento combinado (IECA más ARA II) frente a ARA II, la principal limitación fue la imprecisión por disponer de un número de eventos muy escaso.
Para la comparación del tratamiento combinado (IECA más ARA II) frente a monoterapia se dispone de evidencia de alta calidad para el desenlace de mortalidad. Otros desenlaces presentaron limitaciones de imprecisión o falta de evidencia directa por el uso de variables subrrogadas o desenlaces combinados.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento anti-hipertensivo. De todos modos el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Beneficios y riesgos/carga de las intervenciones
De forma general, la asociación de un tratamiento con ARA II a un IECA no muestra beneficios clínicos relevantes respecto a la reducción del daño vascular o la reducción de la progresión de la enfermedad renal, frente al tratamiento con un IECA o un ARA II solos. El tratamiento combinado aumenta el riesgo de presentar efectos indeseados tales como la necesidad urgente de requerir diálisis, el desarrollo de hipekalemia, la hipotensión y la tos en comparación a un tratamiento solo. Por cada 1.000 pacientes tratados con ARA II asociado a un IECA, 15 pacientes más presentarían hipotensión y 16 pacientes más presentarían tos, en comparación a los tratados con monoterapia.
Balance beneficio-riesgo
El balance beneficio-riesgo de la combinación de un IECA con un ARA II frente al tratamiento con un IECA o un ARA II solos es desfavorable.
Uso de recursos y costes
No se encontraron estudios de costes que compararan las intervenciones evaluadas, aunque el coste unitario del tratamiento combinado es superior.
Recomendaciones
| FUERTE | En pacientes con ERC no se recomienda la asociación de inhibidores de la enzima de la angiotensina y antagonista de los receptores de la angiotensina II. |
Altas dosis de ARA II frente a bajas dosis de ARA II
La RS de Fink 2012 incluye 3 ECA con un total de 1.386 pacientes que evaluaron el tratamiento con ARA II a altas dosis frente a los ARA II a bajas dosis. Los ARA II que se evaluaron fueron el candesartan (16 mg/día, 64 mg/día o 128 mg/día), el telmisartan (40 mg/día frente a 80 mg/día) y el irbesartan (150 mg/día frente a 300 mg/día). Entre los estudios incluidos, dos estudios incluyeron pacientes con hipertensión arterial, así como diabetes mellitus. La media o mediana de seguimiento osciló entre 7 meses a 2 años.
Tratamiento ARA II (altas dosis) frente a ARA II (bajas dosis)
De los 3 ECA que evaluaron un tratamiento con diferentes dosis de ARA II, dos ensayos incluyeron a pacientes con albuminuria (30 – 300 mg/24 h) aunque con una creatinina sérica inferior a 1,5 mg/dL. Un tercer estudio incluyó a pacientes con proteinuria >1g/día y excluyó a pacientes con creatinina sérica superior a 3,4 mg/dL.
Mortalidad por cualquier causa
Dos estudios evaluaron la mortalidad por cualquier causa entre el tratamiento con ARA II a altas dosis frente a los ARA II a bajas dosis Los resultados no mostraron diferencias significativas entre ambas dosis. (2 ECA, 3 eventos, RR: 7,04; IC95% de 0,37 a 135,31)88.
baja
Desenlaces vasculares
Ningún estudio reporto eventos vasculares.
Progresión e la enfermedad renal
Ninguno de los estudios evaluó el riesgo de progresión de la enfermedad renal. Sin embargo dos estudios evaluaron el riesgo de progresión de la albuminuria (>300 mg/24 h). Los estudios mostraron un menor riesgo de progresión de la albuminuria a cifras por encima a 300 mg/24 h con ARA II a altas dosis frente a los ARA II a bajas dosis. (2 ECA, 96 eventos, RR: 0,68; IC95% de 0,46 a 0,98)88.
baja
Efectos indeseados
Dos estudios reportaron el número de pacientes que abandonaron el tratamiento debido a eventos adversos graves. El tratamiento con ARA II a altas dosis se asoció a un riesgo significativamente más bajo de abandonos del tratamiento por eventos adversos graves en comparación con los ARA II a bajas dosis. (2 ECA, 42 eventos, RR: 0,45; IC95% de 0,24 a 0,85)88. Un estudio no mostró diferencias significativas entre los tratamientos para el desarrollo de hiperkalemia (1 ECA, 8 eventos, RR: 1,00; IC95% de 0,26 a 3,88)88.
baja
Valores y preferencias de los pacientes
Ver capítulo 7.1 sobre tratamiento antihipertensivo con IECA o ARA II frente a placebo.
Uso de recursos y costes
No se encontraron estudios de costes que compararan las intervenciones evaluadas.
De la evidencia a la recomendación
La calidad global de la evidencia fue baja. La principal limitación fue la imprecisión de los resultados debido al escaso número de eventos para los desenlaces evaluados. Las variables analizadas para evaluar progresión o efectos indeseados mostraron resultados indirectos de estas medidas de desenlace.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento anti-hipertensivo. De todos modos, el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Beneficios y riesgos/carga de las intervenciones
El tratamiento con dosis altas de ARA II podría reducir el riesgo de presentar albuminuria y presentar mejor tolerancia en comparación a las dosis bajas, aunque la evidencia al respecto es muy incierta.
Balance beneficio-riesgo
El balance beneficio riesgo respecto al uso de dosis altas o bajas de ARA II es incierto.
Uso de recursos y costes
No se encontraron estudios que analizaran las intervenciones evaluadas.
Recomendaciones
| DÉBIL | En pacientes con ERC que reciben tratamiento con antagonistas de los receptores de la angiotensina, se sugiere no incrementar las dosis si presentan un buen control de las cifras de presión arterial. |
7.2. Establecimiento de cifras objetivo de la presión arterial
El concepto de conseguir unas cifras de presión arterial objetivo puede llevar a confusión al parecer que se trata de unas cifras por debajo de las que la morbi-mortalidad es prácticamente nula y por encima de las que existe un riesgo vascular importante. Por el contrario, es conocida la relación lineal de las cifras de presión arterial con futuros eventos vasculares. Establecer cifras de presión arterial objetivo puede ser aún más complejo en pacientes con ERC por la presencia de otros factores como las cifras de albúmina en orina u otras co-morbilidades frecuentemente asociadas en pacientes con ERC que influyen sobre el riesgo vascular. Además, los beneficios de los tratamientos anti-hipertensivos, especialmente los IECA y los ARA II, van más allá de la simple reducción de las cifras de presión arterial y actúan sobre la eliminación de albúmina en orina.
Resumen de la evidencia
Se identificaron dos revisiones sistemáticas (RS) que han evaluado los potenciales beneficios de conseguir unas cifras de presión arterial objetivo88,125. La RS más reciente se limitó a evaluar ECA en pacientes con diabetes, con o sin nefropatía125; la RS de Fink 2012 incluyó ECA en pacientes con nefropatía, ERC como criterio principal o los resultados de estos subgrupos de pacientes, por lo que se utilizó para esta evaluación de la evidencia88.
La RS de Fink 2012 incluye 6 ECA para un total de 2.520 pacientes que recibieron tratamiento anti-hipertensivo orientado a conseguir unas cifras objetivo de presión arterial “estricta” frente a cifras objetivo “habituales”. De forma general, las cifras de presión arterial “estricta” fueron entre 10 y 15 mm Hg inferiores a las cifras objetivo “habituales” aunque estas fueron variables, así como los agentes anti-hipertensivos utilizados. El seguimiento promedio de los estudios fue de 2 años (19 meses a 5 años). De los 6 ECA, un total de 5 incluyeron a pacientes con deterioro de la función renal (disminución de la TFG, del aclaramiento de la creatinina o aumento de la creatinina sérica). La mayoría de los pacientes incluidos no presentaron diabetes.
Mortalidad por cualquier causa
Un total de 4 ECA (1.803 pacientes) no mostraron una reducción significativa de la mortalidad en el control estricto de las cifras objetivo de presión arterial (4 ECA, 193 eventos, RR: 0,86; IC95% de 0,68 a 1,09)88.
moderada
Mortalidad cardiovascular
Un total de 2 ECA (635 pacientes) no mostraron una reducción significativa de la mortalidad cardiovascular en el control estricto de las cifras objetivo de presión arterial (2 ECA, 68 eventos, RR: 0,83; IC95% de 0,54 a 1,26)88.
El análisis de la mortalidad de causa vascular no fue posible en un estudio que incluyó a pacientes con diabetes y proteinuria al sólo proporcionar datos generales y no por grupo de tratamiento130.
moderada
Infarto de miocardio
Un único ECA (335 pacientes) no mostró una reducción significativa de los infartos de miocardio en el control estricto de las cifras objetivo de presión arterial (1 ECA, 2 eventos, RR: 1,00; IC95% de 0,06 a 15,86)88.
baja
Ictus
Un total de 2 ECA (632 pacientes) no mostraron una reducción significativa de los ictus en el control estricto de las cifras objetivo de presión arterial (2 ECA, 11 eventos, RR: 1,09; IC95% de 0,34 a 3,47)88.
baja
Eventos vasculares
Un único ECA (1.094 pacientes) evaluó los eventos vasculares en un desenlace combinado definido como mortalidad cardiovascular y primera hospitalización por causa cardiovascular, sin mostrar diferencias significativas entre las dos estrategias (2,3 % para el control estricto, 2,7% para el control habitual).
baja
Progresión de la enfermedad renal (evolución a fallo renal)
Un total de 5 ECA evaluaron este desenlace aunque sólo 3 mostraron los resultados en el subgrupo de pacientes con ERC. De estos 3 ECA (1.506 pacientes) no mostraron una reducción significativa de la progresión a fallo renal en el control estricto de las cifras objetivo de presión arterial (16,8 % para el control estricto, 16,6% para el control habitual) (3 ECA, 252 eventos, RR: 1,03; IC95% de 0,77 a 1,38)88.
El análisis de número de pacientes con evolución a fallo renal no fue posible en dos estudios que incluyeron a pacientes con diabetes y proteinuria al sólo proporcionar datos generales y no por grupo de tratamiento129,130.
alta
Progresión de la enfermedad renal (parámetros analíticos)
Ninguno de los ensayos incluidos en la RS mostró los resultados en el subgrupo de pacientes con ERC88.
Un estudio que incluyó a pacientes con diabetes y proteinuria mostró una reducción de la proteinuria en el control estricto de la presión arterial; otro estudio mostró que en el subgrupo de pacientes con proteinuria, un peor control de la presión arterial se asoció a un mayor descenso del filtrado glomerular. Ninguno de los dos estudios mostró los resultados de forma que pudieran ser analizados129,130.
Efectos indeseados
Un solo ECA (338 pacientes) no mostró diferencias significativas en los efectos indeseados graves y los abandonos por efectos indeseados graves, entre el tratamiento anti-hipertensivo con cifras objetivo de presión arterial estrictas en comparación a las habituales (21,9 % frente a 14,8% y 3,6 % frente a 1,8%, respectivamente). (1 ECA; 62 eventos, RR: 1,48; IC95% de 0,93 a 2,35) (1 ECA; 9 eventos, RR: 2,00; IC95% de 0,51 a 7,87)88.
baja
Otros 3 ECA mostraron resultados de efectos indeseados específicos sin mostrar diferencias relevantes entre las dos opciones, para el caso de la hipotensión postural fue más frecuente en el tratamiento con cifras objetivo de presión arterial estrictas en comparación a las habituales, al margen de la significación. (17,5 % frente a 6,1%) (1 ECA, 15 eventos, RR: 2,88; IC95% de 0,97 a 8,58)88.
baja
Valores y preferencias de los pacientes
Ver capítulo 7.1 sobre tratamiento antihipertensivo con IECA o ARA II frente a placebo.
Uso de recursos y costes
No se han localizado estudios de costes que evalúen estas dos estrategias de tratamiento.
De la evidencia a la recomendación
La calidad global de la evidencia para los desenlaces vasculares y efectos indeseados fue baja. La principal limitación fueron los resultados imprecisos.
Para el desenlace de progresión, la calidad de la evidencia es alta.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento anti-hipertensivo. De todos modos el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Beneficios y riesgos/carga de las intervenciones
Los diferentes ensayos señalan que en pacientes con ERC, el tratamiento anti-hipertensivo con un control estricto de las cifras de presión arterial objetivo estrictas no ofrece beneficios respecto a un control habitual y además se asocia a un mayor número de efectos indeseables.
En pacientes con ERC, el mayor ensayo y el más reciente, consideró el control estricto una cifra objetivo de presión arterial media de 92 mmHg (cifra equivalente a cifras de PAS/PAD de 130/80 mmHg) mientras que el control habitual la presión arterial media objetivo fue de 107 (cifra equivalente a cifras de PAS/PAD de 140/90 mmHg). Los ensayos que han incluido pacientes con diabetes y proteinuria han mostrado ciertos beneficios relacionados con el control estricto de la presión arterial, aunque en ninguno de los desenlaces considerados de interés en esta guía.
Adicionalmente una RS que incluyó ECA en pacientes con diabetes125 localizó un gran ECA (4.734 pacientes) que evaluó estas dos estrategias y desenlaces de interés en pacientes con diabetes pero sin nefropatía. En este ensayo se consideró el control estricto, una cifra objetivo de presión arterial sistólica <120 mmHg, mientras que el control habitual la presión arterial sistólica objetivo fue <140 mmHg. Este ensayo no mostró beneficios sobre la mortalidad por cualquier causa u otros desenlaces vasculares excepto los ictus (el control estricto se asoció a una disminución absoluta del 1,1%) y por el contrario se asoció a un aumento de más del doble (aumento del 2% absoluto) del riesgo de presentar un efecto indeseado grave.
Diferentes instituciones y Guías de Práctica Clínica han establecido diferentes cifras objetivo de presión arterial, siendo las más estrictas <125/75 mmHg en personas con ERC y proteinuria franca, en otras ocasiones se considera <130/80 mmHg en personas con enfermedad vascular establecida y diabetes, <140/90 mmHg en personas con ERC pero sin otros factores de riesgo específicos, mientras que en otras ocasiones no se han considerado cifras de presión arterial objetivo1,2,126-130.
Balance beneficio-riesgo
Los riesgos de establecer controles estrictos de cifras de presión arterial superan a los beneficios
Uso de recursos y costes
No se han localizado estudios de costes que avalúen estas dos estrategias de tratamiento.
Recomendaciones
| FUERTE | No se recomienda establecer unas cifras objetivo de presión arterial inferiores a 140/90 mm Hg en los pacientes con ERC. |
| DÉBIL | Se sugiere no alterar el tratamiento anti-hipertensivo en pacientes con cifras de presión arterial inferiores a 140/90 mm Hg. |
7.3. Tratamiento con estatinas
Se identificaron siete revisiones sistemáticas (RS) que han evaluado el efecto de las estatinas sobre la mortalidad, los eventos vasculares y renales en comparación a placebo, no tratamiento o diferentes dosis, en pacientes con ERC88,131-136.
Los resultados que se presentan provienen de la RS realizada por Agency for Healthcare Research and Quality de los EEUU88. Esta RS, actualizada hasta enero de 2011, evaluó ECA con un seguimiento superior a 6 meses y que incluyeran un mínimo de 50 pacientes. Los resultados de esta RS, que muestra resultados sobre los principales desenlaces considerados, se centran en pacientes con ERC en estadios 1 a 3.
Las otras RS presentaron limitaciones principalmente por falta de explicitud sobre los estudios incluidos y excluidos así como las razones para ello; algunas presentaron además límites idiomáticos, mezclaron diseños de estudios (aleatorizados y casi-aleatorizados) o falta de información en los análisis conjuntos de los resultados presentados.
La RS de Fink 2012 incluye 12 ECA para un total de 17.460 pacientes que evaluaron el tratamiento con estatinas frente a un control. La mayoría de estudios incluyó a pacientes con niveles elevados de colesterol total o LDL (media de colesterol total y de LDL en los pacientes incluidos fue de 220 mg/dL y de 142 mg/dL, respectivamente). Todos los estudios incluidos menos uno, hicieron análisis por subgrupos, en población con enfermedad renal incluida en estudios más amplios de prevención primaria o secundaria de eventos vasculares. La mayoría de los estudios incluyó pacientes con algún tipo de comorbilidad como diabetes tipo 2, hipertensión o enfermedad vascular. Las estatinas que se evaluaron fueron: pravastatina (4 ECA), rosuvastatina (2 ECA), atorvastatina (3 ECA), simvastatina (1 ECA), fluvastatina (1 ECA), lovastatina (1 ECA). El seguimiento de la mayoría de estudios fue de hasta 4 años88.
Un ECA que incluyó 9.270 pacientes con ERC (concentración de creatinina sérica >1,5 mg/dL en mujeres y 1,7 mg/dL en hombres) y sin antecedentes de enfermedad vascular previa. Aproximadamente el 67% de los pacientes del estudio presentaban enfermedad renal avanzada en fase de diálisis. El estudio no contempló la hiperlipidemia como criterio de inclusión y la media de colesterol total y de LDL en los pacientes sin diálisis fue de 194 mg/dL y de LDL de 111 mg/dL, respectivamente. El estudio, con un seguimiento de hasta 5 años, evaluó el tratamiento con simvastatina (20 mg al día) más ezetimiba, en comparación con placebo. La publicación del estudio sólo muestra los resultados de la variable combinada de eventos ateroescleróticos mayores (infarto de miocardio no mortal, muerte coronaria, ictus no hemorrágico o cualquier intervención de revascularización)137.
Adicionalmente, un estudio observacional de cohortes, que incluyó más de 2 millones de pacientes de bases de datos de Canadá, mostró resultados de tolerabilidad a nivel renal del tratamiento con estatinas a dosis altas o bajas, aunque los pacientes no padecían específicamente enfermedad renal previa138.
Las intervenciones evaluadas fueron:
- Estatinas frente a placebo.
- Estatinas a dosis altas frente a dosis bajas.
1. Estatinas frente a placebo
Mortalidad por cualquier causa
Un total de 8 ECA (13.964 pacientes) evaluaron el tratamiento con estatinas frente a placebo. Muestran una reducción significativa de la mortalidad del 20% (8,7 % para el placebo, 7,1% para el tratamiento con estatinas) (8 ECA, 1.106 eventos, RR: 0,80; IC95% de 0,68 a 0,95)88.
alta
El análisis de los 3 ECA (1.394 pacientes) que incluyeron pacientes con enfermedad coronaria no mostró una reducción significativa de la mortalidad. (3 ECA, 189 eventos, RR: 0,89; IC95% de 0,68 a 1,15)88.
moderada
Mortalidad cardiovascular
Un total de 4 ECA (2.057 pacientes) que evaluaron el tratamiento con estatinas frente a placebo no mostraron una reducción significativa de la mortalidad cardiovascular (4 ECA, 59 eventos, RR: 0,71 IC95% de 0,43 a 1,17)88.
moderada
El análisis de los 2 ECA (889 pacientes) que incluyeron pacientes con enfermedad coronaria tampoco mostró una reducción significativa de la mortalidad cardiovascular. (2 ECA, 50 eventos, RR: 0,69; IC95% de 0,40 a 1,19)88.
moderada
Infarto de miocardio
Un total de 2 ECA (2.015 pacientes) que evaluaron el tratamiento con estatinas frente a placebo muestran una reducción significativa de los infartos de miocardio (mortales y no mortales) del 28% (2 ECA, 74 eventos, RR: 0,52; IC95% de 0,33 a 0,84). La mayoría de eventos provino de un ensayo que incluyó pacientes que recibieron estatinas como estrategia de prevención secundaria88.
moderada
Ictus
Un total de 6 ECA (10.369 pacientes) que evaluaron el tratamiento con estatinas frente a placebo muestran una reducción significativa de los ictus del 38% (1,4 % para el placebo, 2,3% para el tratamiento con estatinas) (6 ECA, 191 eventos, RR: 0,62; IC95% de 0,41 a 0,95). La reducción del riesgo de ictus no fue estadísticamente significativa en los estudios que incluyeron pacientes con enfermedad coronaria que recibieron estatinas como estrategia de prevención secundaria, sin embargo las estatinas se asociaron a una reducción significativa en 3 ECA que incluyeron pacientes sin enfermedad coronaria que recibieron estatinas como estrategia de prevención primaria (3 ECA, 82 eventos, RR: 0,43; IC95% de 0,25 a 0,75)88.
moderada
Eventos vasculares
La mayoría de los estudios incluidos evaluaron una o más variables combinadas de eventos vasculares. La definición de la variable combinada difirió en cada uno de los estudios por lo que no se consideró el análisis conjunto de estos resultados, sin embargo las reducciones relativas de eventos vasculares (basadas en los estimadores centrales del efecto) mostraron un rango de valores entre el 58% y el 1% favorables al tratamiento con estatinas88.
moderada
De forma similar, un ECA mostró una reducción significativa del riesgo de presentar un evento ateroesclerótico mayor para el tratamiento combinado de simvastatina y ezetimiba frente a placebo, del 22% (1 ECA, 669 eventos, RR: 0,78; IC95% de 0,67 a 0,91), en pacientes que no estaban en diálisis. La reducción fue más aparente entre los pacientes con cifras de filtrado glomerular más reducidas y con cifras de albuminuria más elevadas137.
moderada
Progresión de la enfermedad renal
Dos ECA evaluaron el riesgo de progresión de enfermedad renal. Los componentes de este desenlace combinado fueron trasplante renal o inicio de diálisis en un estudio y además muerte por causa renal en otro estudio. En ambos estudios se añadió el empeoramiento de la función renal definida como aumento de dos veces los valores de creatinina o disminución de un 50% o más en el filtrado glomerular.
No se ha considerado analizar conjuntamente los resultados por las diferencias en las definiciones de los desenlaces de progresión y por las diferencias en las intervenciones.
Un ECA evaluó el riesgo de progresión de enfermedad renal definida como muerte por causa renal, trasplante renal o inicio de diálisis. El estudio que incluyó 1.557 pacientes con enfermedad renal pero sin enfermedad coronaria, no mostró una reducción del riesgo de progresión renal para el tratamiento con estatinas frente a placebo (1 ECA, 63 eventos, RR: 1,03; IC95% de 0,64 a 1,67)88.
moderada
Este mismo ensayo, cuando evaluó la progresión de la enfermedad definida como muerte por causa renal, trasplante renal o inicio de diálisis o disminución de un 50% o más en el filtrado glomerular tampoco mostró diferencias entre el tratamiento con estatinas o placebo (1 ECA, 102 eventos, RR: 0,96; IC95% de 0,66 a 1,40)88.
moderada
Un ECA que incluyó a pacientes con enfermedad renal y sin antecedentes vasculares evaluó el riesgo de progresión de enfermedad renal con las siguientes definiciones: trasplante renal o inicio de diálisis; progresión a fallo renal o incremento de dos veces la creatinina. El estudio mostró los resultados en un subgrupo de 6.247 pacientes sin diálisis. El estudio no mostró diferencias significativas en ninguna de las dos definiciones sobre el desenlace de progresión del daño renal con un tratamiento combinado de simvastatina y ezetimiba frente a placebo: 1 ECA, 2.141 eventos, RR: 0,97; IC95% de 0,89 a 1,05 y 1 ECA, 2.447 eventos, RR: 0,93; IC95% de 0,86 a 1,01, respectivamente137.
moderada
Este mismo ensayo, cuando evaluó la progresión de la enfermedad definida como trasplante renal o inicio de diálisis o aumento de dos veces los valores de creatinina tampoco mostró diferencias entre el tratamiento combinado de simvastatina y ezetimiba frente a placebo (1 ECA, 2.447 eventos, RR: 0,93; IC95% de 0,86 a 1,01)137.
moderada
Efectos indeseados
Un total de 5 ECA mostraron resultados de los efectos indeseados en el subgrupo de pacientes con enfermedad renal, siendo en general poco frecuentes. Algunos de los eventos no se evaluaron conjuntamente debido al escaso número de eventos. El efecto indeseado más común fue el incremento de las creatinin quinasas.
Un ECA (1.711 pacientes) mostró que no hubo diferencias significativas entre las estatinas y el placebo en el aumento de 3 veces por encima del limite de la normalidad de las creatin quinasas de 0,7% frente a 0,3% (1 ECA, 9 eventos, RR: 2,05; IC95% de 0,52 a 8,19)88.
muy baja
En 4 ECA (5.871 pacientes) no reportaron diferencias significativas en el riesgo de rabdomiolisis entre las estatinas y el placebo. (4 ECA, 5 eventos, RR: 0,51; IC95% de 0,08 a 3,05)88.
baja
2. Estatinas a dosis altas frente a dosis bajas
Mortalidad por cualquier causa
Un único ECA (10.003 pacientes) evaluó la mortalidad por cualquier causa en un subgrupo de pacientes (3.107) con enfermedad renal en los que se comparó las dosis altas con bajas de estatinas (atorvastatina 80 mg frente a 10 mg al día). Todos los pacientes tenían enfermedad coronaria previa. Los resultados no mostraron diferencias significativas para la mortalidad por cualquier causa (1 ECA, 225 eventos, RR 0,93; IC95% de 0,72 a 1,20)88.
moderada
Efectos indeseados
Un ECA (3.107 pacientes) mostró un mayor número de efectos adversos totales (no especifican de que tipo) con las dosis altas de estatinas en relación a dosis bajas de estatinas (atorvastatina 80mg frente a 10 mg al día) (1 ECA, 218 eventos, RR: 1,69; IC95% de 1,29 a 2,20)88.
baja
Un ECA (3.107 pacientes) mostró una mayor tasa de abandonos del tratamiento asociados a algún tipo de efecto adverso serio con las dosis altas de estatinas en relación a dosis bajas de estatinas (atorvastatina 80mg frente a 10 mg al día) (1 ECA, 97 eventos, RR: 2,20; IC95% de 1,43 a 3,38)88.
baja
Un ECA (3.107 pacientes) mostró un mayor riesgo de disfunción hepática (aumento de las transaminasas ALT/AST por encima de 3 veces el limite de la normalidad) con las dosis altas de estatinas en relación a dosis bajas de estatinas (atorvastatina 80mg frente a 10 mg al día) (1 ECA, 23 eventos, RR: 20,67; IC95% de 2,79 a 153,14)88.
baja
Un estudio observacional de cohortes históricas incluyó registros de más de 2 millones de pacientes de bases de datos institucionales en Canadá. Este estudio mostró que las estatinas a altas dosis (rosuvastatina ≥10 mg/día; atorvastatina ≥20 mg/día; simvastatina ≥40 mg/día) están asociadas a un aumento en el riesgo de hospitalización por daño renal agudo (RR: 1,34; IC95% de 1,25 a 1,43)138.
muy baja
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento con estatinas. De todos modos el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Uso de recursos y costes
Un estudio evaluó el coste-efectividad del tratamiento con estatinas genéricas en personas de más de 65 años con ERC no avanzada (estadio 3 y 4) e hipertensión pero sin enfermedad vascular previa, en comparación con no realizar tratamiento. Los desenlaces que se evaluaron fueron infarto de miocardio e ictus mortales y no mortales. El estudio es en el entorno de EEUU considerando los costes directos del año 2010139.
El estudio muestra que, el tratamiento con estatinas en pacientes de 65 años, tiene un valor de coste-efectividad incrementado (ICER) de $ 18.000 por QALY ganado en relación a no tratar en hombres, y de $ 33.400 por QALY ganado en mujeres. En los pacientes con menor riesgo vascular, los valores de coste efectividad no fueron tan favorables así como para pacientes más jóvenes, probablemente por el riesgo acumulado de presentar problemas musculares (mialgia y rabdomiolisis). Un análisis de sensibilidad mostró que el modelo es sensible al precio de las estatinas, siendo poco favorable para las estatinas no genéricas.
De la evidencia a la recomendación
Calidad de la evidencia
1. Comparación Estatinas frente a placebo
La calidad global de evidencia es moderada.
La principal limitación de la confianza con los resultados fue la imprecisión con los resultados.
2. Comparación: Estatinas a dosis altas frente a dosis bajas
La calidad global de evidencia es baja.
La principal limitación de la confianza con los resultados fue la imprecisión con los resultados.
Valores y preferencias de los pacientes
No se han localizado estudios que evalúen los valores y preferencias de los pacientes en tratamiento con estatinas. De todos modos el grupo elaborador de la guía considera que los pacientes otorgarán, de forma consistente, un mayor valor a evitar cualquier tipo de evento vascular que la probabilidad de presentar un efecto indeseado poco grave.
Beneficios y riesgos/carga frente a placebo
1. Comparación: Estatinas frente a placebo
El tratamiento con estatinas en pacientes con ERC probablemente reduce la mortalidad por cualquier causa, el riesgo de infarto de miocardio e ictus en relación a placebo. No parece reducir de forma significativa la mortalidad de tipo vascular, aunque el número de eventos y participantes fue más escaso. En pacientes con antecedentes vasculares, los estimadores muestran una dirección parecida, aunque sólo han mostrado reducir el riesgo de ictus. Por cada 1000 pacientes tratados con estatinas durante 5 años, se evitarían 17 (de 4 a 28) muertes por cualquier causa, 12 (de 4 a 17) infartos de miocardio y 9 (de 4 a 12) ictus, en relación al placebo. Los diferentes estudios mostraron reducciones relativas del riesgo de presentar cualquier evento vascular (las definiciones fueron muy heterogéneas) de entre un 58% a un 1%, en comparación a placebo. El tratamiento con estatinas no parece reducir el riesgo de progresión de la enfermedad renal. En relación al riesgo de presentar abdomiolisis o aumento de creatininkinasa (de 3 veces por el límite de la normalidad) no parece diferir entre el tratamiento con estatinas y el placebo.
En pacientes con enfermedad renal, sin antecedentes vasculares y sin hiperlipidemia, un tratamiento combinado con simvastatina y ezetimiba reduciría 26 eventos vasculares por 1000 pacientes tratados en comparación con placebo.
2. Comparación: Estatinas a dosis altas frente a dosis bajas
El tratamiento con estatinas a dosis elevadas, en comparación a dosis bajas no parece reducir la mortalidad por cualquier causa, sin embargo, aumenta considerablemente el riesgo de presentar efectos indeseables. Por cada 1.000 pacientes tratados con estatinas a altas dosis durante 5 años, 36 (de 15 a 62) pacientes más presentarían algún tipo de efecto adverso, 23 más (de 8 a 46) abandonarían el tratamiento debido a intolerancia, 13 más (de 1 a 101) presentarían alteración de la función hepática (aumento de 3 veces por encima del limite de la normalidad de la ALT/AST) y 43 más (de 31 a 54) presentarían daño renal agudo, en comparación a las estatinas a dosis bajas.
Balance beneficio-riesgo
Los beneficios del tratamiento con estatinas a dosis estándar superan los riesgos en relación al tratamiento con placebo en pacientes con hipercolesterolemia y/o antecedentes vasculares. Los beneficios de altas dosis de estatinas no superan los riesgos de daño renal frente a las dosis bajas de las mismas.
Diferentes estudios han asociado la enfermedad renal a un riesgo vascular incrementado. En concreto un gran estudio de cohortes longitudinales mostró que la reducción del filtrado glomerular se asocia de forma independiente a un mayor riesgo de muerte, eventos vasculares y hospitalizaciones140. La cohorte incluyó aproximadamente 1.120.000 participantes a los que se determinó el filtrado glomerular (aplicando la fórmula MDRD) y se les realizó un seguimiento de aproximadamente 3 años. Se excluyeron los pacientes en tratamiento sustitutivo renal o trasplante. La clasificación de la enfermedad renal siguió la propuesta de la National Kidney Foundation que establece la TFG de 45 a 59 mL/min/1,72 m2 (Estadio 3a); 30 a 44 mL/min/1,72 m2 (Estadio 3b); 15 a 29 mL/min/1,72 m2 (Estadio 4); <15 mL/min/1,72 m2 (Estadio 5). El riesgo de sufrir un evento vascular se asoció de forma lineal al descenso del filtrado glomerular. En comparación a personas con TFG ≥ 60 mL/ min/1,72 m2, el riesgo de sufrir un evento vascular se incrementó un 40% en pacientes con ERC estadio 3a, mientras que el riesgo fue 2 veces superior en estadio 3b, 2,8 veces superior en estadio 4 y 3,4 veces superior en estadio 5. Atendiendo a este incremento de riesgo vascular en pacientes con enfermedad renal en fases más avanzadas, podría justificar el tratamiento con estatinas aún ante la ausencia de antecedentes vasculares o hipercolesterolemia.
Uso de recursos y costes
El tratamiento con estatinas probablemente es coste-eficaz en pacientes de 65 años o más con riesgo vascular moderado o alto.
Recomendaciones
| FUERTE | En pacientes con ERC con hipercolesterolemia y/o antecedentes vasculares, se recomienda el tratamiento con estatinas. |
| DÉBIL | En pacientes sin hipercolesterolemia o antecedentes vasculares, se sugiere un tratamiento con estatinas sólo en pacientes con ERC en fases avanzadas (estadios 4 y 5). |
| FUERTE | En los pacientes que se requiera un tratamiento con estatinas, se recomienda el uso de dosis bajas. |
7.4. Tratamiento con antiagregantes plaquetarios
Se identificaron dos revisiones sistemáticas (RS) que evaluaron los efectos del tratamiento con ntiagregantes en pacientes con ERC141,142. La RS con metanálisis Palmer 2013 fue seleccionada por incluir una búsqueda de literatura exhaustiva y un mayor número de ensayos clínicos aleatorizados (ECA)141. No se han localizado nuevos ECAs que actualicen esta revisión.
La RS Palmer 2013 incluyó ensayos que evaluaron los antiagregantes frente a placebo así como diferentes tienopiridinas y diferentes inhibidores de la glucoproteína IIb/IIIa comparados entre ellos en pacientes con enfermedad renal crónica, incluyendo también pacientes en tratamiento sustitutivo renal o trasplante. La mayoría de los ensayos los tratamientos antiagregantes fueron administrados en pacientes con antecedentes de enfermedad coronaria.
Las intervenciones evaluadas fueron:
- Tratamientos antiagregantes frente a placebo.
- Diferentes tienopiridinas.
- Diferentes inhibidores de la glucoproteína IIb/IIIa.
1. Tratamientos antiagregantes frente a placebo
Mortalidad por todas las causas
moderada
Mortalidad cardiovascular
En esta RS (9.337 pacientes), no hubo diferencias entre antiagregantes respecto a placebo en la mortalidad cardiovascular (18 ECA, 330 eventos, RR: 0,87; IC95% de 0,65 a 1,15)141. Los resultados fueron homogéneos. No se hallaron diferencias de acuerdo a los diferentes tipos de antiplaquetarios (aspirina, tienopiridinas, inhibidores de la glucoproteína IIb/IIIa) o al estadio de enfermedad renal crónica.
baja
Infarto de miocardio mortal o no mortal
Esta RS (14.451 pacientes) mostró que los agentes antiagregantes reducen el riesgo de infarto de miocardio mortal o no mortal de manera significativa en relación al placebo (17 ECA, 986 eventos, RR: 0,87; IC95% de 0,76 a 0,99)141. No se hallaron diferencias significativas para esta variable según el estadio de enfermedad renal crónica (estadios tempranos, pacientes en diálisis) o al tipo de agente antiagregante evaluado (aspirina, tienopiridinas, inhibidores de la glucoproteína IIb/IIIa).
moderada
Ictus mortal o no mortal
La RS (9.544 pacientes) no mostró diferencias entre antiagregantes y placebo respecto al riesgo de sufrir ictus mortal o no mortal. (11 ECA, 176 eventos, RR: 1,00; IC95% de 0,58 a 1,72)141.
moderada
Ictus hemorrágico
En esta RS (6.044 pacientes), no hubo diferencias entre el tratamiento con antiagregantes y placebo respecto riesgo de ictus hemorrágico. (6 ECA, 47 eventos, RR: 1,22; IC95% de 0,69 a 2,17)141.
baja
Enfermedad renal estadio final
No se hallaron diferencias significativas en el riesgo de progresión a estadios finales de enfermedad renal entre agentes antiagregantes y placebo; en esta revisión que incluyó 825 pacientes. (9 ECA, 116 eventos, RR: 0,96; IC95% de 0,67 a 1,37)141.
baja
Mortalidad por sangrado
El riesgo de mortalidad por sangrado no difiere entre los antiagregantes y el placebo (16 ECA, 7.037 pacientes, RR: 5,11; IC95% de 0,25 a 106)141. Se presentaron dos eventos de mortalidad por sangrado en un ECA de los 16 incluidos.
baja
Sangrado grave
Los eventos de sangrado grave incluyeron: sangrado retroperitoneal, intraarticular, intra-ocular, sangrado intra-craneal o intra-cerebral, sangrado gastrointestinal, sangrado mortal, sangrado que amenaza la vida o requiere transfusión, cirugía correctiva u hospitalización con o sin caída del nivel de hemoglobina de por lo menos 2g/dL.
La RS (15.992 pacientes) mostró que en comparación con placebo, los agentes antiagregantes aumentan significativamente el riesgo de sangrado grave (26 ECA, 592 eventos, RR: 1,35; IC95% de 1,10 a 1,65)141. Los resultados fueron homogéneos. No se hallaron diferencias en el riesgo de sangrado grave de acuerdo al estadio de enfermedad renal crónica o al tipo de agente antiagregante.
moderada
Sangrado leve
Los siguientes eventos de sangrado fueron definidos como leves: epistaxis, equimosis, hematomas, sangrado que no requiere transfusión, hospitalización, alteración de parámetros analíticos, sangrado de sitios de canalización, o hematuria.
En esta RS (13.106 pacientes), los antiagregantes se asocian a un aumento significativo de sangrados leves en relación al placebo (18 ECA, 1.576 eventos, RR: 1,54; IC95% de 1,26 a 1,90)141. Los resultados presentaron una heterogeneidad significativa que no pudo ser atribuida a un riesgo diferencial según el estadio de enfermedad, antecedentes de enfermedad cardiovascular, duración de la intervención, edad o sexo de los participantes, diagnóstico de hipertensión o diabetes.
moderada
Abandono del tratamiento
La RS (2.569 pacientes), no halló diferencias significativas entre antiagregantes y placebo, en relación al riesgo de abandono del tratamiento relacionado a efectos adversos (23 ECA, 427 eventos, RR: 0,97; IC95% de 0,83 a 1,13)141.
baja
2. Diferentes tienopiridinas
Se hallaron dos ensayos clínicos que comparaban diferentes tienopiridinas entre ellas. Las tienopiridinas evaluadas fueron el clopidogrel, el ticagrelor y el prasugrel. No hubo diferencias entre los estudios respecto a los desenlaces evaluados por lo que en la mayoría sólo se presentan los resultados de un solo ensayo.
Mortalidad por todas las causas
Para el desenlace de mortalidad por cualquier causa los resultados del análisis conjunto de ambos ECA mostró un alto grado de heterogeneidad, lo que podría sugerir una estimación global no adecuada, por ello los resultados para estos desenlaces específicos son presentados de manera individual.
No hubo diferencias entre prasugrel respecto a clopidrogrel en la mortalidad por cualquier causa a un año de seguimiento (1 ECA, 1.490 pacientes, RR: 0,81; IC95% de 0,56 a 1,18) 141; sin embargo el ticagrelor mostró una disminución significativa de la mortalidad por cualquier causa en comparación a clopidrogrel (1 ECA, 3.237 pacientes, RR: 0,72; IC95% de 0,58 a 0,89)141.
moderada
Mortalidad cardiovascular
En esta RS (1.469 pacientes), no se hallaron diferencias significativas entre el prasugrel y el clopidogrel en relación al riesgo de mortalidad cardiovascular a un año de seguimiento. (1 ECA, 76 eventos, RR: 1,35; IC95% de 0,87 a 2,10)141.
moderada
Infarto de miocardio mortal o no mortal
En la RS (1.490 pacientes), no se hallaron diferencias significativas en cuanto al riesgo de infarto de miocardio mortal o no mortal en el grupo de estudio sometido a prasugrel y el grupo de estudio sometido a clopidrogrel a un año de seguimiento (1 ECA, 160 eventos, RR: 0,78; IC95% de 0,58 a 1,05)141.
moderada
Ictus mortal o no mortal
No se hallaron diferencias significativas entre ticagrelor y clopidogrel por lo que se refiere a la incidencia de ictus mortales o no mortales a un año de seguimiento (1 ECA, 3.237 pacientes, RR: 1,79; IC95% de 0,43 a 7,51)141.
moderada
Sangrado grave
Dos ensayos evaluaron el riesgo de presentar un sangrado grave a un año de seguimiento. Las definiciones de los dos estudios difirieron. Un estudio consideró sangrado grave como hemorragia intracraneal, sangrado clínicamente evidente, disminución de la hemoglobina de ≥5 g/dL, mientras que un segundo estudio como disminución de la hemoglobina de ≥3 g/dL o <5 g/dL que requirió transfusión o sangrado que causa discapacidad grave.
Los resultados conjuntos de los dos estudios no muestran diferencias significativas por lo que se refiere al riesgo de sangrado grave (2 ECA, 4.727 pacientes, RR: 1,12; IC95% de 0,90 a 1,39)141.
moderada
Sangrado leve
moderada
3. Diferentes inhibidores de las glucoproteínas IIb/IIIa
Mortalidad por todas las causas
La RS (1.192 pacientes) no mostró diferencias significativas en el riesgo de mortalidad por todas las causas en el grupo de estudio sometido a abciximab y el grupo de estudio sometido a tirofiban al año de seguimiento (1 ECA, 40 eventos, RR: 0,85; IC95% de 0,45 a 1,59)141.
alta
Infarto de miocardio mortal o no mortal
La RS (1.192 pacientes) no mostró diferencias significativas en el riesgo de infarto de miocardio mortal o no mortal entre el abciximab y el tirofiban a los seis meses de seguimiento (1 ECA, 104 eventos, RR: 1,14; IC95% de 0,77 a 1,71)141.
alta
Valores y preferencias de los pacientes
Una RS incluyó 48 estudios que evaluaron los valores y preferencias de los pacientes que recibieron tratamientos antitrombóticos. De estos, 12 mostraron valores de utilidad referidos a desenlaces relevantes en un tratamiento antitrombótico. La RS muestra que los pacientes otorgan un mayor valor a evitar un evento vascular (ictus) que a experimentar una hemorragia grave. De todos modos, los resultados fueron variables144.
Los pacientes con ERC otorgan valores de utilidad progresivamente inferiores a medida que avanza la enfermedad.
Uso de recursos y costes
Aunque no se encontraron estudios que analizaran las intervenciones evaluadas, el tratamiento con antiagregantes a la mayoría de pacientes con ERC en estadios avanzados supondría un impacto económico importante. Se desconoce por tanto el coste-efectividad de esta estrategia.
De la evidencia a la recomendación
Calidad de la evidencia
1. Comparación: Tratamientos antiagregantes frente a placebo
La calidad global es baja.
Tanto para los desenlaces de eficacia y de tolerabilidad, el principal factor que limitó la confianza de los resultados, fue la falta de evidencia directa, al incluir en la evolución de muchos desenlaces de interés, población en diálisis o en prediálisis, con diferente tipo de comorbilidad y la imprecisión de los resultados.
2. Comparación: diferentes tieropiridinas
La calidad global es moderada.
Para los desenlaces de eficacia los principales factores que limitaron la confianza de los resultados fueron la imprecisión. Además para el desenlace de mortalidad por todas las causas, se realizó un análisis conjunto de ambos ECA, que evidenció un alto grado de heterogeneidad, lo que limitó la confianza por inconsistencia.
Para los desenlaces de tolerabilidad el principal factor que limitó la confianza fue la imprecisión de los resultados.
3. Comparación: diferentes inhibidores de la glucoproteína IIb/IIIa
Para los desenlace de eficacia el principal factor que limitó la confianza fue la imprecisión de los resultados, no se encontró evidencia que evaluaran los desenlaces de tolerabilidad.
Valores y preferencias de los pacientes
Los pacientes otorgan un mayor valor a evitar un evento vascular (ictus) que a experimentar una hemorragia grave, de todos modos hay una elevada variabilidad de los mismos.
Beneficios y riesgos/carga de las intervenciones
Los efectos del tratamiento con antiagregantes en personas con o sin riesgo vascular han sido evaluados en dos grandes RS con metaanálisis. En el año 2002 se publicó la primera de estas RS que incluyó 287 ECA y hasta 20.000 personas de alto riesgo vascular142. De forma global, el tratamiento con antiagregante en personas de elevado riesgo vascular (incluyendo una gran variedad de factores de riesgo) redujo un 22% el riesgo de presentar un evento vascular en comparación al control. A los dos años, la prevención secundaria con antiagregantes redujo un 25% y un 22% el riesgo de presentar un evento vascular en personas con un infarto de miocardio o ictus previos, respectivamente. La reducción de eventos vasculares se observó para los infartos de miocardio no mortales, los ictus no mortales así como para la mortalidad de tipo vascular. La reducción absoluta por cada 1.000 pacientes tratados durante 1 año fue entre 10 y 20 eventos vasculares graves, dependiendo del tipo de pacientes. En las personas con otros factores de riesgo vascular como angina estable, enfermedad arterial periférica y fibrilación auricular también se redujo el riesgo de presentar eventos vasculares de forma similar (26%) con una reducción absoluta de 12 eventos vasculares graves por cada 1.000 pacientes tratados durante 1 año.
El principal tratamiento antiagregante evaluado fue la aspirina. Aunque la RS se basa en resultados de comparaciones indirectas, las dosis de aspirina entre 75 y 150 mg parecen ser tan efectivas como dosis superiores y se asociaron a un menor riesgo de sangrados graves extracraneales. No hubo diferencias significativas en eficacia según el tipo de antiagregante excepto para el clopidogrel que mostró reducir un 10% el riesgo de eventos vasculares graves en comparación a la aspirina142.
La evidencia de ECA en pacientes con ERC proviene en su gran mayoría de subgrupos de ensayos en los que se incluyeron pacientes con diferentes grados de deterioro de la TFG, en pacientes de alto riesgo vascular (con antecedentes vasculares previos). El número de estudios fue menor y los intervalos de confianza amplios. Aunque no se mostró una reducción significativa en la mayoría de los eventos (excepto en infarto de miocardio), los estimadores muestran una reducción del riesgo de forma consistente con la evidencia procedente de otras poblaciones.
La evidencia proveniente directamente de ECA en pacientes con ERC muestra que el tratamiento con el prasugrel parece tener similar eficacia al clopidogrel en el riesgo de mortalidad por todas las causas, mortalidad cardiovascular, infarto de miocardio mortal y no mortal. En relación a los efectos indeseables el riesgo de sangrado leve no parece diferir entre las intervenciones evaluadas. El tratamiento con ticagrelor parece tener similar eficacia al clopidogrel en el riesgo de ictus mortal o no mortal. Sin embargo el ticagrelor parece tener superior eficacia para proteger del riesgo de mortalidad por todas las causas. La mortalidad por todas las causas y de infarto de miocardio mortal o no mortal no parece diferir entre el abciximab y el tirofiban.
Asimismo, diferentes estudios han asociado la enfermedad renal a un riesgo vascular incrementado. En concreto un gran estudio de cohortes longitudinales mostró que la reducción del filtrado glomerular se asocia de forma independiente a un mayor riesgo de muerte, eventos vasculares y hospitalizaciones140. La cohorte incluyó aproximadamente 1.120.000 participantes a los que se determinó el filtrado glomerular (aplicando la fórmula MDRD) y se les realizó un seguimiento de aproximadamente 3 años. Se excluyeron los pacientes en tratamiento sustitutivo renal o trasplante. La clasificación de la enfermedad renal siguió la propuesta de la National Kidney Foundation que establece la TFG de 45 a 59 mL/min/1,73 m2 (Estadio 3a); 30 a 44 mL/min/1,73 m2 (Estadio 3b); 15 a 29 mL/min/1,73 m2 (Estadio 4); <15 mL/min/1,73 m2 (Estadio 5). El riesgo de sufrir un evento vascular se asoció de forma lineal al descenso del filtrado glomerular. En comparación a personas con TFG ≥ 60 mL/min/1,73 m2, el riesgo de sufrir un evento vascular se incrementó un 40% en pacientes con ERC estadio 3a, mientras que el riesgo fue 2 veces superior en estadio 3b, 2,8 veces superior en estadio 4 y 3,4 veces superior en estadio 5.
Paradójicamente se ha asociado los pacientes con ERC a un aumento del riesgo trombótico y al mismo tiempo un aumento del riesgo de sangrado. Por lo que se refiere al riesgo hemorrágico, la RS Cochrane141 evaluó la eficacia y los efectos indeseados del tratamiento antiagregante en pacientes con ERC, incluyendo también pacientes en tratamiento sustitutivo renal o trasplante. La RS mostró que en comparación con placebo, los agentes antiagregantes aumentan significativamente el riesgo de sangrado grave (26 ECA, 15.992 pacientes, RR: 1,35; IC95% de 1,10 a 1,65). Los resultados fueron homogéneos. No se hallaron diferencias en el riesgo de sangrado grave de acuerdo al estadio de ERC. El riesgo basal anualizado de sangrado en pacientes con ERC es difícil de establecer. Según la RS de Palmer 2013, de los 26 ECA que evaluaron el riesgo de sangrado grave con una duración media de 9 meses, se establece un riesgo anualizado para el grupo control de 3,86%, incluyendo pacientes de todos los estadios141. Una cohorte retrospectiva de pacientes con ERC en hemodiálisis muestra que el riesgo anualizado de sangrado grave para el grupo que no recibió tratamiento antiagregante fue del 0,8%143. (ver tabla 4).
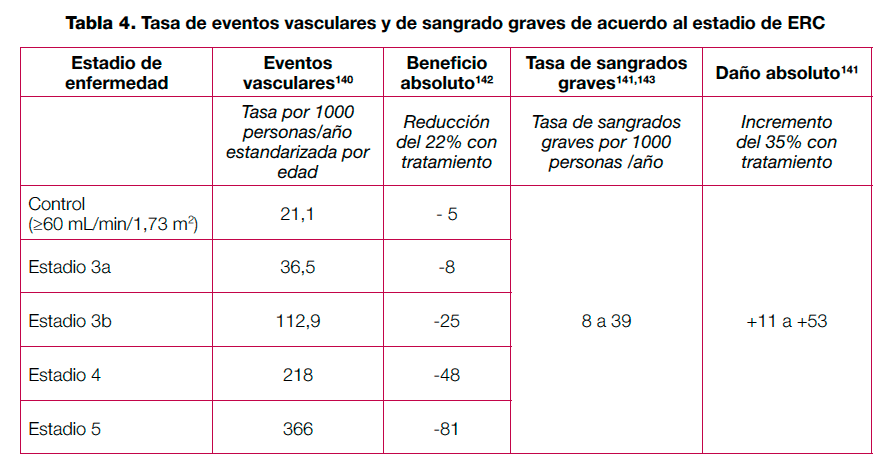
Considerando que, los beneficios absolutos, en términos de reducción del riesgo de eventos vasculares mayores, en personas con ERC (estadios 3, 4 y 5) por cada 1.000 personas tratadas durante 1 año con antiagregantes, oscila entre 8 y 81 eventos menos, en comparación con no tratamiento antiagregante y que el aumento de riesgo de sangrado puede oscilar entre 11 y 53 sangrados graves, el grupo de elaboración de la guía ha considerado que la relación beneficio-riesgo del tratamiento antiagregante es probablemente favorable, aunque dependiendo del estadio de la enfermedad.
En estadios 3 y 4, la reducción de eventos vasculares por cada 1.000 personas tratadas durante 1 año oscilaría entre 8 y 48 eventos, con un aumento de entre 11 y 53 sangrados graves. En estos estadios, el balance beneficio-riesgo es incierto y debería considerarse en cada uno de los pacientes de forma individualizada.
En estadio 5, la reducción de eventos vasculares por cada 1.000 personas tratadas durante 1 año sería de 81 eventos, con un aumento de entre 11 y 53 sangrados graves. En estos estadios, el balance beneficio-riesgo es probablemente favorable.
Uso de recursos y costes
Aunque no se encontraron estudios que analizaran las intervenciones evaluadas, el tratamiento con antiagregantes a la mayoría de pacientes con ERC en estadios avanzados supondría un impacto económico importante. Se desconoce por tanto el coste-efectividad de esta estrategia.
Recomendaciones
| DÉBIL | En pacientes con ERC (estadios 1 a 4), sin antecedentes vasculares, se sugiere evaluar individualmente la introducción de un tratamiento antiagregante con el objetivo de reducir el Riesgo de un evento vascular. |
| DÉBIL | En pacientes con ERC (estadio 5), sin antecedentes vasculares, se sugiere iniciar tratamiento antiagregante con las menores dosis posibles, con el objetivo de reducir el riesgo de un evento Vascular. |
| DÉBIL | En los pacientes que se requiera un tratamiento antiagregante, se sugiere el uso de aspirina o de clopidogrel si el riesgo de sangrado es elevado. |
| FUERTE | En pacientes con ERC con antecedentes vasculares, se recomienda que el manejo del tratamiento antiagregante no difiera de los pacientes sin ERC, que requieren prevención secundaria de eventos vasculares, con el objetivo de reducir el riesgo de un nuevo evento vascular. |
Bibliografía 7. Tratamiento farmacológico de la enfermedad renal crónica
1. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002;39 (2 Suppl 1):S1-266.
2. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013;3:1–150.
14. Van der Velde M, Matsushita K, Coresh J, et al, for the Chronic Kidney Disease Prognosis Consortium. Lower estimated glomerular filtration rate and higher albuminuria are associated with all cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney Int. 2011;79:1341–52.
15. Matsushita K, van der Velde M, Astor BC, et al, for the CKD Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010;375: 2073–81.
87. Susantitaphong P, Sewaralthahab K, Balk EM, et al. Efficacy and safety of combined vs. single renin-angiotensin-aldosterone system blockade in chronic kidney disease: a metaanalysis. Am J Hypertens. 2013;26(3):424-41.
88. Fink HA, Ishani A, Taylor BC, et al. Chronic Kidney Disease Stages 1–3: Screening, Monitoring, and Treatment. Comparative Effectiveness Review No. 37. (Prepared by the Minnesota Evidence-based Practice Center under Contract No. HHSA 290-2007-10064-I.) AHRQ Publication No. 11(12)-EHC075-EF. Rockville, MD: Agency for Healthcare Research and Quality. January 2012. www.effectivehealthcare.ahrq.gov/reports/final.cfm.
89. Sharma P, Blackburn RC, Parke CL, et al. Angiotensin-converting enzyme inhibitors and angiotensin receptor blockers for adults with early (stage 1 to 3) non-diabetic chronic kidney disease. Cochrane Database Syst Rev. 2011;(10):CD007751.
90. Sarafidis PA, Stafylas PC, Kanaki AI, et al. Effects of renin-angiotensin system blockers on renal outcomes and all-cause mortality in patients with diabetic nephropathy: an updated meta-analysis. Am J Hypertens. 2008;21(8):922-9. 91. Balamuthusamy S, Srinivasan L, Verma M, et al. Renin angiotensin system blockade and cardiovascular outcomes in patients with chronic kidney disease and proteinuria: a metaanalysis. Am Heart J. 2008;155(5):791-805.
92. Strippoli GF, Bonifati C, Craig M, et al. Angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists for preventing the progression of diabetic kidney disease. Cochrane Database Syst Rev. 2006, Issue 4. Art. No.: CD006257.
93. Imai E, Chan JC, Ito S, et al. ORIENT study investigators. Effects of olmesartan on renal and cardiovascular outcomes in type 2 diabetes with overt nephropathy: a multicentre, randomised, placebo-controlled study. Diabetologia. 2011;54(12):2978-86.
94. Mann JF, Anderson C, Gao P, et al. ONTARGET investigators. Dual inhibition of the reninangiotensin system in high-risk diabetes and risk for stroke and other outcomes: results of the ONTARGET trial. J Hypertens. 201;31(2):414-21.
95. Ernst ME, Moser M. Use of Diuretics in Patients with Hypertension N Engl J Med. 2009;361: 2153-64.
96. Lewington S, Clarke R, Qizilbash N et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002; 360:1903–13.
97. Astor BC, Matsushita K, Gansevoort RT et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with mortality and end-stage renal disease. A collaborative meta-analysis of kidney disease population cohorts. Kidney Int. 2011; 79: 1331–40.
98. Gansevoort RT, Matsushita K, van der Velde M et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int. 2011;80:93–104.
99. Badve SV, Roberts MA, Hawley CM, et al. Effects of beta-adrenergic antagonists in patients with chronic kidney disease: a systematic review and meta-analysis. J Am Coll Cardiol. 2011;58:1152–61.
100. Asselbergs FW, Diercks GFH, Hillege HL, et al. Prevention of Renal and Vascular Endstage Disease Intervention Trial (PREVEND IT) Investigators. Effects of fosinopril and pravastatin on cardiovascular events in subjects with microalbuminuria. Circulation. 2004;110(18):2809-16
101. O’Hare P, Bilbous R, Mitchell T, et al. Low-dose ramipril reduces microalbuminuria in type 1 diabetic patients without hypertension: results of a randomized controlled trial. Diabetes Care. 2000;23(12):1823–9.
102. Crepaldi G, Carta Q, Deferrari G, et al. Effects of lisinopril and nifedipine on the progression to overt albuminuria in IDDM patients with incipient nephropathy and normal blood pressure. The Italian Microalbuminuria Study Group in IDDM. Diabetes Care. 1998;21(1):104-10.
103. Laffel LM, McGill JB, Gans DJ. The beneficial effect of angiotensin-converting enzyme inhibition with captopril on diabetic nephropathy in normotensive IDDM patients with microalbuminuria. North American Microalbuminuria Study Group. American Journal of Medicine. 1995;99(5):497- 504.
104. Sano T, Kawamura T, Matsumae H, et al. Effects of long-term enalapril treatment on persistent micro-albuminuria in well controlled hypertensive and normotensive NIDDM patients. Diabetes Care. 1994;17(5):420-4.
105. Ravid M, Savin H, Jutrin I, et al. Long-term stabilizing effect of angiotensin-converting enzyme inhibition on plasma creatinine and on proteinuria in normotensive type II diabetic patients. Ann Intern Med. 1993;118(8):577-81.
106. Bojestig M, Karlberg BE, Lindstrom T, et al. Reduction of ACE activity is insuficient to decrease microalbuminuria in normotensive patients with type 1 diabetes. Diabetes Care. 2001;24(5):919-24.
107. Stafylas PC, Sarafidis PA, Lasaridis AN, et al. Cost-effectiveness of losartan in diabetic nephropathy: a Greek perspective. Journal of Nephrology. 2007;20(6):703-15.
108. Adarkwah CC, Gandjour A, Akkerman M, Evers S. To Treat or Not to Treat? Cost-Effectiveness of Ace Inhibitors in Non-Diabetic Advanced Renal Disease - a Dutch Perspective. Kidney Blood Press Res 2013;37:168-80.
109. Centre for Reviews and Dissemination. [Critically appraised economic evaluations] Costeffectiveness of angiotensin€converting enzyme inhibitors in nondiabetic advanced renal disease (Structured abstract). NHS Economic Evaluation Database (NHSEED) 2013 Issue 4.
110. Adarkwah CC, Gandjour A. Cost€effectiveness of angiotensin€converting enzyme inhibitors in nondiabetic advanced renal disease. Expert Review of Pharmacoeconomics and Outcomes Research. 2011;11(2):215€23.
111. Hou FF, Zhang X, Zhang GH et al. Efficacy and safety of benazepril for advanced chronic renal insufficiency. N Engl J Med. 2006(354):131–40.
112. Ihle BU, Whitworth JA, Shahinfar S, et al. Angiotensin-converting enzyme inhibition in nondiabetic progressive renal insufficiency: a controlled double-blind trial. Am J Kidney Dis. 1996(27):489–9.
113. Adarkwah CC, Gandjour A, Akkerman M, et al. To Treat or Not to Treat? Cost-Effectiveness of Ace Inhibitors in Non-Diabetic Advanced Renal Disease - a Dutch Perspective. Kidney Blood Press Res. 2013;37:168-80.
114. Powers BJ, Coeytaux RR, Dolor RJ, et al. Updated report on comparative effectiveness of ACE inhibitors, ARBs, and direct renin inhibitors for patients with essential hypertension: much more data, little new information. J Gen Intern Med. 2012;27(6):716-29.
115. Fernandez Juarez G, Luño J, Barrio V, et al. PRONEDI Study Group. Effect of dual blockade of the renin-angiotensin system on the progression of type 2 diabetic nephropathy: a randomized trial. Am J Kidney Dis. 2013;61(2):211-8.
116. Mann JFE, Schmieder RE, McQueen M, et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial. Lancet. 2008;372(9638):547-53.
117. Sipahi I, Debanne SM, Rowland DY, et al. Angiotensin-receptor blockade and risk of cancer: meta-analysis of randomised controlled trials. Lancet Oncol. 2010;11(7):627-36.
118. Bangalore S, Kumar S, Kjeldsen SE, et al. Antihypertensive drugs and risk of cancer: network meta-analyses and trial sequential analyses of 324,168 participants from randomized trials. Lancet Oncol. 2011;12:65-82.
119. The ARB Trialists Collaboration. Effects of telmisartan, irbesartan, valsartan, and candesartan, and losartan on cancers in 15 trials. J Hypertens. 2011;29:623-35.
120. Pasternak B, Svanström H, Callréus T, et al. Use of angiotensin receptor blockers and the risk of cancer. Circulation. 2011;123:1729-36.
121. Adarkwah CC, Gandjour A. Cost-effectiveness of angiotensin-converting enzyme inhibitors in nondiabetic advanced renal disease. Expert Rev Pharmacoecon Outcomes Res. 2011;11(2): 215-23.
122. Fried LF, Emanuele N, Zhang JH, et al. VA NEPHRON-D Investigators. Combined angiotensin inhibition for the treatment of diabetic nephropathy. N Engl J Med. 2013;369(20):1892-903.
123. Anand IS, Bishu K, Rector TS, et al. Proteinuria, chronic kidney disease, and the effect of an angiotensin receptor blocker in addition to an angiotensin-converting enzyme inhibitor in patients with moderate to severe heart failure. Circulation. 2009;120(16):1577-84.
124. Tobe SW, Clase CM, Gao P, et al. Cardiovascular and renal outcomes with telmisartan, ramipril, or both in people at high renal risk: results from the ONTARGET and TRANSCEND studies. Circulation. 2011;123(10):1098-107.
125. Arguedas JA, Leiva V, Wright JM. Blood pressure targets for hypertension in people with diabetes mellitus. Cochrane Database Syst Rev 2013, Issue 10. Art. No.: CD008277.
126. Royal College of Physicians. Chronic kidney diseases in adults: UK guidelines for identification, management and referral. London: RCP, 2006.
127. Scottish Intercollegiate Guidelines Network. Chronic Kidney Disease. Edinburgh: SIGN, 2008. (SIGN publication no. 103).
128. Williams B, Poulter NR, Brown MJ, et al. Guidelines for management of hypertension: report of the fourth working party of the British Hypertension Society, 2004-BHS IV. Journal of Human Hypertension. 2004;18(3):139-85.
129. Lewis JB, Berl T, Bain RP, et al. Effect of intensive blood pressure control on the course of type 1 diabetic nephropathy. Collaborative Study Group. American Journal of Kidney Diseases. 1999;34(5):809-17.
130. Peterson JC, Adler S, Burkart JM, et al. Blood pressure control, proteinuria, and the progression of renal disease. The Modification of Diet in Renal Disease Study. Ann Intern Med. 1995;123(10):754-62.
131. Barylski M, Nikfar S, Mikhailidis DP, et al. Statins decrease all-cause mortality only in CKD patients not requiring dialysis therapy: a meta-analysis of 11 randomized controlled trials involving 21295 participants. Pharmacol Res. 2013;72:35-44.
132. Hou W, Lv J, Perkovic V, et al. Effect of statin therapy on cardiovascular and renal outcomes in patients with chronic kidney disease: a systematic review and meta-analysis. Eur Heart J. 2013;34(24):1807-17.
133. Upadhyay A, Earley A, Lamont JL, et al. Lipid-lowering therapy in persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med. 2012; 157(4):251-62.
134. Palmer SC, Craig JC, Navaneethan SD, et al. Benefits and harms of statin therapy for persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med. 2012; 157(4):263-75.
135. Navaneethan SD, Pansini F, Perkovic V, et al. HMG CoA reductase inhibitors (statins) for people with chronic kidney disease not requiring dialysis. Cochrane Database Syst Rev. 2009; (2):CD007784.
136. Strippoli GF, Navaneethan SD, Johnson DW, et al. Effects of statins in patients with chronic kidney disease: meta-analysis and meta-regression of randomised controlled trials. BMJ. 2008;336(7645):645-51.
137. Baigent C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181-92.
138. Dormuth CR, Hemmelgarn BR, Paterson JM, et al. Use of high potency statins and rates of admission for acute kidney injury: multicenter, retrospective observational analysis of administrative databases. BMJ. 2013;346:f880.
139. Erickson KF, Japa S, Owens DK, et al. Cost-effectiveness of statins for primary cardiovascular prevention in chronic kidney disease. J Am Coll Cardiol. 2013;61(12):1250-8.
140. Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med. 2004;351(13):1296-305.
141. Palmer SC, Di Micco L, Razavian M, et al. Antiplatelet agents for chronic kidney disease. Cochrane Database Syst Rev 2013, Issue 4. Art. No.: CD008834.
142. Antithrombotic Trialists’ Collaboration: Collaborative meta-analysis of randomised trials for prevention of death, myocardial infarction, and stroke in high risk patients BMJ. 2002; 324(7329):71-86.
143. Holden RM, Harman GJ, Wang M, et al. Major bleeding in hemodialysis patients. Clin J Am Soc Nephrol. 2008;3(1):105-10.
144. MacLean S, Mulla S, Akl E, et al. Patient Values and Preferences in Decision Making for Antithrombotic Therapy: A Systematic Review: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(2):e1S-e23S.






