- En pacientes adultos, ¿cuáles son los factores de riesgo para desarrollar glaucoma de ángulo abierto?
- En personas con factores de riesgo de glaucoma, ¿qué prueba(s) de cribado se deben realizar, y con qué frecuencia, para diagnosticar precozmente el glaucoma de ángulo abierto?
- En personas con sospecha de glaucoma, ¿qué pruebas mínimas deberían realizarse para el diagnóstico y para clasificar el tipo de glaucoma?
Se identificaron cinco revisiones sistemáticas (RS) Hollands 201332, Edwards 200833, Burr 200715, Li 201134 y Marcus 201135 y un estudio de casos y controles, Topouzis 201136 que han evaluado los factores de riesgo para glaucoma de ángulo abierto en población general.
Hollands 2013 determinó los factores de riesgo para glaucoma primario de ángulo abierto que pueden ser detectados durante una visita realizada por el médico de atención primaria32. Esta revisión incluyó estudios de base poblacional identificando 50 referencias provenientes de 34 estudios diferentes.
El estudio Edwards 2008 evaluó la asociación causal entre fumar tabaco y glaucoma de ángulo abierto. Se incluyeron 11 estudios (9 casos y controles, 1 cohorte prospectiva y un análisis agrupado de dos cohortes prospectivas)33.
Burr 2007 evaluó los factores de riesgo de glaucoma de ángulo abierto identificados en estudios epidemiológicos. De las 4.383 referencias evaluadas, finalmente se incluyeron 28 estudios en el análisis15.
El estudio Li 2011 evaluó el efecto de la cafeína en la presión intraocular de individuos normales o pacientes con glaucoma o hipertensión ocular. La variable de resultado principal fue la presión intraocular medida entre las 0,5 y 1,5 horas posteriores a la ingesta de cafeína. Dado el poco impacto para los pacientes del desenlace evaluado este estudio fue descartado34.
La RS Marcus 2011 valoró la asociación entre miopía y glaucoma de ángulo abierto. Se incluyeron 13 estudios observacionales (11 estudios transversales, 1 caso y control, 1 estudio de cohorte)35.
Topouzis 2011 realizó el análisis de los factores de riesgo relacionados con el glaucoma de ángulo abierto en mayores de 60 años. En este estudio se incluyeron 135 sujetos con diagnóstico de glaucoma de ángulo abierto y 2.126 controles sin esta patología. Se evaluaron variables como la edad, la presión intraocular (PIO), la diabetes y su tratamiento, la presión sanguínea, el antecedente de bypass coronario o cirugía vascular o la miopía36.
1. Factores de riesgo demográficos
Edad
La RS de Holland 2013 evidenció que la edad estaba asociada a un incremento significativo del riesgo de glaucoma de ángulo abierto. A partir de los 60 años el riesgo de glaucoma de ángulo abierto aumenta (21 estudios observacionales; OR: 1,5; IC 95% de 1,3 a 1,7), siendo más acusado a partir de los 80 años (13 estudios observacionales; OR: 2,9; IC 95% de 1,9 a 4,3)32. En esta misma línea, la RS de Burr 2007 refiere que existe un aumento de la prevalencia de glaucoma de ángulo abierto con la edad, siendo de 0,3% a los 40 años (7 estudios observacionales; IC 95% de 0,1 a 0,5) y pasando a 3,3% a los 70 años (16 estudios observacioanles; IC95% de 2,5 a 4,0)15.
moderada
Sexo
Esta misma RS evaluó la relación entre el ser hombre y el riesgo de glaucoma de ángulo abierto no encontrando una asociación significativa (20 estudios observacionales; OR: 1,2; IC 95% de 0,97 a 1,4)32.
moderada
Raza
Una RS encontró un estudio transversal realizado en Estados Unidos que evaluó, en mayores de 40 años, la relación entre la raza y el glaucoma de ángulo abierto. El estudio evidenció un aumento del riesgo entre las personas de raza negra (afro-americanos) respecto a personas de raza blanca (1 estudio observacional, RR: 3,80; IC 95% de 2,56 a 5,64)15. La raza también aparece identificada como un factor de riesgo para el desarrollo de glaucoma de ángulo abierto en la RS de Holland 2013, basándose en los resultados del mismo estudio utilizado por Burr 2007.
alta
2. Factores de riesgo oculares
Presión intraocular
Una RS sistemática evaluó la prevalencia de glaucoma de ángulo abierto según la presencia de una presión intraocular mayor o menor a 21 mm Hg15. A través de los siete estudios identificados se observó de forma consistente que el riesgo de presentar un glaucoma de ángulo abierto con una PIO por encima de 21 mm Hg fue mayor que con una PIO menor o igual a 21 mm Hg. Tomando los resultados aportados por esta RS se calculó un estimador conjunto obteniéndose una OR de 30,65 (IC 95% de 13,22 a 71,05). En la misma línea, un estudio posterior realizado también en población caucásica evidenció una asociación entre el incremento de la PIO y el desarrollo de glaucoma de ángulo abierto (1 estudio observacional; OR: 1,19; IC 95% de 1,13 a 1,25 por cada 1 mm Hg de aumento)36.
moderada
Miopía
El estudio de Marcus 2011 mostró una asociación entre la miopía y el glaucoma de ángulo abierto (9 estudios observacionales, OR: 1,88 IC 95% de 1,60 a 2,20)35.
Esta asociación se presentó de forma incremental a medida que avanzaba la severidad de la patología, siendo menor para un grado bajo de miopía baja definido como el defecto refractivo de hasta -3 dioptrías (6 estudios observacionales; OR: 1,77; IC 95% de 1,41 a 2,23) y mayor, para un grado alto de miopía, definido como un defecto refractivo ≥-3 dioptrías (7 estudios observacionales; OR: 2,46; IC 95% de 1,93 a 3,15)35.
Estos hallazgos fueron consistentes con la RS de Holland 2013, que se basó en estudios includios en la revisión de Marcus 2011, pero presentando los resultados según diferentes grados de afectación (0,5; 1; 3,6 y 8 dioptrías). Esta RS evidenció un incremento del riesgo a medida que avanzaba el grado de miopía, resultando en un OR de 5,0 (IC95% de 2,2 a 11) para una miopía con una afectación mayor a 8 dioptrías32.
moderada
3. Factores de riesgo no oculares
Diabetes
La RS de Burr 2007 realiza una síntesis narrativa de estudios que evaluaban la asociación entre la diabetes y el glaucoma de ángulo abierto. Las OR presentadas en los estudios y ajustadas por edad, sexo +/- índice de masa corporal variaban entre 1,84 (IC 95% de 1,09 a 3,11) y 3,11 (IC 95% de 1,12 a 8,66)15. Esta RS mostró que las personas con diabetes tienen dos veces más riesgo de glaucoma de ángulo abierto que las personas sin diabetes (3 estudios observacionales; RR:2,08; IC 95% de 1,44 a 2,99)15. Estos resultados son consistentes con los presentados por Holland 2013 (6 estudios observacionales; OR: 1,8; IC95% de 1,4 a 2,4)32.
moderada
Antecedente familiar de glaucoma
El metanálisis realizado por Burr 2007 mostró que el antecedente familiar de glaucoma se asoció a tres veces más riesgo de desarrollo de glaucoma de ángulo abierto (3 estudios observacionales; RR: 3,14; IC 95% de 2,32 a 4,25)15. Holland 2013 halló resultados similares observandotambién una relación entre el antecedente familiar de glaucoma y su desarrollo (9 estudios observacionales; OR: 3,2; IC 95% de 2,0 a 5,2)32.
moderada
Hábito tabáquico
La RS de Holland 2013 no mostró una asociación entre el hábito de fumar y el gluacoma de ángulo abierto (3 estudios observacionales; OR: 1,1; IC 95% de 0,85 a 1,5)32.
La RS de Edwards 2008 realizó una síntesis narrativa de estudios observacionales que evaluaban la relación entre el hábito tabáquico y el glaucoma de ángulo abierto. Encontró once estudios (2 cohortes y 9 casos y controles), nueve de los cuales no evidenciaban una asociación positiva entre el fumar y el glaucoma de ángulo abierto. En los tres estudios restantes se evidenció una asociación positiva, con OR que variaban entre el 1,9 o el 10,8; esta última con un intervalo de confianza muy amplio (IC 95% de 1,9 a 63,0) dado el bajo número de casos incluidos (32 en total)33.
baja
Migraña
La RS de Holland 2013 evaluó la relación entre el antecedente de migraña y el riesgo de glaucoma de ángulo abiert, no encontrando una asociación significativa entre este antecedente y la enfermedad (3 estudios observacionales; OR: 0,99; IC 95% de 0,66 a 1,5)32.
baja
Antecedente de bypass de arteria coronaria o cirugía cardiovascular
El estudio Topouzis 2011 mostró una asociación entre el antecedente de bypass de arteria coronaria o cirugía cardiovascular y el glaucoma de ángulo abierto (1 estudio observacional; OR: 2,09 IC 95% de 1,16 3,77). Los resultados fueron ajustados según la edad, PIO, tensión arterial, diabetes y miopía36.
muy baja
De la evidencia a la recomendación
Calidad de la evidencia
La calidad global de la evidencia para los factores considerados es moderada. La evidencia disponible proviene de estudios observacionales con algunas limitaciones en el diseño.
Al no evaluarse intervenciones, no se realizó el balance de beneficios y riesgo, la evaluación de los valores y preferencias y el uso de recursos y costes.
Recomendaciones
| Fuerte | La presión intraocular elevada, la miopía, la raza negra, antecedentes familiares de glaucoma, la edad y la diabetes pueden considerarse los principales factores de riesgo para el glaucoma de ángulo abierto. |
Se identificaron dos revisiones sistemáticas para evaluar esta pregunta. La primera de ellas, una revisión Cochrane actualizada al 200937, evaluó el impacto del cribado de glaucoma en la prevalencia del daño del nervio óptico y la pérdida de campo visual, tanto en poblaciones previamente no evaluadas como en aquellas con sospecha de esta condición. Sin embargo, esta revisión sistemática (RS) no identificó ningún ensayo clínico aleatorizado que evaluara el impacto de la realización del cribado de glaucoma sobre los desenlace de interés. Los autores concluyen que en ausencia de ensayos clínicos de calidad no es posible recomendar el cribado de glaucoma poblacional37.
La segunda revisión sistemática evaluó la efectividad y los costes asociados a diferentes técnicas de cribado de glaucoma en personas mayores de 40 años. La revisión forma parte de un informe de evaluación de tecnologías realizado en el 200715. Esta RS incluyó 40 estudios publicados en 46 referencias. 20 estudios de base poblacional, 8 estudios de cohorte y 12 casos y controles que comparaban diferentes pruebas índice respecto a dos posibles patrones de referencia: GAA confirmado en el seguimiento del paciente o GAA diagnosticado por un oftalmólogo que requiriera tratamiento. Este diagnóstico podía basarse en la evaluación del campo visual y/o el nervio óptico, pero sin confirmación de seguimiento.
Finalmente, se identificó una publicación de un consenso desarrollado por 38 profesionales de la salud visual del Reino Unido utilizando la metodología Delphi. El objetivo fue seleccionar un conjunto de estrategias óptimas para el cribado de glaucoma en mayores de 50 años38.
1. Oftalmoscopia
Sensibilidad (verdaderos positivos y falsos negativos)
En la evaluación de la oftalmoscopia, Burr y cols. identificaron siete estudios que incluían un total de 7.279 pacientes. Cuatro de estos estudios fueron de carácter poblacional, dos de cohorte y un estudio de casos y controles15. La experiencia clínica del personal encargado de realizar/interpretar los resultados no fue descrita en cuatro de los siete estudios. En los otros tres, el personal (oftalmólogo, enfermera y médicos capacitados) tenía experiencia en la realización/interpretación de las pruebas. Los autores analizaron los resultados conjuntos de cinco estudios con un punto de corte común, encontrando un valor de sensibilidad combinada del 60% (IC 95% del 34% al 82%). El único estudio sin limitaciones en el diseño y ejecución mostró unos resultados de sensibilidad del 47% (IC 95% del 24% al 71%)15.
muy baja
Especifidad (verdaderos positivos y falsos negativos)
Respecto a la capacidad de clasificar a las personas sin glaucoma, los autores de la revisión encontraron que la especificidad combinada para la oftalmoscopia fue del 94% (IC 95% del 76 al 99)15. El único estudio sin limitaciones en diseño y ejecución reportó una especificidad del 98% (IC 95% del 95 al 99).
El Odds Ratio Diagnóstico (DOR) fue de 26 (IC 95% 6 a 110). Esto significa que es mucho más probable (26 veces) encontrar alteraciones durante el examen oftalmoscópico en personas con glaucoma que en personas sanas15.
muy baja
2. Fotografía del disco óptico
Sensibilidad (verdaderos positivos y falsos negativos)
En la evaluación de la fotografía del disco óptico, la revisión de Burr y colaboradores identificó seis estudios con 7.800 participantes, dos de ellos de base poblacional, una cohorte y tres estudios de casos y controles15. La experiencia clínica del personal encargado de realizar/interpretar los resultados no fue descrita en dos de los seis estudios. Los otros estudios incorporaban técnicos con experiencia, residentes de oftalmología de tercer año o especialistas. El análisis de los resultados de dichos estudios muestra un valor conjunto para la sensibilidad del 73% (IC 95% de 61 a 83), siendo esta cifra similar cuando solo se toma la información de tres estudios sin limitaciones en su diseño y ejecución15.
baja
Especifidad (verdaderos negativos y falsos positivos)
En relación con la capacidad de clasificar correctamente a la población sin glaucom, los autores de la revisión encontraron una especificidad agrupada de 89% (IC 95% del 50% al 99%)15.
El Odds Ratio Diagnóstico (DOR) fue de 22 (IC 95% de 3 a 148). Esto significa que es mucho más probable (22 veces) encontrar alteraciones durante el examen fotográfico del disco óptico en personas con glaucoma que en personas sanas15.
muy baja
3. Valoración de la capa de fibras nerviosas mediante fotografía
Sensibilidad (verdaderos positivos y falsos negativos)
En la evaluación de valoración de la capa de fibras nerviosas de la retina mediante fotografía se identificaron cuatro estudios con 700 participantes, tres de ellos casos y controles y uno de base poblacional. La RS no especifica la experiencia del personal encargado de realizar/interpretar los resultados. La sensibilidad agrupada fue del 75% (IC 95% de 46 a 92)15.
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Respecto a la capacidad de la prueba de clasificar correctamente a los pacientes sin enfermedad, la especificidad agrupada fue del 88% (IC 95% de 53% a 98%)15.
El Odds Ratio Diagnóstico (DOR) fue de 23 (IC 95% de 4 a 124). Esto significa que es mucho más probable (23 veces) encontrar alteraciones en las fibras nerviosas durante el examen fotográfico en personas con glaucoma que en personas sanas15.
muy baja
4. Tomografía retinal de Heidelberg II
Sensibilidad (verdaderos positivos y falsos negativos)
En relación a la Tomografía retinal de Heidelberg II (HRT II), Burr y cols. identificaron tres estudios con 1.073 participantes en total, dos con base poblacional y un estudio de casos y controles15. Ninguno de los estudios se evaluó respecto a una prueba de referencia adecuada. La sensibilidad agrupada del 86% (IC 95% de 55% a 97%)15.
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Asimismo, los autores de la revisión reportaron una especificidad agrupada del 89% (IC 95% de 66% a 98%)15.
El Odds Ratio Diagnóstico (DOR) fue de 51 (IC 95% de 11 a 246). Esto significa que es mucho más probable (51 veces) encontrar alteraciones durante la realización de la tomografía retinal en personas con glaucoma que en personas sanas15.
muy baja
5. Perimetrías
5.1. Perimetría de duplicación de frecuencia (FDT)
5.1.1. Perimetría de duplación de frecuencia C-201-1
Sensibilidad (verdaderos positivos y falsos negativos)
Respecto a la perimetría de duplicación de frecuencia (FDT) C-201-1, Burr y cols. identificaron tres estudios con 575 participantes, con dos estudios de casos y controles y uno de base poblacional15. Ninguno de los estudios realizó un seguimiento adecuado para verificar el diagnóstico. La sensibilidad combinada fue del 92% (IC 95% de 65 a 99)15.
muy baja
Especifidad (verdaderos negativos y falsos positivos)
La revisión de Burr y cols. mostró una especificidad conjunta de 94% (IC 95% de 73 a 99%), aunque los resultados fueron muy variables15.
El Odds Ratio Diagnóstico (DOR) fue de 181 (IC 95% de 25 a 2139). Esto significa que es mucho más probable (181 veces) encontrar alteraciones perimétricas con esta exploración en personas con glaucoma que en personas sanas15.
muy baja
5.1.2. Perimetría de duplación de frecuencia C-20-5
Sensibilidad (verdaderos positivos y falsos negativos)
En la evaluación de la perimetría de duplicación de frecuencia (FDT) C-20-5 se identificaron cinco estudios con 2.956 participantes, incluyendo tres estudios de base poblacional y dos casos y controles15. Solo dos de los estudios contaban con un espectro adecuado de pacientes y ninguno referenciaba claramente un seguimiento para confirmar el diagnóstico. La revisión mostró una sensibilidad combinada de 78% (IC 95% de 19 a 99)15.
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Asimismo, los autores de la revisión estimaron una especificidad agrupada del 75% (IC 95% de 57 a 87)15.
El Odds Ratio Diagnóstico (DOR) fue de 10 (IC 95% de 0.7 a 249). Esto significa que es mucho más probable (10 veces) encontrar alteraciones perimétricas con esta exploración en personas con glaucoma que en personas sanas15.
muy baja
5.2. Perimetría oculocinética
Sensibilidad (verdaderos positivos y falsos negativos)
En la evaluación de las características operativas de la perimetría oculocinética (OKP) Burr y cols. encontraron cuatro estudios que incluían 768 participantes, dos de ellos de base poblacional y los restantes casos y controles. Solo uno de ellos sin limitaciones metodológicas relevantes. La sensibilidad agrupada fue del 86% (IC 95% de 29% a 100%). En el estudio sin limitaciones medológicas la sensibilidad fue del 95% (IC 95% de 74 a 100)15.
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Asimismo, Burr y cols. estimaron la especificidad conjunta en 90% (IC 95% de 79 a 96). En el estudio sin limitaciones metodológicas la especificidad fue del 78% (IC 95% de 70 a 84)15.
El Odds Ratio Diagnóstico (DOR) fue de 58 (IC 95% de 4 a 1585). Esto significa que es mucho más probable (58 veces) encontrar alteraciones perimétricas con esta exploración en personas con glaucoma que en personas sanas15.
muy baja
5.3. Perimetría automatizada convencional (SAP)
5.3.1. Perimetría automatizada convencional supra umbral
Sensibilidad (verdaderos positivos y falsos negativos)
En relación a la perimetría automatizada convencional (SAP) supra umbral, los autores de la revisión identificaron nueve estudios con un total de 10.200 participantes, de los cuales seis eran de base poblacional, una cohorte y dos estudios de casos y controles. En la mayoría de los estudios se identificaron limitaciones en el diseño y ejecución. La sensibilidad agrupada fue del 71% (IC 95% de 51% a 86%)15.
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Respecto a la especificidad del SAP supra umbral, Burr y colaboradores estimaron una especificidad agrupada del 85% (IC 95% de 73% a 93%)15.
El Odds Ratio Diagnóstico (DOR) fue de 14 (IC 95% de 6 a 34). Esto significa que es mucho más probable (14 veces) encontrar alteraciones perimétricas con esta exploración en personas con glaucoma que en personas sanas15.
muy baja
5.3.2. Perimetría automatizada convencional umbral
Sensibilidad (verdaderos positivos y falsos negativos)
En relación a la perimetría automatizada convencional (SAP) umbral, Burr y cols. identificaron cinco estudios con 1. 457 participantes, siendo dos estudios de base poblacional, dos casos y controles y una cohorte15. En la mayoría de los estudios se identificaron limitaciones en el diseño y ejecución. La sensibilidad agrupada fue del 88% (IC 95% de 65% a 97%).
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Burr y cols. estiman la especificidad agrupada en 80% (IC 95% de 55% a 93%)15.
El Odds Ratio Diagnóstico (DOR) fue de 30 (IC 95% de 6 a 159). Esto significa que es mucho más probable (30 veces) encontrar alteraciones perimétricas con esta exploración en personas con glaucoma que en personas sanas15.
muy baja
6. Tomómetro de aplanación Goldmann
Sensibilidad (verdaderos positivos y falsos negativos)
En la evaluación del tonómetro de aplanación de Goldmann (TAG), Burr y cols. identificaron nueve estudios con 20.308 participantes, entre los cuales siete fueron de base poblacional, y los restantes estudios fueron cohortes15. En la mayoría de los estudios se identificaron limitaciones en el diseño y ejecución. La sensibilidad agrupada fue del 46% (IC 95% de 22% a 71%).
muy baja
Especifidad (verdaderos negativos y falsos positivos)
Asimismo, los autores de la revisión reportaron una sensibilidad agrupada del 95% (IC 95% de 89% a 97%)15.
El Odds Ratio Diagnóstico (DOR) fue de 15 (IC 95% de 4 a 49). Esto significa que es mucho más probable (15 veces) encontrar alteraciones de la presión intraocular con la tonometría en personas con glaucoma que en personas sanas15.
muy baja
7. Resultados del consenso de expertos
Se encontró un estudio que identificó un conjunto de pruebas potencialmente útiles para el cribado de glaucoma en la población general. La selección de las pruebas surgió del acuerdo entre un conjunto de expertos a través de la metodología Delphi38. Participaron un total de 38 profesionales de la salud (oftalmólogos, optometristas y6 personal de enfermería especializados en salud visual y el manejo de pacientes con glaucoma) así como pacientes, todos ellos del Reino Unido. Después de dos rondas de consenso, las intervenciones consideradas fueron:
- Tonometría de no contacto (TNC) + SAP (multiple stimuli) + HRT realizadas por un técnico/optometrista en la consulta de optometría.
- Tonómetro ICare® + FDT + Fotografía del disco óptico: realizadas por un técnico en la consulta de optometría.
- Tonometría (ICare® o Tono-pen o TNC) + FDT realizadas por un técnico en centros de cribado visual.
- TAG + SAP + fotografía del disco óptico realizadas por un técnico en centros de cribado visual.
- Tonometría + imágenes reproducibles rápidamente o prueba de función visual: realizadas por un técnico en centros de cribado visual y en población con resultados de riesgo (risk scores).
- TNC+ FDT + HRT o Polarimetría con láser de barrido (GDx) realizadas por un técnico.
Los autores del consenso proponen que este listado debe ser la base de futuros estudios que evalúen los potenciales beneficios y daños asociados de diferentes programas de cribado, así como estudios de implementabilidad y de coste- efectividad38.
8. Otras técnicas
Existen otras técnicas, como la tomografía de coherencia óptica (OCT), Polarimetría láser de barrido (GDx), Polarimetría láser de barrido con compensación corneal variable (GDx-VCC), analizador de grosor retiniano (RTA), campimetría automática de longitud de onda corta (SWAP), perimetría pulsar (PULSAR), umbrales de detección de movimiento (MDP) y Tonopen, que fueron excluidas de la revisión hecha para esta GPC, debido a que únicamente se encontraron estudios que no cumplieron con los criterios de inclusión establecidos. Se trataba de estudios de tamaño pequeño (<100 pacientes y/o con diseños no poblacionales)39-43.
Valores y preferencias de los pacientes
No se localizaron estudios que evaluaran los valores y preferencias de los pacientes en relación a las pruebas de cribado incluidas15.
Uso de recursos y costes
El informe de evaluación de tecnologías de Burr et al. 2007 realizó una revisión de estudios de coste-efectividad del cribado de glaucoma en población adulta15. Se incluyeron cuatro estudios con características similares en población ≥40 años y que utilizaron la oftalmoscopia, la tonometría o la evaluación del campo visual. El estudio más reciente identificado fue llevado a cabo en el año 1997 y solo uno de ellos comparaba la estrategia de cribado de glaucoma respecto a la práctica habitual. Estos estudios fueron descartados dada la limitada aplicabilidad de sus resultados (utilización actual de nuevos fármacos para el tratamiento, nuevas pruebas diagnósticas, etc).
Un análisis de coste efectividad (ACE) y coste utilidad (ACU) realizado en Finlandia comparaba un programa de cribado de glaucoma realizado en atención primaria cada cinco años respecto a la práctica habitual (despistaje oportunista de casos)44. Las pruebas realizadas en el programa de cribado incluían la toma de la PIO, la evaluación del fondo de ojo, de la refracción y la evaluación del campo visual, así como una confirmación del diagnóstico en los casos positivos en una población entre 50 y 79 años de edad.
En el caso del fondo de ojo se evaluaron dos tipos de pruebas, la retinografia (fotografía) de campo amplio «libre de rojos» y la tomografía de retina Heidelberg. En el caso de la perimetría, se evaluó con Humphrey SITA-Fast y FDT. Una vez hecho el diagnóstico los pacientes recibieron tratamiento y se les realizó un seguimiento con tonometría dos veces al año y perimetría automática e imágenes una vez al año. La práctica habitual consistió en la evaluación del campo visual e imágenes fotográficas realizadas en el sector privado y reembolsadas por la seguridad social.
La perspectiva utilizada fue la del sistema de salud y el horizonte temporal fue 20 años de media (entre 10 y 40 años). Se utilizaron dos medidas de efectividad: para el ACE la medida de beneficio fueron los años de discapacidad visual prevenidos por el cribado y para el ACU, los años de vida ajustados por calidad de vida (QALY). Se incluyeron los costes directos (año 2003, euros) del sistema de salud y costes no médicos entre los cuales estaban los costes de personal, equipamiento, instalaciones, viajes y servicios sociales asociados a la discapacidad visual.
Para el ACE, el ratio de coste-efectividad incremental (ICER) de un año de discapacidad visual prevenido por el cribado fue de 32.602 €, comparado con la práctica habitual. Para el ACU, el coste de un QALY ganado por el cribado fue de 9.024 € respecto a la práctica habitual. Durante el horizonte temporal medio de 20 años, el coste incremental acumulado del programa de cribado en una población de 1 millón de habitantes sería de 30 millones de euros, produciendo un aumento de 3.360 QALYS y 930 años de discapacidad visual prevenida en 701 personas.
Los autores reportaron que el coste variaba desde 52.517 € por QALY ganado en la cohorte de pacientes más jóvenes a presentarse en una fuerte dominancia del programa de cribado en las cohortes de pacientes de mayor edad (≥75 años).
El análisis de sensibilidad del modelo mostró que los resultados eran especialmente sensibles a la especificidad de las pruebas de cribado (96-99% de especificidad requerida) y al coste del programa de cribado.
Se identificó otro estudio cuyo objetivo era evaluar el coste-efectividad de dos estrategias de cribado de glaucoma de ángulo abierto respecto a la práctica habitual en atención primaria y en hombres de 40, 60 y 75 años de edad del Reino Unido (RU)45. La primera estrategia era una evaluación de la PIO, el nervio óptico y el campo visual realizada por un optometrista entrenado. La segunda estrategia consistía en realizar una prueba, llevada a cabo por un técnico, en la cual se valoraba la pérdida del campo visual o el daño estructural del nervio óptico de forma automática, junto con la valoración de la PIO. Aquellos identificados como «de riesgo» eran remitidos a una valoración completa realizada por un optometrista. La práctica habitual consistía en la identificación oportunista de casos por un optometrista como parte de una evaluación rutinaria.
La perspectiva utilizada fue la del sistema nacional de salud del RU y el horizonte temporal, a vida. Se utilizaron los QUALY como medida de beneficio. El análisis de costes (año 2006, libras esterlinas) incluyó los costes de diagnosticar y tratar el glaucoma, los costes anuales de la discapacidad visual y el coste de las invitaciones al programa de cribado.
En la cohorte de pacientes de 40 años la estrategia de cribado realizada por el técnico, comparada con la práctica habitual, tuvo un ICER de 29.051 £ para una prevalencia de glaucoma del 6% y de 20.527 £ para una prevalencia de glaucoma del 10%. Sin embargo, para prevalencias menores al 6% o para las otras cohortes de edad el ICER fue superior a 30.000 £. Los autores concluyen que es improbable que el cribado poblacional de glaucoma de ángulo abierto sea coste-efectivo dadas las bajas prevalencias en las cohortes jóvenes (0,9% a los 50 años). Refieren que el cribado podría ser coste-efectivo si es dirigido a subgrupos específicos con factores de riesgo, por ejemplo grupos entre 40 y 50 años, población negra o con antecedentes familiares de glaucoma. En estos grupos de riesgo pueden llegar a presentar prevalencias de entre 3-4% y el cribado podría ser realizado a 10 años de intervalo.
Un tercer estudio llevado a cabo en Holanda realizó un ACE de tres estrategias de detección temprana y tratamiento de la hipertensión ocular y glaucoma de ángulo abierto en estadio temprano, realizadas por la consulta oftalmológica46. A todos los pacientes (≥40 años) se les realizaba una oftalmoscopia. La primera estrategia consistía en la realización de una tonometría de forma rutinaria (TAG); en la segunda estrategia la tonometría se realizaba solo a los pacientes de riesgo (historia familiar de glaucoma) y, en la tercera estrategia, no se realizaba tonometría. Se adoptó una perspectiva social con un horizonte temporal a 20 años. Se usaron dos medidas de beneficio: la proporción de pacientes que perdían totalmente la visión, y los años de ceguera. El análisis incluyó los costes (año no especificado, euros) de las visitas de los pacientes, la perimetría, la terapia con láser, la cirugía, la monoterapia, la terapia combinada y el transporte. Los costes debidos a la pérdida total de la visión o al uso de ayudas a la discapacidad no fueron incluidos.
En comparación con la no realización de tonometría, el coste incremental de prevenir la pérdida total de la visión de una persona fue de 7.778 € con la estrategia uno (realizar a todos tonometría) y de 20.000 euros con la estrategia dos (tonometría selectiva). El coste incremental por año de visión salvada fue de 1.707 € con la estrategia uno y de 4.444 € con la estrategia dos. El modelo fue especialmente sensible a la incidencia de glaucoma entre los pacientes no diagnosticados de hipertensión ocular. Los autores concluyeron que la realización de la tonometría de forma rutinaria era la estrategia preferida para la prevención de la ceguera debida a glaucoma.
De la evidencia a la recomendación
Calidad de la evidencia
La calidad global de la evidencia es muy baja.
Los principales factores que determinaron la calidad de la evidencia fueron el riesgo de sesgo asociado a los tipos de estudios encontrados (solo estudios observacionales) y la evaluación indirecta de los desenlaces importantes para los pacientes a través de los resultados de rendimiento de las pruebas evaluadas, que fueron imprecisos.
Valores y preferencias de los pacientes
El grupo de trabajo consideró que la mayor parte de las personas valoran positivamente una identificación temprana de la enfermedad y preferirían pruebas menos invasivas.
Beneficios y riesgos/carga de las pruebas de cribado
La tabla 1 muestra los valores absolutos por 1.000 personas sometidas a cribado en dos escenarios de prevalencia de glaucoma: uno de baja prevalencia (1,4% en personas de más de 60 años) y un escenario de alta prevalencia (6,7% en personas con antecedente familiar de glaucoma).
Tabla 1. Resumen de valores predictivos positivos y negativos de las pruebas de cribado
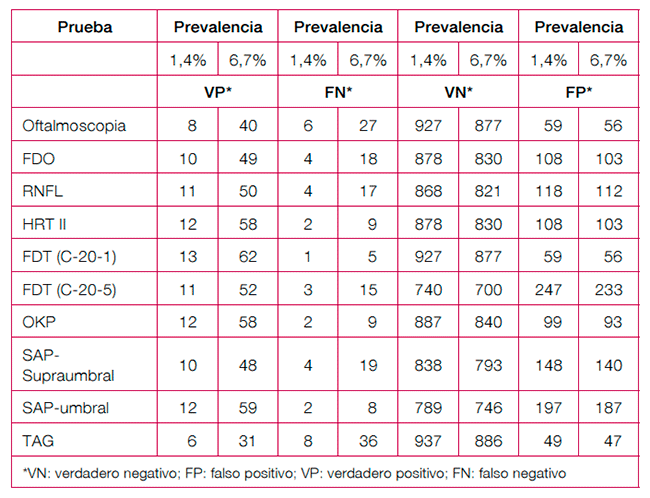
Los VN por cada 1.000 personas cribadas de más de 60 años (prevalencia 1,4%) variaron de 740 a 937 y en el escenario de mayor prevalencia estos valores fueron inferiores, aunque no de forma muy acusada (entre 700-886 por 1.000). Las pruebas con mayor capacidad para descartar la enfermedad fueron la oftalmoscopia, la FDT C-20-1 o el TAG. De estas tres pruebas en el escenario de baja prevalencia, la que mostró menos falsos negativos por cada 1.000 personas cribadas fue la FDT C-20-1 (1 caso) y tanto en la oftalmoscopia como en la GTP, los FN fueron de 6 y 8 respectivamente. En el caso de alta prevalencia, los falsos negativos por cada 1.000 personas cribadas fue la FDT C-20-1 (5 casos) y tanto en la oftalmoscopia como en la GTP, los FN fueron de 27 y 36, respectivamente.
Balance beneficio-riesgo
Se considera que un cribado poblacional de glaucoma debería incluir pruebas con un adecuado rendimiento diagnóstico, con un coste razonable y de fácil aplicación en un entorno de atención primaria.
En una patología como el glaucoma de ángulo abierto, de evolución relativamente lenta y no letal, existe la posibilidad de que se puedan realizar varios ciclos de cribado a lo largo de la vida y que se puedan detectar casos no descubiertos en ciclos de cribado previos. Por tanto, para la elección de las pruebas de cribado se consideraría más importante su especificidad, que descarte los casos sin patología (verdaderos negativos [VN]) y pocos falsos positivos (FP), que se excluirían de la confirmación del diagnóstico posterior.
Uso de recursos y costes
En los estudios económicos encontrados, en su mayoría las pruebas de cribado evaluadas consistían en la determinación de la PIO, y la evaluación del fondo de ojo y del campo visual. Los programas de cribado que incluyen estas pruebas pueden ser coste-efectivos en poblaciones seleccionadas con riesgo de glaucoma (ej. edad, antecedentes familiares de glaucoma o raza negra). Sin embargo, los costes varían según el programa de cribado (pruebas incluidas, personal que lo realiza, tiempo…), la prevalencia de la enfermedad, los costes generados por la pérdida la visión, entre otros.
Aplicabilidad/equidad/aceptabilidad/factibilidad
Aunque no existe evidencia sólida sobre su coste, aplicabilidad y factibilidad, los estudios disponibles sugieren que la realización del cribado dirigido a población de riesgo de sufrir glaucoma puede ser coste-efectivo24.
De todas las pruebas mencionadas, las más fácilmente aplicables en el ámbito de la atención primaria a través de profesionales sanitarios (médicos, enfermería) u ópticos-optometristas, son las medidas de la agudeza visual (necesaria para conocer el estado de la visión, aunque aporte poco al diagnóstico de glaucoma), la medida de la presión intraocular, el campo visual y la evaluación de la estructura del nervio óptico (papila y capa de fibras nerviosas) mediante fotografías en color del fondo de ojo. Dichas pruebas están disponibles en muchos centros de atención de primaria y, dado que son inocuas y cortas, suelen aceptarlas tanto los pacientes como los profesionales sanitarios. En la medida de la presión intraocular, se debe tener en cuenta la influencia que puede tener el estado de la córnea en su estimación, pudiendo requerirse la asociación de otras pruebas para corregir las estimaciones de la presión intraocular obtenidas en el momento del diagnóstico.
A todas las personas con riesgo de sufrir glaucoma deberían preguntarles si tienen antecedentes familiares o personales de la enfermedad, a todas debería medírsele la presión intraocular (en lo posible, realizar varias mediciones) y a todas debería examinárseles el fondo del ojo. Es preferible que se registre en forma de fotografía para que puedan evaluarla expertos y para que, en un futuro, pueda ser comparada con próximas exploraciones.
Las pruebas funcionales (campo visual) son imprescindibles para el diagnóstico y seguimiento del glaucoma pero probablemente poco adecuadas para el cribado, ya que requieren más tiempo en su realización y, con frecuencia, es necesario repetir la prueba varias veces antes de obtener un resultado fiable (efecto aprendizaje).
El cribado debería repetirse de forma periódica. La evidencia es variable y la frecuencia sugerida es de entre 2 y 10 años. La Academia Americana de Oftalmología (AAO) recomienda realizarse un examen ocular completo por un oftalmólogo/optometrista experto en evaluación del nervio óptico. En pacientes entre 40 y 60 años, debe hacerse cada 3-5 años, y cada 1-2 años si existen otros factores de riesgo, o después de los 60 años.
Cabe destacar el papel de los médicos de atención primaria, de enfermería y de los óptico-optometristas en la detección de los factores de riesgo mencionados para derivar oportunamente a oftalmología aquellos con hipertensión ocular y papilas sospechosas. En casos diagnosticados, hay que vigilar la adherencia al tratamiento y detectar los posibles efectos adversos e interacciones (anexo 3).
Recomendaciones
| Débil | Se sugiere realizar cribado de glaucoma en pacientes con factores de riesgo de desarrollo de la enfermedad. |
| Débil | Se sugiere realizar el cribado con tonometría y asociarlo a una prueba funcional corta y/o una prueba de imagen. |
| Débil | Se sugiere que el cribado sea realizado por profesionales sanitarios específicamente entrenados (médicos de atención primaria, profesionales de enfermería, ópticos-optometristas), pero sus resultados deben ser supervisados por un especialista en oftalmología. |
Se identificó una RS que evaluó la precisión de diferentes pruebas para el diagnóstico de glaucoma de ángulo abierto47, así como otra RS que evaluó la correlación y la información adicional que proporcionaban distintas pruebas de imágenes respecto a la gonioscopia en la evaluación del segmento anterior48. Estas revisiones no identificaron estudios de rendimiento diagnóstico para la mayoría de pruebas, por eso el grupo elaborador decidió abordar este apartado de forma narrativa. Las RS descritas sirvieron de apoyo al grupo elaborador de la GPC para la elección de pruebas consideradas como mínimas o imprescindibles, así como para la identificación de otras pruebas consideradas como útiles o convenientes y, finalmente, pruebas de utilidad limitada. Las recomendaciones también se apoyaron en la guía de terminología y pautas para el glaucoma de la Sociedad Europea de Glaucoma3 y algunas otras referencias bibliográficas de interés.
Ninguna prueba diagnóstica aislada o asociada a otras es suficientemente precisa por sí misma y deben ser adecuadamente interpretadas por un oftalmólogo para reducir al máximo los falsos positivos y negativos.
1. Pruebas mínimas
- Anamnesis sobre historia familiar relacionada con el glaucoma, antecedentes médicos generales (ej. tratamiento farmacológico con corticoides) y, particularmente, sobre la historia de patología y tratamientos oftalmológicos previos y actuales, cumplimiento de tratamientos farmacológicos y tolerancia, cirugías oculares, copias de pruebas realizadas anteriormente, etc.
- Tonometría. Aunque otros tipos de tonometría (aire, aplanación portátil…) son muy útiles para la detección o el seguimiento se recomienda utilizar tonometría de aplanación tipo Goldmann en el momento del diagnóstico47. Es conveniente obtener distintas medidas y, si fuera posible, a distintas horas del día. Además, se debe tener presente la influencia del estado corneal en su medición y realizar los ajustes necesarios.
- Examen estereoscópico en lámpara de hendidura del fondo de ojo (papila y capa de fibras) mediante lámpara de hendidura y una lente directa o indirecta y en condiciones de midriasis farmacológica3, 47).
- Gonioscopia. La evaluación de la configuración del ángulo de la cámara anterior y su profundidad mediante gonioscopia debe ser realizada en todos los casos de sospecha de glaucoma. Solo en aquellos casos en los que resulte imposible realizarla debe sustituirse por la estimación de la profundidad de la cámara periférica mediante la técnica de Van Herick47, dado que su precisión es muy baja.
- Campo visual con perimetría estándar (blanco sobre blanco)3, 47. Hay que conseguir dos campos visuales fiables y con resultados similares en unos dos meses. Se debe repetir hasta obtener el mejor resultado en casos de aprendizaje. Tienen que obtenerse seis campos visuales en los primeros dos años para calcular la tendencia y tasa de progresión3. Cuando una persona no sea capaz de realizar la perimetría estándar de forma fiable, se realizarán otros tipos de perimetrías3.
- La agudeza visual aporta poco al diagnóstico de glaucoma, dado que solo se afecta en casos muy avanzados de la enfermedad, pero debe ser parte de toda exploración oftalmológica.
2. Pruebas muy útiles y convenientes
- Imágenes de la papila:
- Retinografías. Una fotografía centrada, enfocada y de calidad es muy útil para el diagnóstico, y aun más, para el seguimiento de la enfermedad. Para la papila se recomienda fotografía en color, si es posible estereoscópica, y con el mayor aumento posible (15-35°). Para la capa de fibras se recomienda un campo más amplio que incluya las arcadas vasculares (45-50°) y realizada en color y blanco y negro, mediante filtro azul (anexo 2).
- Imágenes digitales con OCT, HRT o GDx. Dos imágenes de buena calidad (cada instrumento tiene sus estándares de calidad) y resultados similares en las dos. Deben considerarse un complemento a la exploración clínica del fondo de ojo49.
- Paquimetría. Se recomienda su realización en todos los casos de sospecha de glaucoma47 y realizar la media de múltiples medidas (ej. 10) en el centro de la córnea. Existen diversos instrumentos que realizan la media automáticamente. Hay que tener en cuenta, además, los ajustes necesarios que hay que realizar en caso, por ejemplo, de antecedentes de cirugía refractiva.
3. Pruebas de utilidad limitada
- Campo visual con tres tipos de perimetría. Se utilizan en casos muy concretos como campañas de detección (FDT, OKP, MDT…), en casos de imposibilidad para obtener campos estándar fiables (FDT) o para conocer con mayor detalle el grado de daño funcional (cualquiera de ellos).
- Imágenes ultrasónicas del ángulo de la cámara anterior.
Recomendaciones
| Buena práctica clínica | Una anamnesis completa, la tonometría, el exámen estereoscópico en lámpara de hendidura del fondo de ojo, la gonioscopia y la evaluación del campo visual pueden considerarse las pruebas mínimas para el diagnóstico del paciente y con sospecha de glaucoma de ángulo abierto. |
Bibliografía 4. Factores de riesgo, despistaje y pruebas mínimas para el diagnóstico del glaucoma de ángulo abierto
(47) National Institute for Health and Care Excellence-National Collaborating Centre for Acute Care. Glaucoma: Diagnosis and management of chronic open angle glaucoma and ocular hypertension 2009 [citado el 25/02/2015]. Disponible en: http://publications.nice.org.uk/glaucoma-cg85.
(48) Smith SD, Singh K, Lin SC, Chen PP, Chen TC, Francis BA, et al. Evaluation of the Anterior Chamber Angle in Glaucoma: A Report by the American Academy of Ophthalmology. Ophthalmology. 2013;120:1985-97.
(49) Reus NJ LH, Garway-Heath DF, Airaksinen PJ, Anton A, Bron AM, Faschinger C, Holló G, Iester M, Jonas JB, Mistlberger A, Topouzis F, Zeyen TG. Clinical assessment of stereoscopic optic disc photographs for glaucoma: the European Optic Disc Assessment Trial. Ophthalmology. 2010(4):717-23.
(50) Chander A, Kapoor H, Thomas S. Comparison of the efficacy and safety of bimatoprost (0.03 %) and travoprost (0.004 %) in patients with primary open angle glaucoma. Nepal J Ophthalmol. 2013;5(9):75-80.
(51) Eyawo O, Nachega J, Lefebvre P, Meyer D, Rachlis B, Lee CW, et al. Efficacy and safety of prostaglandin analogues in patients with predominantly primary open-angle glaucoma or ocular hypertension: a meta-analysis. Clin Ophthalmol. 2009;3:447-56.
(52) Hodge WG, Lachaine J, Steffensen I, Murray C, Barnes D, Foerster V, et al. The efficacy and harm of prostaglandin analogues for IOP reduction in glaucoma patients compared to dorzolamide and brimonidine: a systematic review. Br J Ophthalmol. 2008;92(1):7-12.
(53) Krupin T, Liebmann JM, Greenfield DS, Ritch R, Gardiner S. A randomized trial of brimonidine versus timolol in preserving visual function: results from the Low-Pressure Glaucoma Treatment Study. Am J Ophthalmol. 2011;151(4):671-81.
(54) Loon SC, Liew G, Fung A, Reid SE, Craig JC. Meta-analysis of randomized controlled trials comparing timolol with brimonidine in the treatment of glaucoma. Clin Experiment Ophthalmol. 2008;36(3):281-9.
(55) Vass C, Hirn C, Sycha T, Findl O, Bauer P, Schmetterer L. Medical interventions for primary open angle glaucoma and ocular hypertension. Cochrane Database Syst Rev. 2007(4):CD003167.
(56) Burr JM, Kilonzo M, Vale L, Ryan M. Developing a preference-based Glaucoma Utility Index using a discrete choice experiment. Optom Vis Sci. 2007;84(8):797-808.
(57) Mangham LJ, Hanson K, McPake B. How to do (or not to do) ... Designing a discrete choice experiment for application in a low-income country. Health Policy Plan. 2009;24(2):151-8.
(58) Aptel F, Cucherat M, Denis P. Efficacy and tolerability of prostaglandin analogs: a meta-analysis of randomized controlled clinical trials. J Glaucoma. 2008;17(8):667-73.
(59) Honrubia F, Garcia-Sanchez J, Polo V, de la Casa JM, Soto J. Conjunctival hyperaemia with the use of latanoprost versus other prostaglandin analogues in patients with ocular hypertension or glaucoma: a meta-analysis of randomised clinical trials. Br J Ophthalmol. 2009;93(3):316-21.
(60) Yildirim N, Sahin A, Gultekin S. The effect of latanoprost, bimatoprost, and travoprost on circadian variation of intraocular pressure in patients with open-angle glaucoma. J Glaucoma. 2008;17(1):36-9.
(61) Birt CM, Buys YM, Ahmed, II, Trope GE. Prostaglandin efficacy and safety study undertaken by race (the PRESSURE study). J Glaucoma. 2010 Sep:460-7.
(62) Mizoguchi T, Ozaki M, Unoki K, Dake Y, Eto T, Arai M. A randomized crossover study comparing tafluprost 0.0015% with travoprost 0.004% in patients with normaltension glaucoma [corrected]. Clin Ophthalmol. 2012;6:1579-84.
(63) Sawada A, Yamamoto T, Takatsuka N. Randomized crossover study of latanoprost and travoprost in eyes with open-angle glaucoma. Graefes Arch Clin Exp Ophthalmol. 2012;250(1):123-9.
(64) Cox JA, Mollan SP, Bankart J, Robinson R. Efficacy of antiglaucoma fixed combination therapy versus unfixed components in reducing intraocular pressure: a systematic review. Br J Ophthalmol. 2008;92(6):729-34.
(65) Quaranta L, Biagioli E, Riva I, Rulli E, Poli D, Katsanos A, et al. Prostaglandin analogs and timolol-fixed versus unfixed combinations or monotherapy for open-angle glaucoma: a systematic review and meta-analysis. J Ocul Pharmacol Ther. 2013;29(4):382-9.
(66) Webers CA, Beckers HJ, Zeegers MP, Nuijts RM, Hendrikse F, Schouten JS. The intraocular pressure-lowering effect of prostaglandin analogs combined with topical beta-blocker therapy: a systematic review and meta-analysis. Ophthalmology. 2010;117(11):2067-74 e1-6.
(67) Hommer A, Wickstrom J, Friis MM, Steeds C, Thygesen J, Ferreras A, et al. A costeffectiveness analysis of fixed-combination therapies in patients with open-angle glaucoma: a European perspective. Curr Med Res Opin. 2008;24(4):1057-63.
(68) Lewis RA, Katz GJ, Weiss MJ, Landry TA, Dickerson JE, James JE, et al. Travoprost 0.004% with and without benzalkonium chloride: a comparison of safety and efficacy. Journal of Glaucoma. 2007(1):98-103.
(69) Shedden A, Adamsons IA, Getson AJ, Laurence JK, Lines CR, Hewitt DJ, et al. Comparison of the efficacy and tolerability of preservative-free and preservative-containing formulations of the dorzolamide/timolol fixed combination (COSOPT?) in patients with elevated intraocular pressure in a randomized clinical trial. Graefe’s archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv für klinische und experimentelle Ophthalmologie. 2010(12):1757-64.
(70) Day DG, Walters TR, Schwartz GF, Mundorf TK, Liu C, Schiffman RM, et al. Bimatoprost 0.03% preservative-free ophthalmic solution versus bimatoprost 0.03% ophthalmic solution (Lumigan) for glaucoma or ocular hypertension: a 12-week, randomised, double-masked trial. Br J Ophthalmol. 2013;97(8):989-93.
(71) Rouland JF, Traverso CE, Stalmans I, Fekih LE, Delval L, Renault D, et al. Efficacy and safety of preservative-free latanoprost eyedrops, compared with BAK-preserved latanoprost in patients with ocular hypertension or glaucoma. Br J Ophthalmol. 2013;97(2):196-200.






